Похожие презентации:
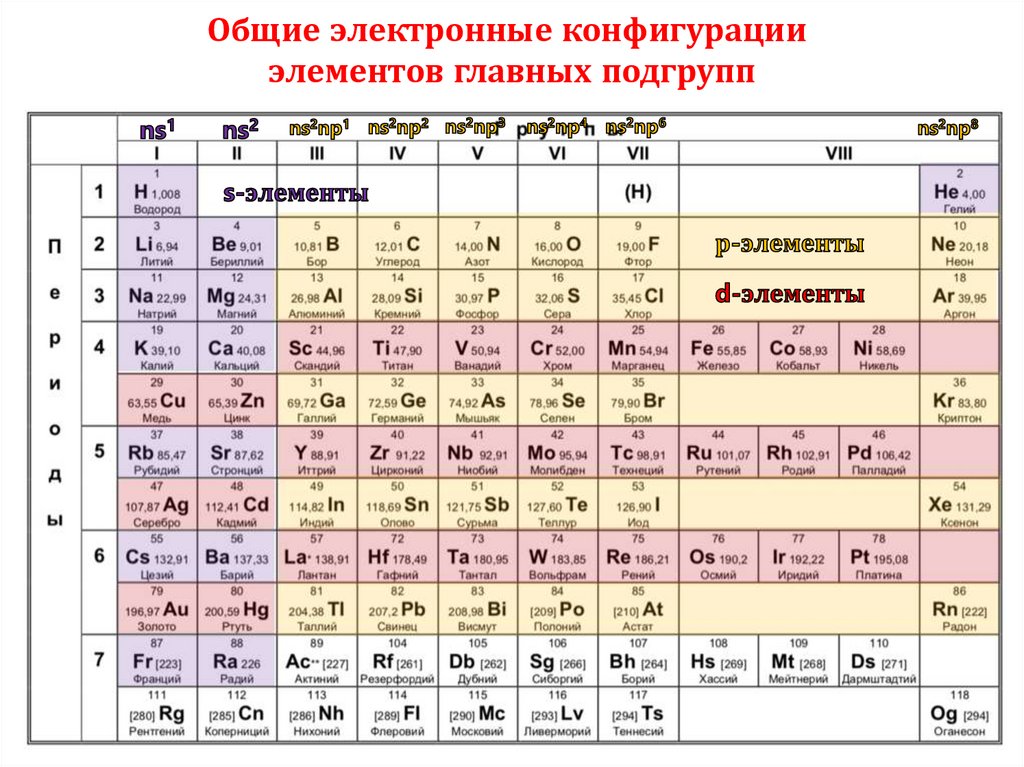
Общие электронные конфигурации элементов главных подгрупп
1.
Задание 1Понятие
1. Последовательность
заполнения орбиталей
электронами
2. Внешние/валентные
электроны на s- и pподуровнях
3. Внешние/валентные
электроны на
d-подуровнях
Что нужно знать?
2.
Задание 1Понятие
4. «Проскок» электрона
5. Одинаковые
электронные
конфигурации внешних
электронов
6. Сходные электронные
конфигурации
внешних/валентных
электронов
7. Спаренные/
неспаренные электроны
Что нужно знать?
3.
Задание 1Понятие
8. Возбужденное
состояние атома
Что нужно знать?
4.
Задание 1Понятие
9. Образование катиона
10. Образование аниона
11. Количество частиц
Что нужно знать?
5.
Общие электронные конфигурацииэлементов главных подгрупп
6.
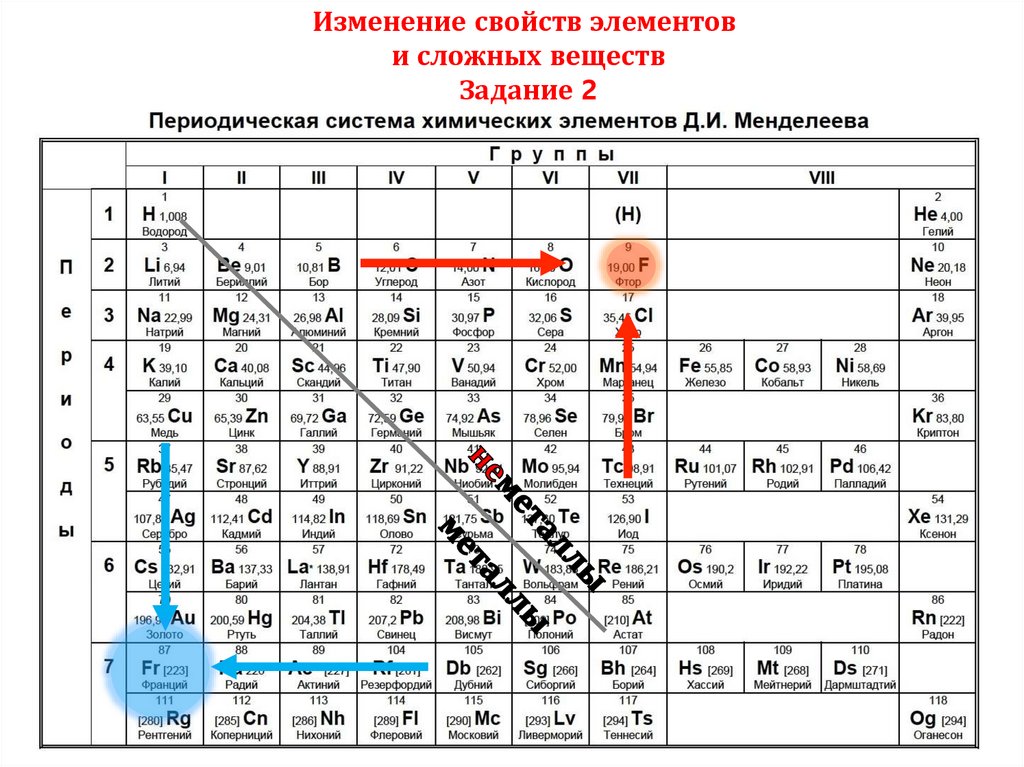
Изменение свойств элементови сложных веществ
Задание 2
7.
Изменение свойств элементови сложных веществ
Задание 2
Параметр/свойство
Радиус атома
Количество внешних
электронов
Электроотрицательность
Неметаллические/окислитель
ные свойства
Кислотные свойства оксидов,
гидроксидов элементов
Металлические/восстановите
льные свойства
Основные свойства оксидов,
гидроксидов элементов
Кислотные свойства
водородных соединений
Основные свойства
водородных соединений
Изменение по главной
подгруппе сверху вниз
⇩
Изменение по периоду слева
направо
➩
8.
Валентность и степень окисленияЗадание 3
Практически всегда валентность равна
Примеры, которые нужно запомнить –
Элемент
H, F, Li, K, Na, Rb, Cs, F
O, Be, Mg,Ca, Sr, Ba, Zn
B, Al
C, Si
Cu
Fe
Cr
Mn
S
N
P
Cl, Br, I
Валентность
9.
Степень окисленияЭлектроотрицательность –
металлы
Высшая степень окисления (max c.o.) =
Низшая степень окисления (min c.o.) для металлов всегда
Низшая степень окисления (min c.o.)
У фтора высшая степень окисления
У кислорода высшая степень окисления
У фтора и кислорода не достигается
Инертные газы не проявляют
Постоянная степень окисления (валентность) элемента Переменная степень окисления (валентность) элемента –
10.
Основные степени окисления-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
+7
H
Li
Na, K, Rb, Cs, Ag
Be
Mg, Ca, Sr, Ba, Zn
B
C
Si, Ge
Sn
Pb
N
O
F
Al
Ga, In
P
S
Se, Te
Cl
Br, I
Cr
Fe
Mn
Cu
Hg
11.
Типы химической связиЗадание 4
Тип химической
связи
Ковалентная
Внутримолекулярные связи
Ковалентная
неполярная
Ковалентная полярная
Ионная
Межмолекуля
рная
Металлическая
Водородная
Между кем
образуется?
Механизм
образования
Примеры
12.
СтроениеТип решетки
Молекулярное
Типы кристаллических решеток
и их характерные физические свойства
Молекулярная
Немолекулярное
Атомная
Ионная
Металлическая
Частицы в узлах
решетки
Примеры
13.
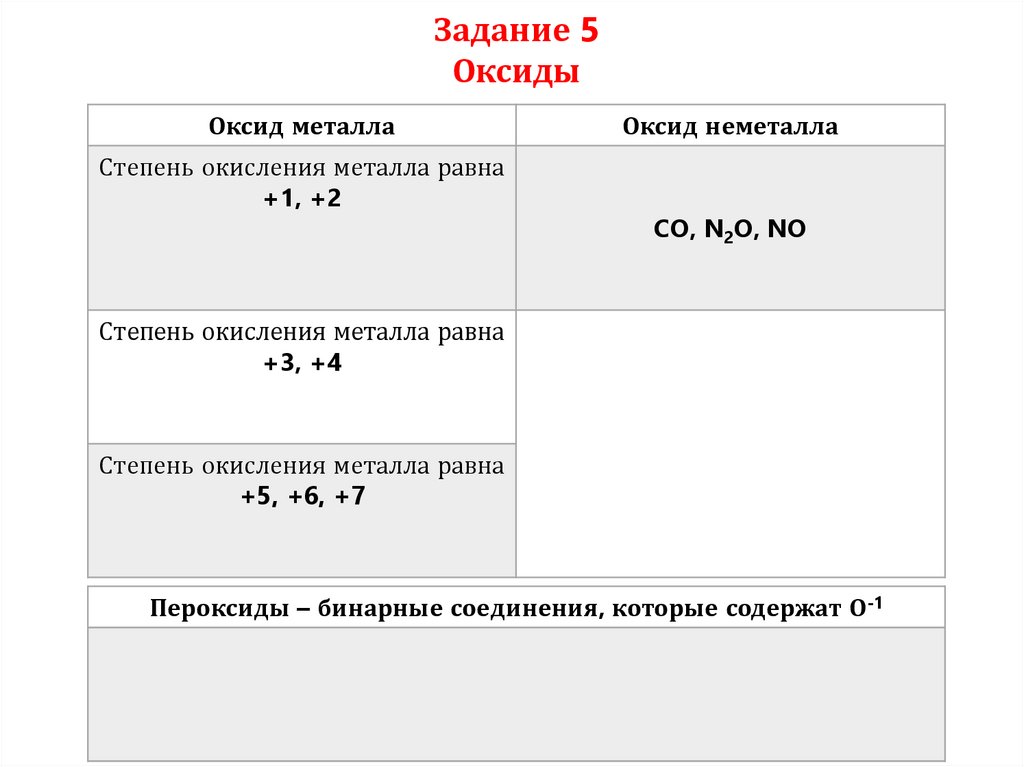
Задание 5Оксиды
Оксид металла
Степень окисления металла равна
+1, +2
Оксид неметалла
CO, N2O, NO
Степень окисления металла равна
+3, +4
Степень окисления металла равна
+5, +6, +7
Пероксиды – бинарные соединения, которые содержат О-1
14.
Задание 5Гидроксиды
Гидроксид металла
Гидроксид неметалла
Примеры
15.
Классификация кислот1. По наличию кислорода
2. По количеству атомов Н
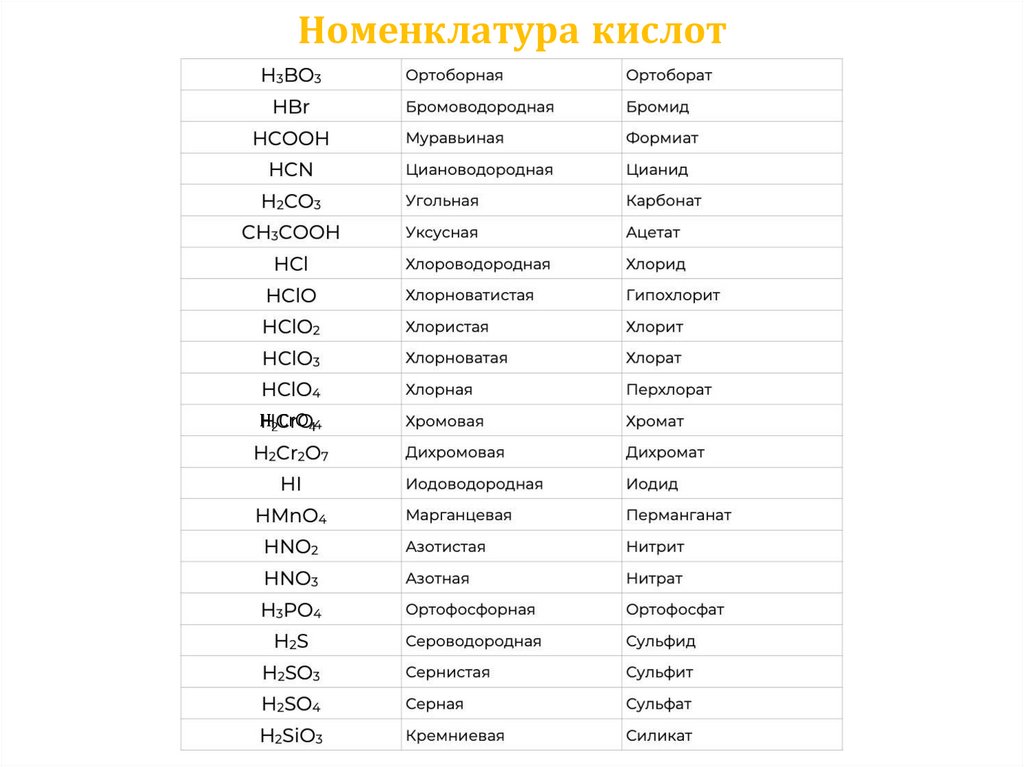
16.
Номенклатура кислотН2СrO4
17.
Задание 5Соли
Понятие
Определение
Примеры
18.
Задание 5Тривиальные названия неорганических веществ
ОКСИДЫ
ОСНОВАНИЯ
СОЛИ
19.
Задание 17Классификация химических реакций
Классификационн
ый признак
1. Изменение
степени окисления
2. По количеству
исходных веществ и
продуктов реакции
3. Тепловой эффект
Тип реакции
Примеры
20.
Задание 17Классификация химических реакций
Классификационный
признак
4. Наличие или отсутствие
катализатора
5. По наличие поверхности
раздела фаз
Тип реакции
Примеры
21.
Задание 17Классификация химических реакций
Классификационный
признак
6. Обратимость
7. Механизм реакции
Тип реакции
Примеры
22.
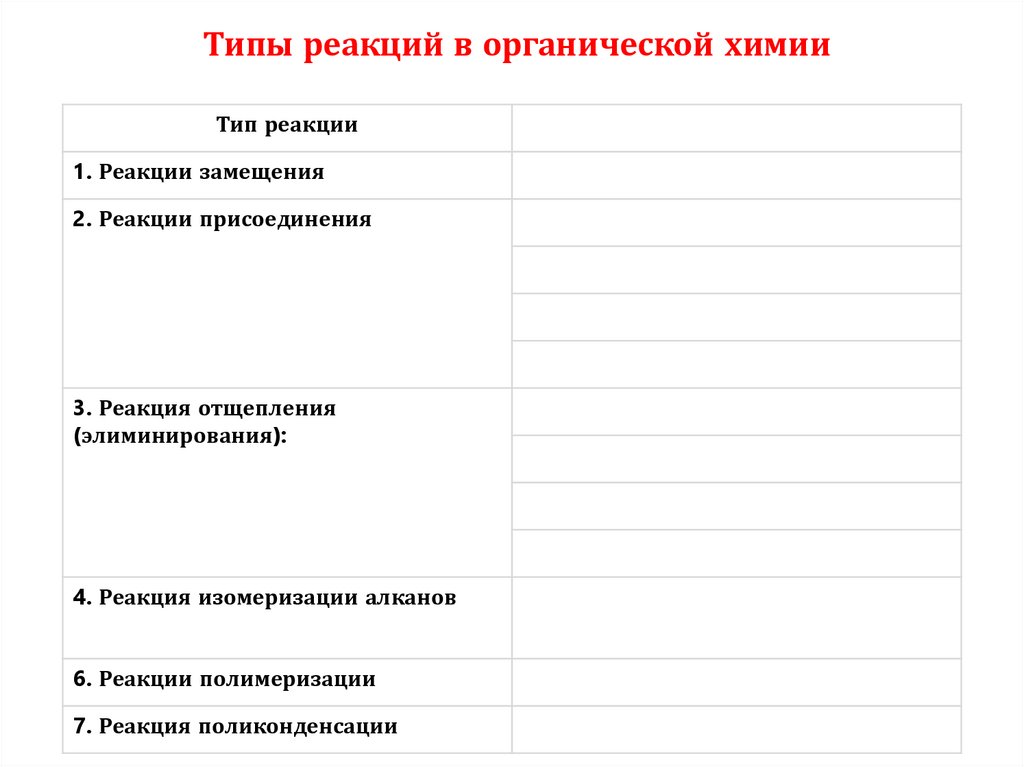
Типы реакций в органической химииТип реакции
1. Реакции замещения
2. Реакции присоединения
3. Реакция отщепления
(элиминирования):
4. Реакция изомеризации алканов
6. Реакции полимеризации
7. Реакция поликонденсации
23.
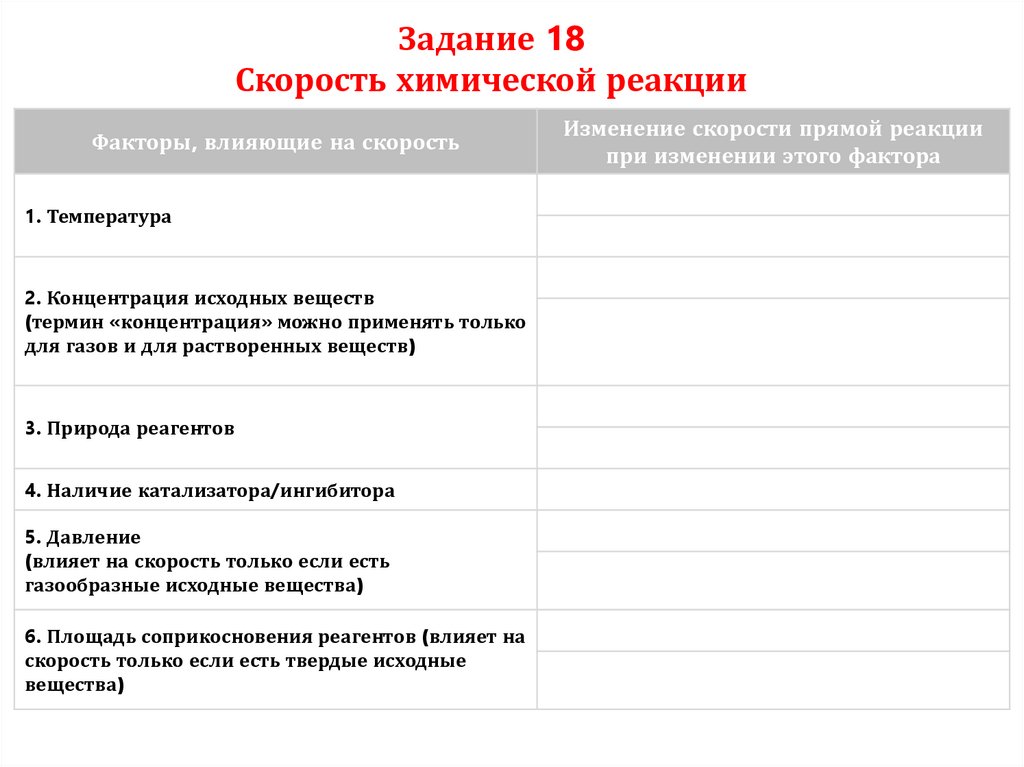
Задание 18Скорость химической реакции
Факторы, влияющие на скорость
1. Температура
2. Концентрация исходных веществ
(термин «концентрация» можно применять только
для газов и для растворенных веществ)
3. Природа реагентов
4. Наличие катализатора/ингибитора
5. Давление
(влияет на скорость только если есть
газообразные исходные вещества)
6. Площадь соприкосновения реагентов (влияет на
скорость только если есть твердые исходные
вещества)
Изменение скорости прямой реакции
при изменении этого фактора
24.
Задание 18Скорость химической реакции
Пример реакции
Скорость протекания
реакции
25.
ОВРЗадание 19
Окислитель
Восстановитель
И окислитель, и восстановитель
26.
ЭлектролизЗадание 20
Процессы на катоде (-)
Li K Ca Na Mg Al
Mn Zn Fe Ni Sn Pb
H2
Cu Hg Ag Pt Au
Процессы на аноде (+)
Кислотный остаток Аm–
Бескислородный
(Cl–, Br–, I–, S2-)
Нерастворимый/ин
ертный
(графитовый анод,
Pt/Pd анод)
Кислородсодержащий
(NO3–, SO42–, PO43– и др.)
и F–
27.
Задание 20Электролиз
Вещество
Уравнение электролиза
Получение веществ
Аl
Щелочные
(Li-Cs) и
щелочноземельн
ые металлы (CaBa) и Mg
F2
Другие металлы
Другие
неметаллы
Углеводороды
Кислота
Щелочь
28.
ЭлектролитыСильные
Слабые
1. КИСЛОТЫ
2. ГИДРОКСИДЫ МЕТАЛЛОВ
3. СОЛИ
Кислотная
Индикатор
Нейтральная
Щелочная
29.
Задание 21Гидролиз
Гидролиз идет по иону, который соответствует
слабому электролиту
1. Соли, образованные сильной кислотой и сильным основанием
2. Соли, образованные слабой кислотой и сильным основанием
3. Соли, образованные сильной кислотой и слабым основанием
4. Cоли, образованные слабой кислотой и слабым основанием
5. Cоли, образованные слабой летучей кислотой
и гидроксидами алюминия, хрома (III), железа (III)
30.
Гидролиз кислых солейСоль
Преобладающий процесс
31.
Среда растворов. рНрН
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Кислотность среды
Примеры веществ
32.
Задание 22Химическое равновесие
Внешние воздействия
1. Температура
2. Давление
3. Концентрация
Смещение химического равновесия
33.
Применение химических веществЗадание 25
Пищевая промышленность
Удобрения. Производство удобрений
Производство каучука. Производство резины
Производство красителей
Топливо. Получение энергии
Растворители
Защита растений
Сварка и резка металлов
34.
Применение химических веществПроизводство полимеров и пластмасс
Металлургия. Выплавка металлов
Производство бумаги
Водоочистка. Водоподготовка
Компонент антифризов
Получение стекла и керамики
Производство моющих средств, отбеливателей
Медицина. Производство лекарств
Производство взрывчатых веществ
35.
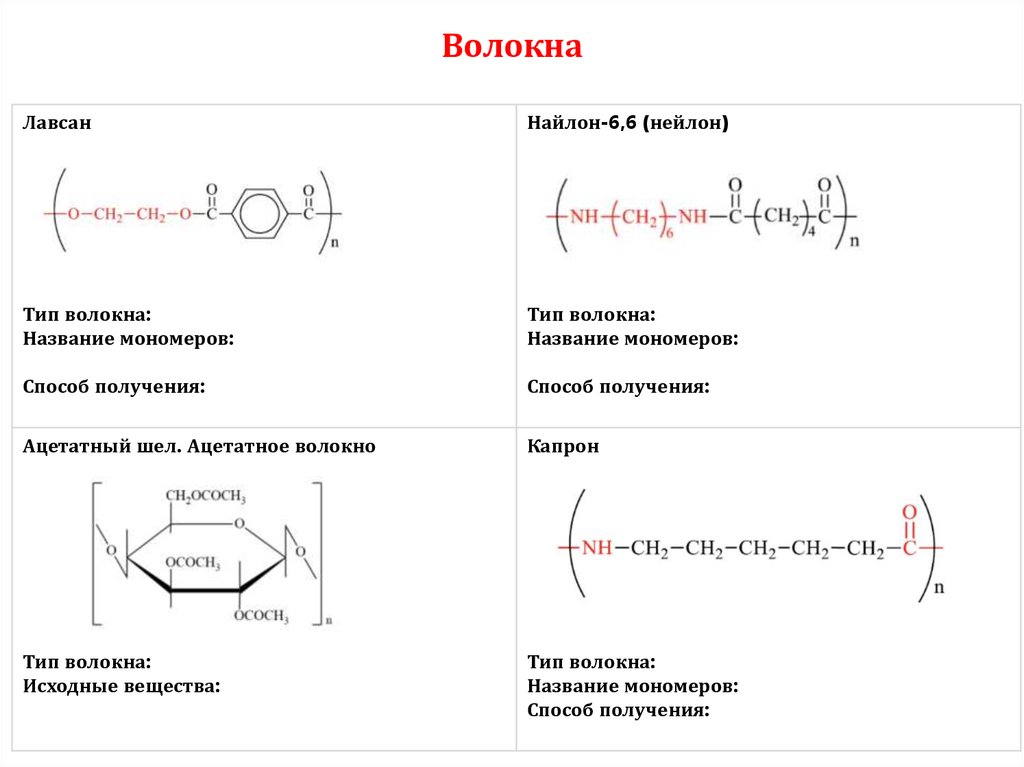
ВолокнаЛавсан
Найлон-6,6 (нейлон)
Тип волокна:
Название мономеров:
Тип волокна:
Название мономеров:
Способ получения:
Способ получения:
Ацетатный шел. Ацетатное волокно
Капрон
Тип волокна:
Исходные вещества:
Тип волокна:
Название мономеров:
Способ получения:
36.
ВолокнаТип волокна:
Исходные вещества:
Тип волокна:
Тип волокна:
Лён, хлопок
Тип волокна:
37.
ПроизводствоБензин, керосин, дизель, мазут, воск, асфальт
Сырьё для производства
Аппараты
Назначение
Серная кислота H2SO4
Сырьё для производства
Аппараты
Назначение
38.
ПроизводствоАзотная кислота HNO3
Сырьё для производства
Аппараты
Назначение
39.
ПроизводствоАммиак NH3
Сырьё для производства
Аппараты
Метанол CH3OH
Сырьё для производства
Назначение
40.
ПроизводствоЖелезо Fe
Сырьё для производства
Аппараты
Назначение
Алюминий Al
Сырьё для производства
Аппараты
Назначение
Щелочные металлы
Сырьё для производства
Аппараты
Назначение



































 Химия
Химия








