Похожие презентации:
Биохимические подходы в интерактомике
1. Биохимические подходы в интерактомике.
Доклад студента МБФгруппы 3.4.11а
Балакиревой
Анастасии
2. 1. Коиммунопреципитация
1. Коиммунопреципитация• Коиммунопреципитация считается золотым
стандартом анализа белок-белковых
взаимодействий.
• Представляющий интерес белок выделяют с
помощью специфического антитела .
• Выбор антител является ключевым звеном в данной
технологии!!!
• Антитела должны быть
– высокоаффинными
– высокоспецифичными
• Используются антитела как
– моноклональные ( более специфичны, но менее
толеранты к изменениям антигена) так и
– поликлональные( более толерантны к изменениям
антигена, но менее специфичны)
3.
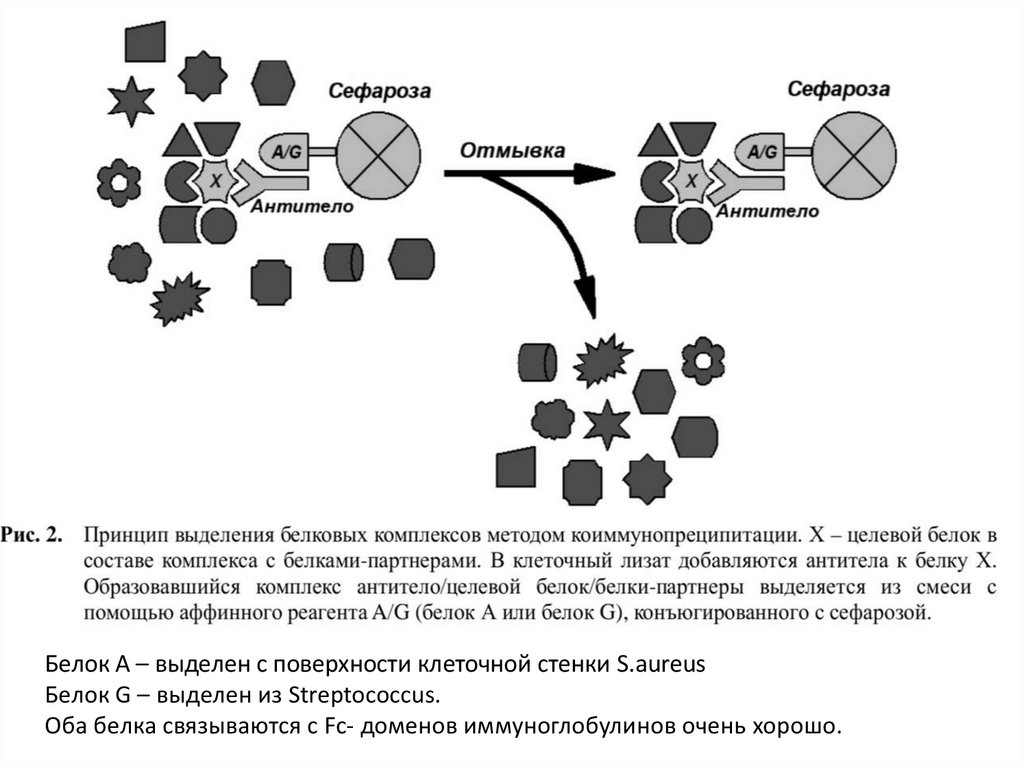
Белок А – выделен с поверхности клеточной стенки S.aureusБелок G – выделен из Streptococcus.
Оба белка связываются с Fc- доменов иммуноглобулинов очень хорошо.
4. 2. Аффинная хроматография белков со специфической меткой.
• В отличие от коиммунопреципитации, в данном подходеотсутствует этап добавления антител в клеточный лизат.
• Целевой белок с включенным в его состав меткой в
комплексе с белками-партнерами сразу выделяется из
лизата с помощью аффинного сорбента.
• Различные метки: эпитопы типа Myc (пептидный эпитоп из
фактора транскрипции c-Myc) , FLAG (октапептид NDYKDDDDK-C) ; GST(глутатион-S-трансфераза ; 6хHis –
специфическая пептидная метка в виде 6 остатков
гистидина;
• аффинный сорбент - сефароза, ионообменная смола или
микрочастицы с закрепленным на нем аффинным
реагентом (антитела для выделения белков, меченных
пептидными эпитопами; глутатион для выделения белков,
меченных GST; нитрилотриуксусная кислота (NTA) для
выделения белков с 6хHis-меткой).
5.
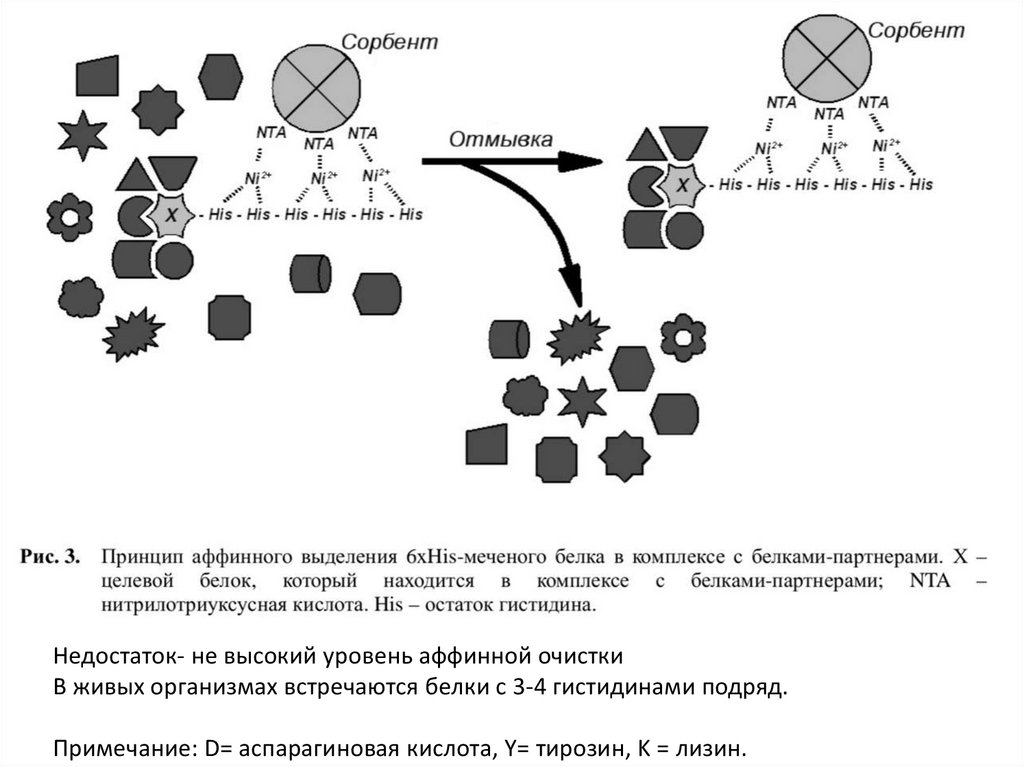
Недостаток- не высокий уровень аффинной очисткиВ живых организмах встречаются белки с 3-4 гистидинами подряд.
Примечание: D= аспарагиновая кислота, Y= тирозин, K = лизин.
6. 3. Тандемная аффинная очистка (Tandem Affinity Purification, TAP).
• Выделение белковых комплексов из клеточного лизатапутем одновременного использования двух аффинных
меток в составе целевого белка.
• Типичный вариант ТАР основан на использовании генномодифицированного целевого белка с двумя аффинными
метками, разделенными специфическим сайтом TCS
(пептидная последовательность ENLYFQG) разрезания
белковой цепи протеиназой вируса гравировки табака
(Tobacco Etch Virus, TEV).
• В качестве меток используются: белок А из S. aureus (или
его IgGсвязывающий домен) и кальмодулинсвязывающий
пептид (СВР) .
• ТАР-технология имеет два основных преимущества:
– все процедуры выполняются в близких к физиологическим
условиях,
– отмывки белковых комплексов происходят в мягких условиях,
не вызывающих их разрушения.
7.
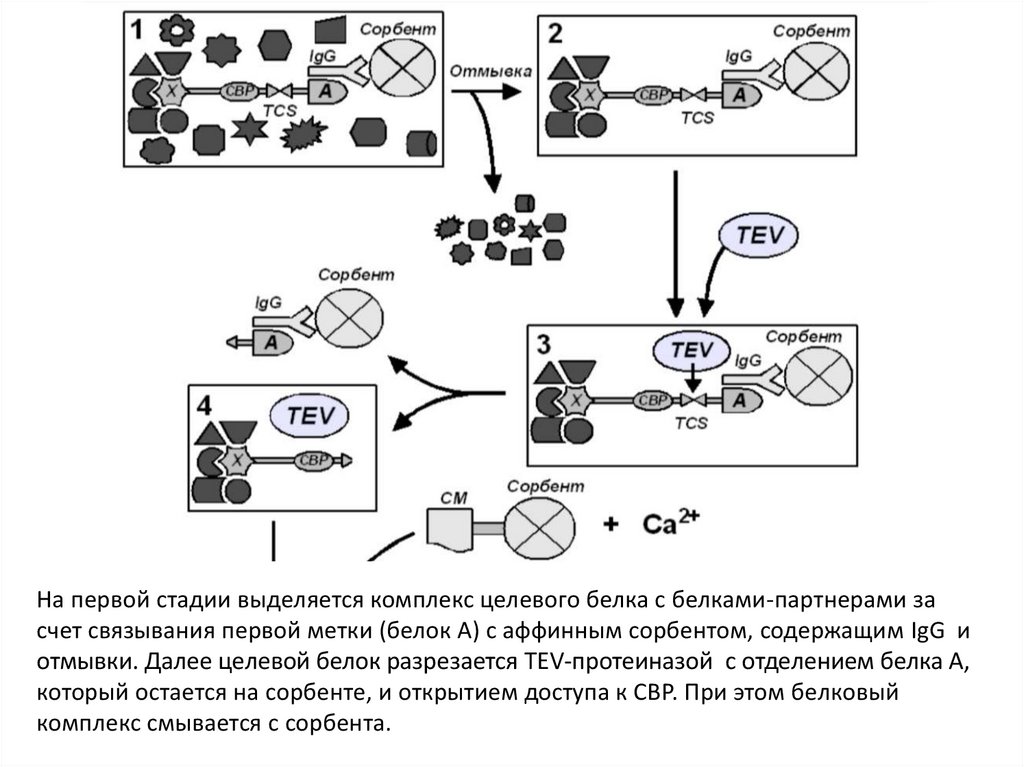
На первой стадии выделяется комплекс целевого белка с белками-партнерами засчет связывания первой метки (белок А) с аффинным сорбентом, содержащим IgG и
отмывки. Далее целевой белок разрезается TEV-протеиназой с отделением белка А,
который остается на сорбенте, и открытием доступа к СВР. При этом белковый
комплекс смывается с сорбента.
8.
На второй стадии аффинной очистки белковый комплекс выделяется в присутствии ионовкальция на микрочастицах с иммобилизованным кальмодулином (СМ). После
аккуратной отмывки осуществляется элюция белкового комплекса путем связывания
ионов кальция комплексоном (EGTA), что приводит к распаду комплекса СВР-СМ.





 Биология
Биология








