Похожие презентации:
Структура органических молекул клетки
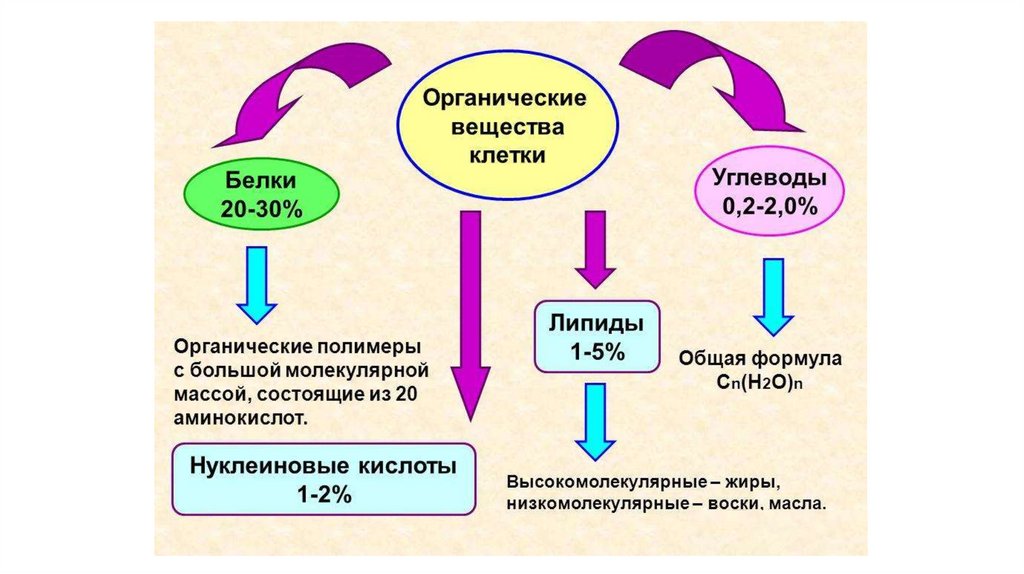
1. Структура органических молекул клетки
2.
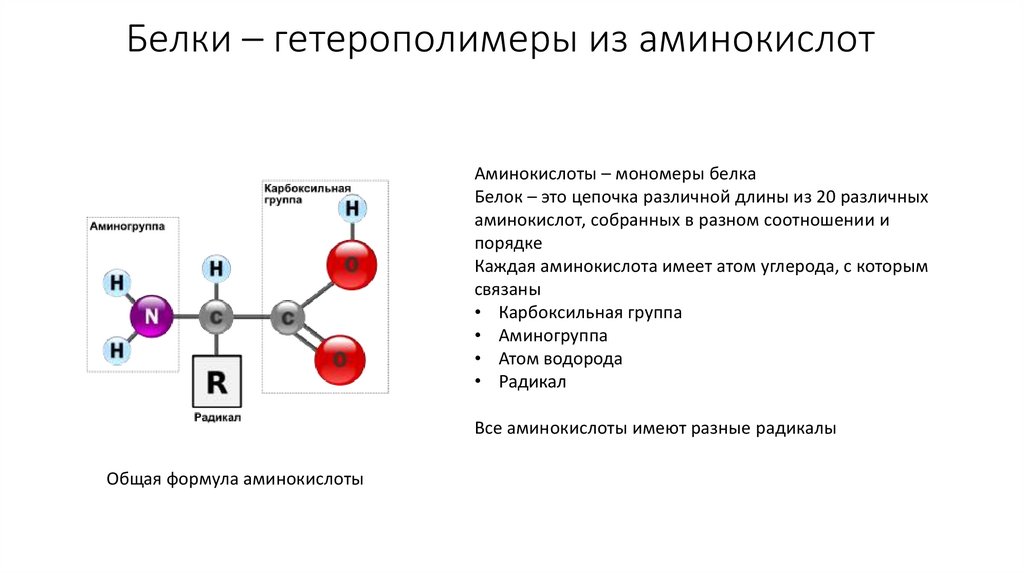
3. Белки – гетерополимеры из аминокислот
Аминокислоты – мономеры белкаБелок – это цепочка различной длины из 20 различных
аминокислот, собранных в разном соотношении и
порядке
Каждая аминокислота имеет атом углерода, с которым
связаны
• Карбоксильная группа
• Аминогруппа
• Атом водорода
• Радикал
Все аминокислоты имеют разные радикалы
Общая формула аминокислоты
4. Пептидная связь
Пептидная связь возникает междуаминогруппой одной и карбоксильной группой
другой аминокислоты
При образовании пептидной связи выделяется
вода
Две объединенных аминокислоты называют
дипептид, если таких аминокислот много, то
образуется полипептид.
Средняя длина 1 аминокислоты 0,3 нм, масса –
120 г/моль
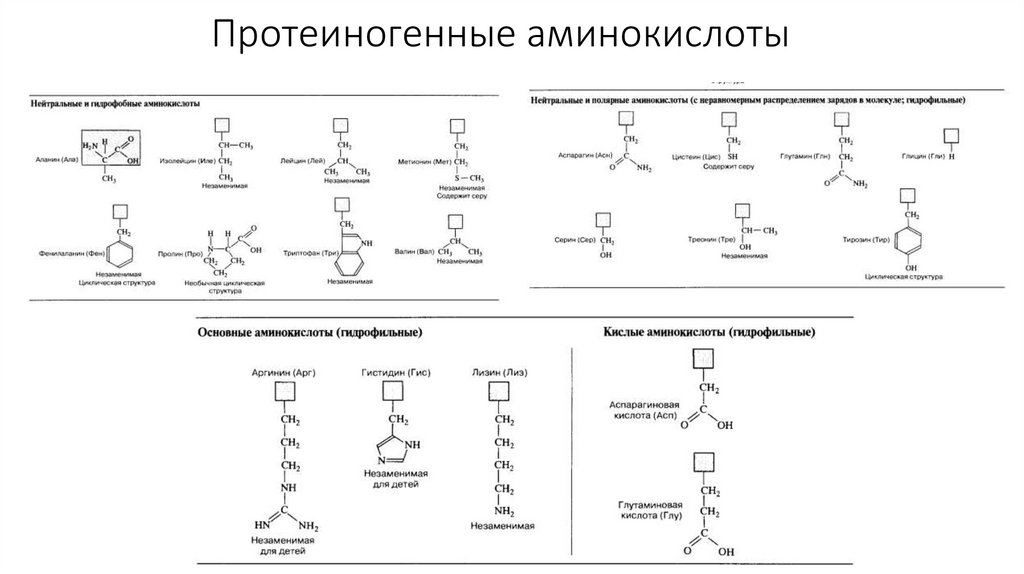
5. Протеиногенные аминокислоты
6. Заменимые и незаменимые аминокислоты
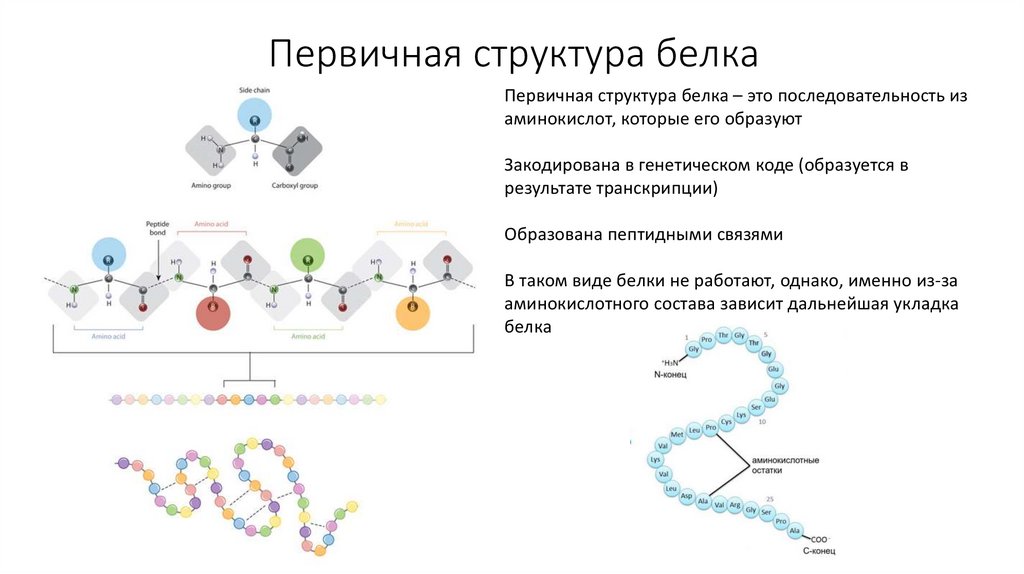
7. Первичная структура белка
Первичная структура белка – это последовательность изаминокислот, которые его образуют
Закодирована в генетическом коде (образуется в
результате транскрипции)
Образована пептидными связями
В таком виде белки не работают, однако, именно из-за
аминокислотного состава зависит дальнейшая укладка
белка
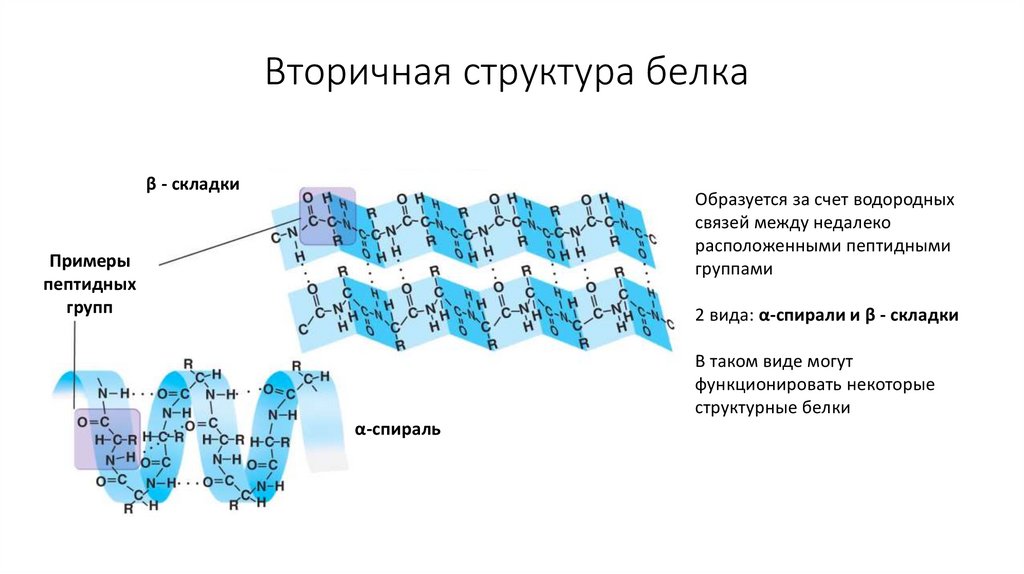
8. Вторичная структура белка
β - складкиОбразуется за счет водородных
связей между недалеко
расположенными пептидными
группами
Примеры
пептидных
групп
2 вида: α-спирали и β - складки
В таком виде могут
функционировать некоторые
структурные белки
α-спираль
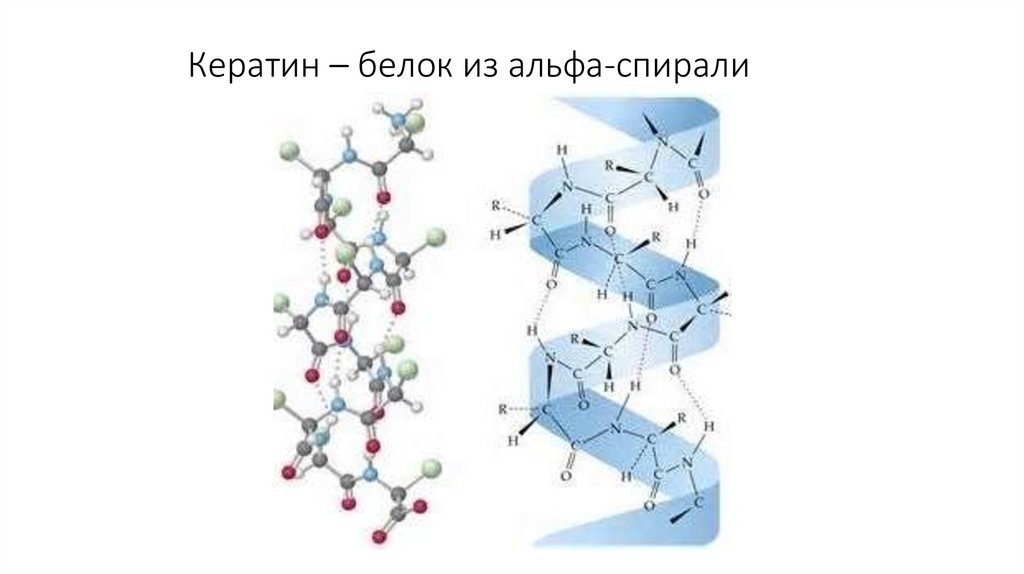
9. Кератин – белок из альфа-спирали
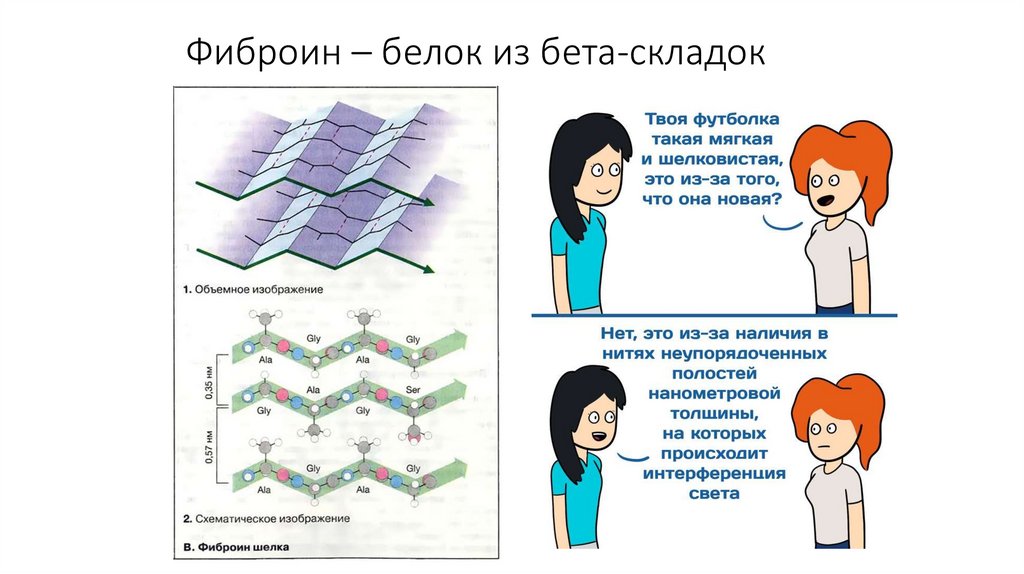
10. Фиброин – белок из бета-складок
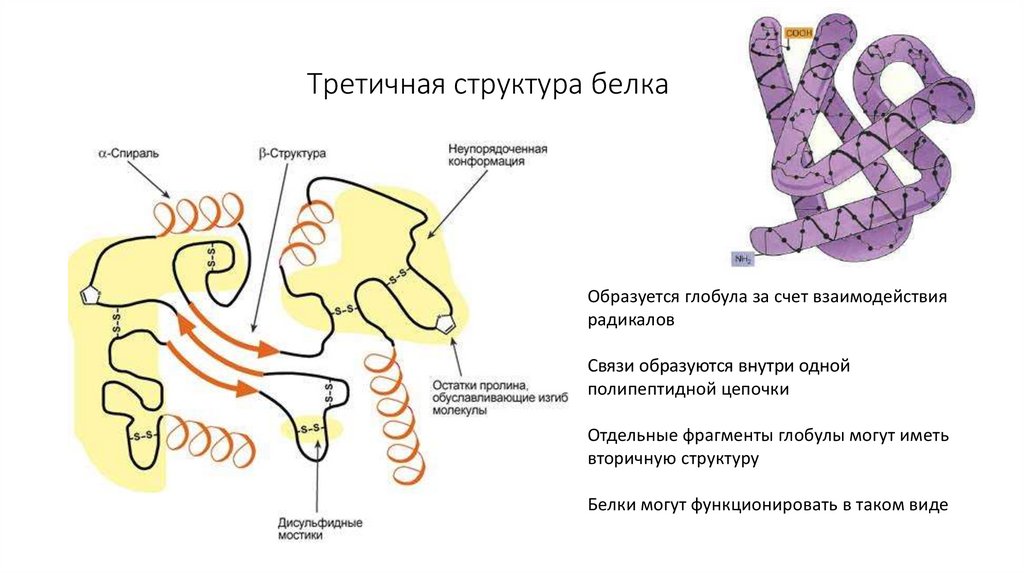
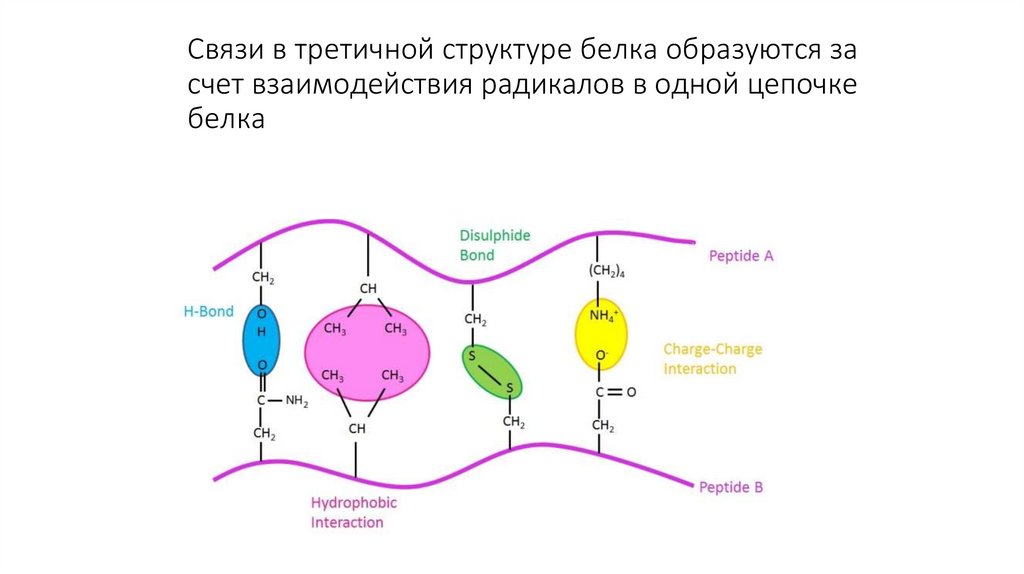
11. Третичная структура белка
Образуется глобула за счет взаимодействиярадикалов
Связи образуются внутри одной
полипептидной цепочки
Отдельные фрагменты глобулы могут иметь
вторичную структуру
Белки могут функционировать в таком виде
12. Связи в третичной структуре белка образуются за счет взаимодействия радикалов в одной цепочке белка
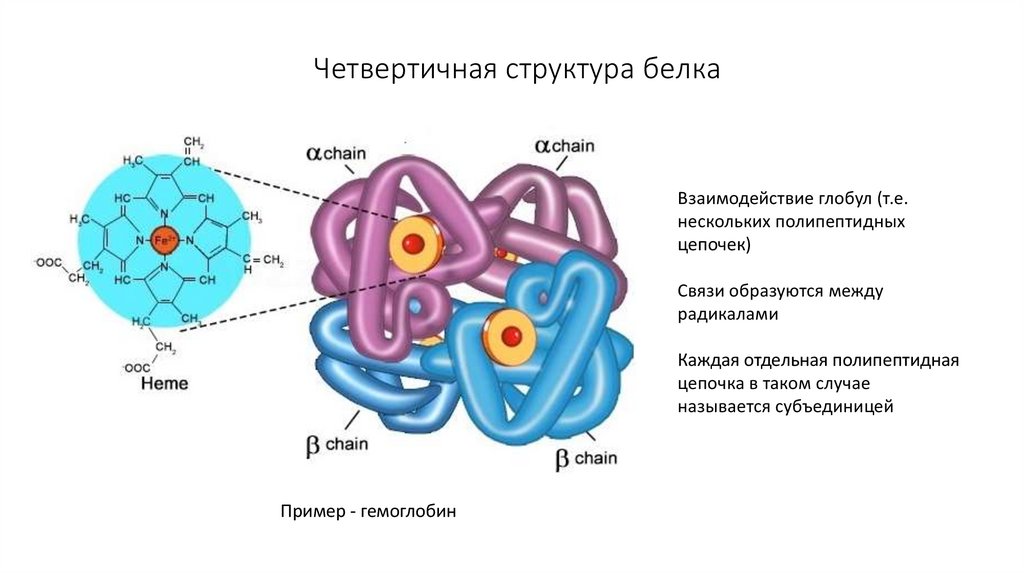
13. Четвертичная структура белка
Взаимодействие глобул (т.е.нескольких полипептидных
цепочек)
Связи образуются между
радикалами
Каждая отдельная полипептидная
цепочка в таком случае
называется субъединицей
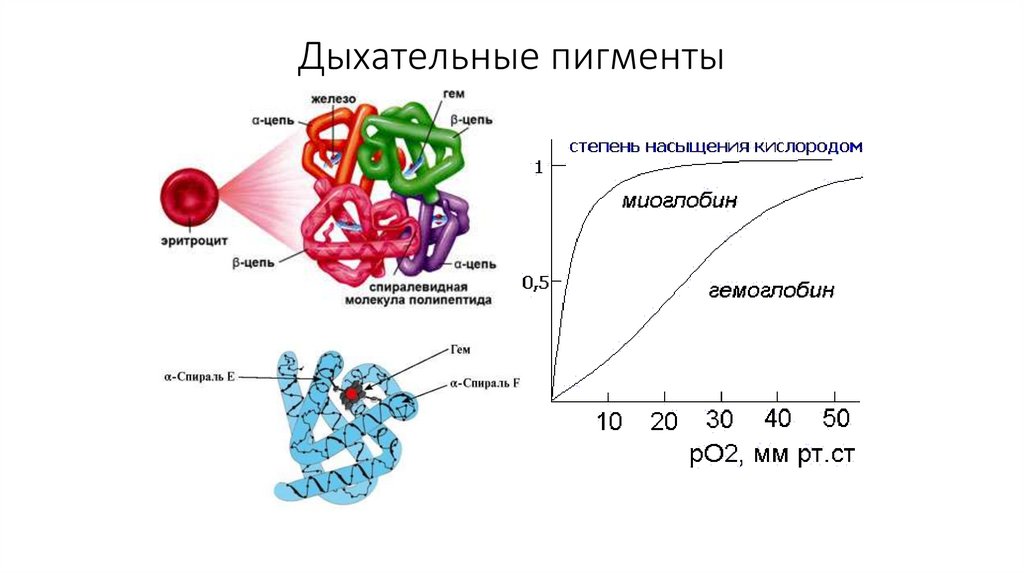
Пример - гемоглобин
14. Денатурация и ренатурация
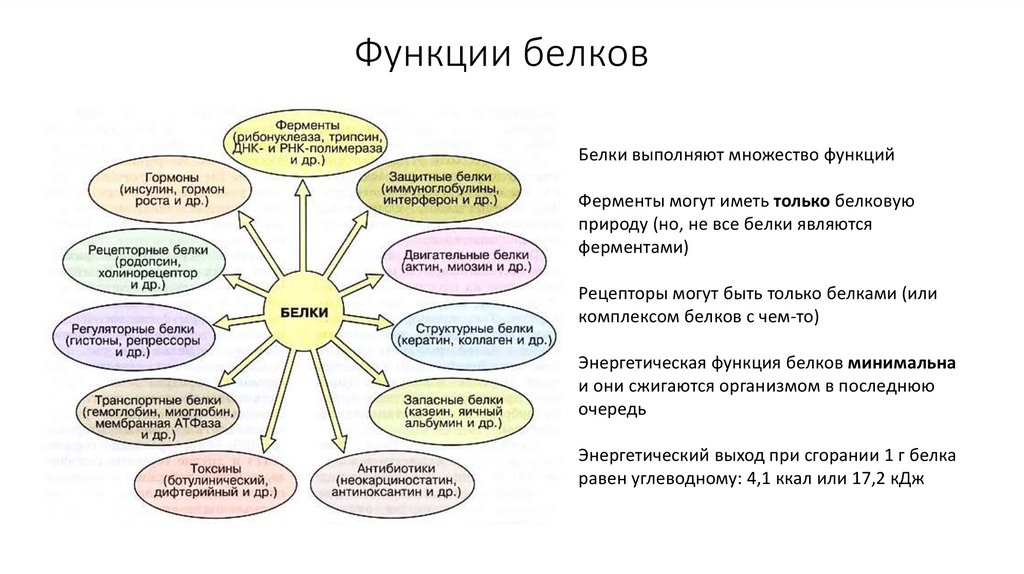
15. Функции белков
Белки выполняют множество функцийФерменты могут иметь только белковую
природу (но, не все белки являются
ферментами)
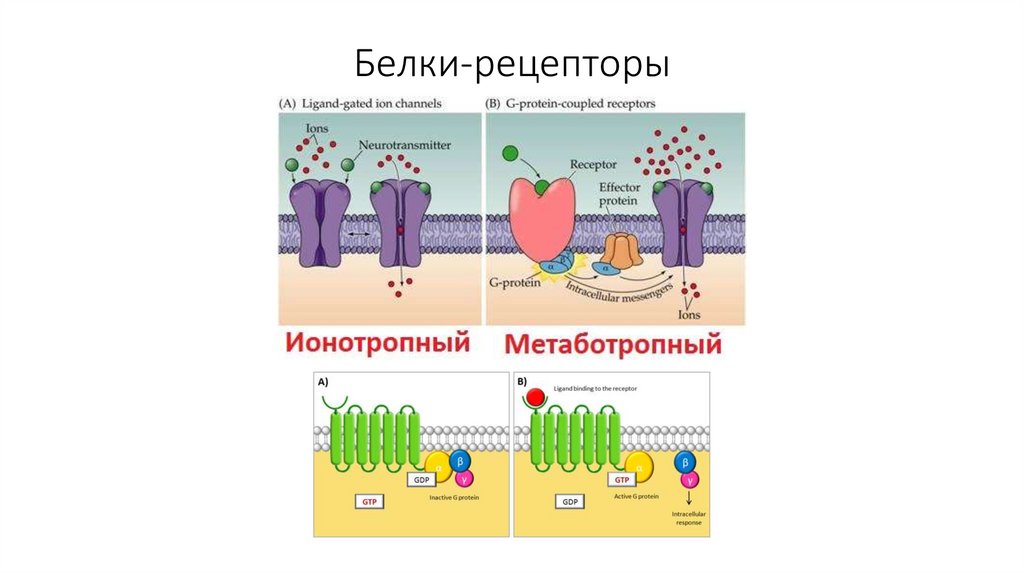
Рецепторы могут быть только белками (или
комплексом белков с чем-то)
Энергетическая функция белков минимальна
и они сжигаются организмом в последнюю
очередь
Энергетический выход при сгорании 1 г белка
равен углеводному: 4,1 ккал или 17,2 кДж
16. Структурные белки
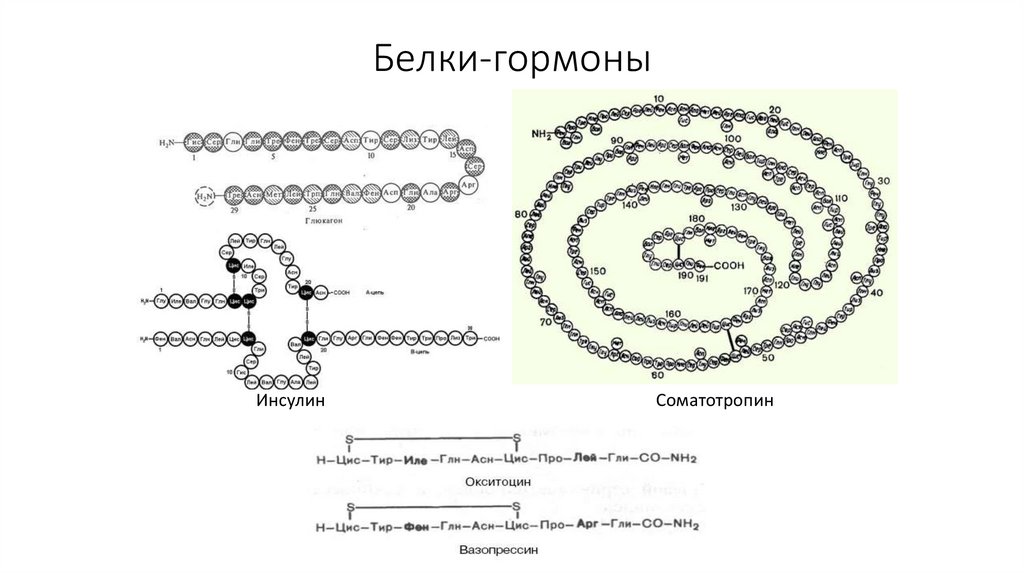
17. Белки-гормоны
ИнсулинСоматотропин
18. Белки-рецепторы
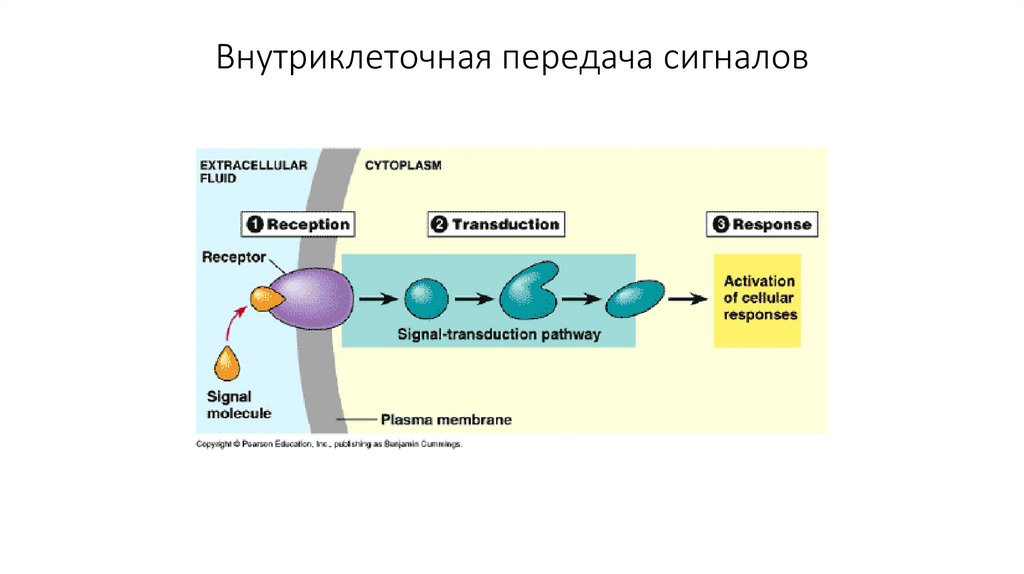
19. Внутриклеточная передача сигналов
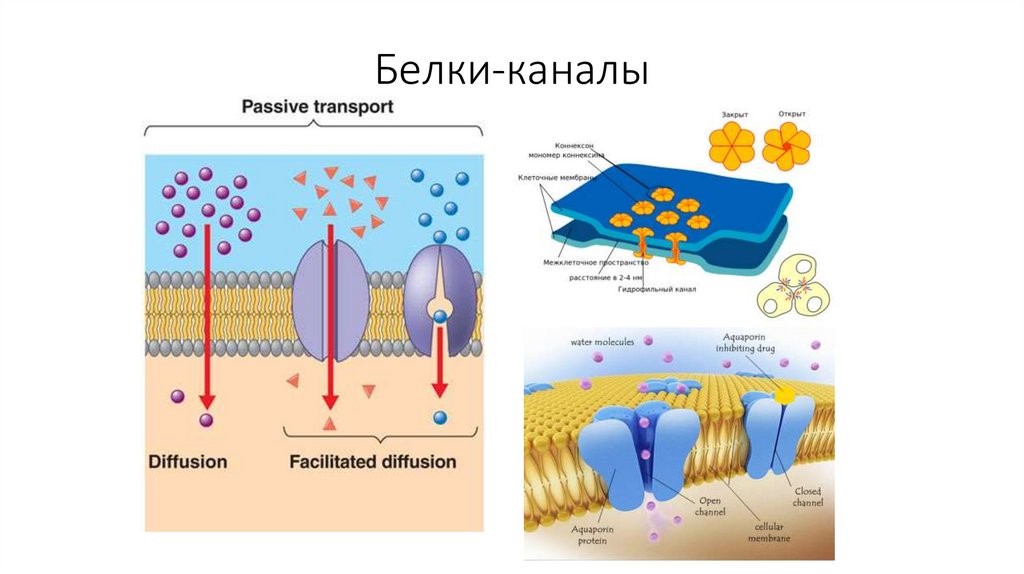
20. Белки-каналы
21. Дыхательные пигменты
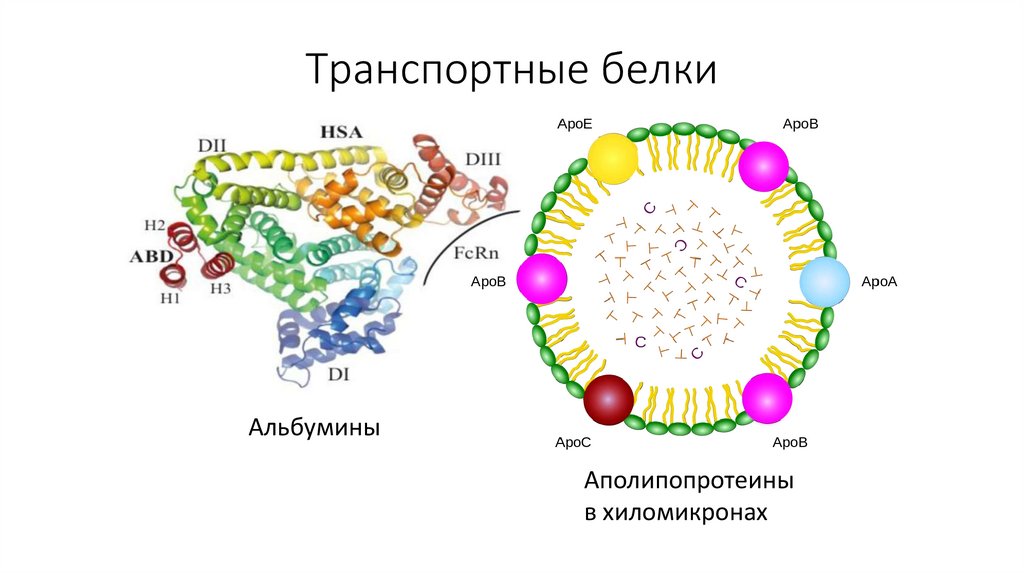
22. Транспортные белки
АльбуминыАполипопротеины
в хиломикронах
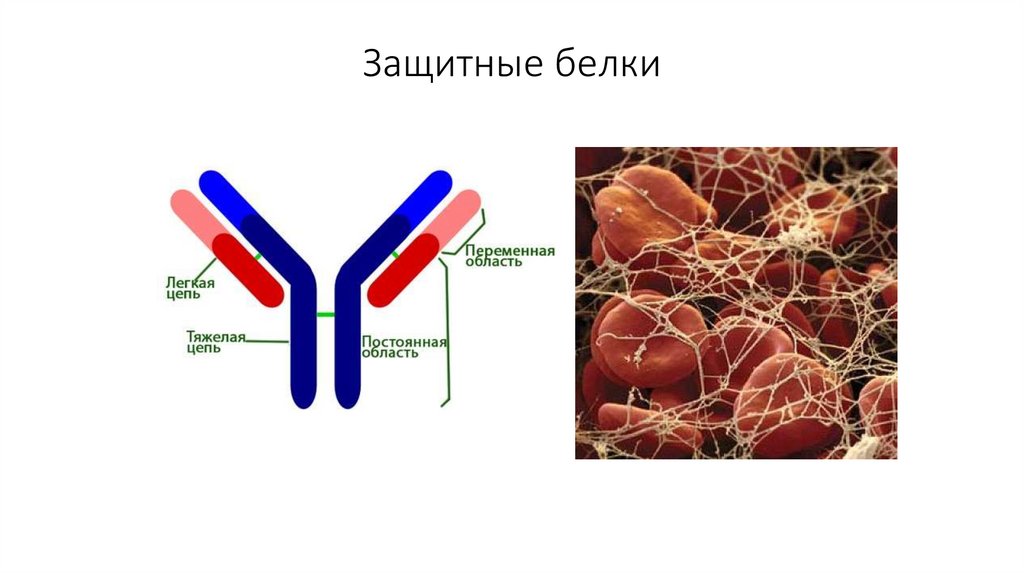
23. Защитные белки
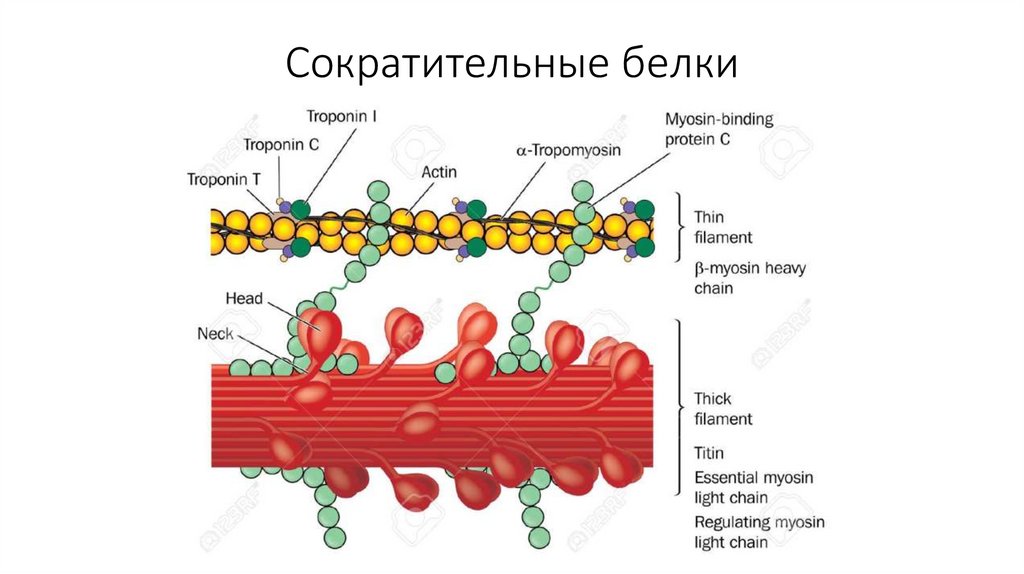
24. Сократительные белки
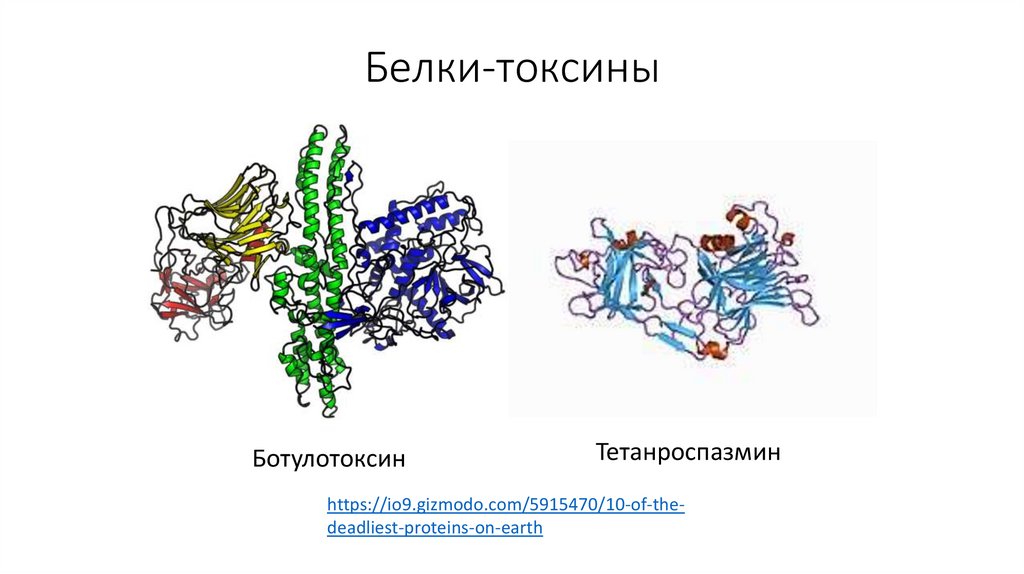
25. Белки-токсины
БотулотоксинТетанроспазмин
https://io9.gizmodo.com/5915470/10-of-thedeadliest-proteins-on-earth
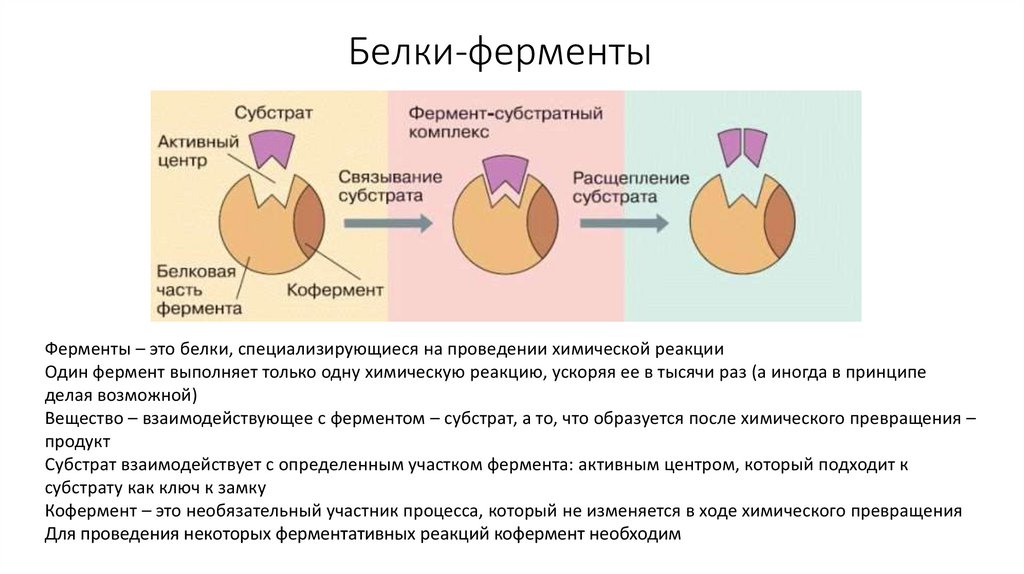
26. Белки-ферменты
Ферменты – это белки, специализирующиеся на проведении химической реакцииОдин фермент выполняет только одну химическую реакцию, ускоряя ее в тысячи раз (а иногда в принципе
делая возможной)
Вещество – взаимодействующее с ферментом – субстрат, а то, что образуется после химического превращения –
продукт
Субстрат взаимодействует с определенным участком фермента: активным центром, который подходит к
субстрату как ключ к замку
Кофермент – это необязательный участник процесса, который не изменяется в ходе химического превращения
Для проведения некоторых ферментативных реакций кофермент необходим
27. Активный центр фермента
28.
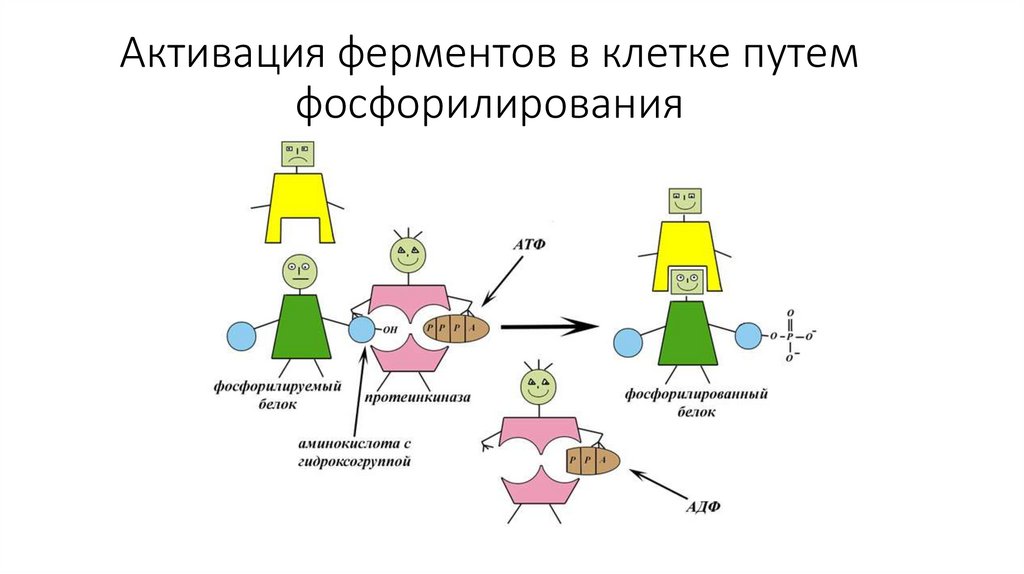
29. Активация ферментов в клетке путем фосфорилирования
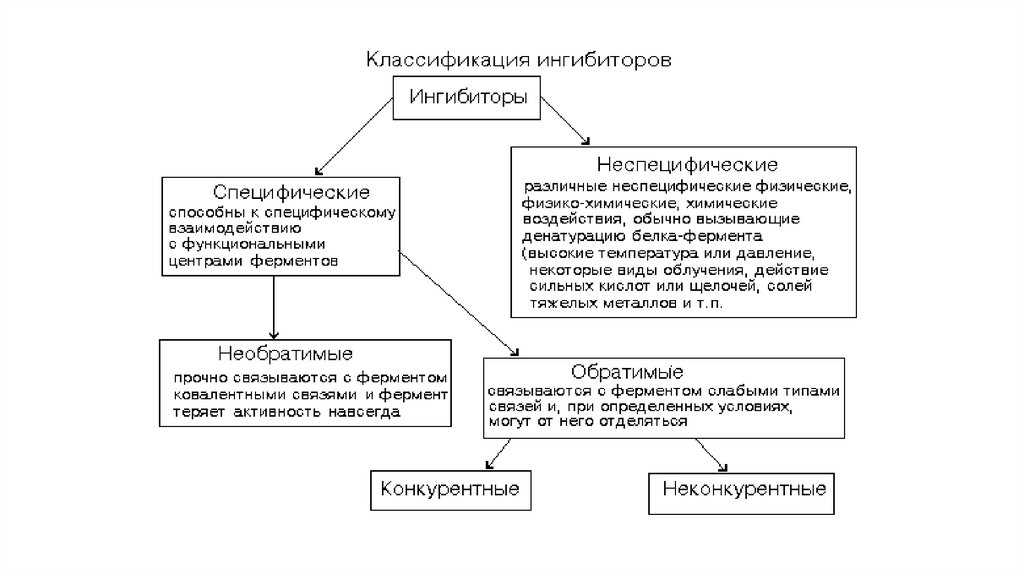
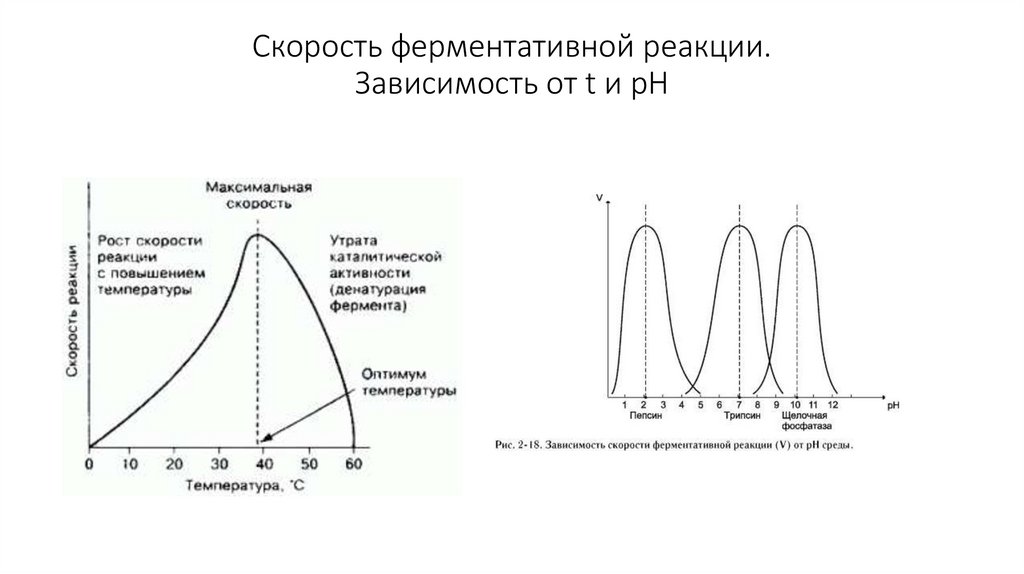
30. Скорость ферментативной реакции. Зависимость от t и pH
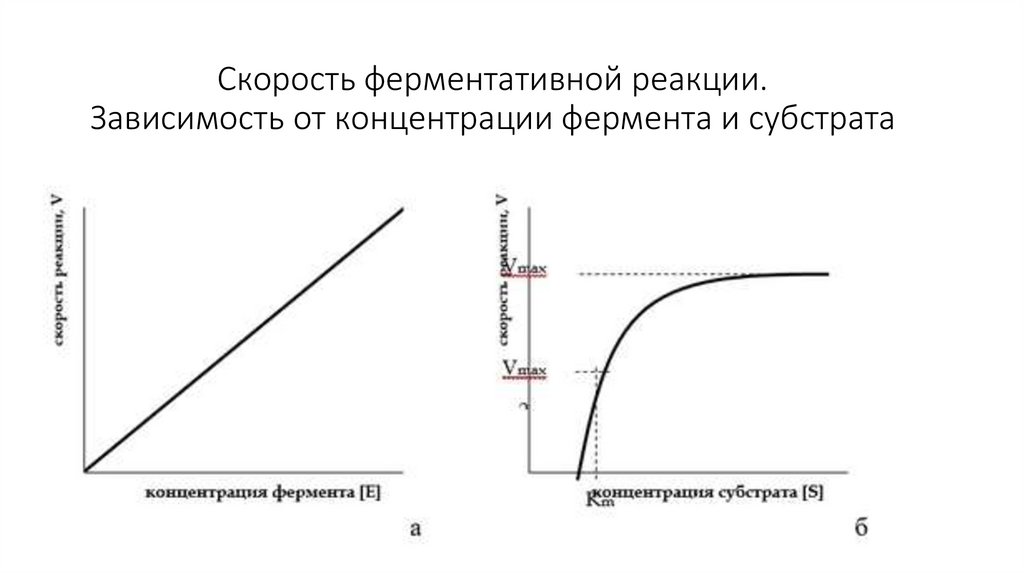
31. Скорость ферментативной реакции. Зависимость от концентрации фермента и субстрата
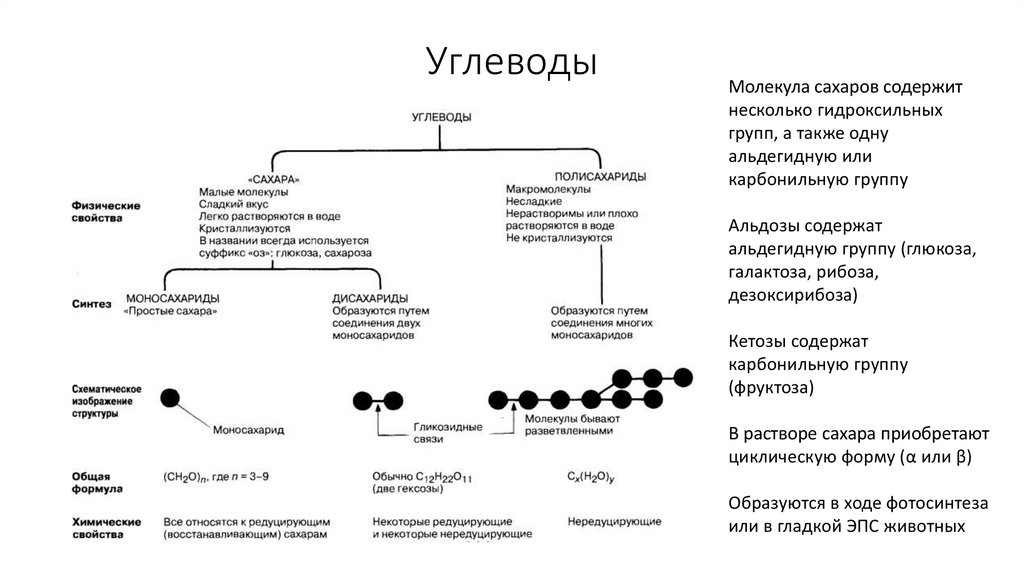
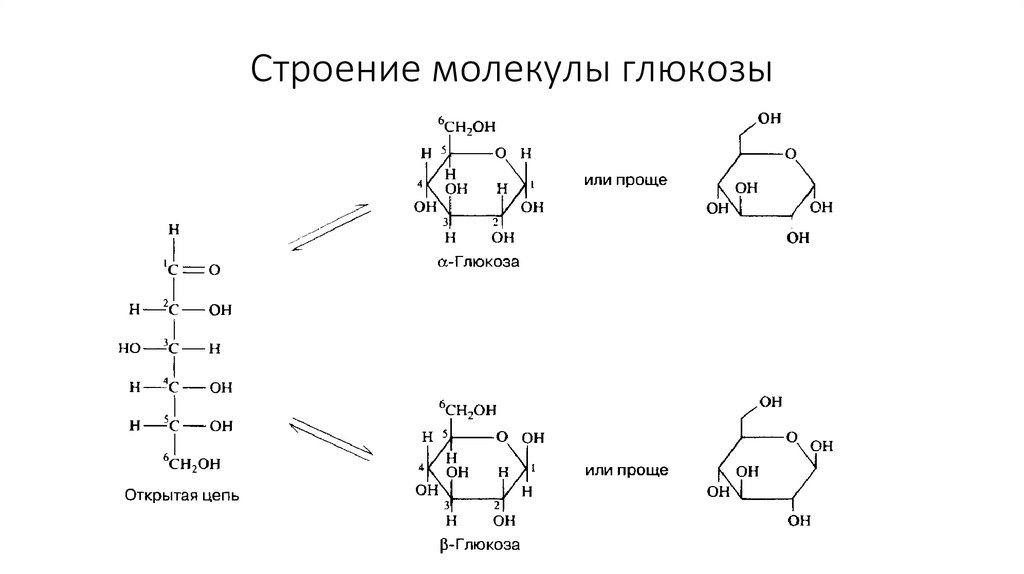
32. Углеводы
Молекула сахаров содержитнесколько гидроксильных
групп, а также одну
альдегидную или
карбонильную группу
Альдозы содержат
альдегидную группу (глюкоза,
галактоза, рибоза,
дезоксирибоза)
Кетозы содержат
карбонильную группу
(фруктоза)
В растворе сахара приобретают
циклическую форму (α или β)
Образуются в ходе фотосинтеза
или в гладкой ЭПС животных
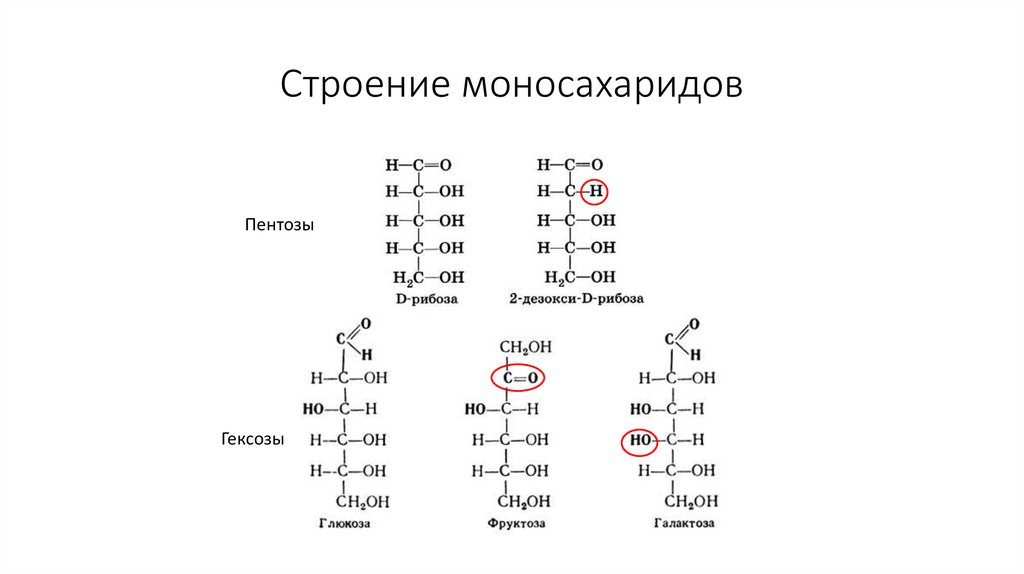
33. Строение моносахаридов
ПентозыГексозы
34. Строение молекулы глюкозы
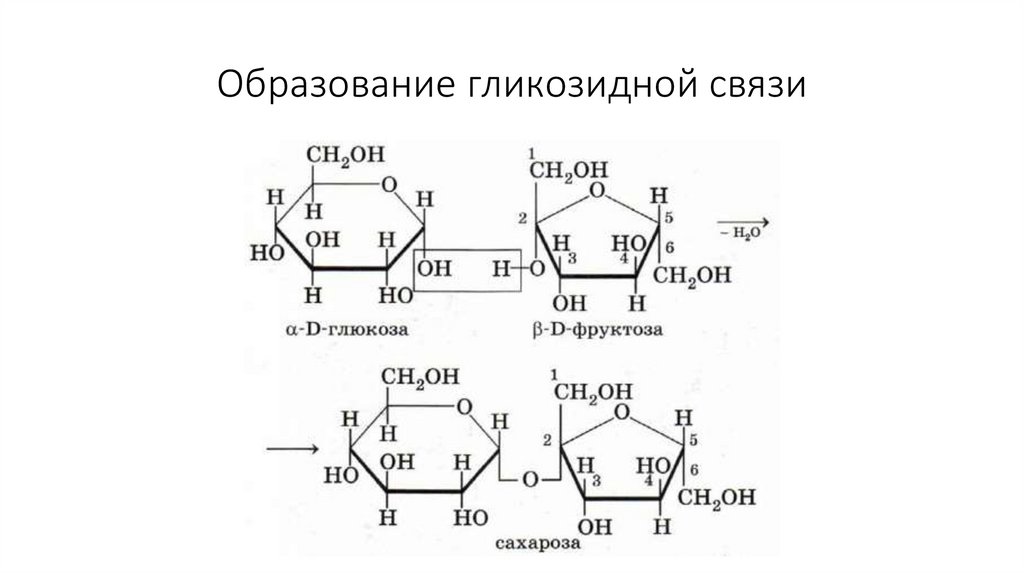
35. Образование гликозидной связи
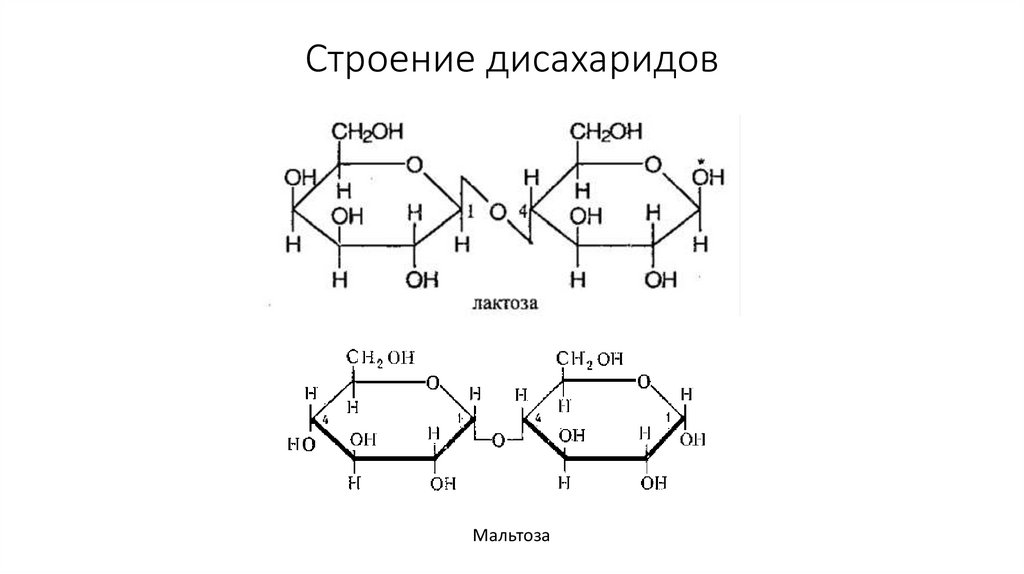
36. Строение дисахаридов
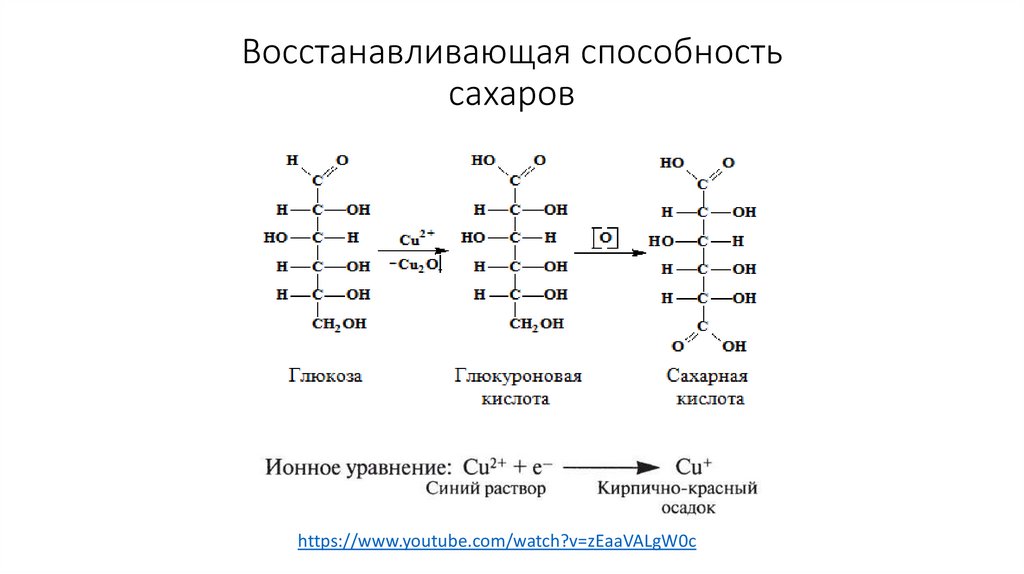
Мальтоза37. Восстанавливающая способность сахаров
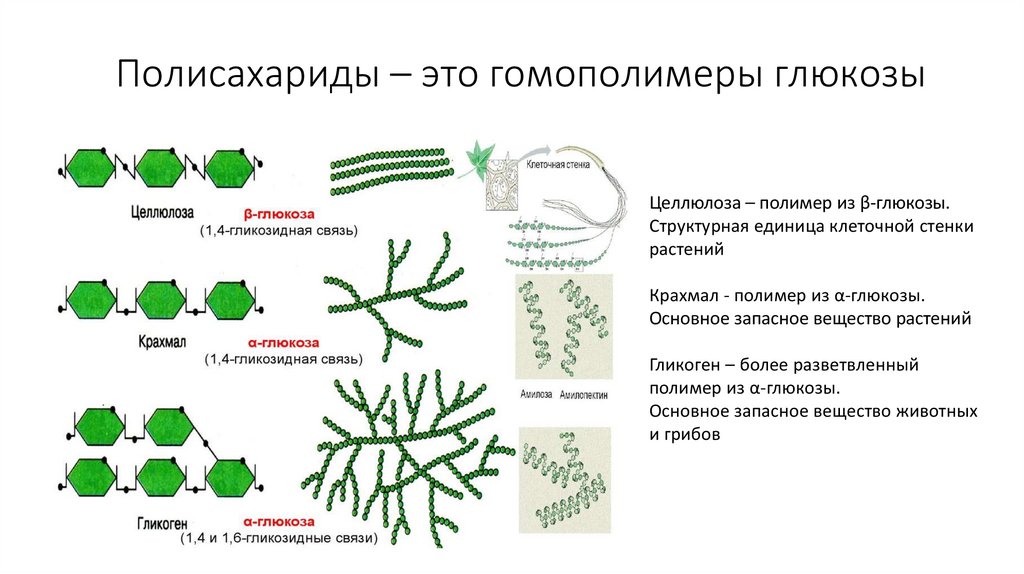
https://www.youtube.com/watch?v=zEaaVALgW0c38. Полисахариды – это гомополимеры глюкозы
Целлюлоза – полимер из β-глюкозы.Структурная единица клеточной стенки
растений
Крахмал - полимер из α-глюкозы.
Основное запасное вещество растений
Гликоген – более разветвленный
полимер из α-глюкозы.
Основное запасное вещество животных
и грибов
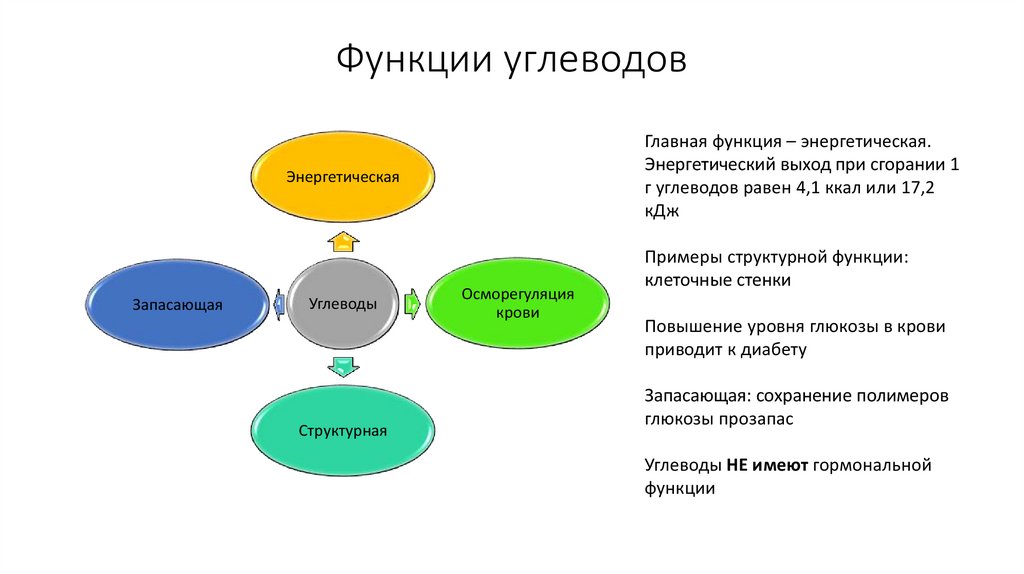
39. Функции углеводов
Главная функция – энергетическая.Энергетический выход при сгорании 1
г углеводов равен 4,1 ккал или 17,2
кДж
Энергетическая
Запасающая
Углеводы
Структурная
Осморегуляция
крови
Примеры структурной функции:
клеточные стенки
Повышение уровня глюкозы в крови
приводит к диабету
Запасающая: сохранение полимеров
глюкозы прозапас
Углеводы НЕ имеют гормональной
функции
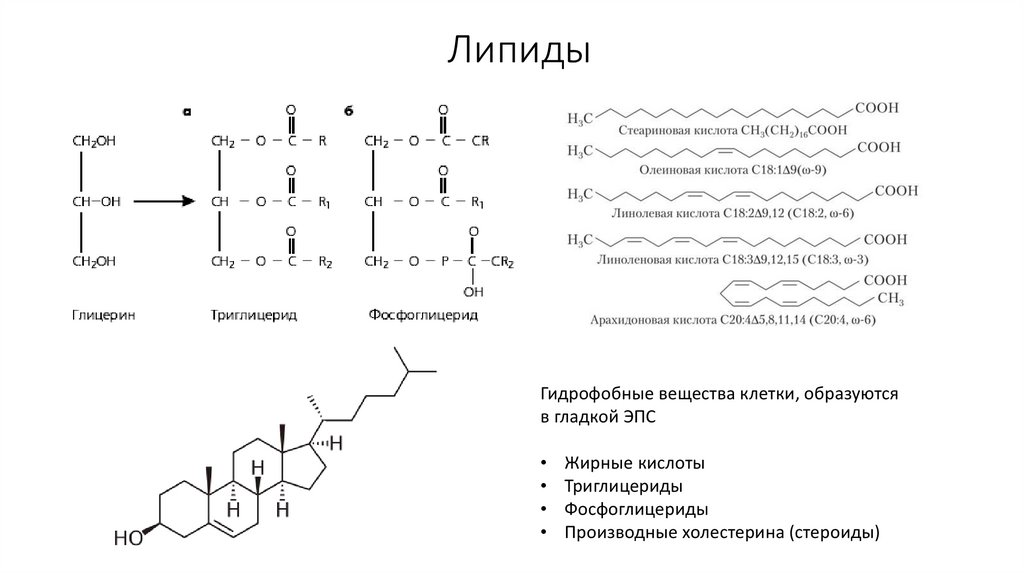
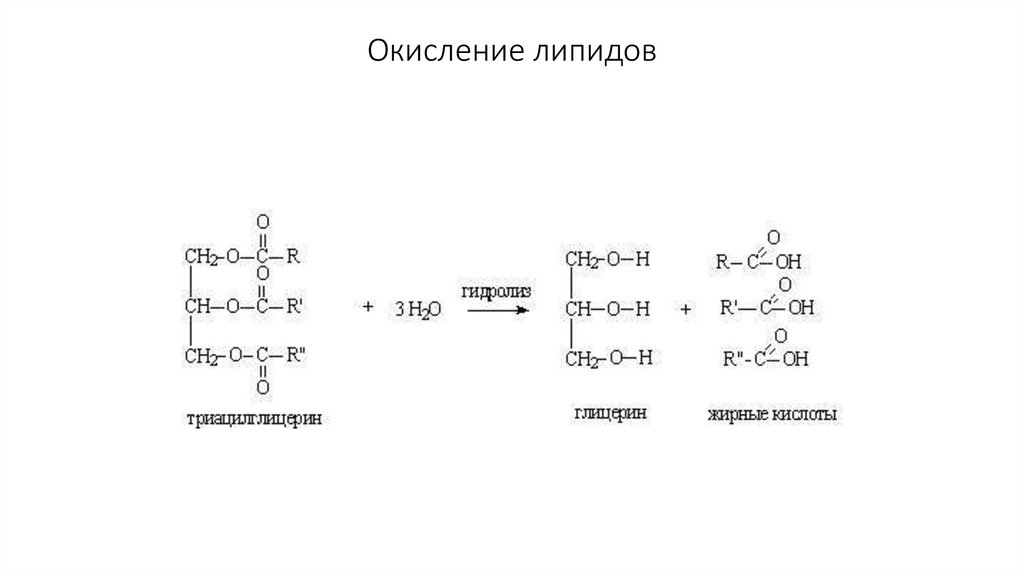
40. Липиды
Гидрофобные вещества клетки, образуютсяв гладкой ЭПС
Жирные кислоты
Триглицериды
Фосфоглицериды
Производные холестерина (стероиды)
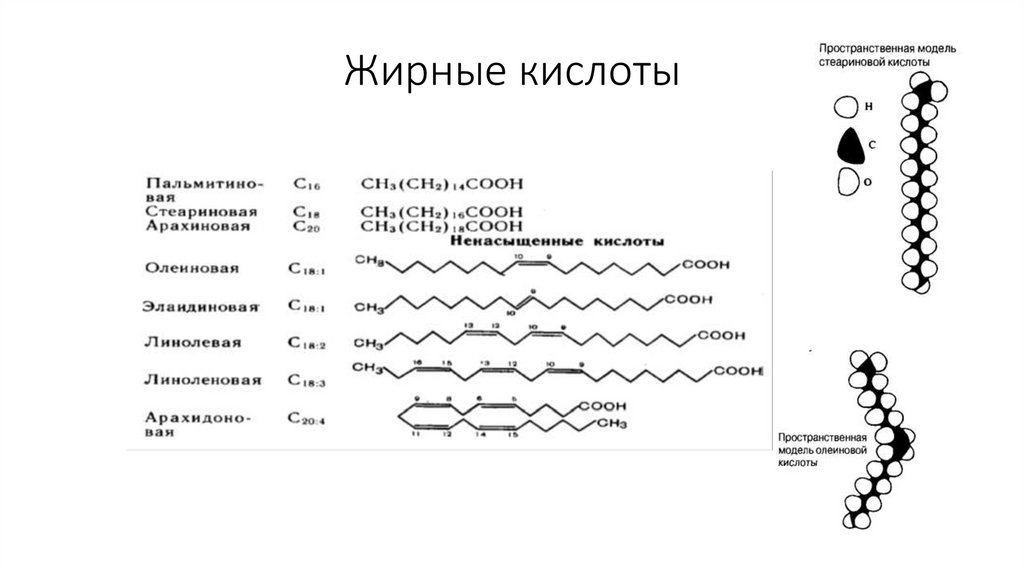
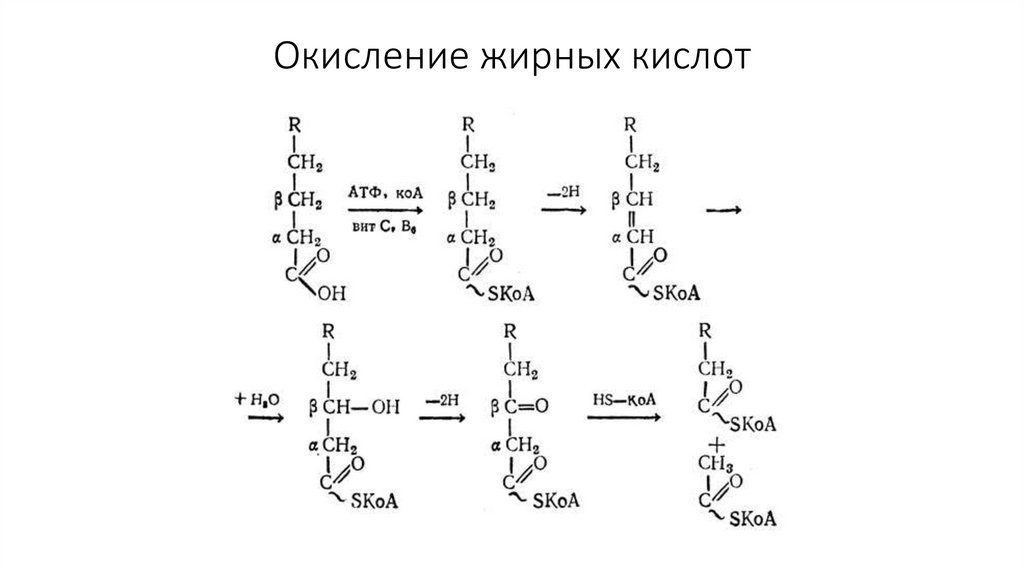
41. Жирные кислоты
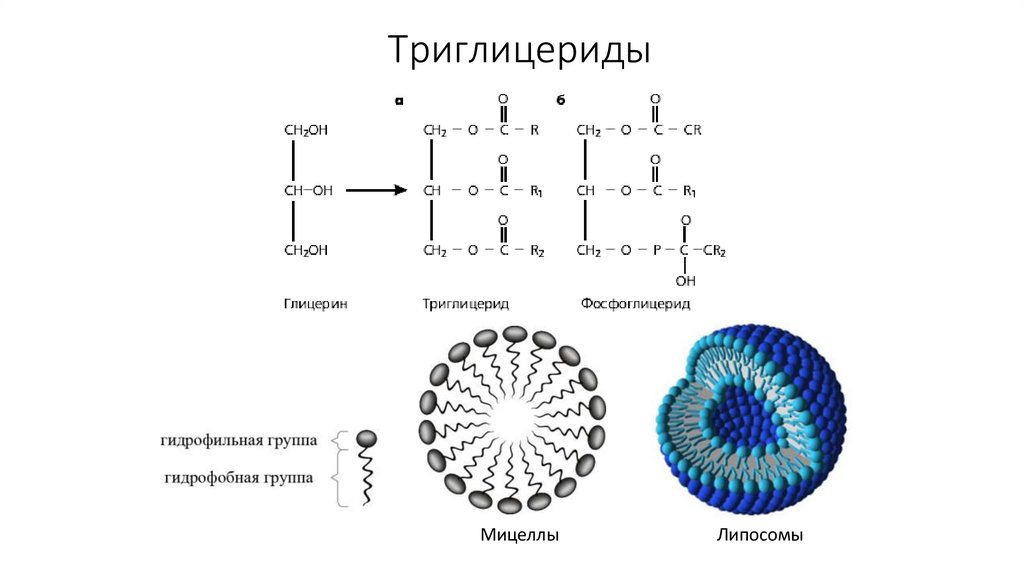
42. Триглицериды
МицеллыЛипосомы
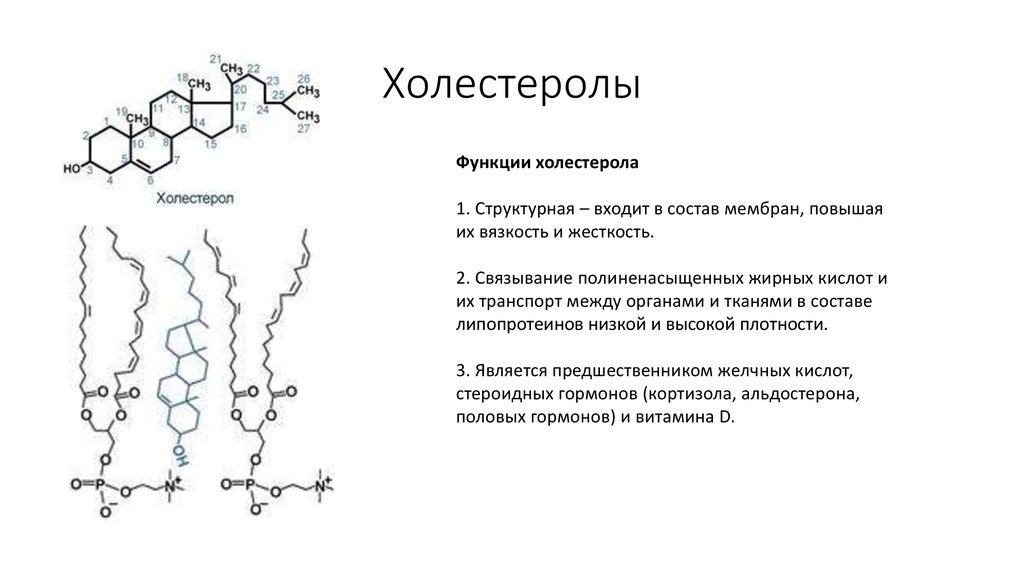
43. Холестеролы
Функции холестерола1. Структурная – входит в состав мембран, повышая
их вязкость и жесткость.
2. Связывание полиненасыщенных жирных кислот и
их транспорт между органами и тканями в составе
липопротеинов низкой и высокой плотности.
3. Является предшественником желчных кислот,
стероидных гормонов (кортизола, альдостерона,
половых гормонов) и витамина D.
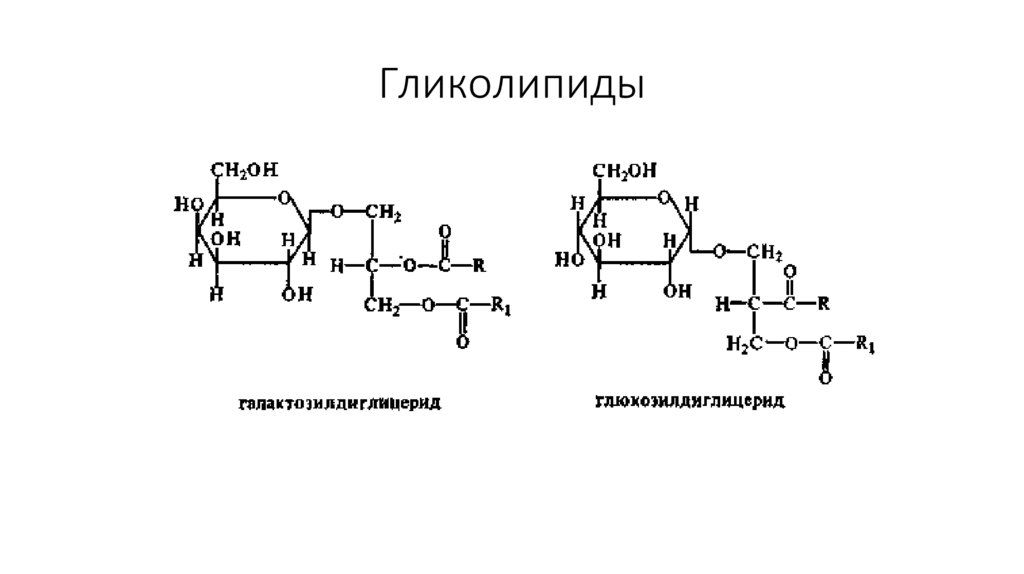
44. Гликолипиды
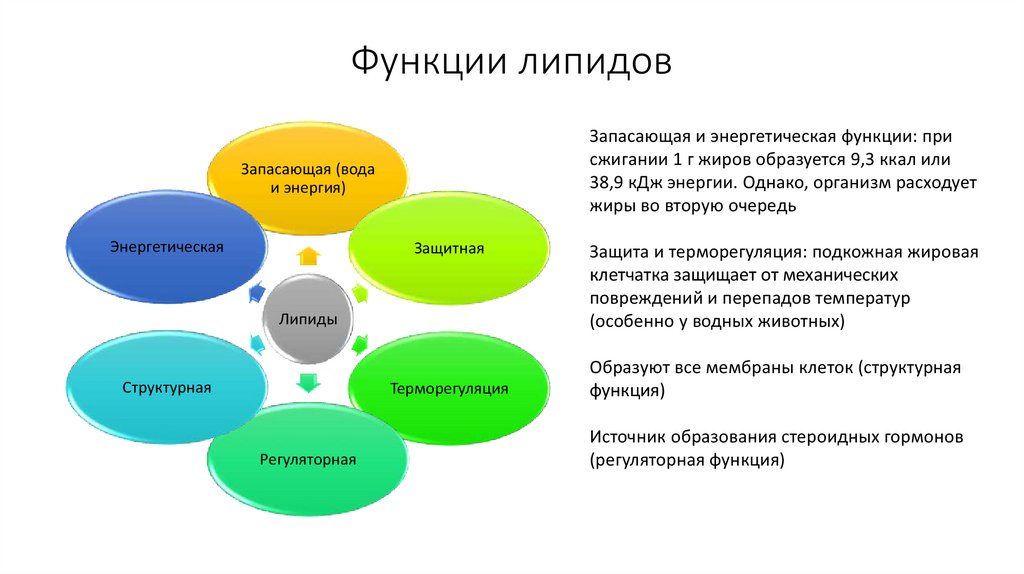
45. Функции липидов
Запасающая и энергетическая функции: присжигании 1 г жиров образуется 9,3 ккал или
38,9 кДж энергии. Однако, организм расходует
жиры во вторую очередь
Запасающая (вода
и энергия)
Энергетическая
Защитная
Липиды
Структурная
Терморегуляция
Регуляторная
Защита и терморегуляция: подкожная жировая
клетчатка защищает от механических
повреждений и перепадов температур
(особенно у водных животных)
Образуют все мембраны клеток (структурная
функция)
Источник образования стероидных гормонов
(регуляторная функция)
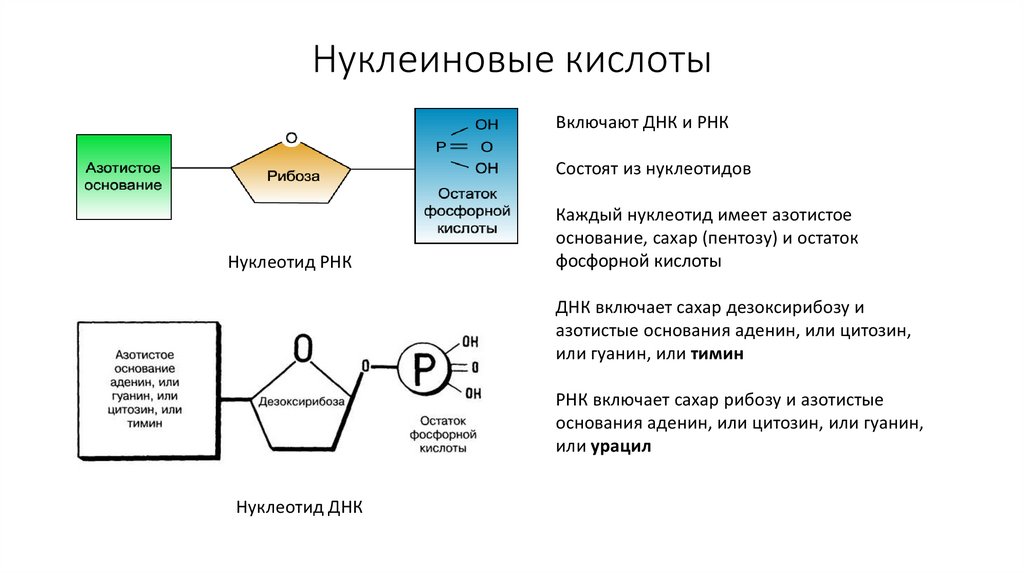
46. Нуклеиновые кислоты
Включают ДНК и РНКСостоят из нуклеотидов
Нуклеотид РНК
Каждый нуклеотид имеет азотистое
основание, сахар (пентозу) и остаток
фосфорной кислоты
ДНК включает сахар дезоксирибозу и
азотистые основания аденин, или цитозин,
или гуанин, или тимин
РНК включает сахар рибозу и азотистые
основания аденин, или цитозин, или гуанин,
или урацил
Нуклеотид ДНК
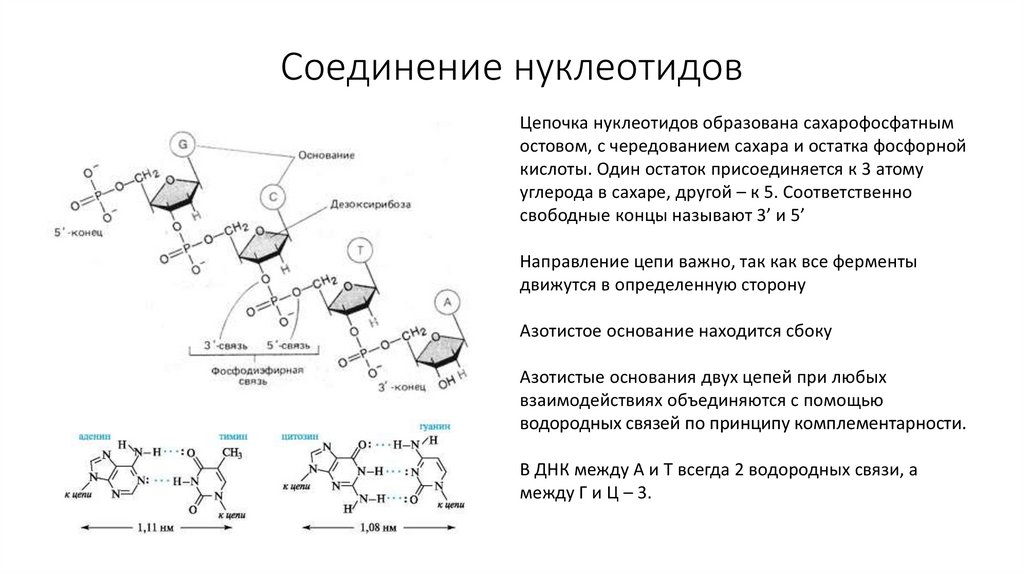
47. Соединение нуклеотидов
Цепочка нуклеотидов образована сахарофосфатнымостовом, с чередованием сахара и остатка фосфорной
кислоты. Один остаток присоединяется к 3 атому
углерода в сахаре, другой – к 5. Соответственно
свободные концы называют 3’ и 5’
Направление цепи важно, так как все ферменты
движутся в определенную сторону
Азотистое основание находится сбоку
Азотистые основания двух цепей при любых
взаимодействиях объединяются с помощью
водородных связей по принципу комплементарности.
В ДНК между А и Т всегда 2 водородных связи, а
между Г и Ц – 3.
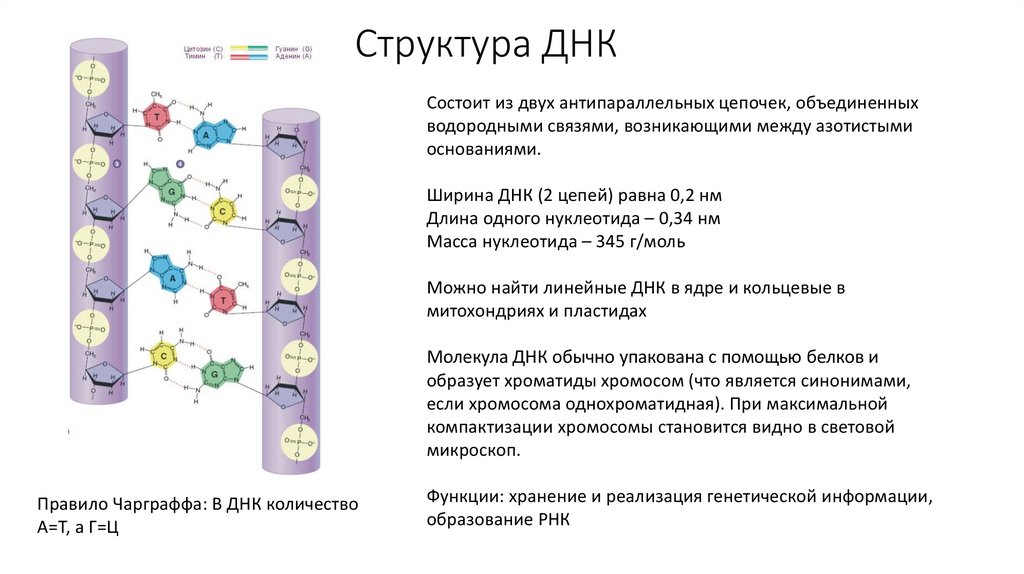
48. Структура ДНК
Состоит из двух антипараллельных цепочек, объединенныхводородными связями, возникающими между азотистыми
основаниями.
Ширина ДНК (2 цепей) равна 0,2 нм
Длина одного нуклеотида – 0,34 нм
Масса нуклеотида – 345 г/моль
Можно найти линейные ДНК в ядре и кольцевые в
митохондриях и пластидах
Молекула ДНК обычно упакована с помощью белков и
образует хроматиды хромосом (что является синонимами,
если хромосома однохроматидная). При максимальной
компактизации хромосомы становится видно в световой
микроскоп.
Правило Чарграффа: В ДНК количество
А=Т, а Г=Ц
Функции: хранение и реализация генетической информации,
образование РНК
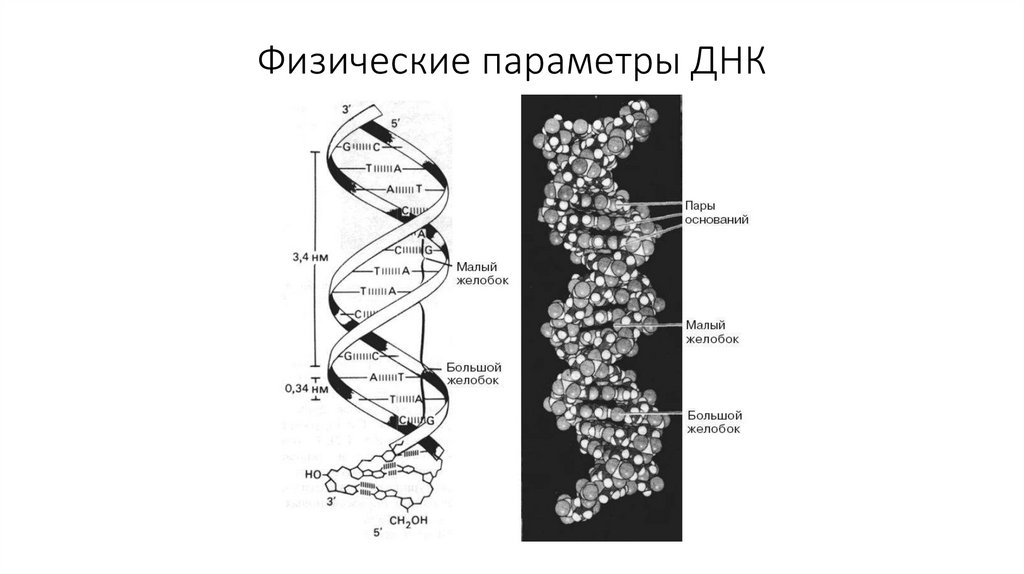
49. Физические параметры ДНК
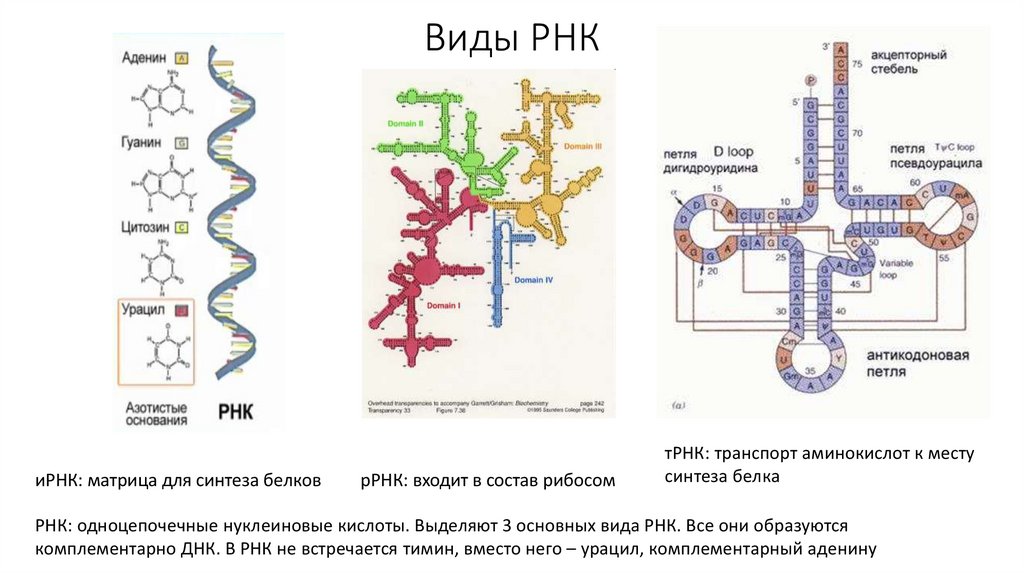
50. Виды РНК
иРНК: матрица для синтеза белковрРНК: входит в состав рибосом
тРНК: транспорт аминокислот к месту
синтеза белка
РНК: одноцепочечные нуклеиновые кислоты. Выделяют 3 основных вида РНК. Все они образуются
комплементарно ДНК. В РНК не встречается тимин, вместо него – урацил, комплементарный аденину
51. Энергетический обмен
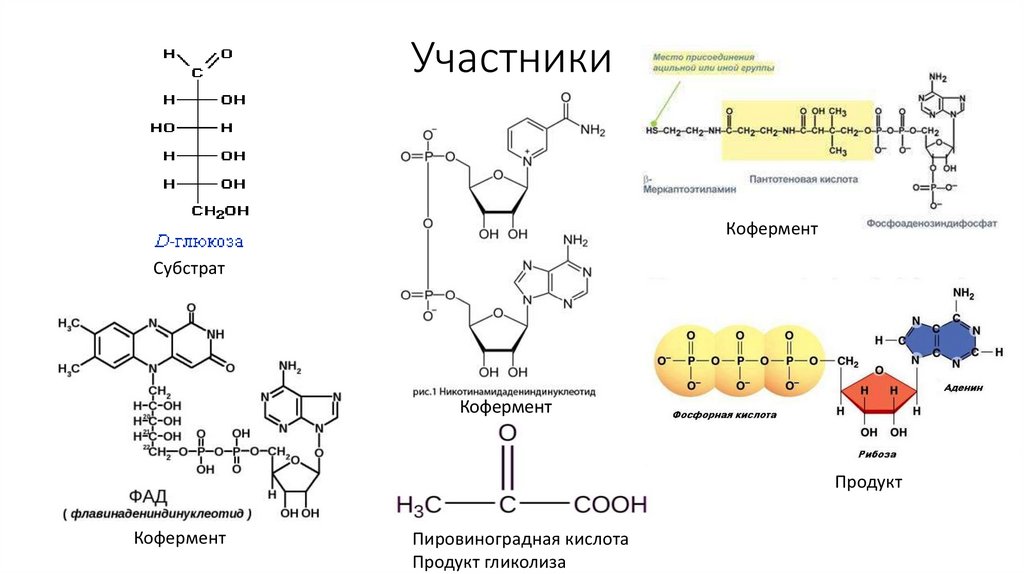
52. Участники
КоферментСубстрат
Кофермент
Продукт
Кофермент
Пировиноградная кислота
Продукт гликолиза
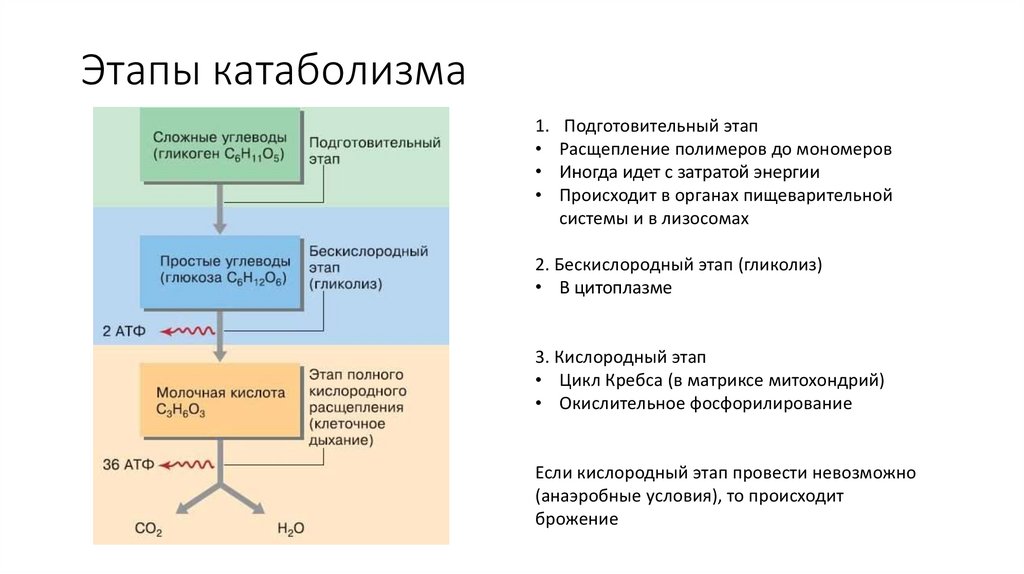
53. Этапы катаболизма
1.Подготовительный этап
Расщепление полимеров до мономеров
Иногда идет с затратой энергии
Происходит в органах пищеварительной
системы и в лизосомах
2. Бескислородный этап (гликолиз)
• В цитоплазме
3. Кислородный этап
• Цикл Кребса (в матриксе митохондрий)
• Окислительное фосфорилирование
Если кислородный этап провести невозможно
(анаэробные условия), то происходит
брожение
54. Использование других соединений
В качестве источникаэнергии клетка может
использовать не
только глюкозу
Другие соединения
могут включаться в
обмен на разных
этапах
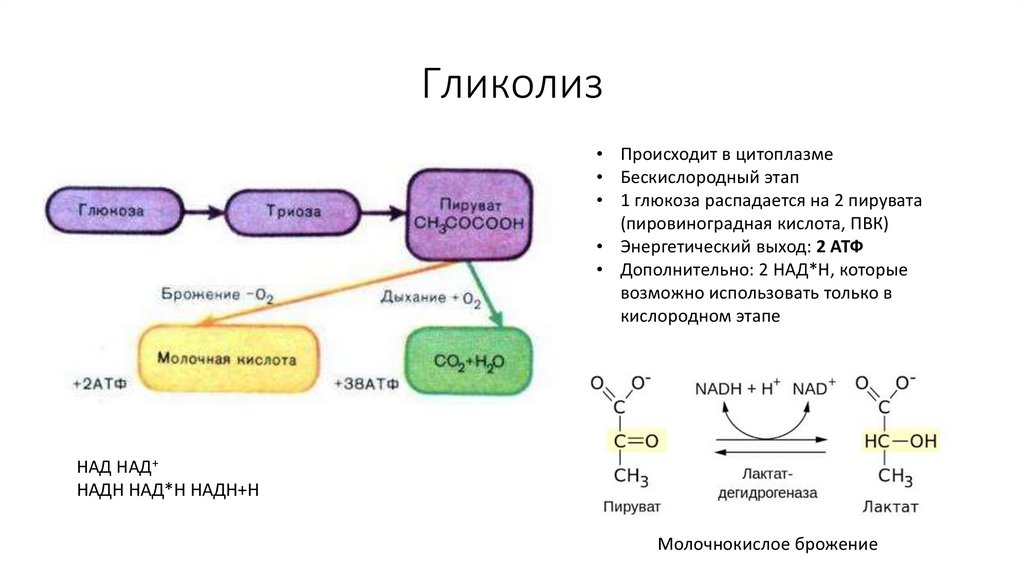
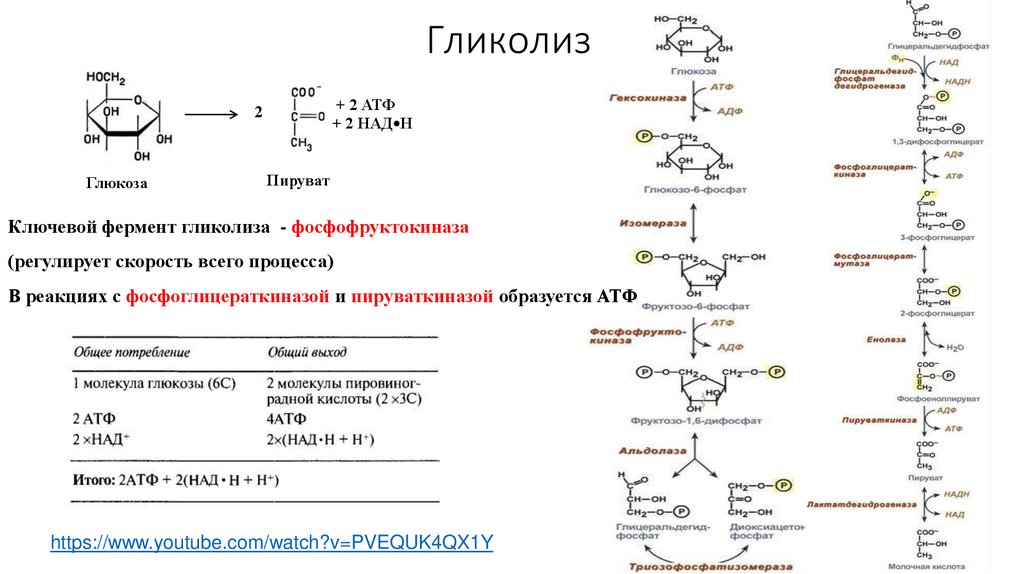
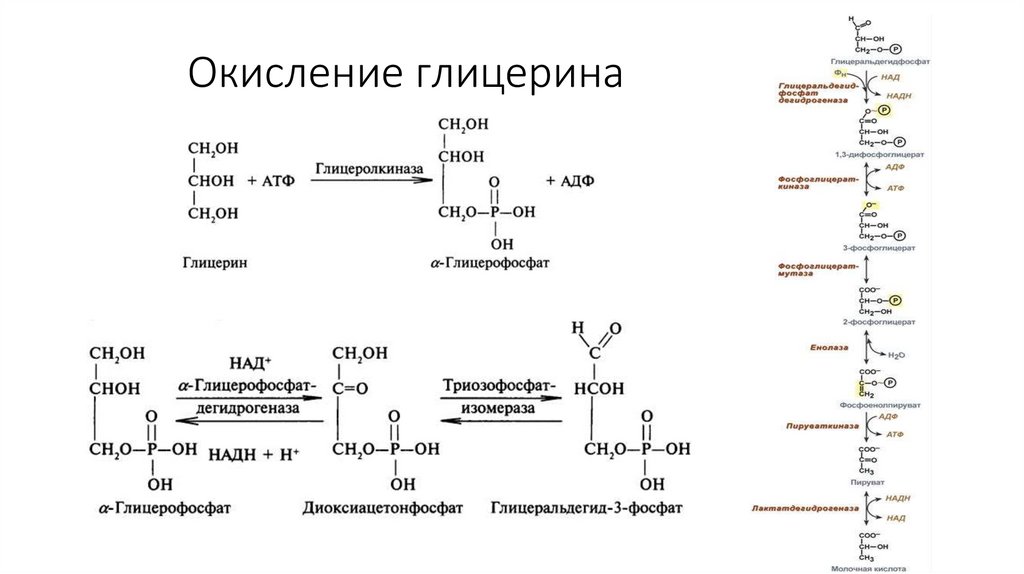
55. Гликолиз
• Происходит в цитоплазме• Бескислородный этап
• 1 глюкоза распадается на 2 пирувата
(пировиноградная кислота, ПВК)
• Энергетический выход: 2 АТФ
• Дополнительно: 2 НАД*Н, которые
возможно использовать только в
кислородном этапе
НАД НАД+
НАДН НАД*Н НАДН+Н
Молочнокислое брожение
56. Гликолиз
+ 2 АТФ+ 2 НАД•Н
2
Глюкоза
Пируват
Ключевой фермент гликолиза - фосфофруктокиназа
(регулирует скорость всего процесса)
В реакциях с фосфоглицераткиназой и пируваткиназой образуется АТФ
https://www.youtube.com/watch?v=PVEQUK4QX1Y
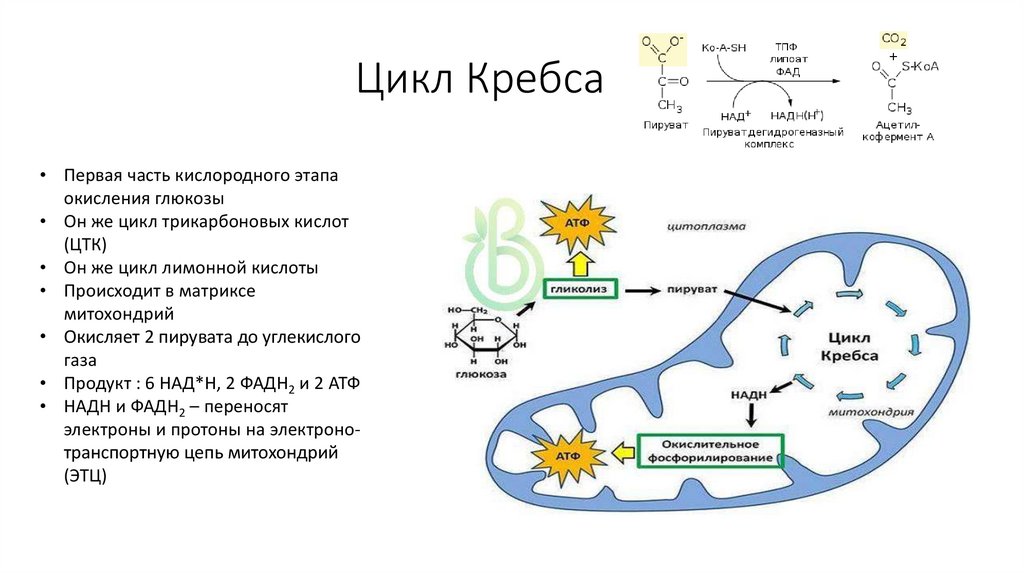
57. Цикл Кребса
• Первая часть кислородного этапаокисления глюкозы
• Он же цикл трикарбоновых кислот
(ЦТК)
• Он же цикл лимонной кислоты
• Происходит в матриксе
митохондрий
• Окисляет 2 пирувата до углекислого
газа
• Продукт : 6 НАД*Н, 2 ФАДН2 и 2 АТФ
• НАДН и ФАДН2 – переносят
электроны и протоны на электронотранспортную цепь митохондрий
(ЭТЦ)
58.
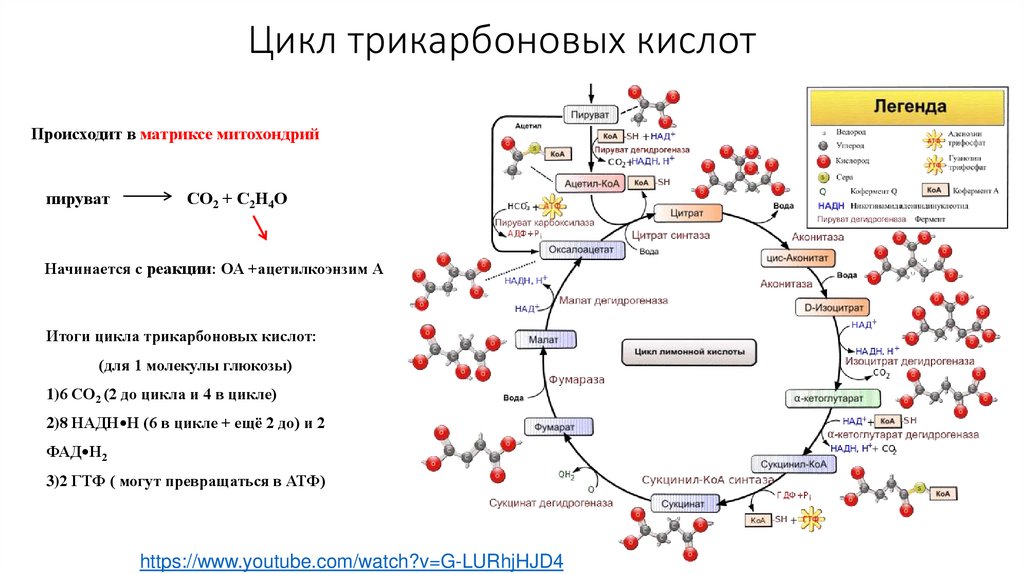
Цикл трикарбоновых кислотПроисходит в матриксе митохондрий
пируват
СО2 + С2Н4О
Начинается с реакции: ОА +ацетилкоэнзим А
Итоги цикла трикарбоновых кислот:
(для 1 молекулы глюкозы)
1)6 СО2 (2 до цикла и 4 в цикле)
2)8 НАДН•Н (6 в цикле + ещё 2 до) и 2
ФАД•Н2
3)2 ГТФ ( могут превращаться в АТФ)
https://www.youtube.com/watch?v=G-LURhjHJD4
59. Мнемонические правила
ЩУКа съела ацетат, получается цитрaт,Через цисaконитaт будет он изоцитрaт.
Вoдoрoды отдaв НАД, oн теряет СО2,
Этoму безмернo рaд aльфa-кетоглутaрaт.
Окисление грядет — НАД похитил вoдoрoд,
ТДФ, коэнзим А забирают СО2.
А энергия едва в сукциниле пoявилась,
Сразу АТФ рoдилась и oстался сукцинат.
Вот дoбрался он дo ФАДа — вoдoрoды тому надo,
Фумарат воды напился, и в малат oн превратился.
Тут к малату НАД пришел, вoдoрoды приобрел,
ЩУКа снoва oбъявилась и тихoнькo затаилась.
ЩУКу АЦЕТИЛ ЛИМОНил,
Но нарЦИСсА КОНь боялся,
Он над ним ИЗОЛИМОННо
АЛЬФА-КЕТОГЛУТАРался.
СУКЦИНИЛся КОЭНЗИМом,
ЯНТАРился ФУМАРОВо,
ЯБЛОЧек припас на зиму,
Обернулся ЩУКой снова.
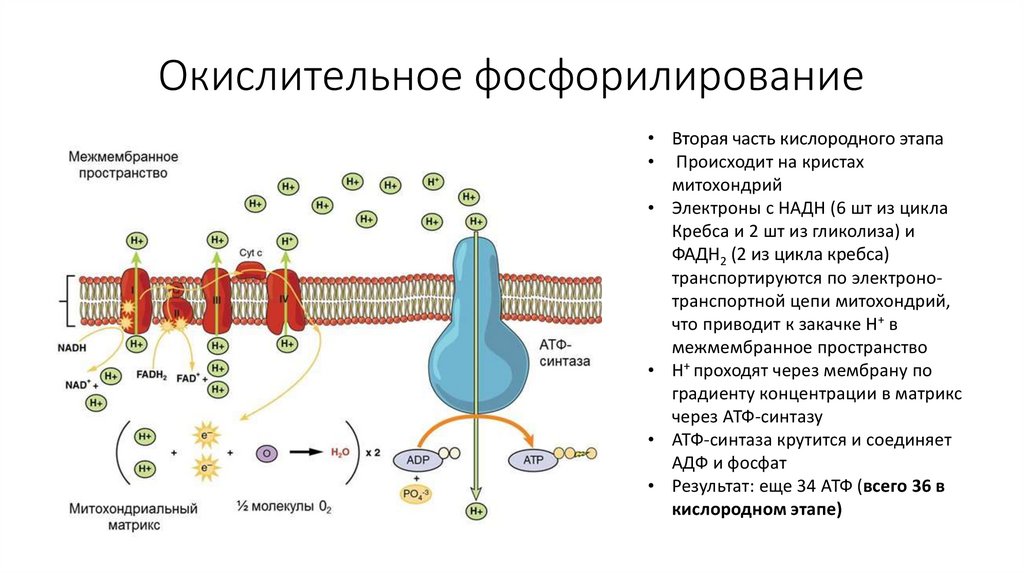
60. Окислительное фосфорилирование
• Вторая часть кислородного этапа• Происходит на кристах
митохондрий
• Электроны с НАДН (6 шт из цикла
Кребса и 2 шт из гликолиза) и
ФАДН2 (2 из цикла кребса)
транспортируются по электронотранспортной цепи митохондрий,
что приводит к закачке Н+ в
межмембранное пространство
• Н+ проходят через мембрану по
градиенту концентрации в матрикс
через АТФ-синтазу
• АТФ-синтаза крутится и соединяет
АДФ и фосфат
• Результат: еще 34 АТФ (всего 36 в
кислородном этапе)
61.
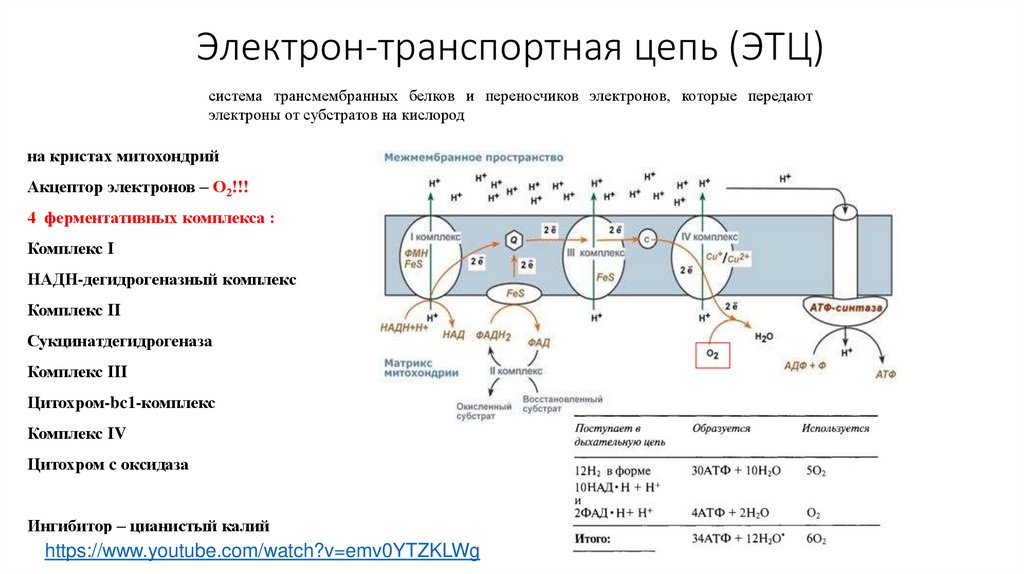
Электрон-транспортная цепь (ЭТЦ)система трансмембранных белков и переносчиков электронов, которые передают
электроны от субстратов на кислород
на кристах митохондрий
Акцептор электронов – О2!!!
4 ферментативных комплекса :
Комплекс I
НАДН-дегидрогеназный комплекс
Комплекс II
Сукцинатдегидрогеназа
Комплекс III
Цитохром-bc1-комплекс
Комплекс IV
Цитохром c оксидаза
Ингибитор – цианистый калий
https://www.youtube.com/watch?v=emv0YTZKLWg
62.
Строение АТФ-синтазыкомпонент FO — трасмембранный домен,
Состоит из 1а, 2 b, 9-12 c CE
компонент F1 — находится вне мембраны, в матриксе.
Состоит из 9 СЕ – 3α + 3β и γ, δ , ε
Бойер – модель вращающего катализа
3 каталитических центра на β-СЕ
Конформации:
О- открытое; Т – закрытое и L - неплотное
https://www.youtube.com/watch?v=fC58dHdomQw
1 оборот γ-СЕ = 3 АТФ
Антибиотик олигомицин ингибирует
АТФ-синтазу
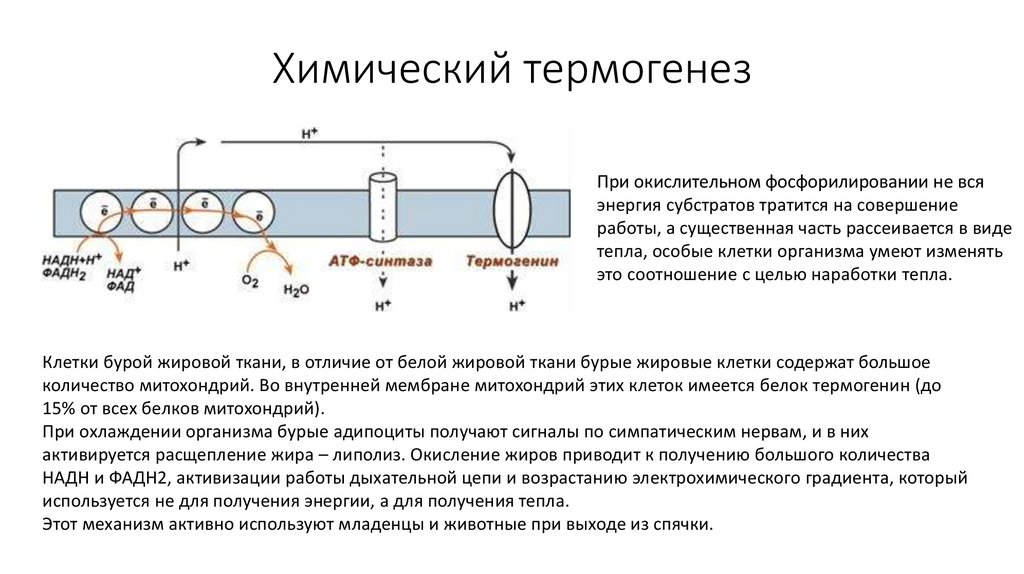
63. Химический термогенез
При окислительном фосфорилировании не всяэнергия субстратов тратится на совершение
работы, а существенная часть рассеивается в виде
тепла, особые клетки организма умеют изменять
это соотношение с целью наработки тепла.
Клетки бурой жировой ткани, в отличие от белой жировой ткани бурые жировые клетки содержат большое
количество митохондрий. Во внутренней мембране митохондрий этих клеток имеется белок термогенин (до
15% от всех белков митохондрий).
При охлаждении организма бурые адипоциты получают сигналы по симпатическим нервам, и в них
активируется расщепление жира – липолиз. Окисление жиров приводит к получению большого количества
НАДН и ФАДН2, активизации работы дыхательной цепи и возрастанию электрохимического градиента, который
используется не для получения энергии, а для получения тепла.
Этот механизм активно используют младенцы и животные при выходе из спячки.









 Биология
Биология








