Похожие презентации:
Элементы VIА группы
1. Элементы VIА группы
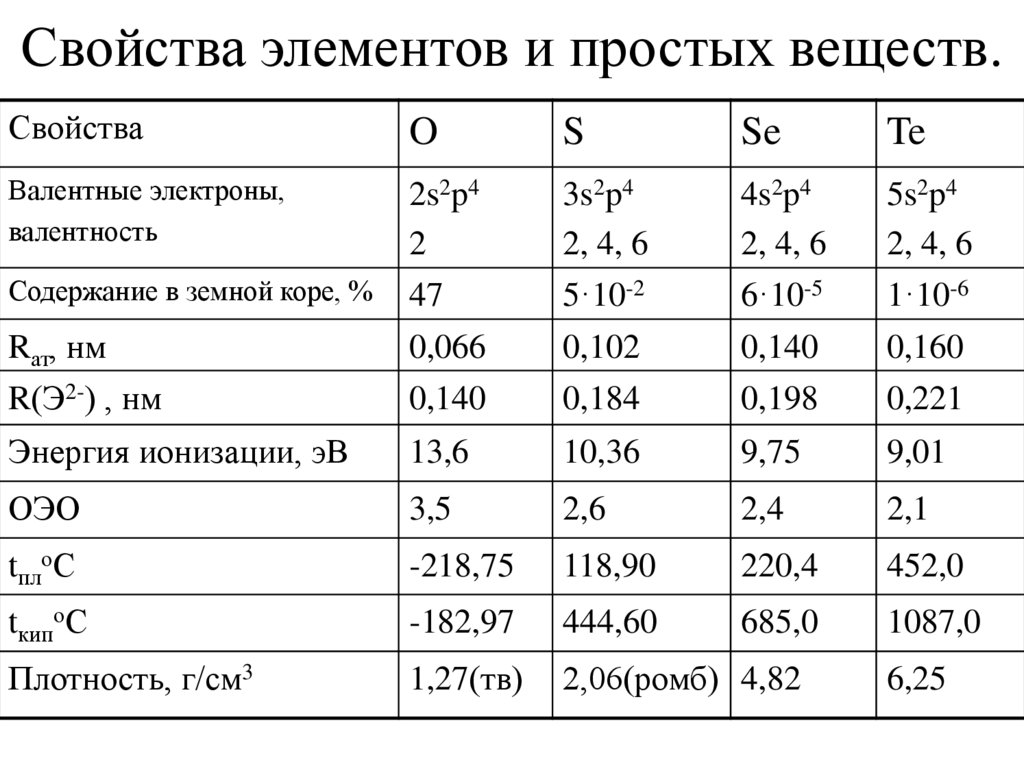
Кислород и сера2. Свойства элементов и простых веществ.
СвойстваO
S
Se
Te
Валентные электроны,
валентность
Содержание в земной коре, %
2s2p4
2
47
3s2p4
2, 4, 6
5·10-2
4s2p4
2, 4, 6
6·10-5
5s2p4
2, 4, 6
1·10-6
Rат, нм
R(Э2-) , нм
0,066
0,140
0,102
0,184
0,140
0,198
0,160
0,221
Энергия ионизации, эВ
13,6
10,36
9,75
9,01
ОЭО
3,5
2,6
2,4
2,1
tплоС
-218,75
118,90
220,4
452,0
tкипоС
-182,97
444,60
685,0
1087,0
Плотность, г/см3
1,27(тв)
2,06(ромб) 4,82
6,25
3. Кислород
• В природе - входит в состав: Н2О, кварца,карбонатов, силикатов, алюмосиликатов, живых
организмов. Составляет 21% воздуха по объему.
• На высоте 25 км образует озоновый экран (О3).
• Получение. В промышленности:
1)ректификация жидкого воздуха, 2)электролиз
Н2О.
2)В лаборатории - термическое разложение
KMnO4 при 250оС, и KClO3 при 400оС:
2KMnO4=K2MnO4+MnO2+O2
2KClO3=2KCl+3O2
4. Свойства кислорода
• Физические: бесцветных газ, не имеющийзапаха, тяжелее воздуха, мало растворим в воде
(в 100 об. Н2О – 5 об. О2 при 0оС).
• Химические. Образует соединения со всеми
элементами кроме He, Ne, Ar.
Непосредственно не взаимодействует только с
галогенами, Au, Pt.
Белый фосфор (Р4), Ba, Rb, Cs + O2 →
самовоспламенение.
С др. в-вами взаимодействует при нагревании,
облучении или в присутствии катализатора.
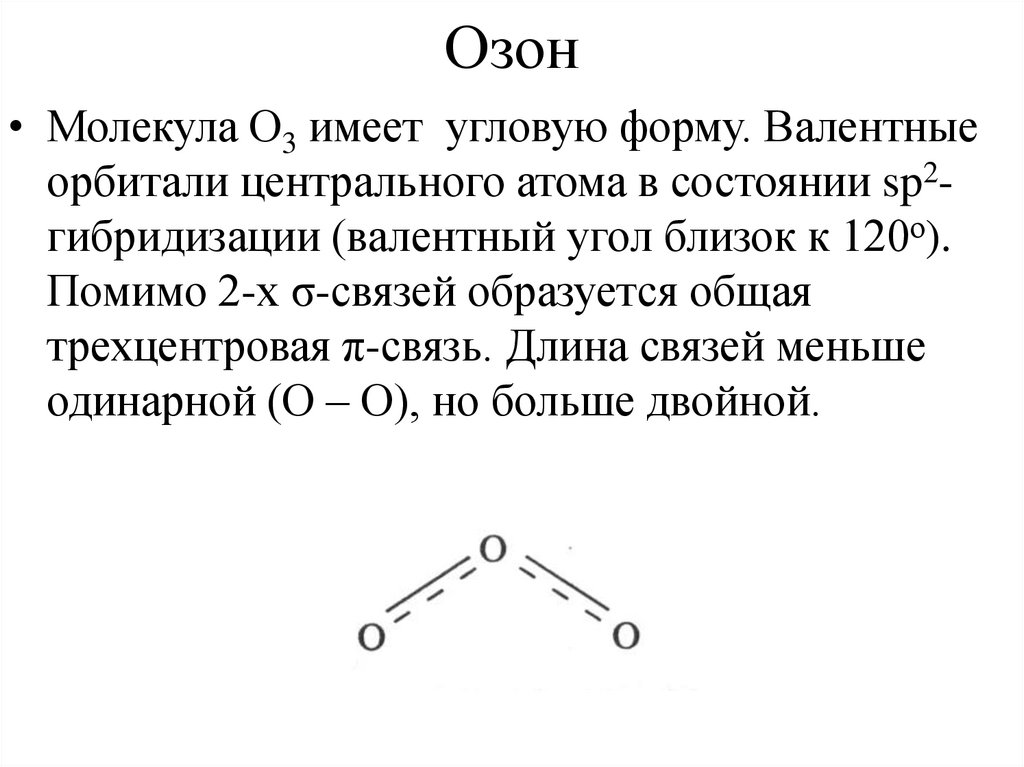
5. Озон
• Молекула О3 имеет угловую форму. Валентныеорбитали центрального атома в состоянии sp2гибридизации (валентный угол близок к 120о).
Помимо 2-х σ-связей образуется общая
трехцентровая π-связь. Длина связей меньше
одинарной (О – О), но больше двойной.
6. Свойства озона
• Бесцветный газ с резким запахом, растворяется вводе ( в 100 об Н2O - 49 об. О3), в жидком
состоянии имеет синюю окраску, tкип=-111,9оС
(выше чем у О2), ядовит.
• О3 – сильный окислитель. Окисляет металлы
(кроме Au, Pt), неметаллы, сложные вещества.
Качественная реакция:
2KI+H2O+O3=I2+2KOH+O2
• Получение – действием тихого электрического
разряда на О2 в озонаторе.
7. Применение кислорода и озона
• О2 – интенсификация процессов в производствеH2SO4, HNO3, чугуна, стали.
Получение высоких to в ацетиленовых и
водородных горелках.
В медицине - при затрудненном дыхании.
• О3 – обеззараживание воды и дезинфекция
воздуха.
Окислитель в органической химии, реактивной
технике.
8. Сера
• Нахождение в природе: FeS2 – пирит, CuFeS2- медныйколчедан, PbS – свинцовый блеск, ZnS – цинковая
обманка, CaSO4·2H2O –гипс, Na2SO4·10H2O –
мирабилит.
• Получение – выплавление из горных пород
самородной серы;
разложение полисульфидов: FeS2=tFeS+S;
из газов, образующихся при коксовании и
газификации угля:
2H2S+3O2=2H2O+2SO2,
2H2S+SO2=2H2O+3S↓.
9. Аллотропия серы
• Sромбическая - -сера – хрупкие, желтые кристаллы беззапаха, нерастворимые в воде, хорошо растворимы в
сероуглероде (циклические молекулы S8).
• Sмоноклинная – β-сера образуется при t>95,4оС, светложелтые пластинчатые кристаллы (S8).
• Пластическая – темная резиноподобная масса,
образуется, при быстром охлаждении водой
расплавленной и выдержанной при 250оС S.
10. Химические свойства серы
• При to взаимодействует с простыми веществамикроме: инертных газов, N2, Se, Te, I2 , Au.
• Восстанавливается:
S+Zn=ZnS2S+H2=H2S2• Окисляется:
S+O2=SO2
S+4HNO3(к)=H2SO3+4NO2↑+H2O
2S+3O2+4NaOH(расплав) =2Na2SO4+2H2O
• Диспропорционирует:
3S+6NaOH(р-р)=t 2Na2S+Na2SO3+3H2O.
11. Соединения серы в С.О. 2-
Соединения серы в С.О. 2• H2S – сероводород – бесцветный ядовитый газ с запахом тухлыхяиц, растворим (1v H2O:3v H2S). Форма молекулы –
равнобедренный треугольник.
• Сильный восстановитель - горит на воздухе, окисляется
галогенами:
2H2S+3O2=2SO2+2H2O,
2H2S+O2=2H2O+2S;
H2S+Br2=2HBr+S
• В воде - сероводородная кислота – слабая :
• H2S↔H++HS- (K1=8,7·10-8)
HS-↔H++S2- (K2=1,3·10-13)
• Сульфиды – соли сероводородной кислоты. Растворимые соли
щелочных Ме подвергаются гидролизу:
S2-+HOH=OH-+ HS-,
K2S+HOH=KOH+KHS
гидросудьфид калия (кислая соль)
12. Химические свойства сульфидов
• Восстановительные свойства:2Na2S+3O2=2Na2SO3 (сульфит)
Na2S+2O2=t Na2SO4 (сульфат).
• Нерастворимые сульфиды получают реакциями обмена:
CuSO4+H2S=H2SO4+CuS↓ (ПР=3,2·10-38)
CuS, HgS не растворяются в H2SO4..
• Другие сульфиды:
FeS+H2SO4=H2S↑+FeSO4 (ПР(FeS)= 5·10-18 )
FeS нельзя получить действием H2S на р-р соли, но
можно - реакцией между солями:
Na2S+FeSO4=FeS↓+Na2SO4
S2-+Fe2+=FeS↓
13. Соединения серы в С.О. +4
• SO2 – оксид серы(IV) –бесцветный газ с резким запахомгорящей серы, растворим в воде (1v H2O:40v SO2 при
20оС).
• Сернистая кислота – H2SO3:
H2O+SO2<=>H2SO3 <=> H++HSO3- <=> 2H++SO32Непрочная, слабая (K1=1,3·10-2; K2=6,8·10-8),
двухосновная кислота образует сульфиты(Na2SO3) и
гидросульфиты (NaHSO3).
• Восстановительные св-ва: 2H2SO3+O2=2H2SO4
• Окислительные св-ва: H2SO3+2H2S=3S+3H2O
• Сульфиты наиболее активных металлов
диспропорционируют при прокаливании:
4Na2SO3=tNa2S+3Na2SO4.
Гидролизуются по аниону:
Na2SO3+HOH=NaHSO3+NaOH.
14. Соединения серы в С.О. +6
• SO3 – оксид серы(VI) – бесцветная, легкоподвижная жидкость.
• Форма молекулы – плоский правильный Δ, в
центре - S (sp2-гибридизация, валентный
∟OSO=120о).
• Получают каталитическим окислением SO2:
2SO2+O2= 2SO3
• Сильный окислитель: 2SO3+C=CO2+SO2
• Образует H2SO4 :
SO3+H2O=H2SO4
15. Серная кислота и её соли
• H2SO4 - бесцветная, маслянистая, гигроскопичнаяжидкость.
• Сильный окислитель ( в р-циях с Ме, неМе и сложными
в-вами):
8HI+H2SO4=4I2+H2S+4H2O
C+2H2SO4=CO2+2SO2+2H2O
• Сильная двухосновная кислота:
H2SO4→H++HSO4-,
HSO4-↔SO42-+H+ (K2=10-2).
• Соли – сульфаты: K2SO4, MgSO4, CaSO4, CuSO4;
гидросульфаты: NaHSO4, KHSO4.
• Нерастворимые: BaSO4, SrSO4, PbSO4.
Качественная реакция на ионы SO42-:
SO42-+Ba2+=BaSO4↓
16. Тиосерная кислота и ее соли
• Тиосерная кислота – H2S2O3 – неустойчива,распадается при комнатной температуре.
• С.О. атомов S +4 и 0:
H2S2O3=H2O+SO2↑+S↓
• Na2S2O3·5H2O – тиосульфат натрия восстановитель:
Na2S2O3+4Cl2+5H2O=2H2SO4+2NaCl+6HCl
• Получение - кипячение р-ра Na2SO3 с S:
S+Na2SO3=Na2S2O3
17. Применение серы и ее соединений.
• S – вулканизация каучука (получение резины иэбонита), для уничтожения вредных насекомых,
получения ультрамарина, спичек, сероуглерода, серной
кислоты, лечения кожных заболеваний.
• Сульфиды Fe, Pb, Zn – сырье для получения цветных
металлов. Сульфиды щелочных и щелочно-земельных
металлов – в кожевенном производстве. Некоторые
сульфиды – полупроводники, применяются в
электронике.
• Сульфиты Na, K – для отбеливания некоторых
материалов, при крашении тканей. Ca(HSO3)2 – в
производстве бумаги из древесины.
• H2SO4 – производство кислот, щелочей, удобрений,
хлора, взрывчатых веществ, очистка нефтепродуктов,
травление металлов, изготовление красок и т.д.















 Химия
Химия








