Похожие презентации:
Закономерности в таблице Д. И. Менделеева
1. Задание
2. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
Физический смысл порядкового номера:порядковый номер равен числу
протонов и электронов и заряду ядра
Физический смысл номера периода:
номер
периода
равен
числу
заполняемых электронных слоёв
Физический смысл номера группы:
номер главной подгруппы равен
числу электронов на внешнем слое
(валентных электронов)
3. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
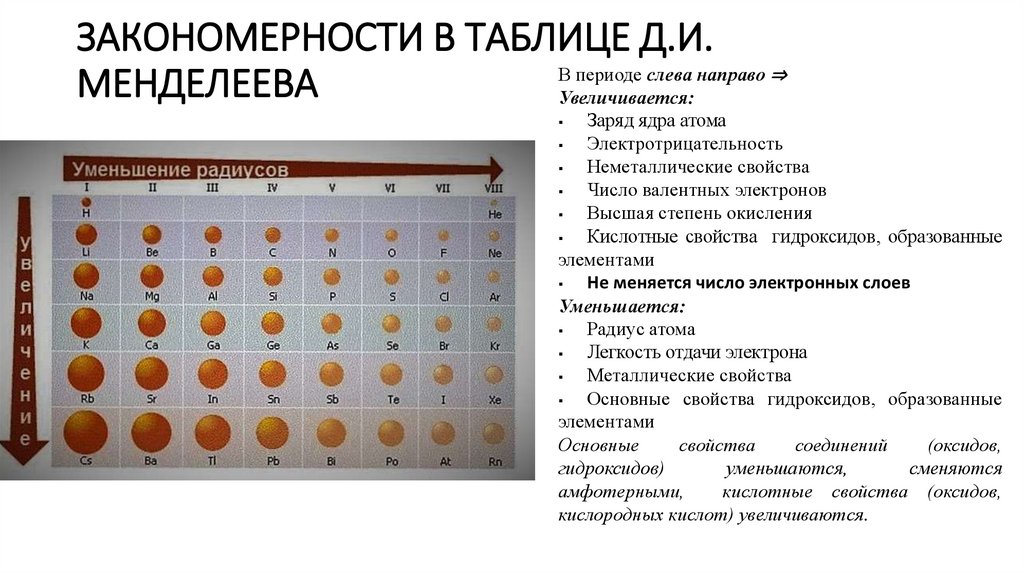
ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И.В периоде слева направо ⇒
МЕНДЕЛЕЕВА
Увеличивается:
Заряд ядра атома
Электротрицательность
Неметаллические свойства
Число валентных электронов
Высшая степень окисления
Кислотные свойства гидроксидов, образованные
элементами
Не меняется число электронных слоев
Уменьшается:
Радиус атома
Легкость отдачи электрона
Металлические свойства
Основные свойства гидроксидов, образованные
элементами
Основные
свойства
соединений
(оксидов,
гидроксидов)
уменьшаются,
сменяются
амфотерными,
кислотные свойства (оксидов,
кислородных кислот) увеличиваются.
4. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И.В группе сверху вниз ⇓
МЕНДЕЛЕЕВА
Увеличивается:
Заряд ядра атома;
Радиус атома
Легкость отдачи электрона
Металлические свойства
Основные свойства гидроксидов, образованные
элементами
Число электронных слоев
Основные свойства соединений (оксидов, гидроксидов)
увеличиваются, кислотные свойства соединений
(оксидов, кислородных кислот) уменьшаются;
Кислотные
свойства
бескислородных
кислот
увеличиваются.
Уменьшается:
Электроотрицательность
Неметаллические свойства
Кислотные
свойства
соединений
(оксидов,
кислородных кислот) уменьшаются
5.
решитеВ ряду химичeских элементов Si – P – S
1. Увеличивается число валентных электронов в атомах
2. Уменьшается число валентных электронов в атомах
3. Уменьшается число протонов в ядрах атомов
4. Увеличиваются радиусы атомов
6.
Степень окисленияВалентность
Определение Условный заряд атома в
молекуле, вычисленный исходя
из предположения, что все
связи в молекуле – ионные.
Число химических
связей, которые
образует атом в
химическом
соединении.
Знак
Валентность не имеет
знака.
Имеет знак – она может быть
отрицательной, нулевой или
положительной.
Обозначение Арабские цифры со знаком
Римские цифры
Примеры
N (V), C (IV)
Cl (-1), Fe (+3)
7. Правила подсчета степени окисления
• Степень окисления элемента в составе простого веществапринимается равной нулю
• Ряд элементов проявляют в соединениях постоянную степень
(табл.растворимости)
• Кислород, как правило, проявляет степень окисления -2 (искл:
пероксид Н2О2(-1) и фторид кислорода OF2 (+2)).
• Водород в соединениях с металлами (в гидридах) проявляет степень
окисления -1, как правило, +1(кроме SiH4, B2H6).
• Алгебраическая сумма степеней окисления всех атомов в молекуле
должна быть равной нулю, а в сложном ионе – заряду этого иона.
8.
решите1) Степени окисления фосфора в соединениях
K3PO4 и Mg3P2 соответственно равны:
1. +5 и -3
2. +5 и +3
3. +3 и +5
4. +2 и -3
2) Максимальная валентность атома фосфора:
1. +5
2. V
3. +4
4. IV
9. Теория к заданию №8 ОГЭ по химии
• Реакция ионного обмена - одна из видов химических реакций,продуктами которой являются вода, газ или осадок
На практике чаще всего мы сталкиваемся с реакциями в
растворах, в результате которых образуется осадок, либо
газ, либо вода. Чаще всего это реакции обмена.
Пример - реакция карбоната натрия и серной кислоты с
выделением углекислого газа:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
10.
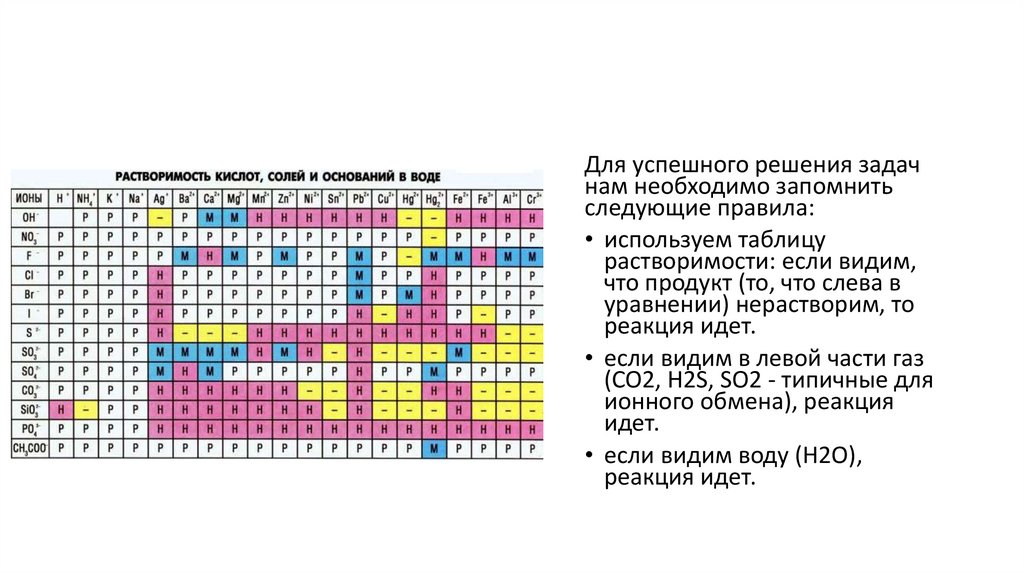
Для успешного решения задачнам необходимо запомнить
следующие правила:
• используем таблицу
растворимости: если видим,
что продукт (то, что слева в
уравнении) нерастворим, то
реакция идет.
• если видим в левой части газ
(CO2, H2S, SO2 - типичные для
ионного обмена), реакция
идет.
• если видим воду (H2O),
реакция идет.
11. Правила подсчета валентности
Валентные возможности атома определяются числом:• Неспаренных электронов.
• Неподелённых электронных пар.
• Вакантных валентных пар.
Примеры: Н –водород IА группа, имеет 1 валентный электрон,
образует 1 ковалентную связь с каким-либо другим атомом.
Валентность I.
12.
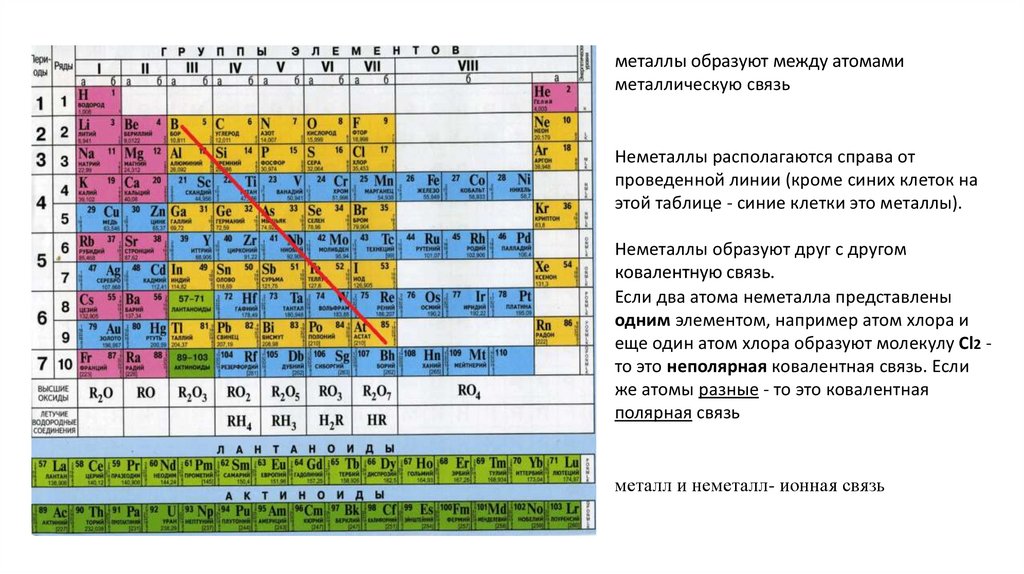
металлы образуют между атомамиметаллическую связь
Неметаллы располагаются справа от
проведенной линии (кроме синих клеток на
этой таблице - синие клетки это металлы).
Неметаллы образуют друг с другом
ковалентную связь.
Если два атома неметалла представлены
одним элементом, например атом хлора и
еще один атом хлора образуют молекулу Cl2 то это неполярная ковалентная связь. Если
же атомы разные - то это ковалентная
полярная связь
металл и неметалл- ионная связь
13. решите
Веществами с ионной и ковалентной полярной связью являютсясоответственно
1. Сероводород и фторид цезия
2. Хлорид натрия и кислород
3. Фосфид кальция и оксид азота(IV)
4. Кислород и озон
14. Теория к заданию №9 ОГЭ по химии
Химические свойства металлов1. металлы реагируют с неметаллами всегда
2. металлы реагируют с кислотами
Записать
3. металлы реагируют с кислородом
Химические свойства неметаллов
1. неметаллы реагируют с металлами
2. неметаллы реагируют с водородом
3. неметаллы реагируют с кислородом
и Выучить
15.
С водой реагируют металлы, стоящие в ряду напряженийдо алюминия:
16. решите
• Не реагируют друг с другом1.
хлор и водород
2.
кислород и кальций
3.
азот и вода
4.
железо и сера
• Какой из указанных металлов
проявляет наибольшую химическую
активность в реакции с водой?
1. кальций
2. алюминий
3. свинец
4. железо
1.
2.
3.
4.
1.
2.
3.
4.
С водой при комнатной температуре реагирует
Сu
Ag
Са
Hg
В реакцию с соляной кислотой вступает каждый
из двух металлов:
Hg и Ag
Fe и Zn
Аu и Сu
Zn и Ag
17. Теория к заданию №10 ОГЭ по химии
Химические свойства оксидов• оксиды реагируют с водой
• основные оксиды реагируют с кислотами
• кислотные оксиды реагируют с основаниями
• амфотерные металлы и их оксиды - цинк и алюминий - реагируют и с кислотами, и с
основаниями
• основания реагируют как с кислотами, так и с амфотерными основаниями (цинк и алюминий)
• кислоты реагируют как с основаниями, так и с амфотерными основаниями (цинк и алюминий)
Многие варианты построены на свойстве амфотерности, поэтому про алюминий и цинк
необходимо помнить всегда.
18. решите
• Оксид цинка реагирует с каждым из двух веществ:1. Na2O и H2O
2. SiO2 и Ag
3. NaOH и HCl
4. HNO3 и O2
19. РАЗБОР И РЕШЕНИЕ ЗАДАНИЯ №11 ОГЭ ПО ХИМИИ ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ И ОСНОВАНИЙ
• Кислоты• Напомню, что кислоты - это химические соединения,
диссоциирующие на протоны (H+). Примеры простейших кислот соляная (HCl), серная (H2SO4), азотная (HNO3).
• Основания
• Основания же - вещества, диссоциирующие на гидроксид ионы
(OH-).
20. Химические свойства кислот
1.реакция с основными оксидами: В данной реакции продуктами
являются соль и вода
2.
3.
реакция с амфотерными оксидами соль + вода
реакция кислот со щелочами носит название нейтрализации
:продуктами являются соль и вода.
обменные реакции с солями, если в результате реакции образуется
нерастворимое вещество (осадок) либо газ.
реакция с нерастворимыми основаниями: соль и вода
реакция с металлами, стоящими в ряду напряжений до водорода - с
4.
5.
6.
выделением водорода
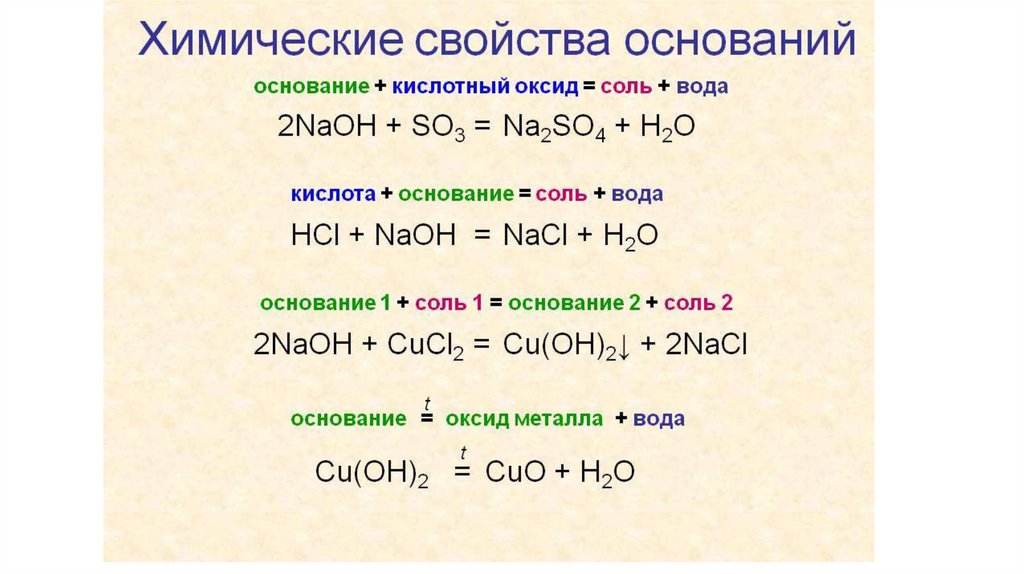
21. химические свойства оснований
1. вышеприведенная реакция с кислотами - реакциянейтрализации
2. реакция с амфотерными основаниями: соли
3. реакция с кислотными оксидами с образованием соли и воды.
4. обменные реакции с солями, если образуется осадок или газ
(аммиак).
22. решите
• В реакцию с соляной кислотой вступает:1. нитрат серебра
2. нитрат бария
3. серебро
4. оксид кремния




















 Химия
Химия








