Похожие презентации:
Общие положения ТКП
1.
Общие положения ТКПТКП – теория кристаллического поля (Бете, 1929)
1. Рассматриваются соединения, состоящие из катиона
d-металла и лигандов, связанных электростатическим
взаимодействием (лиганды – ионы или диполи).
2. Лиганды рассматриваются только как точечные
заряды, являющиеся источником электростатического
поля. Может учитываться радиус, но не структура.
3.Взаимодействие центрального атома с лигандами
рассматривается, напротив, подробно: с учетом всех
особенностей d- (и f-) орбиталей центрального атома и
распределения электронов на них.
2.
23.
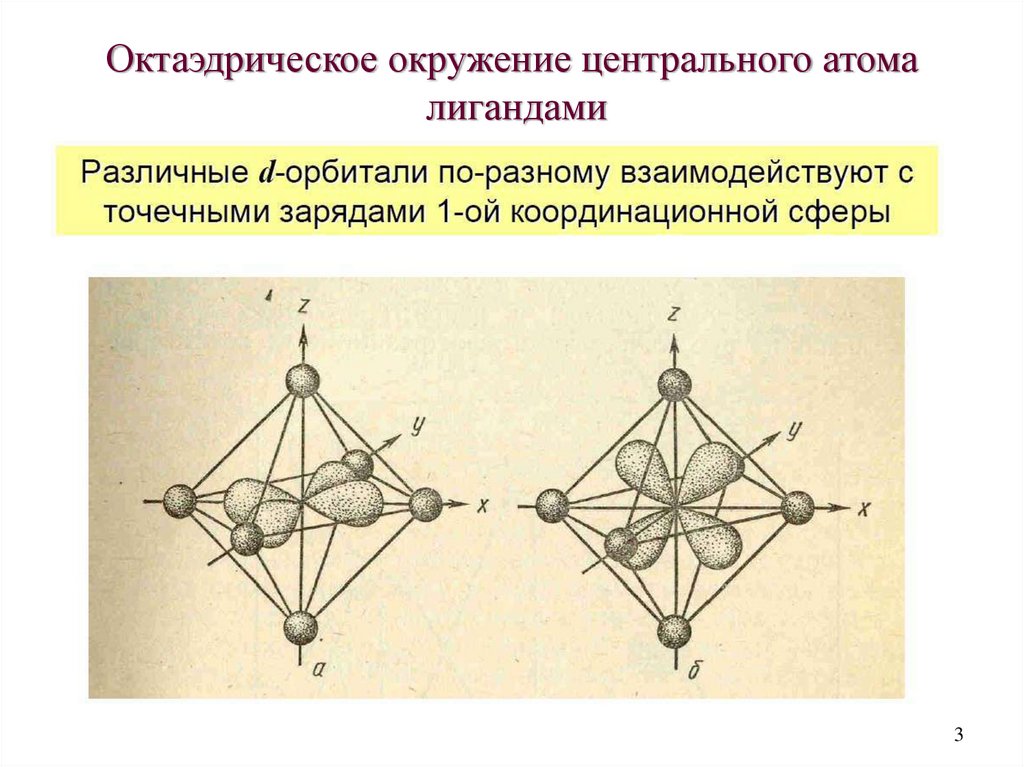
Октаэдрическое окружение центрального атомалигандами
3
4.
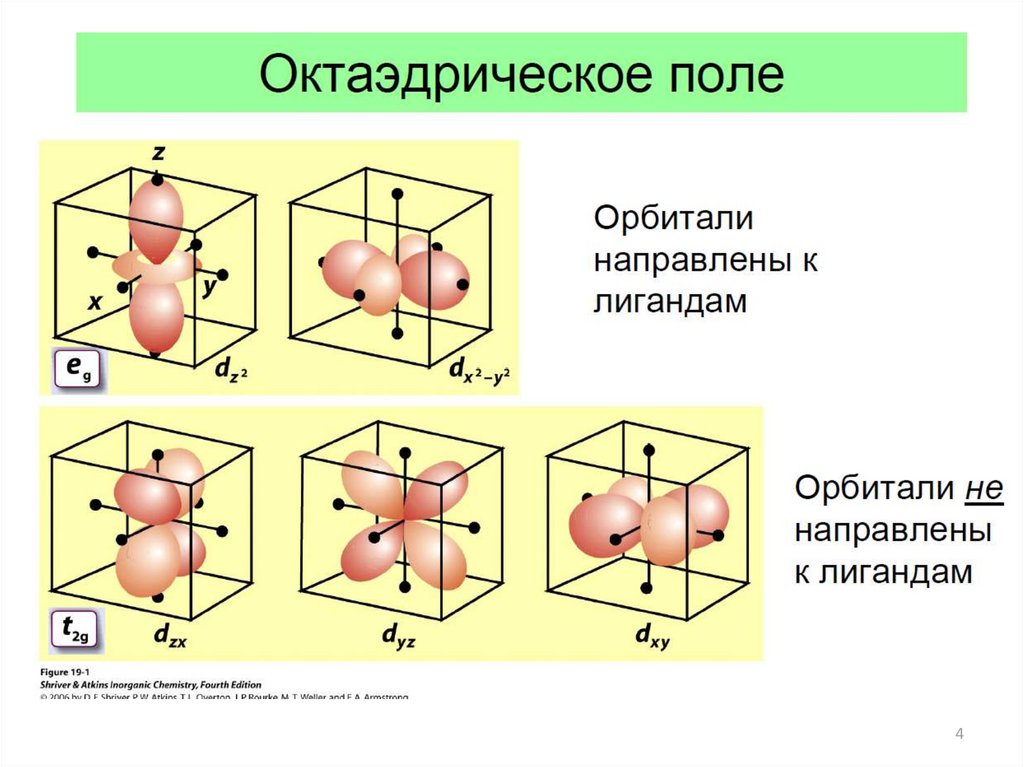
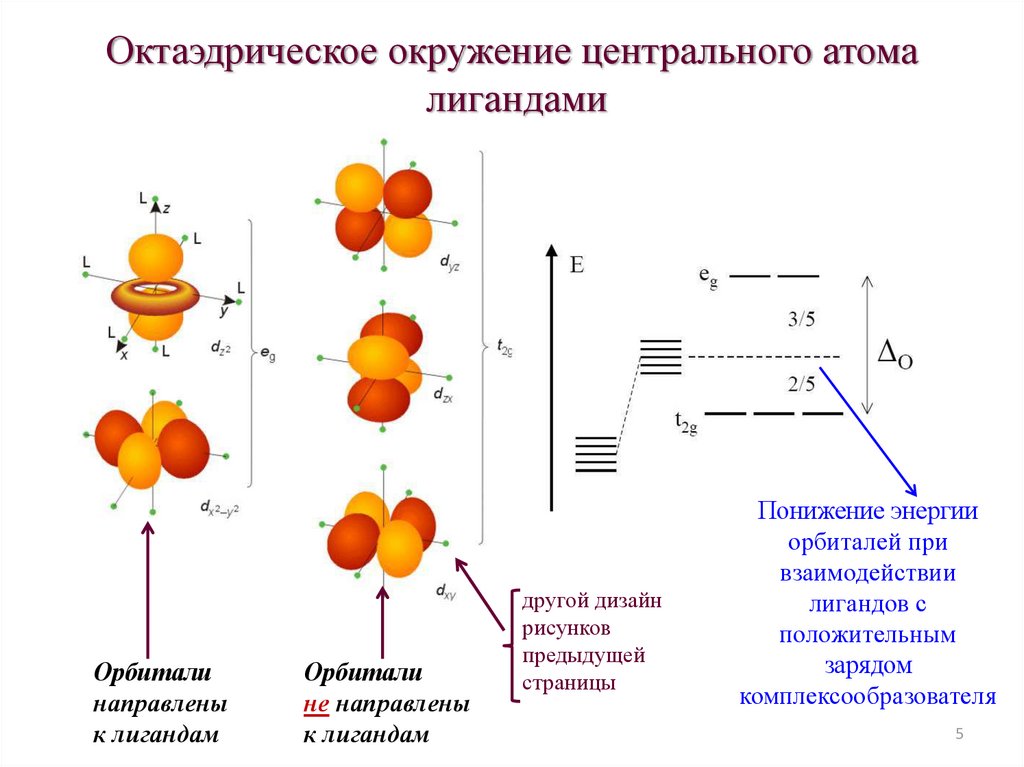
45.
Октаэдрическое окружение центрального атомалигандами
Орбитали
направлены
к лигандам
Орбитали
не направлены
к лигандам
другой дизайн
рисунков
предыдущей
страницы
Понижение энергии
орбиталей при
взаимодействии
лигандов с
положительным
зарядом
комплексообразователя
5
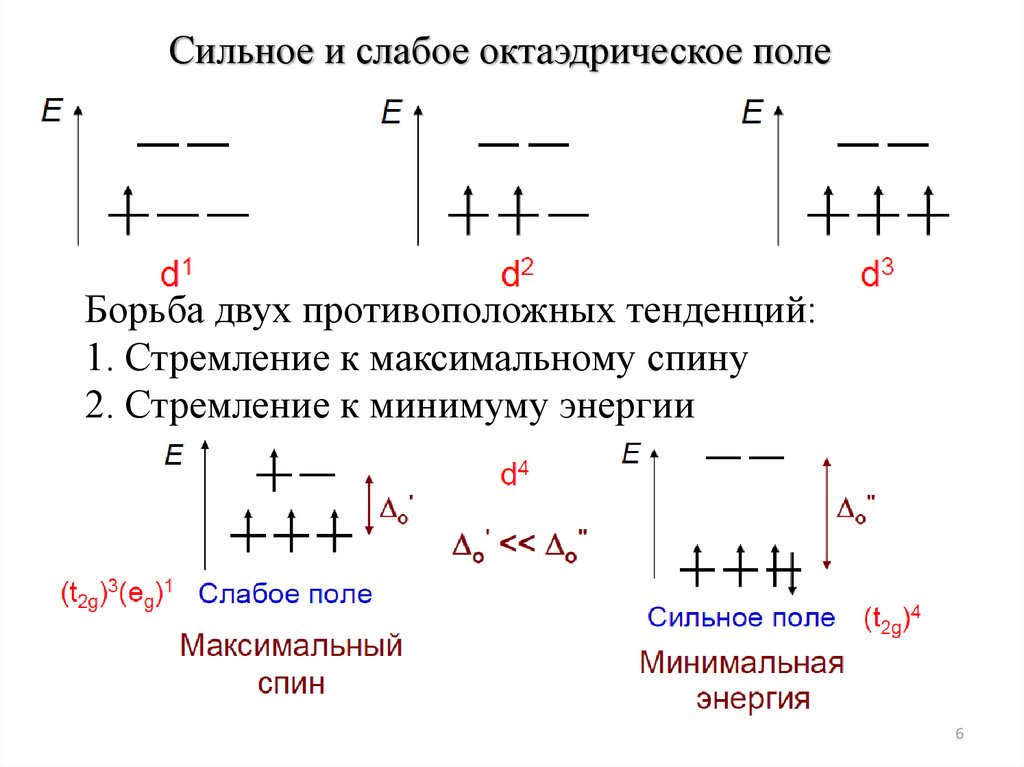
6.
Сильное и слабое октаэдрическое полеБорьба двух противоположных тенденций:
1. Стремление к максимальному спину
2. Стремление к минимуму энергии
6
7.
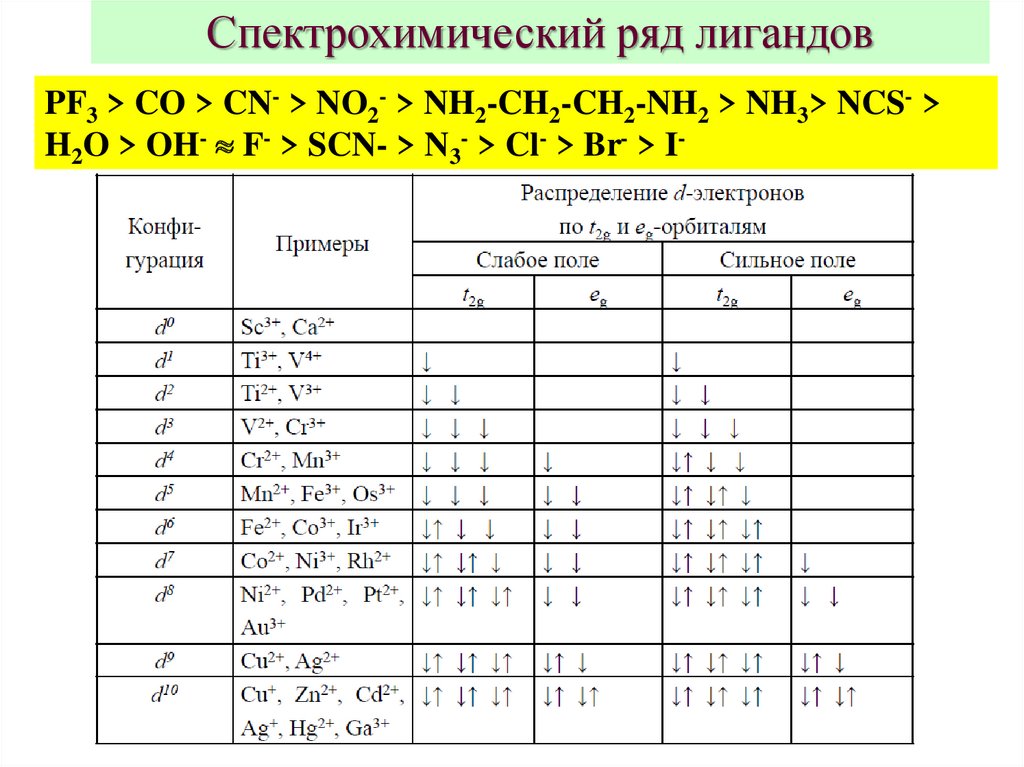
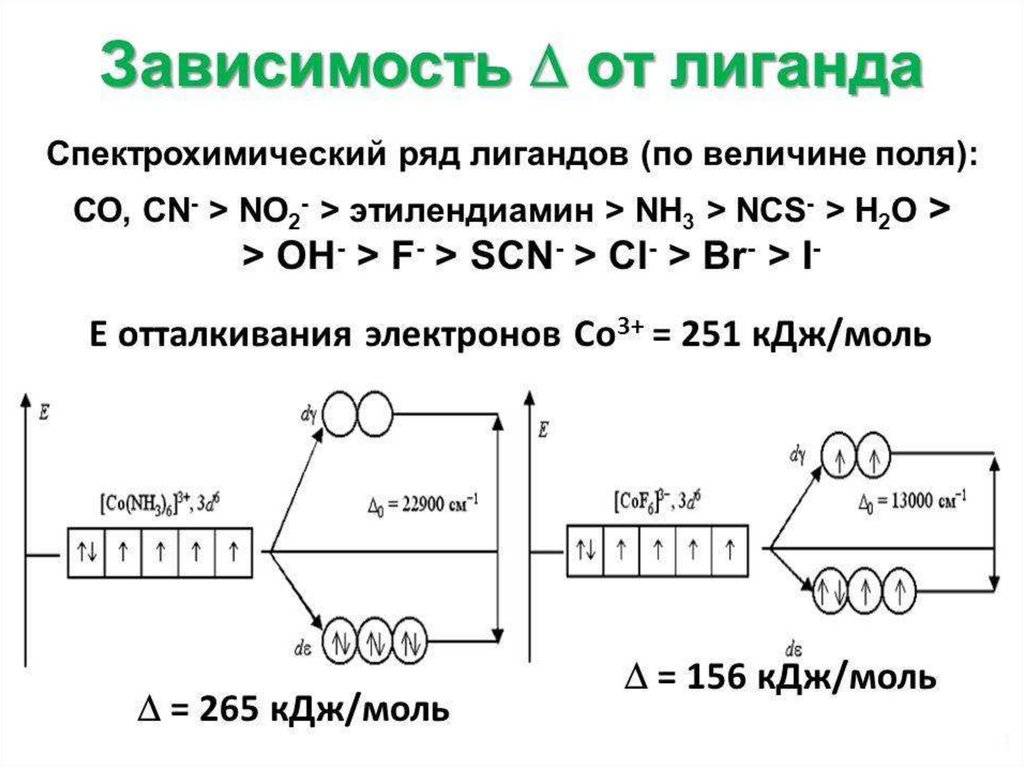
Спектрохимический ряд лигандовPF3 > CO > CN- > NO2- > NH2-CH2-CH2-NH2 > NH3> NCS- >
H2O > OH- F- > SCN- > N3- > Cl- > Br- > I-
7
8.
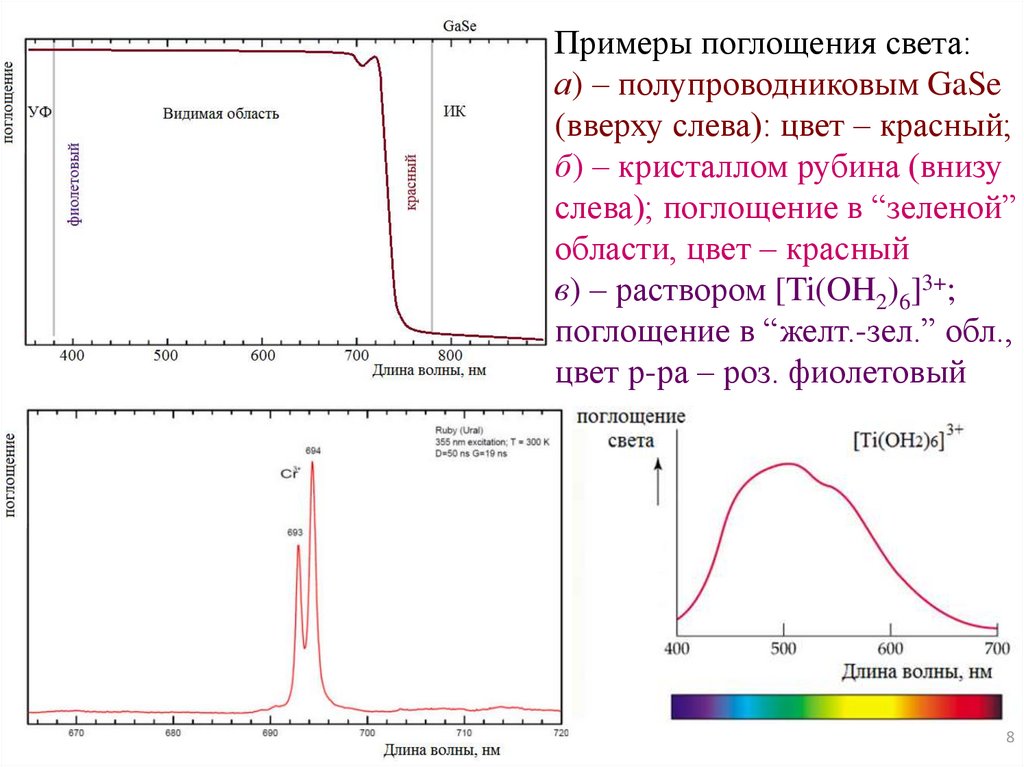
Примеры поглощения света:а) – полупроводниковым GaSe
(вверху слева): цвет – красный;
б) – кристаллом рубина (внизу
слева); поглощение в “зеленой”
области, цвет – красный
в) – раствором [Ti(OH2)6]3+;
поглощение в “желт.-зел.” обл.,
цвет р-ра – роз. фиолетовый
8
9.
Пример расщепления воктаэдрических
комплексах Ni2+
Красный
Оранж.-желт.
Желтый
9
10.
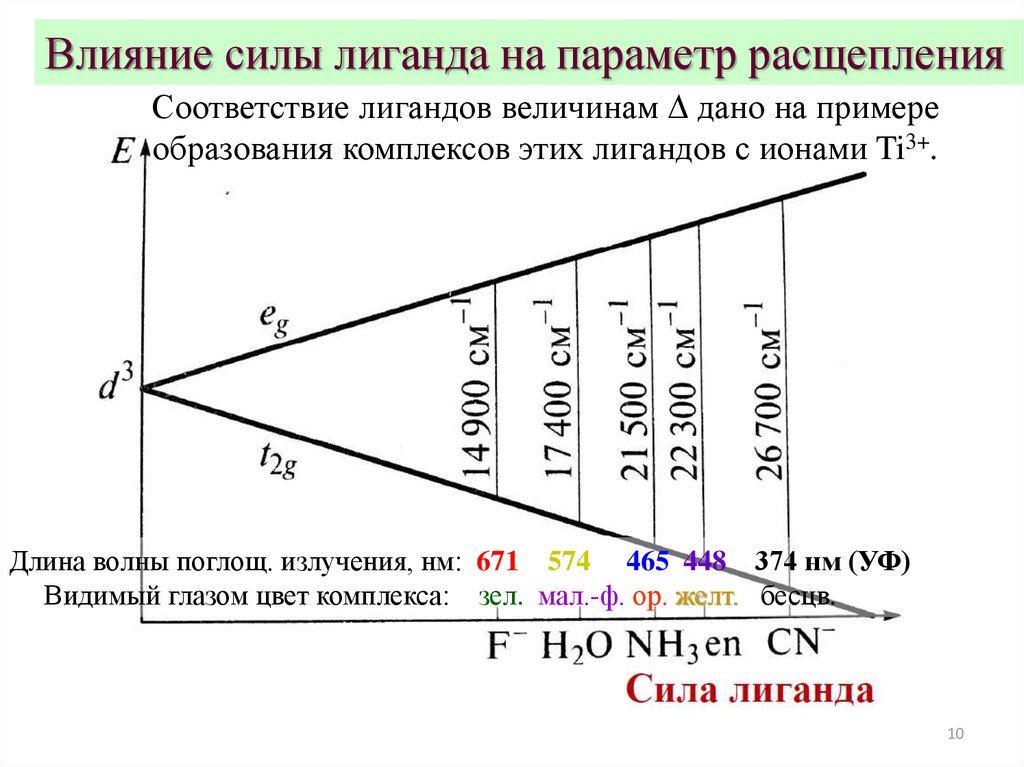
Влияние силы лиганда на параметр расщепленияСоответствие лигандов величинам D дано на примере
образования комплексов этих лигандов с ионами Ti3+.
Длина волны поглощ. излучения, нм: 671 574 465 448 374 нм (УФ)
Видимый глазом цвет комплекса: зел. мал.-ф. ор. желт. бесцв.
10
11.
1112.
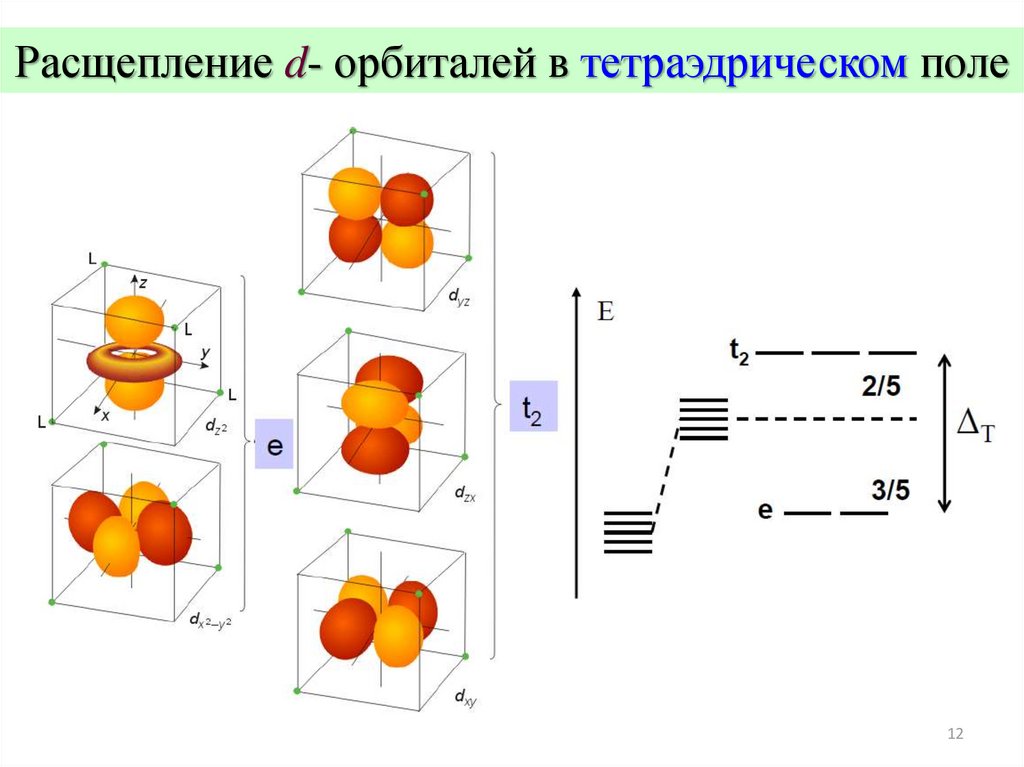
Расщепление d- орбиталей в тетраэдрическом поле12
13.
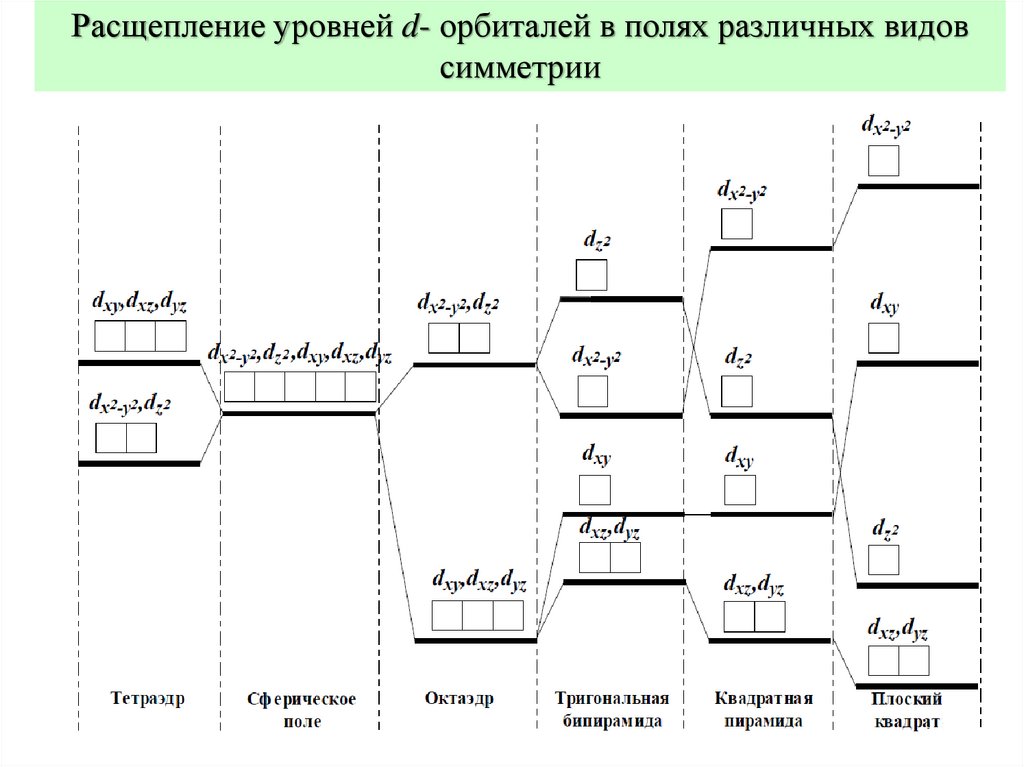
Расщепление уровней d- орбиталей в полях различных видовсимметрии
13
14.
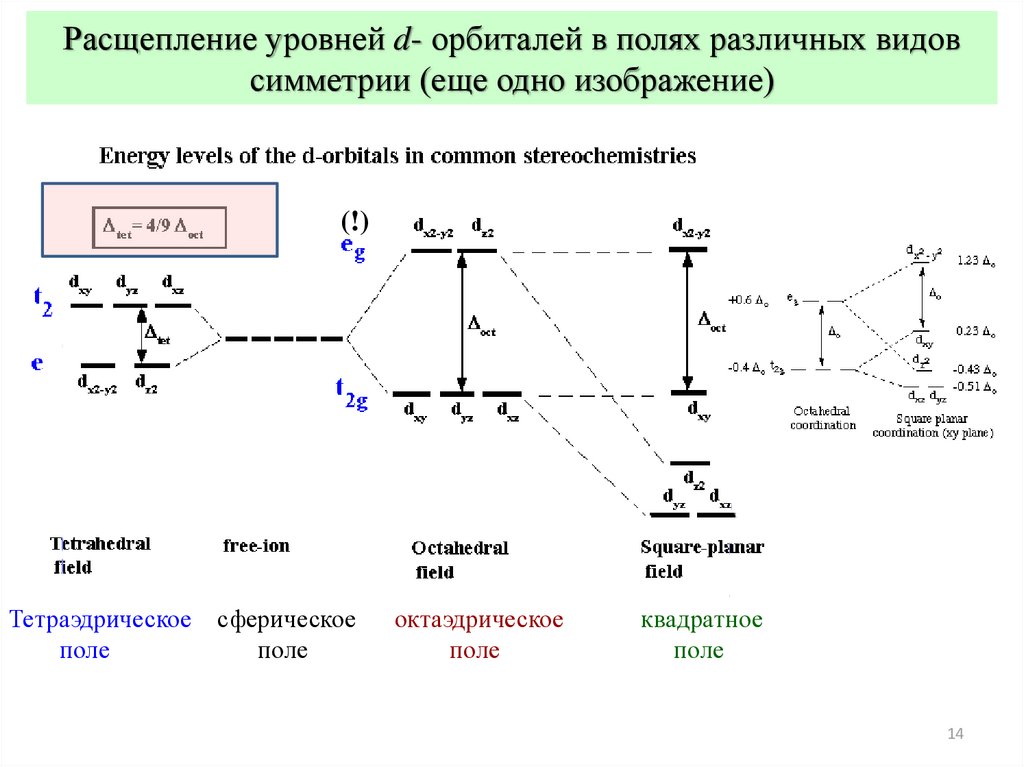
Расщепление уровней d- орбиталей в полях различных видовсимметрии (еще одно изображение)
(!)
Тетраэдрическое
поле
сферическое
поле
октаэдрическое
поле
квадратное
поле
14
15.
ЭСКП - энергия стабилизациикристаллическим полем
ЭСКП – величина энергии электронной конфигурации
иона d- или f-элемента в комплексном соединении,
рассчитанная относительно средней энергии орбиталей.
ΔO >P – сильное поле
ΔO < P – слабое поле
Для конфигурации d4 (Cr2+, Mn3+) в октаэдрическом поле:
Слабое поле: ЭСКП= (2/5·3 – 3/5·1)ΔO= 3/5ΔO
Сильное поле:
(t2g)4: ЭСКП = (2/5·4 – 0)ΔO – P = 8/5ΔO – P
15
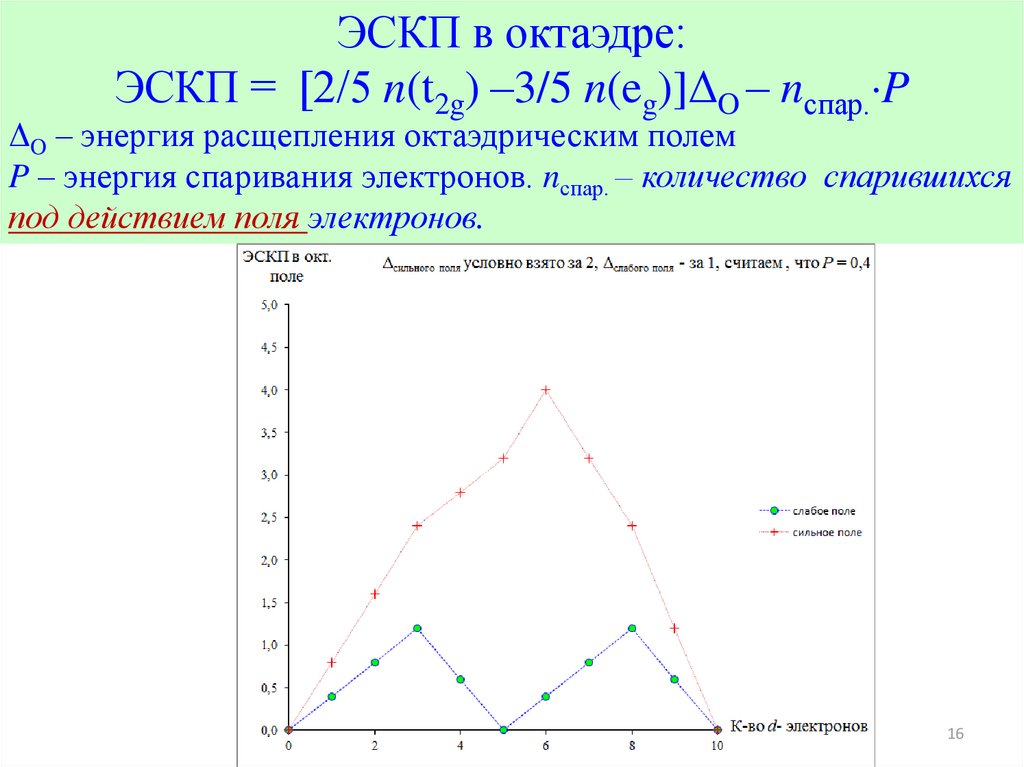
16.
ЭСКП в октаэдре:ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO – nспар. P
ΔO – энергия расщепления октаэдрическим полем
P – энергия спаривания электронов. nспар. – количество спарившихся
под действием поля электронов.
16
17.
Расчет ЭСКП-P
-P
. Для октаэдра:
17
18.
ЭСКП в октаэдре:ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO – nспар. P
ΔO – энергия расщепления октаэдрическим полем
P – E спаривания электронов. nспар. – к-во спарившихся в поле эл-нов.
Зависимость энтальпии гидратации (с обр. знаком) ионов
M2+ 3d-элементов от числа d-электронов в каждом ионе. 18
19.
Лучше взять ион NO2– вместо Cl– !Он ближе к NH3 в спектр-хим. ряду!
19
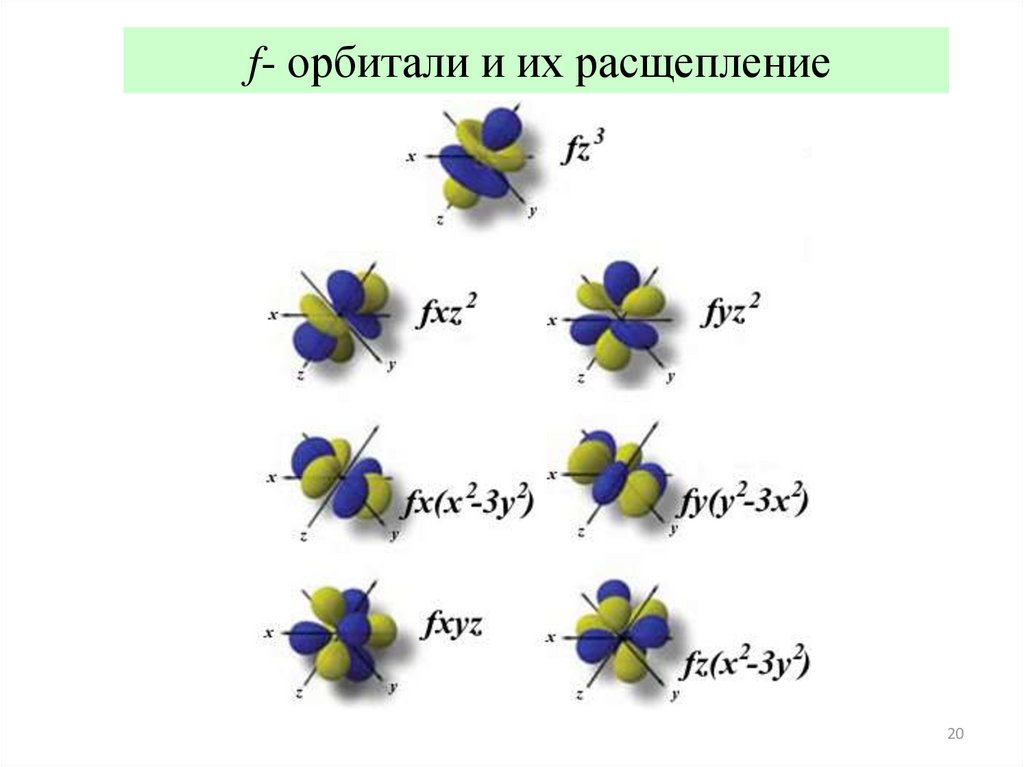
20.
f- орбитали и их расщепление20
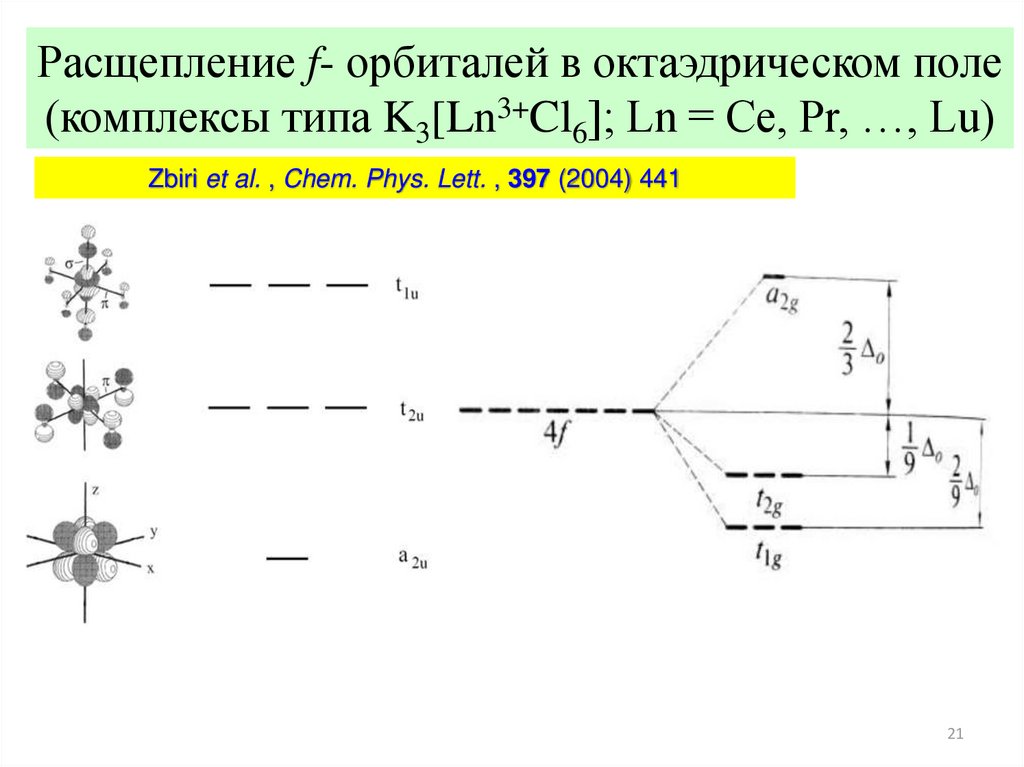
21.
Расщепление f- орбиталей в октаэдрическом поле(комплексы типа K3[Ln3+Cl6]; Ln = Ce, Pr, …, Lu)
Zbiri et al. , Chem. Phys. Lett. , 397 (2004) 441
21
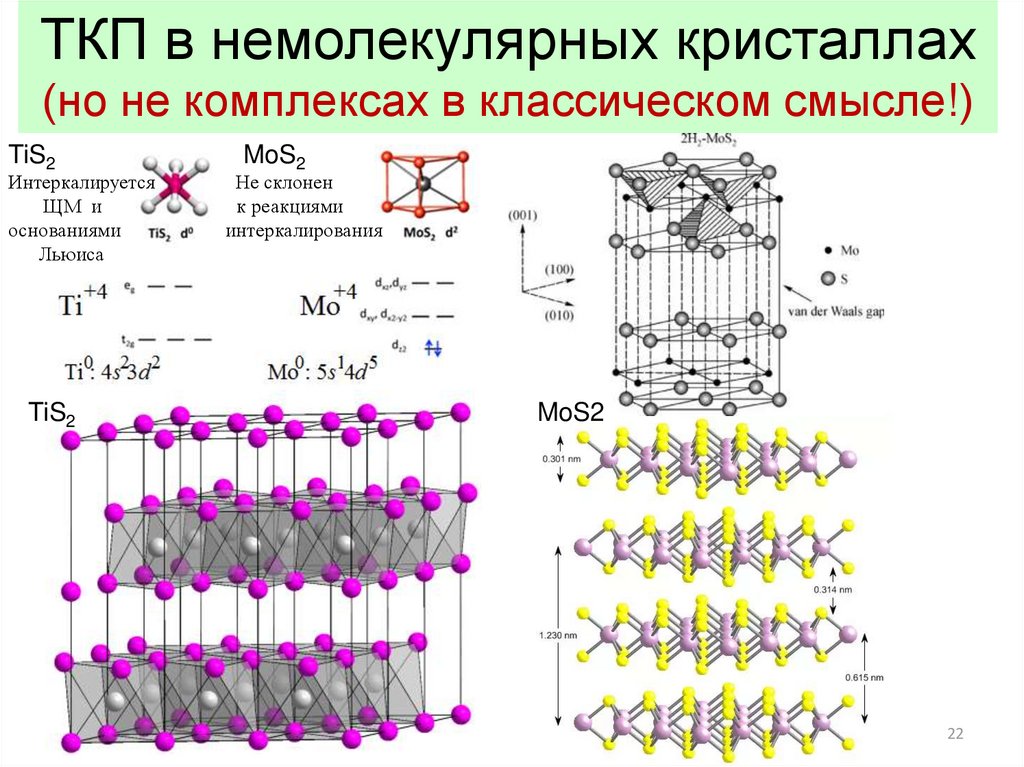
22.
ТКП в немолекулярных кристаллах(но не комплексах в классическом смысле!)
TiS2
Интеркалируется
ЩМ и
основаниями
Льюиса
TiS2
MoS2
Не склонен
к реакциями
интеркалирования
MoS2
22
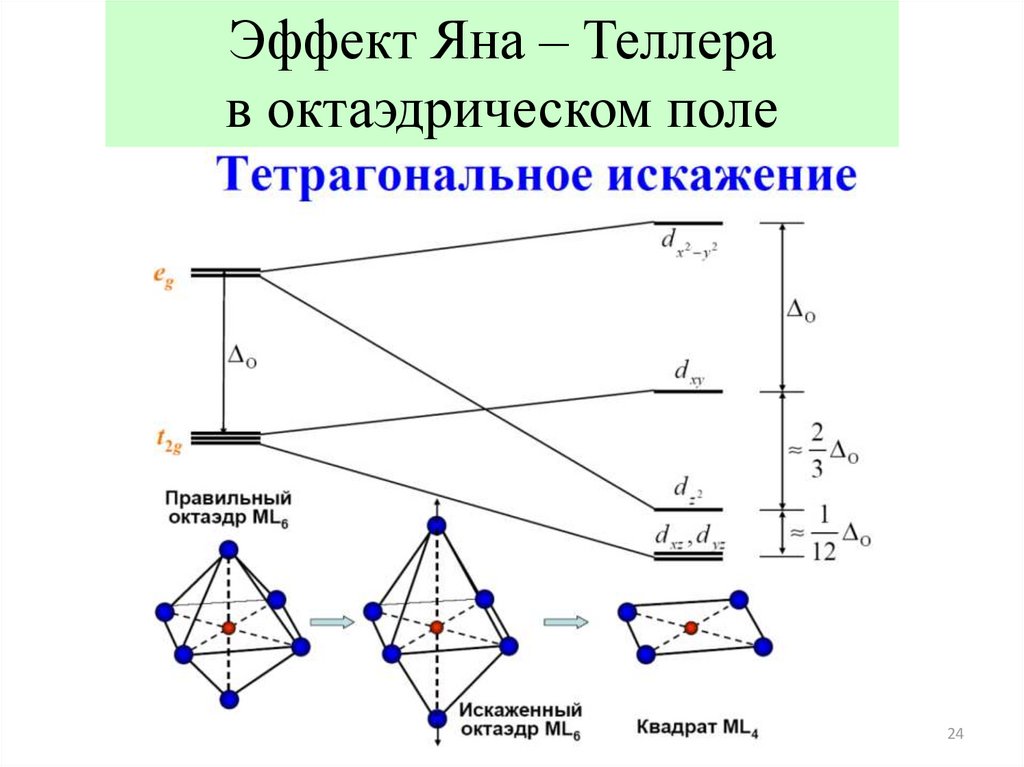
23.
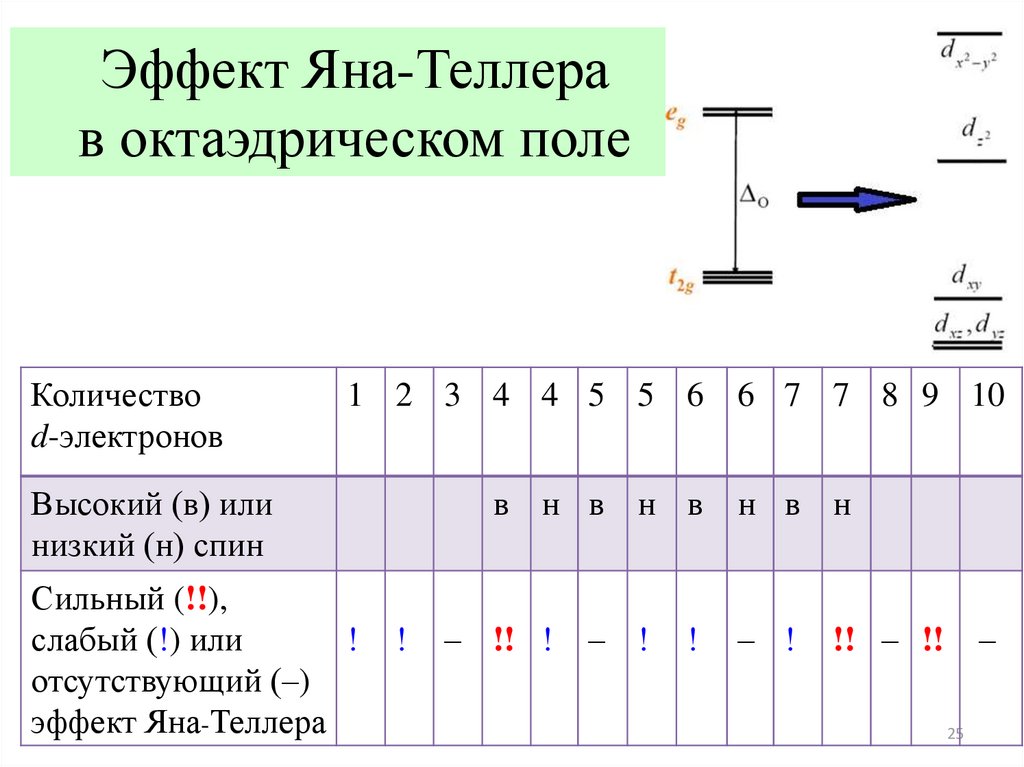
Эффект Яна-ТеллераЭффект Яна-Теллера – круг явлений, связанных с особенностями
поведения систем с вырожденными электронными состояниями.
Симметричная конфигурация атомов в ряде случаев в комплексных
(координационных) соединениях оказывается нестабильной и
искажается при понижении симметрии со снятием вырождения.
Особенно к этому склонна конфигурация d9 (спаренный и
неспаренный электрон на верхнем энергетическом уровне).
23
24.
Эффект Яна – Теллерав октаэдрическом поле
24
25.
Эффект Яна-Теллерав октаэдрическом поле
Количество
d-электронов
1 2 3 4 4 5 5 6 6 7 7 8 9 10
Высокий (в) или
низкий (н) спин
Сильный (!!),
слабый (!) или
!
отсутствующий (–)
эффект Яна-Теллера
в н в н в
!
– !! !
– !
!
н в н
– !
!! – !! –
25
26.
Метод молекулярных орбиталей длякомплексных (координационных)
соединений
(иллюстрируется с заимствованием материалов
авторов других вузов)
26
27.
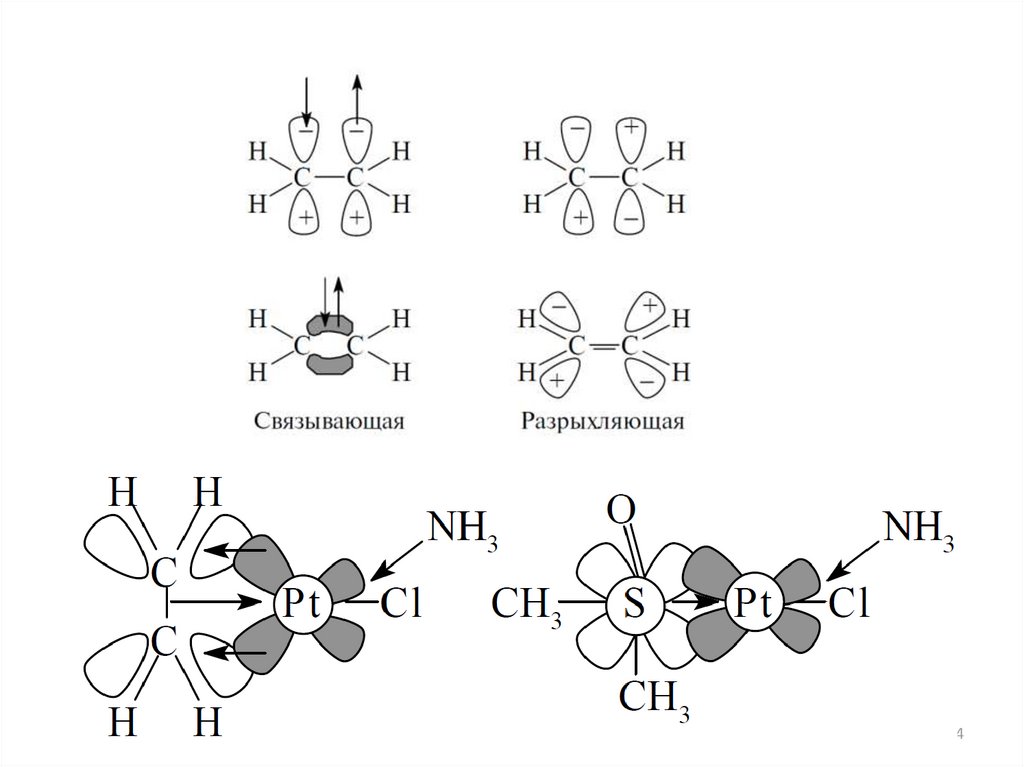
Основы ММО для комплексовВан Флек, 30-40 гг. XX в.
• Образование комплекса и снятие вырождения dорбиталей
происходит не только за счет электростатического
взаимодействия, но и за счет перекрывания орбиталей ЦА
и лигандов (ковалентного взаимодействия)
• Уитываются не только d-орбитали ЦА, но и s, p…
• Учитывается строение лигандов
• Взаимодействие двух АО (ЦА и лиганда) приводит к
образованию 2 МО. Связывающая МО лежит ниже АО,
разрыхляющая – выше. (МО ЛКАО)
• Взаимодействуют только АО, одинаковые по симметрии.
Если симметрия не совпадает – несвязывающие орбитали
• Соблюдается принцип Паули и правила Хунда
27
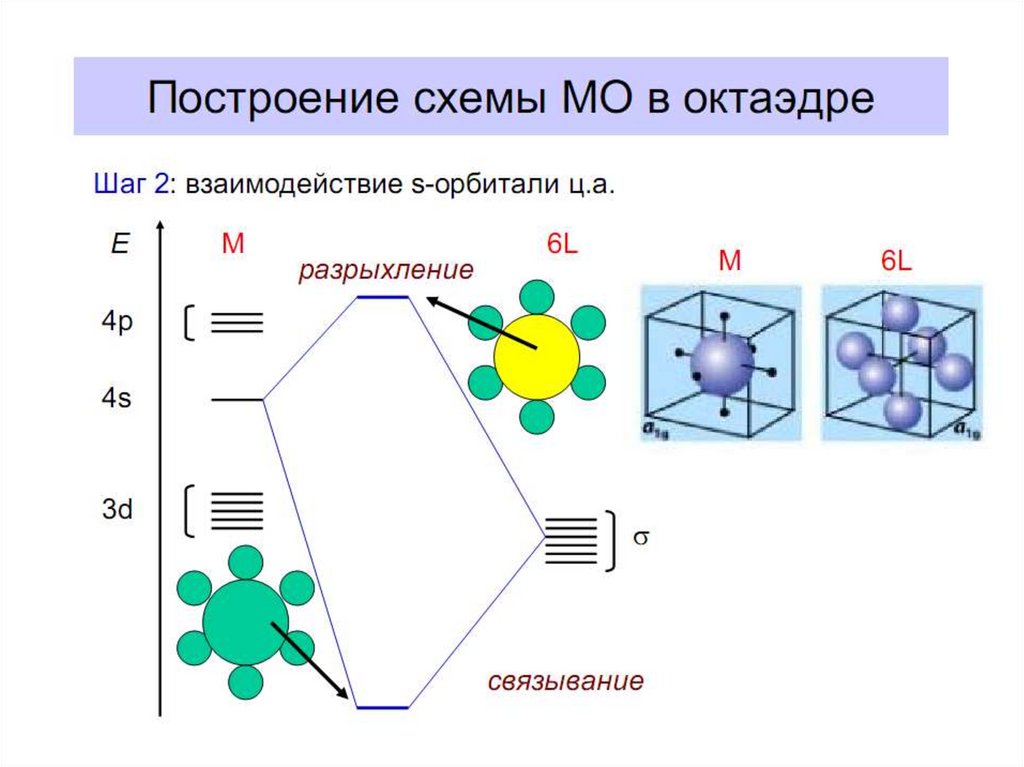
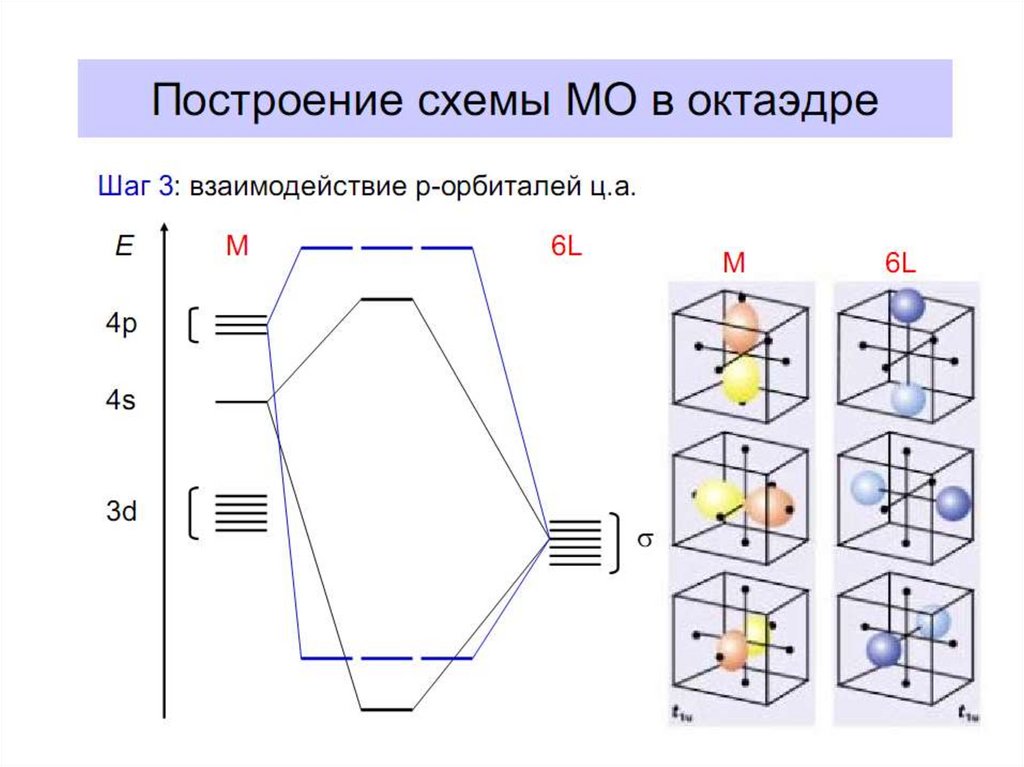
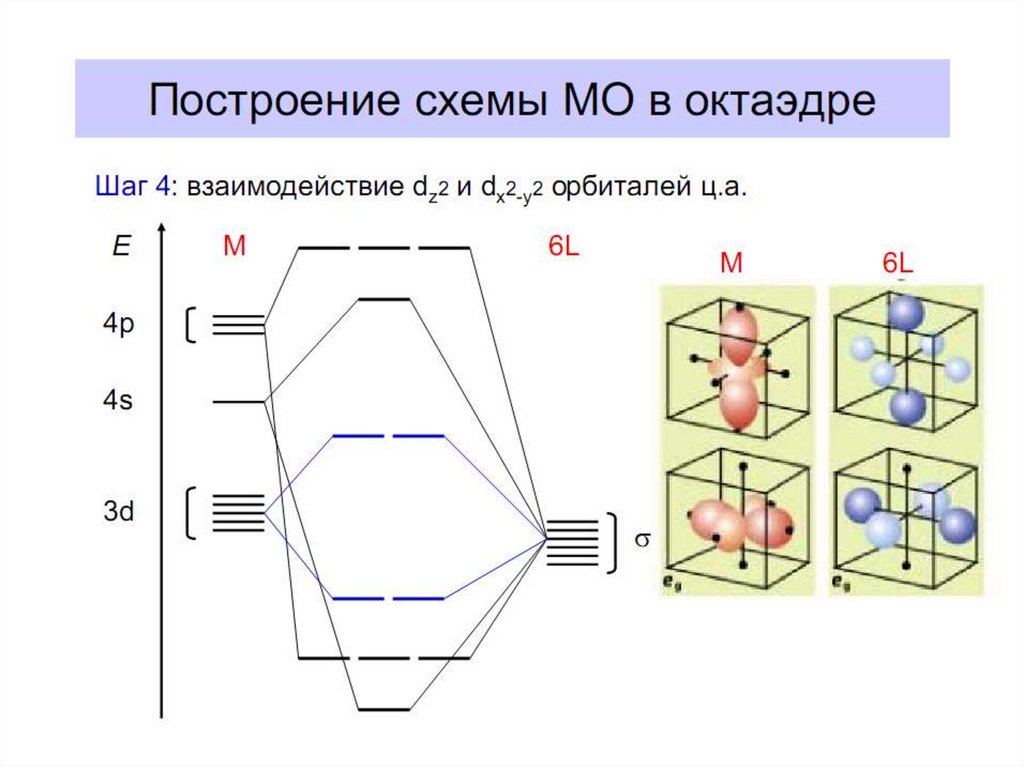
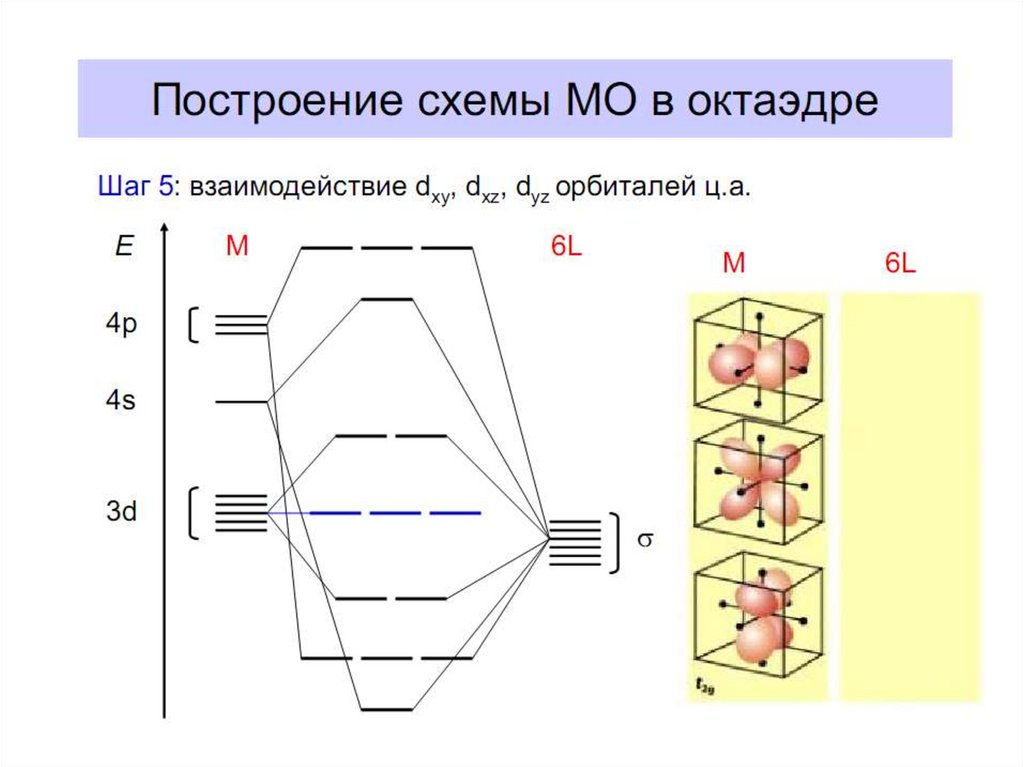
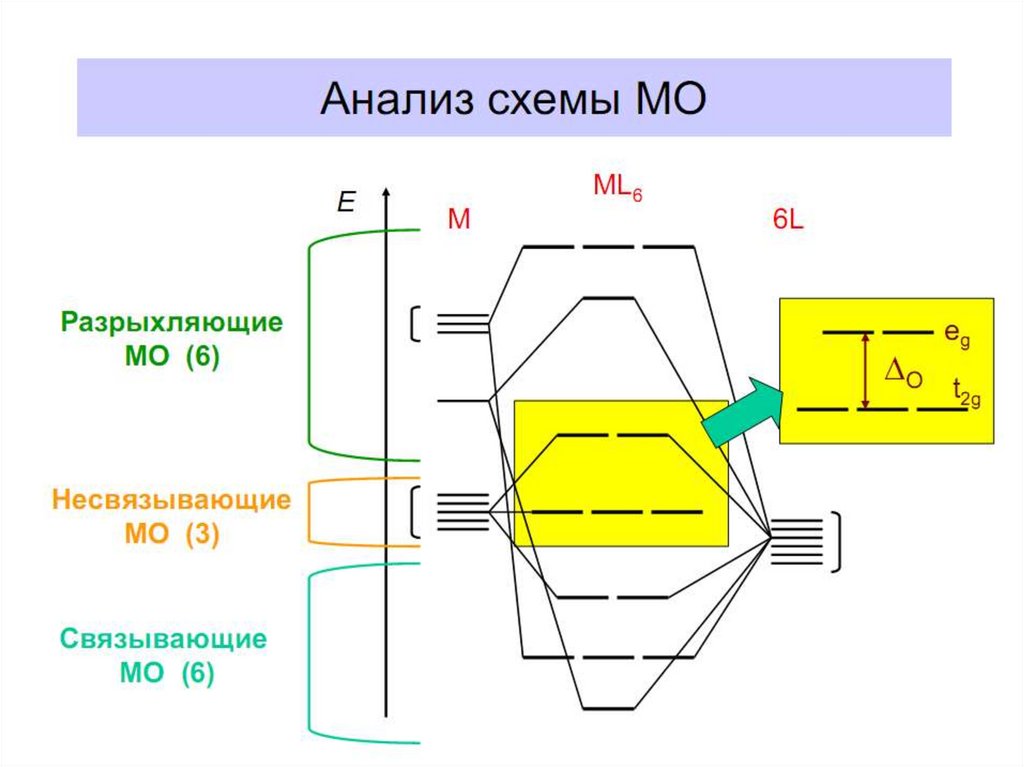
28. Построение схемы молекулярных орбиталей в октаэдре
Общие принципы:1. Центральный атом предоставляет 9 орбиталей–
5АО (n–1)d, 1АО ns, 3АО np(по возрастанию энергии);
для 3-d металлов: 5(3d)+1(4s)+3(4p)=9АО.
2. Шесть лигандов предоставляют по одной орбитали
σ-симметрии каждая.
3. Орбитали лигандов рассматриваются не независимо, а в совокупности
(подход групповых орбиталей).
4. Число молекулярных орбиталей равно сумме атомных орбиталей
(правило МО-ЛКАО).
5.
Взаимодействие
орбиталей
может
быть
конструктивным
(связывающее),
деструктивным (разрыхляющее) и безразличным
(несвязывающее).
В октаэдрическом поле с 6 орбиталями лигандов перекрываются валентные орбитали 3-d
металлов: 2АО (3dz2 и 3dx2-y2)+1АО (4s)+3АО (4p) в соответствии с их пространственной
ориентацией вдоль осей координат. Из них образуются 6σсвяз МО и 6σ*разр МО. Три
валентные орбитали: dxy, dxz, dyz ориентированы между осями координат, так что их
перекрывание с орбиталями лигандов невозможно. Из них образуются несвязывающие МО.
29.
30.
31.
32.
33.
34.
35.
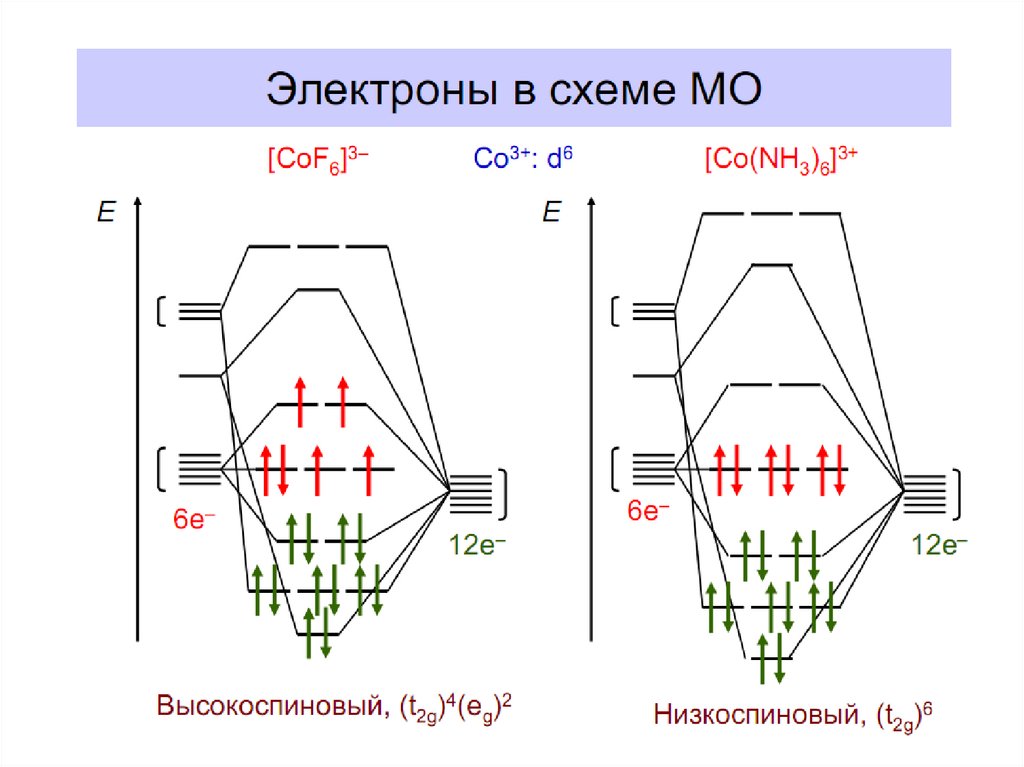
36. Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б)
37.
3738.
3839.
3940.
4041.
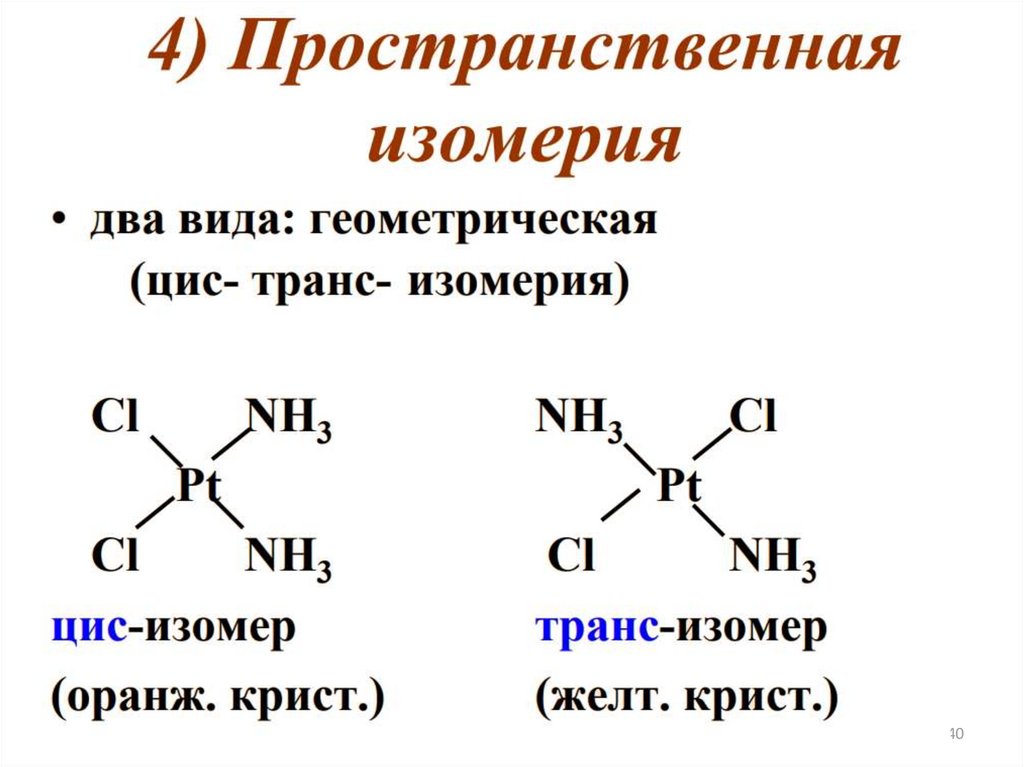
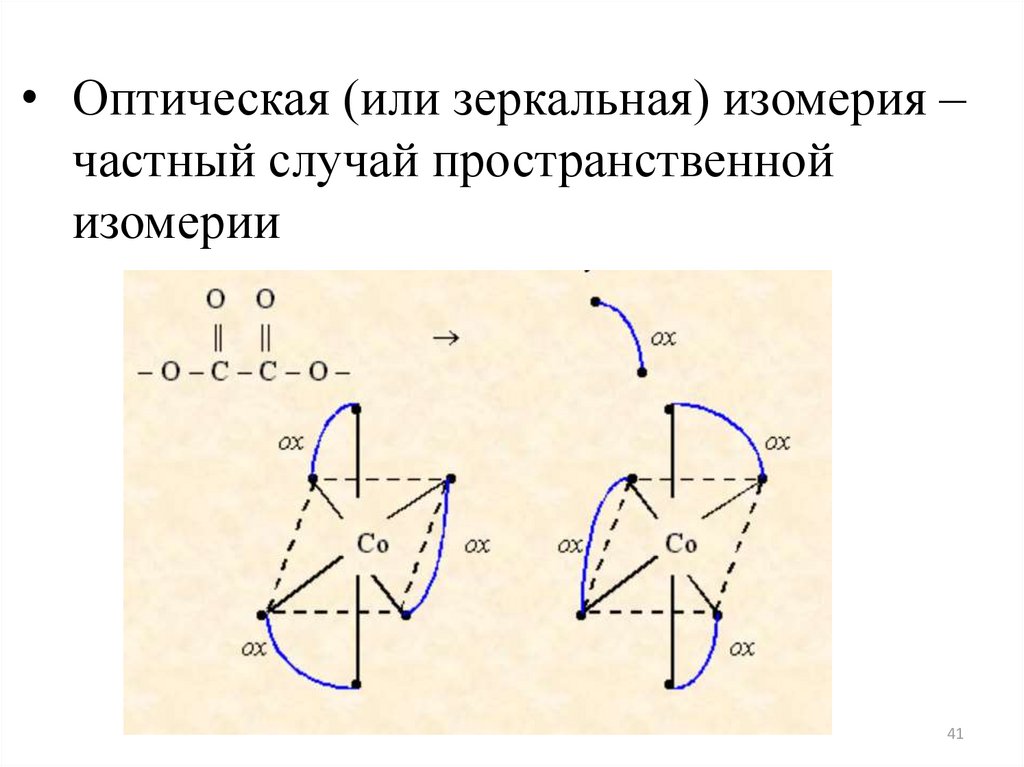
• Оптическая (или зеркальная) изомерия –частный случай пространственной
изомерии
41
42.
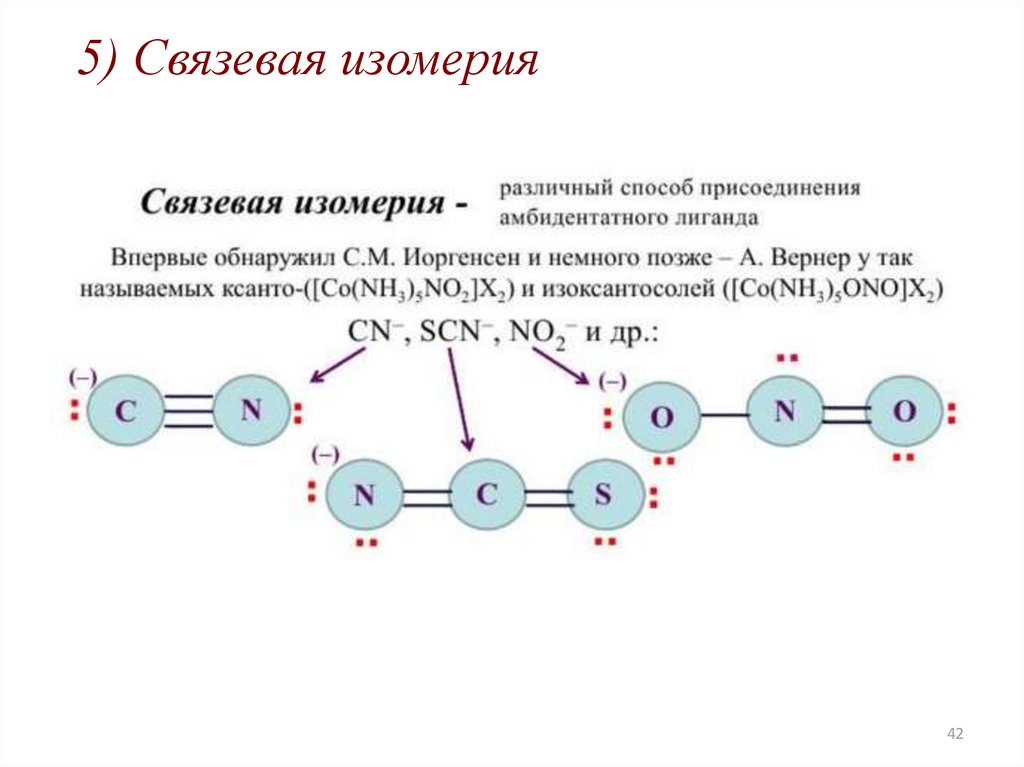
5) Связевая изомерия42
43.
Эффект транс-влияния Черняева (факультативно!)Для квадратных и октаэдрических комплексов, скорость реакции
замещения лиганда L определяется природой заместителя X (тоже
лиганда), занимающего противоположный конец диагонали
L-Me-X (Me – атом комплексобразователя, находящийся в центре
квадрата или октаэдра).
43
44.
4445.
Эффект транс-влияния Черняева45
46.
Эффект транс-влияния Черняева(еще один пример)
Cl
Cl
Cl
NH3
K2 [ Pt
] + 2NH3 = [ Pt ] + 2 KCl
Cl
Cl
Cl NH3
NH3
[
Pt
NH3
NH3
Cl
] Cl2 + 2HCl = [
NH3
NH3
Pt
NH3
]
+ 2 NH4Cl
Cl
46












![Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б) Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б)](https://cf3.ppt-online.org/files3/slide/i/iCtD3kJU5nALWVRqFISaMoyfwdYQNu4vZe0g1H/slide-35.jpg)






 Химия
Химия








