Похожие презентации:
Закономерности управления простым обратимым гомогенным процессом
1. Закономерности управления простым обратимым гомогенным процессом
Желательно предварительно ознакомиться скинетикой формальных химических реакций
2.
Обратимыми называются процессы, в которых одновременнопротекают прямая и обратная реакции.
Рассмотрим реакцию aA + bB ↔ cC + dD.
В начальный момент времени скорость прямой реакции,
которая пропорциональна произведению концентраций
реагентов А и В
больше скорости обратной реакции, пропорциональной
произведению концентраций продуктов С и D
3.
Но с течением времени, по мере увеличения концентрациивеществ C и D скорость обратной реакции увеличивается, а
скорость прямой реакции уменьшается. В некоторый момент
времени они становятся равными и наступает химическое
равновесие. После достижения равновесия соотношение
участников реакции остается постоянным во времени. Вводится
соотношение, которое называется константой равновесия.
Для газофазных реакций константу равновесия можно
выразить через парциальные давления участников реакции,
которые пропорциональны их концентрации pi = Ci RT.
4.
Константы Кс и Кр зависят только от температуры.В случае реальных газовых смесей и растворов концентрации и
парциальные давления в выражении констант меняют на
активность «а» и фугитивность «f».
Пределом протекания обратимых процессов является
состояние равновесия, при котором скорости прямой и
обратной реакции равны, а концентрации и парциальные
давления продуктов и реагентов остаются постоянными во
времени. При этом достигается некоторая максимальная в этих
условиях степень превращения реагентов – равновесная
конверсия α* и равновесный выход целевого продукта -β*. Их
величина зависит от степени смещения равновесия в сторону
образования
целевого
продукта.
Следовательно,
при
управлении обратимым процессом важно не только
обеспечить высокую скорость процесса, но и создать условия,
при которых химическое равновесие смещено в сторону
образования целевого продукта.
5.
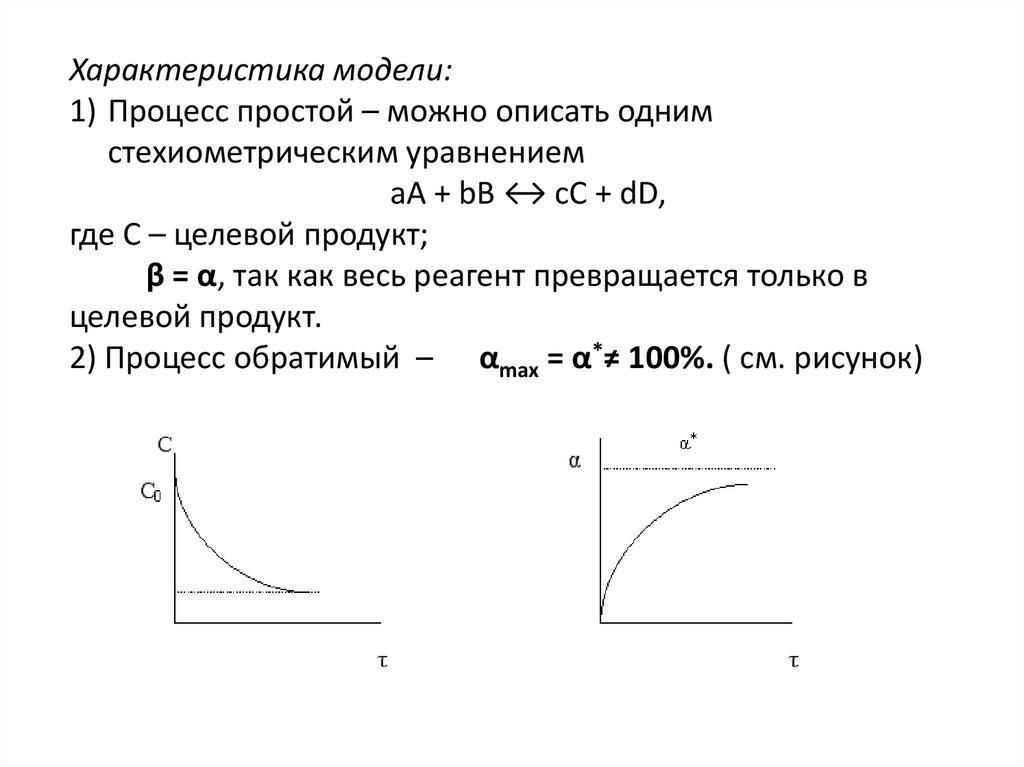
Характеристика модели:1) Процесс простой – можно описать одним
стехиометрическим уравнением
аА + bВ ↔ cС + dD,
где С – целевой продукт;
β = α, так как весь реагент превращается только в
целевой продукт.
2) Процесс обратимый – αmax = α*≠ 100%. ( см. рисунок)
6.
3. Процесс гомогенный – скорость процесса равна скоростихимической реакции. Однако следует помнить, что в
обратимых процессах скорость равна разности скорости
прямой и обратной реакции и при наступлении равновесия
через некоторое время равна нулю.
Объекты управления: скорость химической реакции и
положение равновесия.
Инструменты управления: кинетические параметры.
Правила смещения равновесия в обратимых процессах очень
часто ( но не всегда!) подчиняется правилу Ле-Шетелье.
7.
Смещение равновесия происходит только в том случае, когдапроизведенное воздействие неодинаково влияет на скорость
прямой и обратной реакции. Например, катализатор всегда
одинаково ускоряет как прямую, так и обратную реакцию, и
поэтому не оказывает влияния на положение равновесия.
Влияние температуры
При повышении температуры скорость химической реакции
увеличивается за счет увеличения константы скорости, причем,
чем больше энергия активации процесса, тем больше влияние
температуры на скорость. Энергия активации эндотермического
процесса всегда больше энергии активации обратного
экзотермического процесса на величину теплового эффекта
реакции. (см. рис.).
8.
Пусть реакция взаимодействия А+В является экзотермической,∆Н < 0. Тогда энергия системы в результате реакции будет
понижаться; энергетический уровень продуктов С и D будет
меньше энергетического уровня исходных реагентов. Разница
между энергиями конечного и начального состояния есть
тепловой эффект процесса ∆Н.
9.
Из диаграммы следует, что энергия активации обратной(эндотермической реакции) выше, чем прямой экзотермической
реакции. Согласно закону Аррениуса константа скорости зависит
экспоненциально от величины энергии активации.
Следовательно повышение температуры увеличивает в
большей степени скорость эндотермической реакции.
Если реакция образования целевого продукта С экзотермическая
повышение температуры увеличит в большей степени константу
скорости обратной реакции, чем константу скорости прямой
реакции; константа равновесия уменьшится, равновесие
сместится в сторону образования исходных веществ А и В.
Если же реакция эндотермическая, повышение температуры в
большей степени увеличит константу прямой реакции; константа
равновесия увеличится, равновесие сместится в сторону
образования целевого
10.
ТемператураСмещение равновесия означает изменение величины
равновесной конверсии и выхода; в случае простого процесса
они синхронно уменьшаются при увеличении температуры в
экзотермических процессах и увеличиваются в эндотермических.
11.
Наряду с максимальной конверсией желательно иметь имаксимальную скорость процесса. Посмотрим возможно ли
это.
В области низких температур при повышении температуры
суммарная скорость процесса увеличивается за счет
увеличения скорости прямой экзотермической реакции;
обратная эндотермическая реакция при этих температурах еще
практически не протекает. При переходе к более высоким
температурам начинает протекать обратная реакция, ее
скорость в большей степени возрастает под воздействием
температуры, чем скорость экзотермической реакции. В
результате
суммарная
скорость
процесса
начинает
уменьшаться.
Температура, при которой достигается максимальная
скорость, называется оптимальной.
12.
СкоростьСкорость
13.
Если α2 > α1, кривая зависимости r =f (T) располагается нижекривой, соответствующей α1. Если α3 > α2, то соответствующая
кривая располагается еще ниже и т.д.
Это связано с тем, что для того, чтобы достичь более высоких
значений конверсии, требуется больше времени (максимальная
конверсия достигается в момент наступления равновесия).
Но по мере приближения к равновесию суммарная скорость
процесса падает и в момент равновесия она равна нулю. Для
каждой величины конверсии получается своя кривая
зависимости r =f (T),
При этом, чем выше конверсия, тем ниже расположена эта
кривая и тем меньше оптимальная температура. Линия,
соединяющая максимумы полученных таким образом кривых,
является линией оптимальных температур (ЛОТ). Эта линия
показывает, как нужно изменять температуру в ходе процесса для
того, чтобы увеличить степень превращения реагентов, работая
все время при максимально возможных в этих условиях скоростях
процесса.
14.
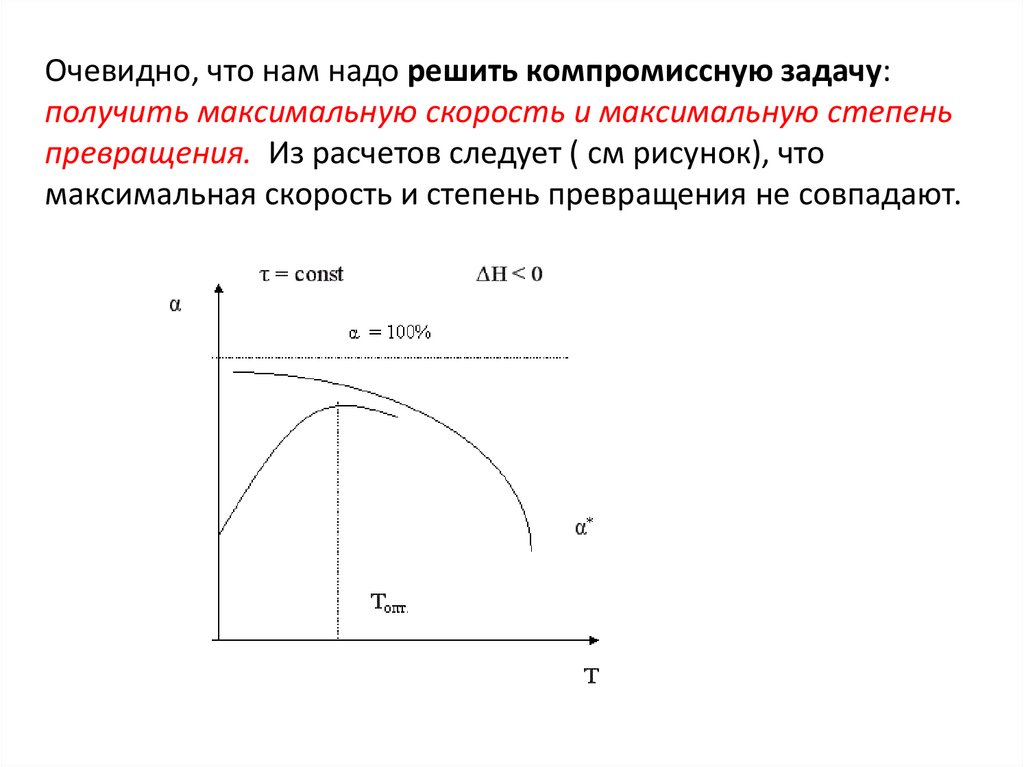
Очевидно, что нам надо решить компромиссную задачу:получить максимальную скорость и максимальную степень
превращения. Из расчетов следует ( см рисунок), что
максимальная скорость и степень превращения не совпадают.
15.
Кривая, соответствующая τ2 > τ1, располагается выше, чем τ3 >τ2 – еще выше и т.д. Кривая, соединяющая максимумы,
является линией оптимальных температур (ЛОТ).
16.
Таким образом, для обратимого экзотермическогопроцесса не существует единой оптимальной
температуры.
В начале процесса нужно задавать более высокую
температуру для поддержания высокой скорости
процесса, а затем температуру следует снижать
по ЛОТ, чтобы при достижении более высоких
значений конверсии поддерживать максимально
возможную скорость процесса.
Этот же вывод следует из правила Лейтиса-Сама,см.
лекцию о равновесном термодинамическом процессе.
17.
Не следует думать, что линия оптимальныхтемператур имеет только одну форму. На рис.
Показаны ЛОТ для различных реакций (В-целевой
продукт)
18.
Для простого обратимого эндотермического процессавопрос о влиянии температуры решается однозначно:
при
повышении
температуры
увеличивается
и
равновесная и фактическая степень превращения.
Однако, и в этом случае есть некоторая оптимальная
температура, выше которой процесс вести нерационально,
поскольку конверсия увеличивается незначительно.
19.
Влияние концентрации участников реакцииСуммарная скорость обратимого процесса равна
При увеличении начальной концентрации исходных реагентов
А и В увеличиваются их текущие концентрации, а,
следовательно, скорость прямой реакции и скорость всего
процесса в целом (химическое равновесие устанавливается
быстрее). Константа равновесия при этом не меняется: во
сколько
раз
увеличивается
произведение равновесных концентраций реагентов, во столько раз
увеличивается и произведение равновесных концентраций
продуктов, однако состав равновесной смеси зависит от
соотношения исходных продуктов.
20.
Таким образом, в случае обратимого процесса такжецелесообразно работать с высококонцентрированным
сырьем и можно использовать избыток одного из
реагентов. Это позволяет не только поддерживать высокую
скорость процесса в течение необходимого времени, но и
сдвигает равновесие в сторону образования целевого
продукта. Однако это правило действует не всегда, т.к. в
равновесной смеси оказывается большое содержание
исходных продуктов, что может вызвать большие затраты на
их отделение.
Равновесие
обратимого
процесса
можно
сместить вправо также уменьшая концентрацию
продуктов С и D, выводя их из реакционной зоны.
Уменьшение концентрации продуктов в реакционной смеси
приводит к уменьшению скорости обратной реакции и к
увеличению суммарной скорости процесса.
21.
Влияние давленияСкорость обратимого газофазного процесса зависит от
давления, причем тем больше, чем больше отличаются
порядки прямой и обратной реакции.
Если реакция протекает без изменения числа
молей, скорость обратимого процесса не зависит от
давления.
Если число молей в результате реакции
уменьшается, увеличение давления приводит к
увеличению скорости процесса.
В противном случае повышение давления
вызывает
уменьшение
скорости
установления
химического равновесия.
22.
Таким образом,если число молей в результате прямой реакции
уменьшается, увеличение давления способствует сдвигу
равновесия в сторону образования целевого продукта и
увеличению скорости процесса.
Если число молей в результате прямой реакции
увеличивается, для увеличения скорости процесса и
сдвига равновесия в сторону образования целевого
продукта нужно уменьшить давление в системе. Это
правило действует не всегда, т.к. иногда продукты
реакции необходимо снова сжать и поэтому уменьшение
давление нецелесообразно.
Если число молей в результате прямой реакции близко к
нулю,
использовать
давление
для
повышения
эффективности процесса нецелесообразно, так как
затраты намного превысят полученный эффект.




















 Химия
Химия








