Похожие презентации:
Реальные газы
1. Реальные газы
• При высоких давлениях модельюидеального газа пользоваться нельзя
• Необходимо учитывать силы
межмолекулярного притяжения
• Между молекулами вещества одновременно
действуют силы притяжения и отталкивания
2. Силы притяжения
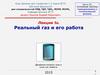
• Ориентационные• Возникают между полярными молекулами
Fпр
1
r
7
3.
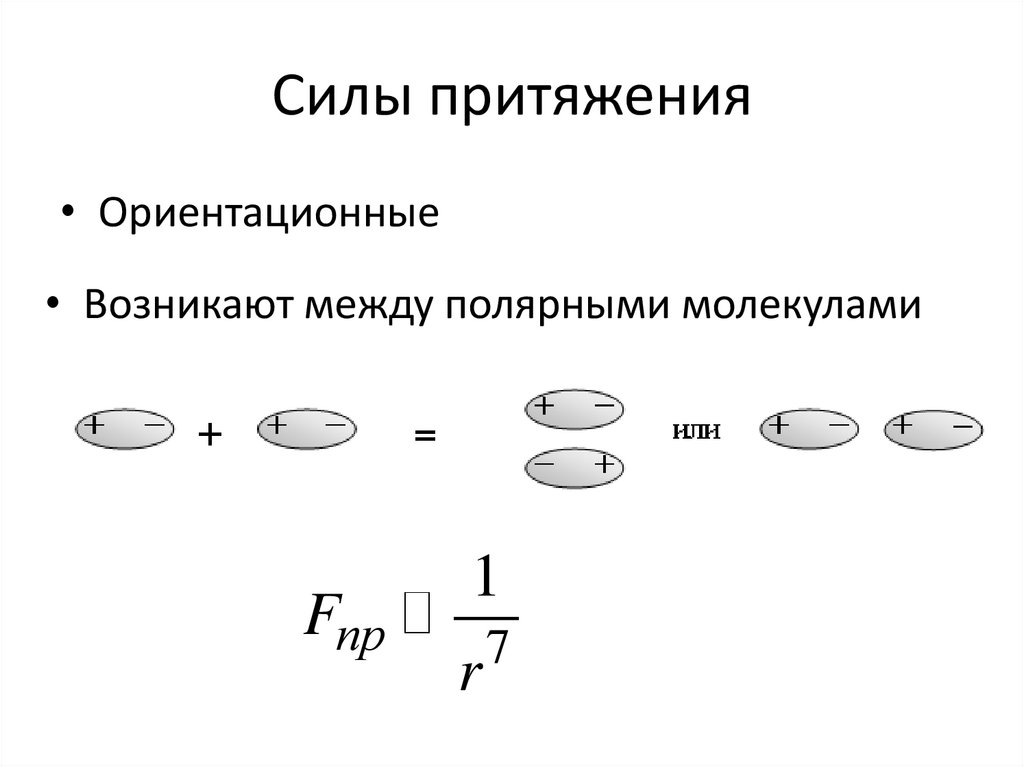
• Индукционные• Возникают между полярными и неполярными
• молекулами
Fпр
1
r
7
4.
• Дисперсионные• Возникают между неполярными молекулами
Fпр
1
r
7
5.
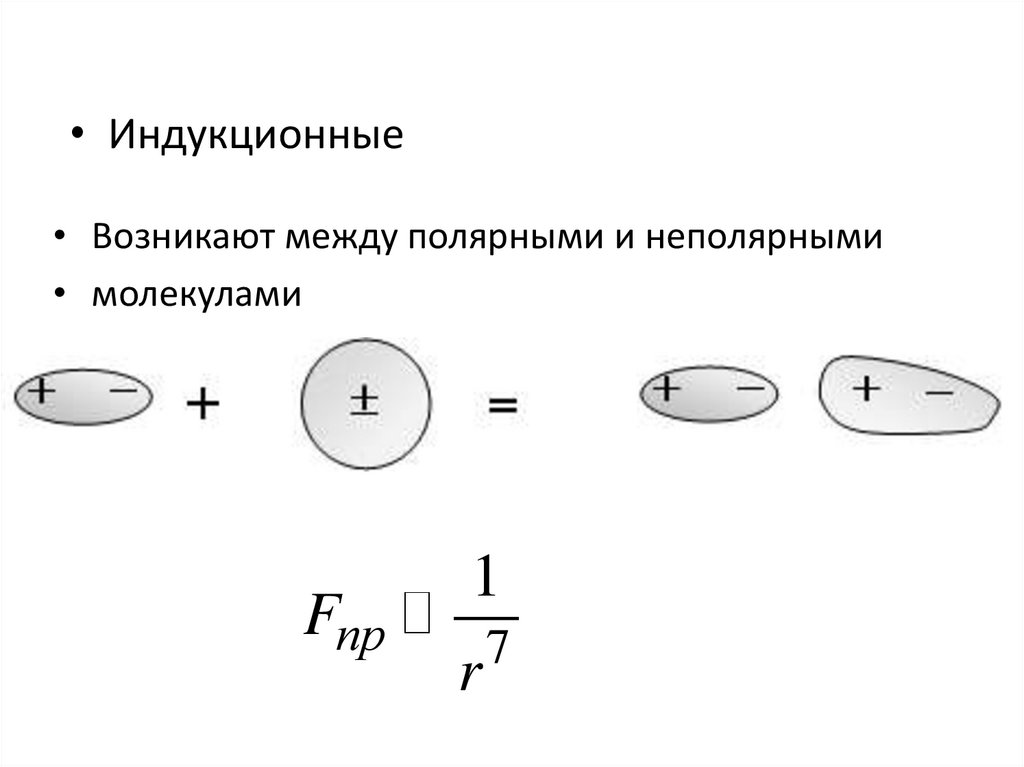
• Силы отталкиванияFотт
1
r
13
6.
FпрFот
r
r
7
13
7.
• При r=r0 силы отталкивания равны силампритяжения
• При r>r0 силы действуют силы притяжения
• При r<r0 силы действуют силы отталкивания
F Fприт Fотталкив
α
r
7
β
13
r
8.
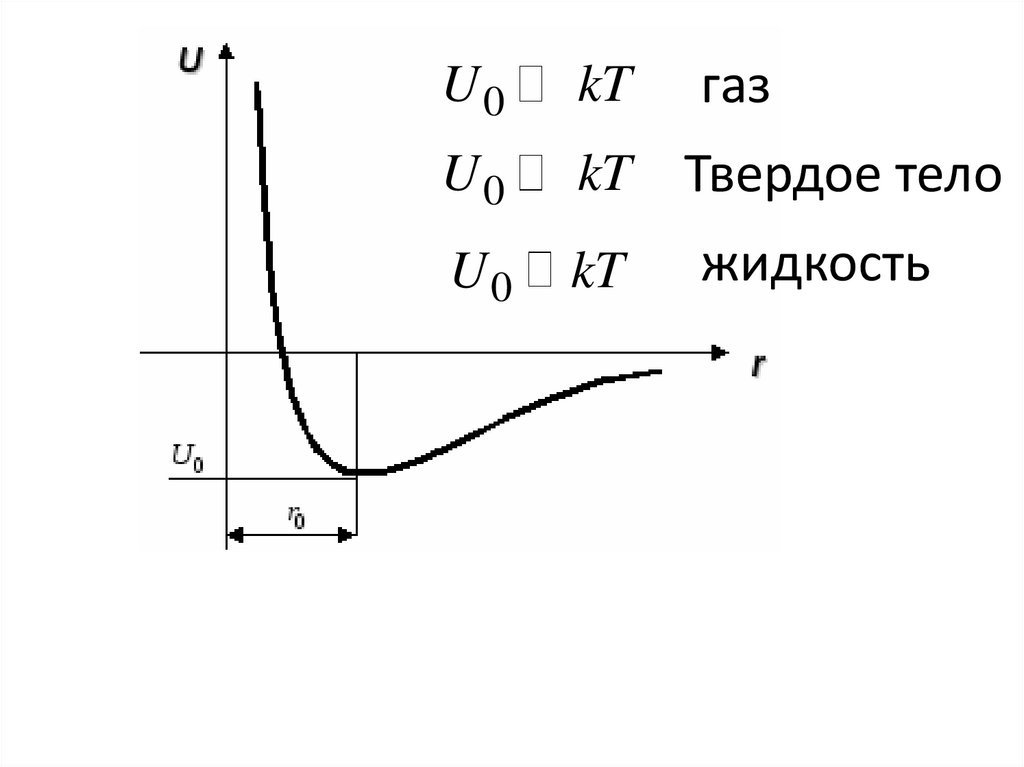
• Потенциальная энергия взаимодействиямолекул
U (r ) Fрез dr
α
r
6
• Потенциал Леннарда-Джонса
β
12
r
9.
U0kT
U0
kT
U0
kT
газ
Твердое тело
жидкость
10. Учет объема молекул
• В реальных газах молекулы имеютконечный объем
• r- радиус молекулы
3
3
3
3
V V 2r V d
• Доступный для движения объем
11.
• Если молекул 2V 3V d
3
N 4 3
πd
2 3
12.
3 N 4• Для N молекул 3
3
V V d πd
3V
2 3
d
2
16
3
3
V V Nπd V Nπr V 4 NVмол
3
3
• Поправка на объем молекул
b 4 NVмол
13. Уравнение Ван дер Ваальса
• Для 1 моля реального газаa
P 2 Vm b RT
Vm
a
Повышение давления за счет сил
межмолекулярного притяжения
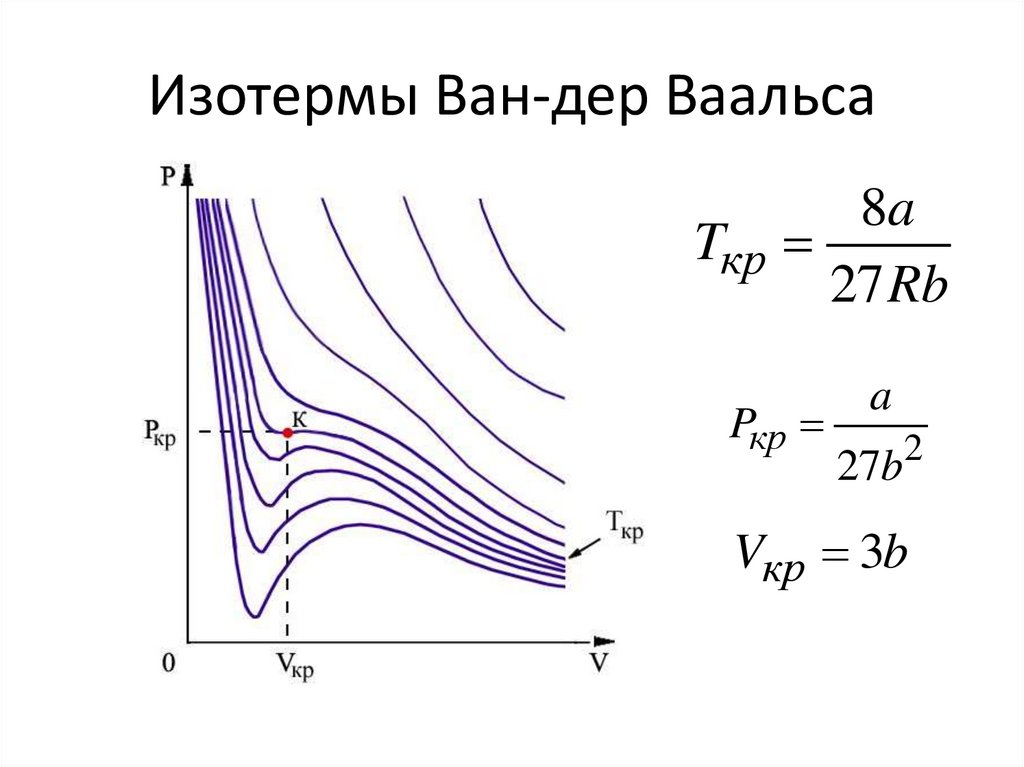
14. Изотермы Ван-дер Ваальса
8aTкр
27 Rb
Pкр
a
27b
2
Vкр 3b
15.
• При повышении температуры максимумы иминимумы сглаживаются
• При некоторой температуре превращаются
в точку перегиба
• КРИТИЧЕСКАЯ температура
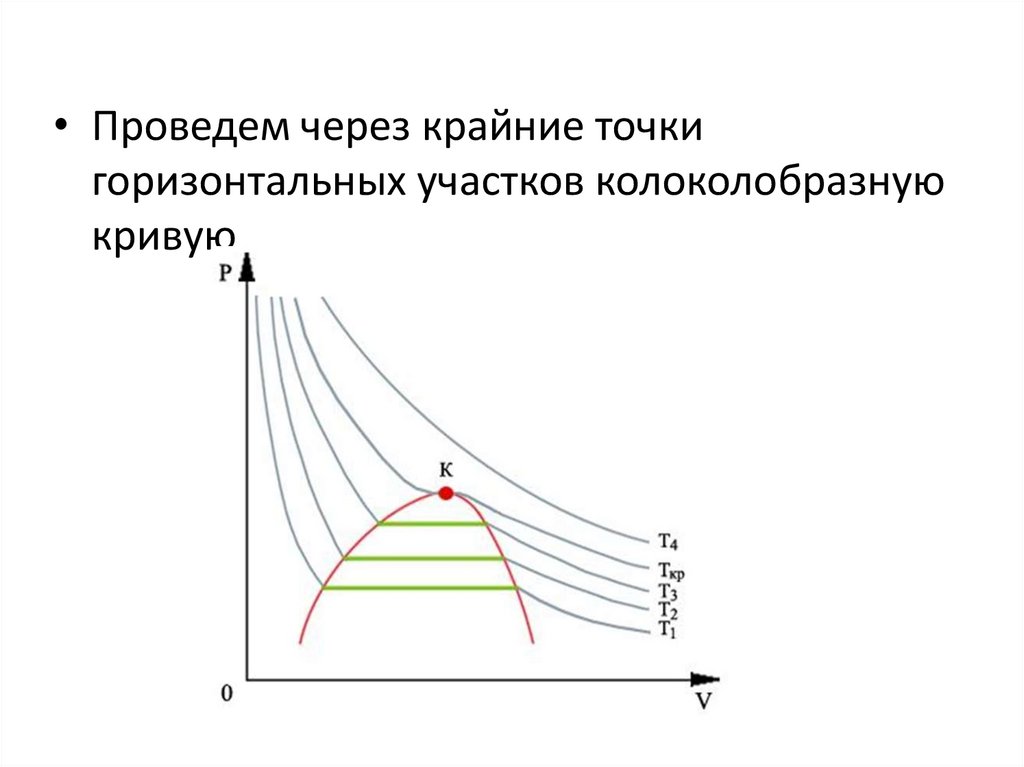
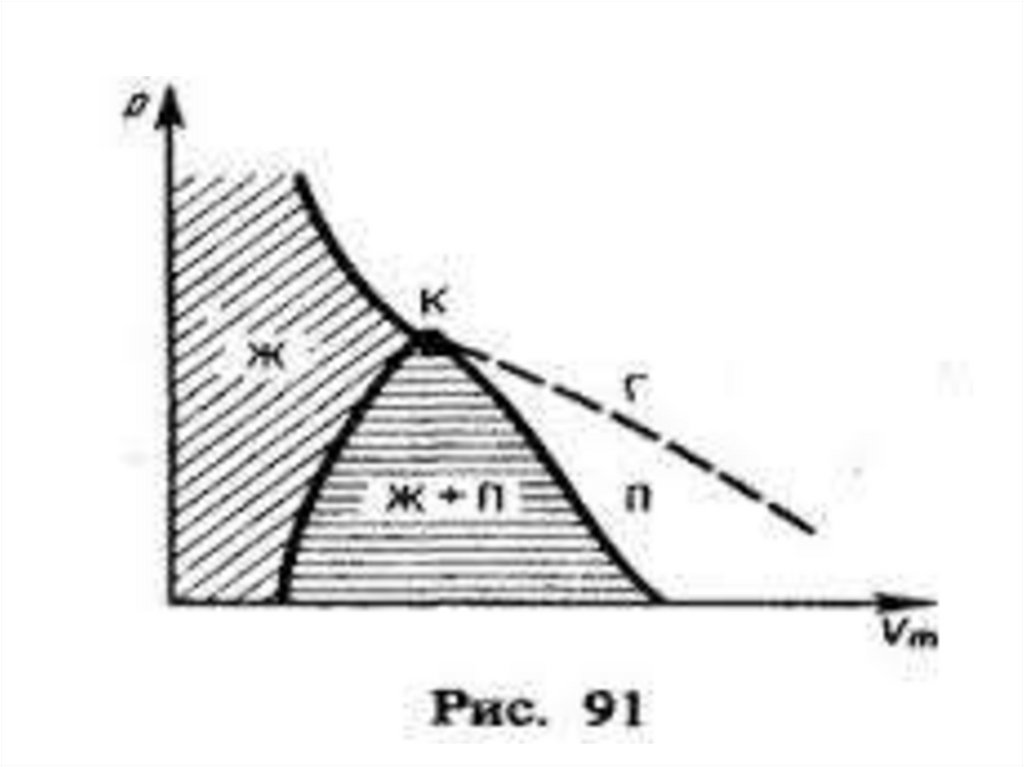
16. Изотермы реального газа
• На участке DB давление растет при увеличенииобъема
• В природе такого не бывает
• Реальный участок АС
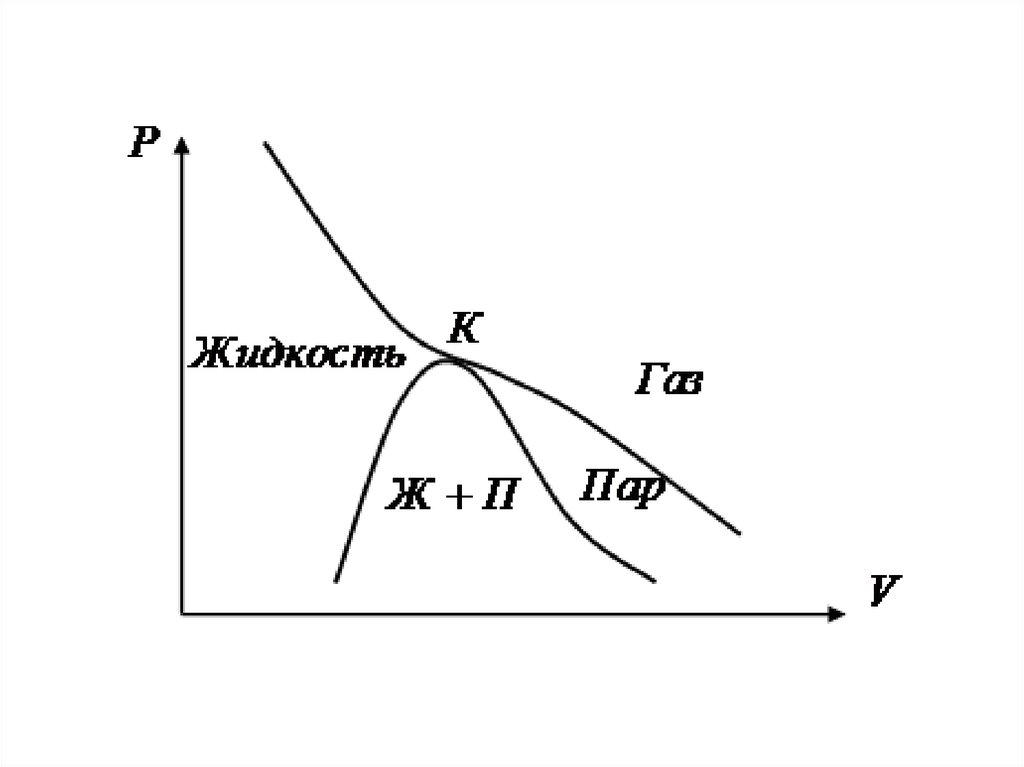
17.
• Справа от А - газ• Слева от С - жидкость
• АС – двухфазное состояние
• Газ при температуре ниже критической - ПАР
• Пар, в равновесии с жидкостью
• – насыщенный пар
18.
• Проведем через крайние точкигоризонтальных участков колоколобразную
кривую












 Физика
Физика