Похожие презентации:
Основания, их состав и название
1. Основания, их состав и название.
2. Цель урока:
1. Познакомить учащихся с новымклассом неорганических соединений –
основаниями.
2. Рассмотреть классификацию, состав и
номенклатуру оснований.
3.
1.Что такое бинарныесоединения?
2. Что такое оксиды?
3. В каких агрегатных состояниях
при н. у. встречаются оксиды?
4. Приведите формулы: воды,
углекислого газа, негашеной
извести,
хлороводорода.
5.
Составьте
формулы:
оксида азота (V), оксида азота(IV),
оксида азота(II).
4. Выпишите отдельно оксиды металлов и оксиды неметаллов и дайте им название.
1.2.
Na2O, SO
H2O,
HCl,
2,
CaCl
2, NO,
FeO,
HNO3,
BaO,
CO2,NaOH,
CaS,
CuO,
P2O5.
SO
3, LiOH.
5.
Основания– это сложные вещества, состоящие из
ионов металлов и связанных с ними
одного или нескольких гидроксидионов.
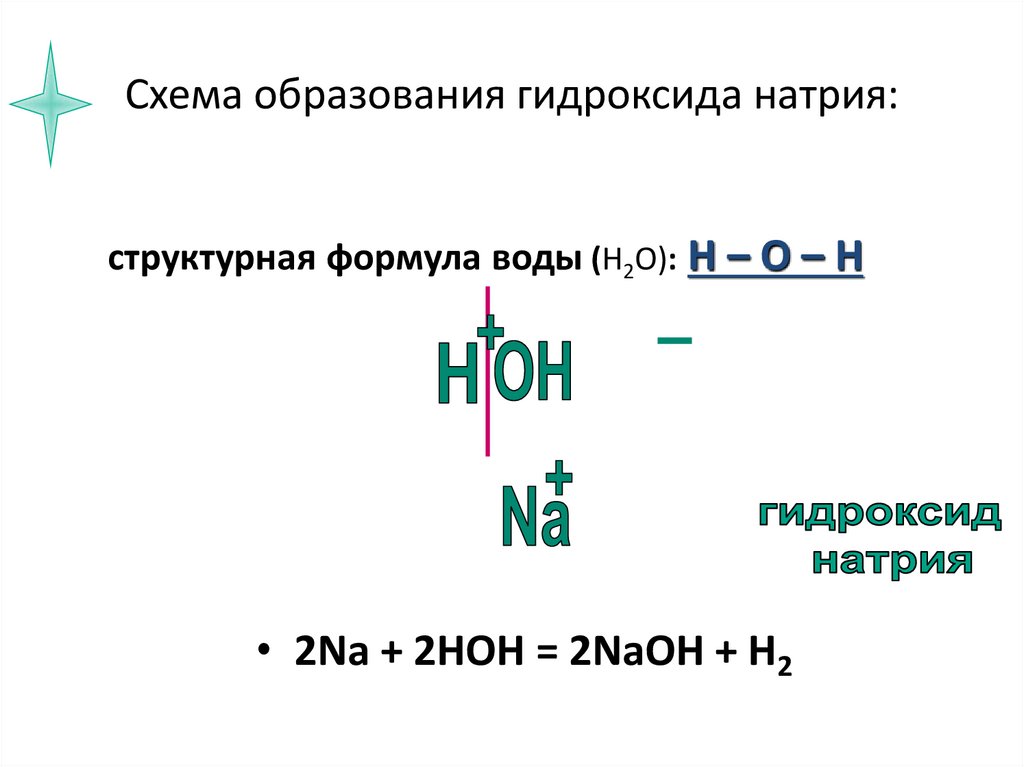
6. Схема образования гидроксида натрия:
структурная формула воды (Н2О): Н – О – Н• 2Na + 2HOH = 2NaOH + H2
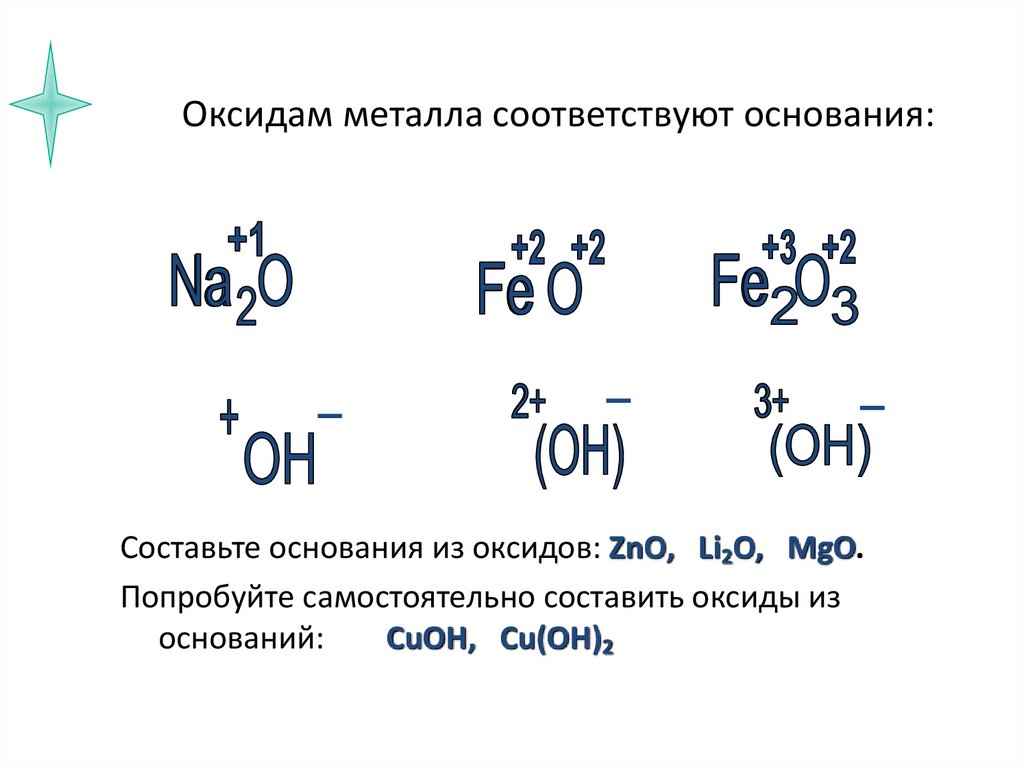
7. Оксидам металла соответствуют основания:
Составьте основания из оксидов: ZnO, Li2O, MgO.Попробуйте самостоятельно составить оксиды из
оснований:
CuOH, Cu(OH)2
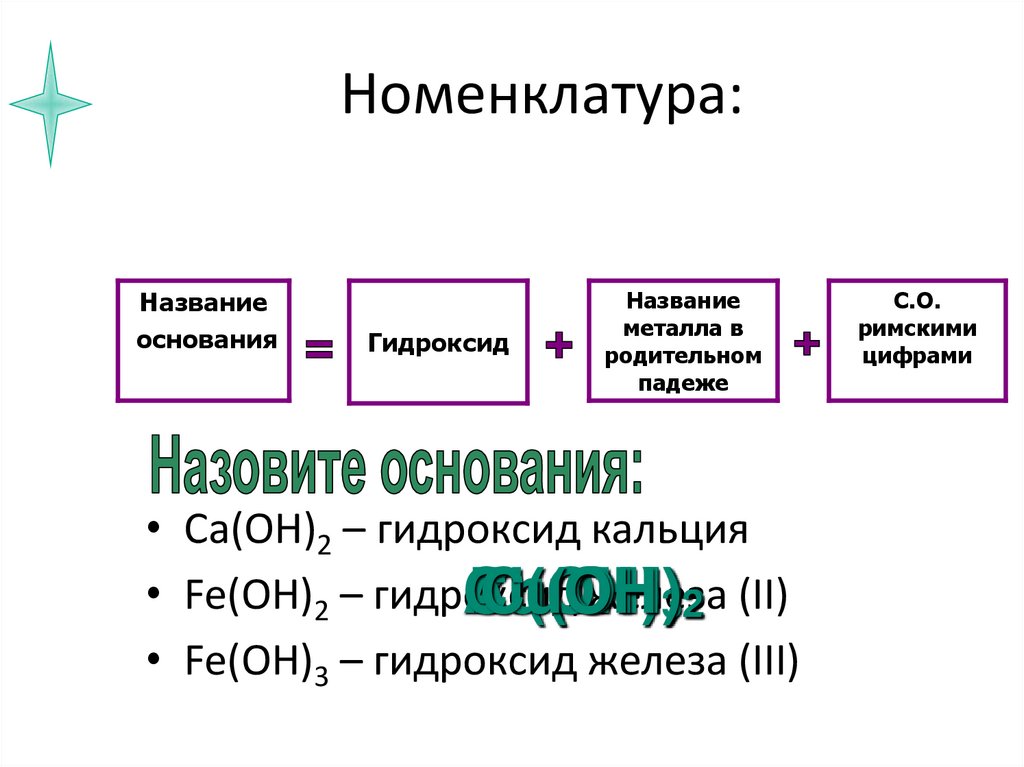
8. Номенклатура:
Названиеоснования
Гидроксид
Название
металла в
родительном
падеже
• Ca(OH)2 – гидроксид кальция
• Fe(OH)2 – гидроксид
железа
Al(OH)
Cu(OH)
Zn(OH)
CuOH
32 (II)
• Fe(OH)3 – гидроксид железа (III)
С.О.
римскими
цифрами
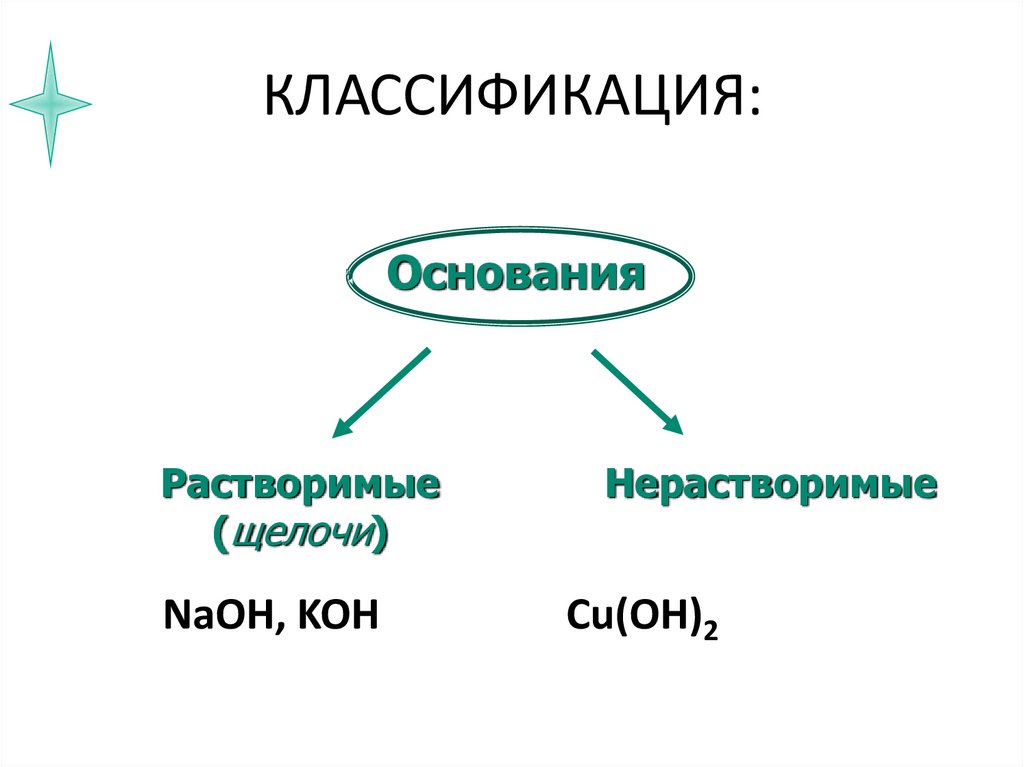
9. КЛАССИФИКАЦИЯ:
ОснованияРастворимые
(щелочи)
NaOH, KOH
Нерастворимые
Cu(OH)2
10. Закрепление
Составитьоксиды
и назвать:
2.
Какимиоксидам
пооснования
растворимости
4.5.
и назвать:
3.Составить
Каким
1. Что такое
основание?
бывают
основания?
соответствуют
основания?
LiOH,
Ca(OH)
K2O, BaO,
Cr2O3.
2.
11.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs)
(Ca, Ba, Ra)
или щелочноземельный
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла
(Li, Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
12.
Химическиесвойства .
13.
Щёлочи1.Щёлочи изменяют окраску
индикаторов:
Лакмус-синий
Метилоранж-жёлтый
Фенолфталеин-малиновый
14.
2.Реакция нейтрализацииМе(ОН) +HАсd=H2O+MeАсd
n
2NaOH+H2SO4=Na2SO4+H2O
!
Осторожно !
Едкие вещества !
15.
Реакция между основанием икислотой в результате
которой образуется соль и
вода-называется реакцией
нейтрализации.
16.
3.Ме(ОН)n+неМеО=МеR+H2O2Ca(OH)2+CO2=CaCO3+H2O
4.Ме(ОН)n+Me1R=MeR+Me1(OH)n
Ba(OH)2+CuSO4=Cu(OH)2+BaSO4
Щёлочи разъедают кожу,ткани,бумагу.
Осторожно!
Смыть водой.
17.
Нерастворимыеоснования .
Реакция нейтрализации .
1.
Ме(ОН) +HR=MeR+H O
n
2
Fe(OH)2+H2SO4=FeSO4+2H2O
18.
2.Термическое разложение.Ме(ОН)n
MeO+H2O
Cu(OH)2=CuO+H2O
19. Особые свойства оснований.
1. Качественная реакция на Са(ОН)2 –помутнение известковой воды:
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
2. Качественные реакции на ион Ва+2:
SO42- + Ва+2 → BaSO4↓
2F- + Ва+2 → BaF2 ↓











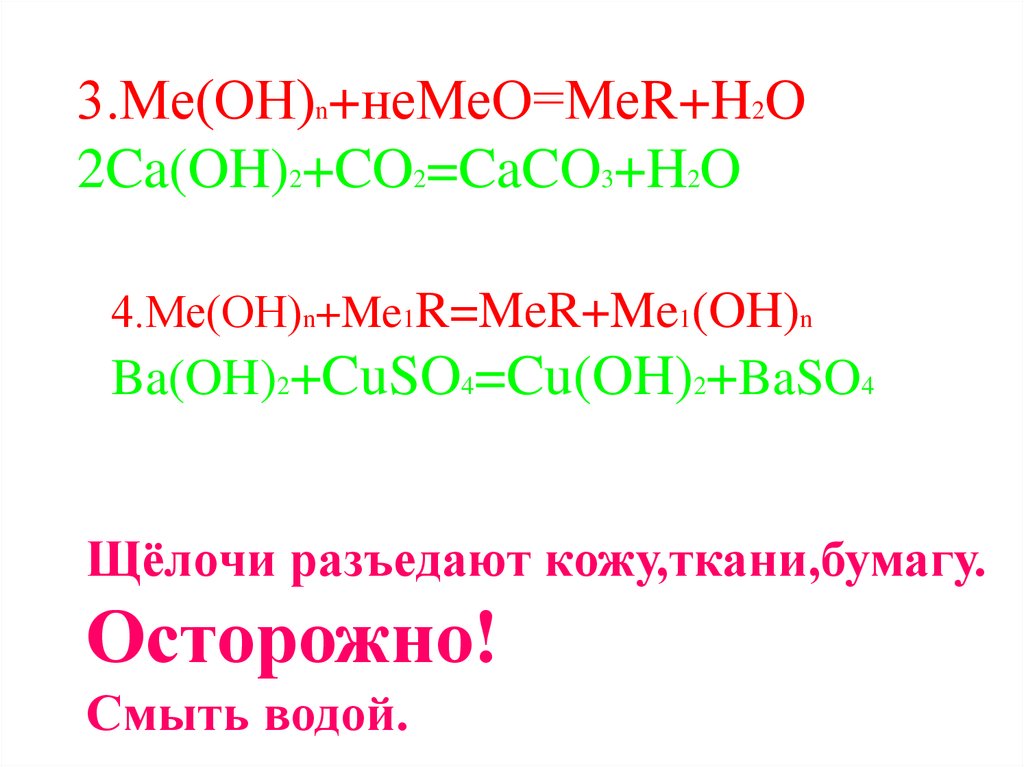



 Химия
Химия








