Похожие презентации:
Асептика. Стерилизация питательных сред
1. АСЕПТИКА. СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД
Пред ферментационная стадия. Часть 22. Типовые стадии биотехнологического процесса
1. Предферментационная2. Ферментационная
3. Постферментационная
3. Предферментационная стадия
• Основы промышленной асептики• Приготовление и стерилизация питательных сред (субстрата)
• Приготовление посевного материала (биологического объекта –
инокулята)
• Подготовка технологического воздуха
4. Основы промышленной асептики
Асептика – комплекс технологических и гигиеническихмероприятий, обеспечивающих защиту продукта от попадания в
него микроорганизмов на всех этапах технологического процесса
Методы асептики:
• Очистка (устранение загрязнений, включая, пыль, грязь,
основное количество микроорганизмов и органических веществ)
• Дезинфекция (снижение количества микроорганизмов до уровня,
безопасного для здоровья, но не бактериальных спор)
• Стерилизация – процесс полного уничтожения или удаления из
объекта всех форм микроорганизмов
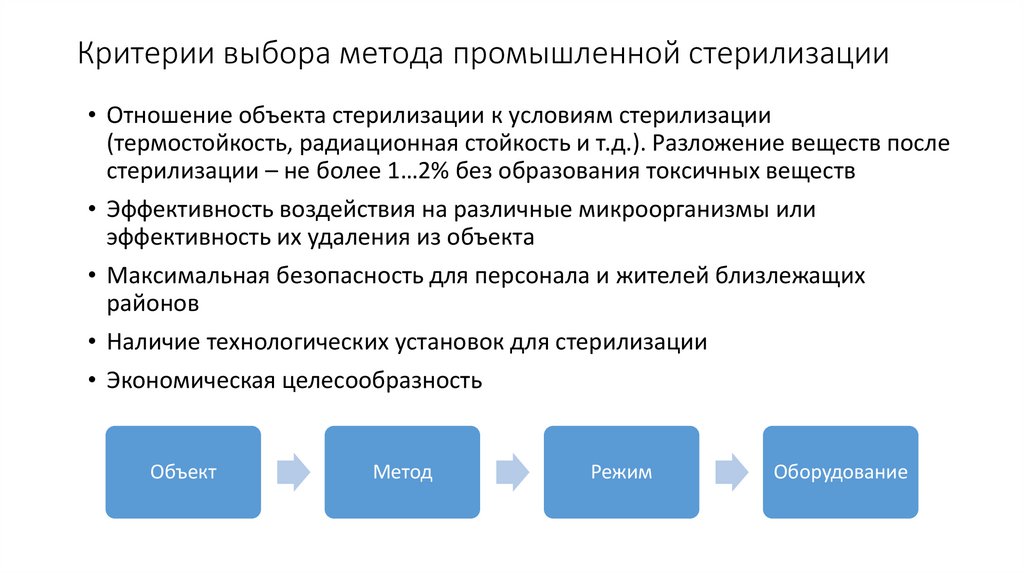
5. Критерии выбора метода промышленной стерилизации
• Отношение объекта стерилизации к условиям стерилизации(термостойкость, радиационная стойкость и т.д.). Разложение веществ после
стерилизации – не более 1…2% без образования токсичных веществ
• Эффективность воздействия на различные микроорганизмы или
эффективность их удаления из объекта
• Максимальная безопасность для персонала и жителей близлежащих
районов
• Наличие технологических установок для стерилизации
• Экономическая целесообразность
Объект
Метод
Режим
Оборудование
6. Объекты стерилизации
• Оборудование, коммуникации, арматура• Технологические среды (питательная среда, посевной материал,
газы)
• Технологическая одежда
• Готовые препараты
• Упаковка для стерильной продукции
7. Методы стерилизации
• Действие всех стерилизующих агентов основано на инактивацииважнейших в внутриклеточных веществ, необходимых для роста
и репродукции клеток (полное уничтожение и вегетативных и
споровых форм)
• Для стерилизации потоком могут применяться тепловые (с
нагревом) и «холодные» (без нагрева) методы стерилизации
• Могут осуществляться в периодическом или непрерывном
режиме
8. Тепловые методы стерилизации
• Водяным паром (глухим, острым, текучим)Избыточное давление:
Ризб.= 0,1 МПа (Рабс.= 2 атм), Т=121 оС
Ризб.= 0,2 МПа (Рабс.= 3 атм), Т=132 оС
• Горячим воздухом (сухожаровой способ: Т=160; 180; 200 оС)
• Инфракрасными лучами
• Высокочастотным и СВЧ нагревом
9. Проблемы применения тепловых методов
• Денатурация белков• Активация окислительно-восстановительных процессов
10. «Холодные» методы стерилизации
• Ионизирующее излучение (радиационный метод) для изделий изполимерных материалов
• Ультразвуковое воздействие
• Воздействие химическими реагентами (растворы: перекись
водорода, надкислоты; газы: окись этилена и др.) для
оборудования, упаковки
• Ультрафиолетовое облучение
• Декомпрессионное воздействие – для жидких сред
• Стерилизующая фильтрация - для жидких сред
• Центрифугирование и электростатического осаждение - для
жидких сред
11. Проблемы применения «холодных» методов стерилизации
• Необходимость удаления следов стерилизующего агента(промывка, дегазация и др.)
• Прямое и косвенное воздействие на объект (токсичность)
• Слабая проникающая способность УФ-лучей, фотохимическое
воздействие
• Попадание волокон стерилизующего материала в фильтрат
• Адсорбция макромолекул на фильтрующем материале
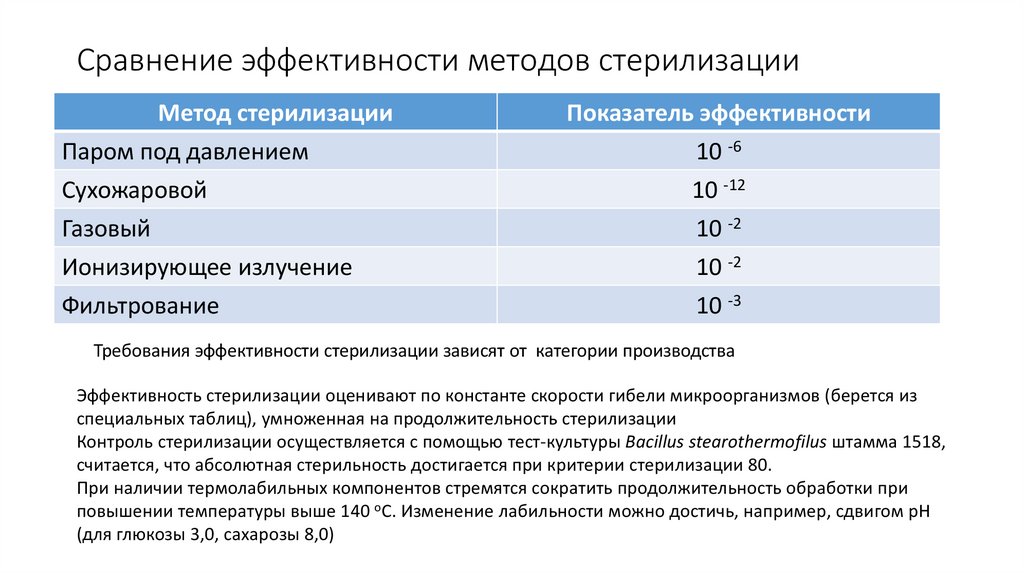
12. Сравнение эффективности методов стерилизации
Метод стерилизацииПаром под давлением
Сухожаровой
Газовый
Ионизирующее излучение
Фильтрование
Показатель эффективности
10 -6
10 -12
10 -2
10 -2
10 -3
Требования эффективности стерилизации зависят от категории производства
Эффективность стерилизации оценивают по константе скорости гибели микроорганизмов (берется из
специальных таблиц), умноженная на продолжительность стерилизации
Контроль стерилизации осуществляется с помощью тест-культуры Bacillus stearothermofilus штамма 1518,
считается, что абсолютная стерильность достигается при критерии стерилизации 80.
При наличии термолабильных компонентов стремятся сократить продолжительность обработки при
повышении температуры выше 140 оС. Изменение лабильности можно достичь, например, сдвигом рН
(для глюкозы 3,0, сахарозы 8,0)
13. Преимущества стерилизации водяным паром
• Легко транспортируется• Хорошо проникает в труднодоступные места
• Обладает хорошей теплоотдачей при конденсации
• Не токсичен для персонала и микроорганизмов (после
стерилизации)
• Относительно дешев
• Не изменяет состава питательной среды
14. Особенности стерилизации питательных сред
• Необходимое условие успешной стерилизации питательной среды тщательная гомогенизация ее твердых компонентов.• Длительность выдержки (при температуре стерилизации) крупных частиц,
медленно прогревающихся при стерилизации, бывает меньше расчетной,
и в них сохраняется посторонняя микрофлора, способная инфицировать
культуральную жидкость.
• Скорость растворения вещества в жидкости пропорциональна мощности
мешалки, приходящейся на единицу объема жидкости. В связи с этим
реакторы для приготовления питательной среды должны быть снабжены
достаточно мощными мешалками, а также перегородками-отражателями,
не допускающими завихрения и вращения жидкости в аппаратах
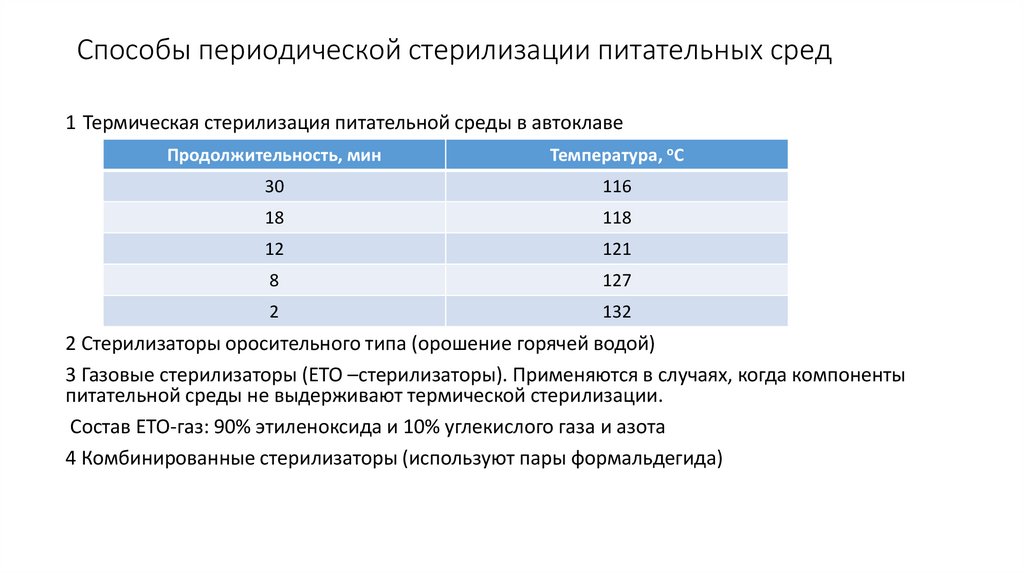
15. Способы периодической стерилизации питательных сред
1 Термическая стерилизация питательной среды в автоклавеПродолжительность, мин
Температура, оС
30
116
18
118
12
121
8
127
2
132
2 Стерилизаторы оросительного типа (орошение горячей водой)
3 Газовые стерилизаторы (ЕТО –стерилизаторы). Применяются в случаях, когда компоненты
питательной среды не выдерживают термической стерилизации.
Состав ЕТО-газ: 90% этиленоксида и 10% углекислого газа и азота
4 Комбинированные стерилизаторы (используют пары формальдегида)
16.
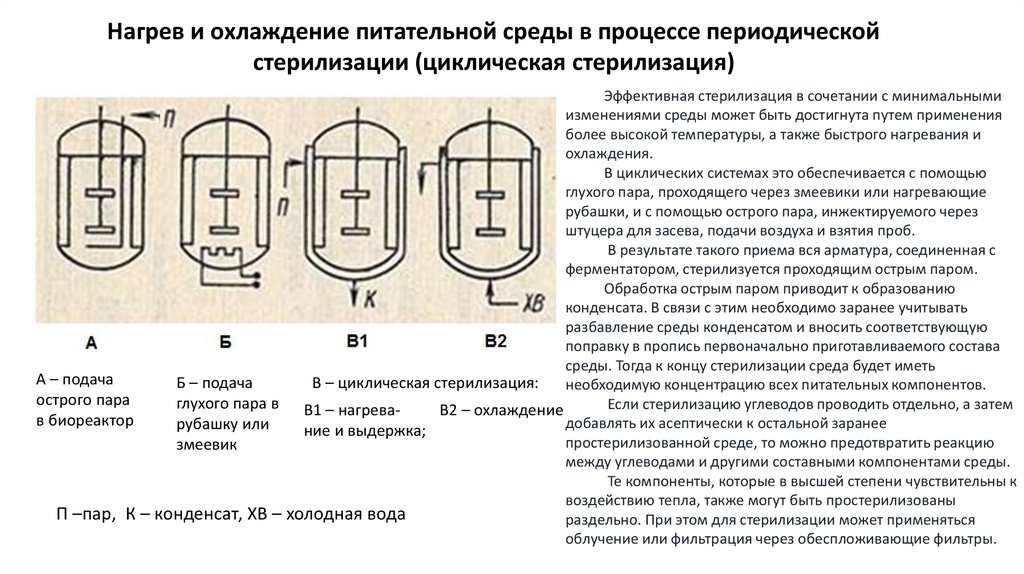
Нагрев и охлаждение питательной среды в процессе периодическойстерилизации (циклическая стерилизация)
Эффективная стерилизация в сочетании с минимальными
изменениями среды может быть достигнута путем применения
более высокой температуры, а также быстрого нагревания и
охлаждения.
В циклических системах это обеспечивается с помощью
глухого пара, проходящего через змеевики или нагревающие
рубашки, и с помощью острого пара, инжектируемого через
штуцера для засева, подачи воздуха и взятия проб.
В результате такого приема вся арматура, соединенная с
ферментатором, стерилизуется проходящим острым паром.
Обработка острым паром приводит к образованию
конденсата. В связи с этим необходимо заранее учитывать
разбавление среды конденсатом и вносить соответствующую
поправку в пропись первоначально приготавливаемого состава
среды. Тогда к концу стерилизации среда будет иметь
А – подача
Б – подача
В – циклическая стерилизация:
необходимую концентрацию всех питательных компонентов.
острого пара
глухого пара в В1 – нагреваЕсли стерилизацию углеводов проводить отдельно, а затем
В2 – охлаждение
в биореактор
добавлять их асептически к остальной заранее
рубашку или
ние и выдержка;
простерилизованной среде, то можно предотвратить реакцию
змеевик
между углеводами и другими составными компонентами среды.
Те компоненты, которые в высшей степени чувствительны к
воздействию тепла, также могут быть простерилизованы
П –пар, К – конденсат, ХВ – холодная вода
раздельно. При этом для стерилизации может применяться
облучение или фильтрация через обеспложивающие фильтры.
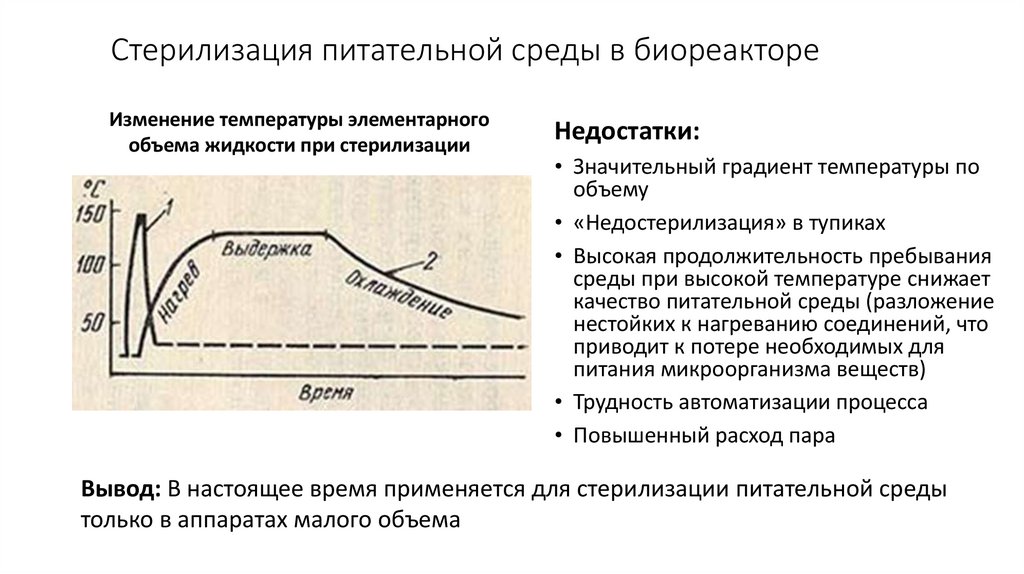
17. Стерилизация питательной среды в биореакторе
Изменение температуры элементарногообъема жидкости при стерилизации
Недостатки:
• Значительный градиент температуры по
объему
• «Недостерилизация» в тупиках
• Высокая продолжительность пребывания
среды при высокой температуре снижает
качество питательной среды (разложение
нестойких к нагреванию соединений, что
приводит к потере необходимых для
питания микроорганизма веществ)
• Трудность автоматизации процесса
• Повышенный расход пара
Вывод: В настоящее время применяется для стерилизации питательной среды
только в аппаратах малого объема
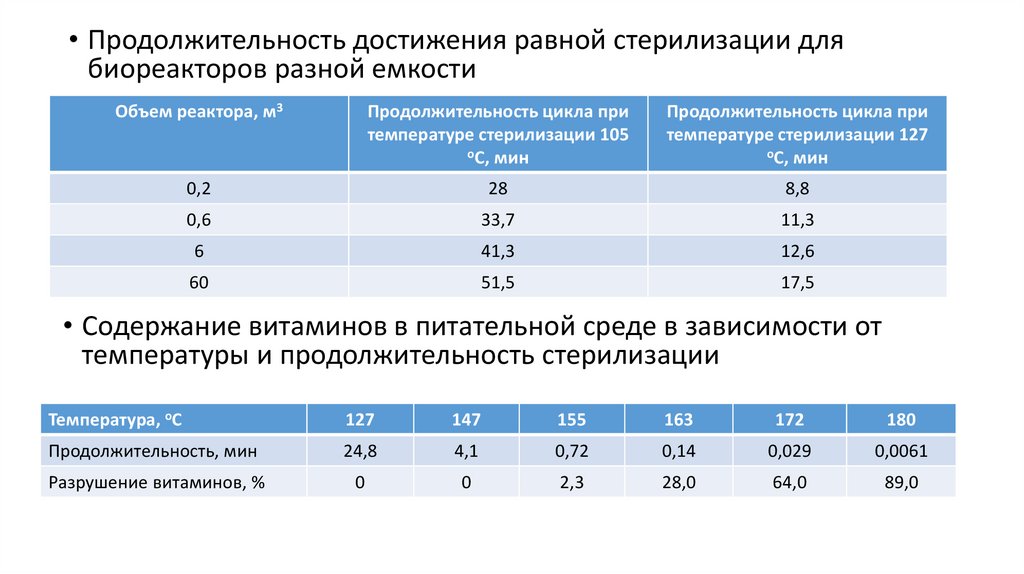
18.
• Продолжительность достижения равной стерилизации длябиореакторов разной емкости
Объем реактора, м3
Продолжительность цикла при
температуре стерилизации 105
оС, мин
Продолжительность цикла при
температуре стерилизации 127
оС, мин
0,2
28
8,8
0,6
33,7
11,3
6
41,3
12,6
60
51,5
17,5
• Содержание витаминов в питательной среде в зависимости от
температуры и продолжительность стерилизации
Температура, оС
127
147
155
163
172
180
Продолжительность, мин
24,8
4,1
0,72
0,14
0,029
0,0061
Разрушение витаминов, %
0
0
2,3
28,0
64,0
89,0
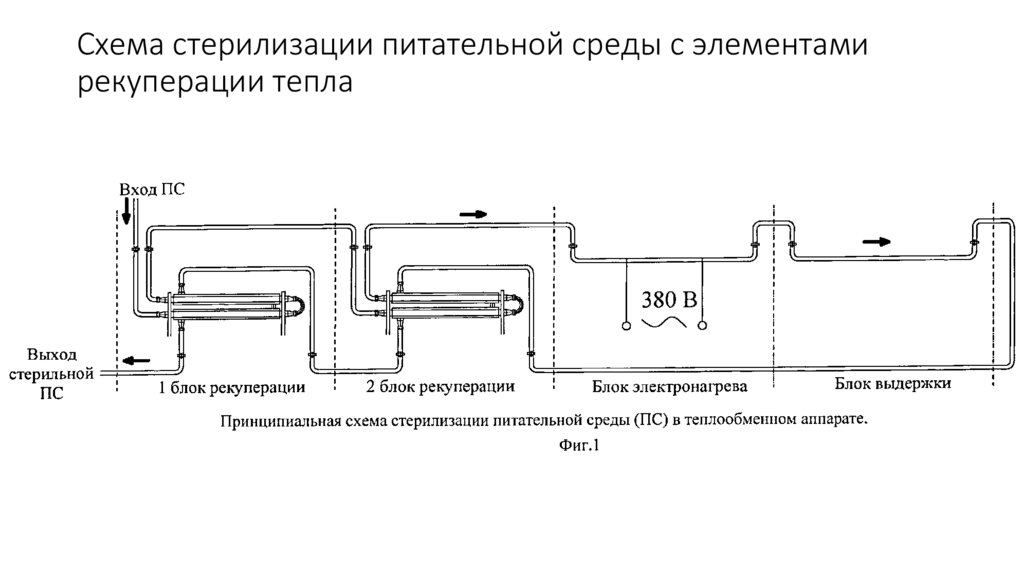
19. Непрерывная термическая стерилизация питательных сред
Схема установки для непрерывной стерилизациипитательной среды
Среда готовится в отдельной емкости 1, а затем насосом
2 прокачивается через установку для стерилизации в заранее
простерилизованный ферментатор.
Установка непрерывной стерилизации состоит из
последовательно соединенных секций (аппаратов):
нагревателя 3, выдерживателя 4 и холодильника 5.
В такой системе можно применять более высокие
температуры, чем те, которые могут считаться экономичными
при циклической стерилизации.
В результате продолжительность выдерживания среды
при максимальной температуре резко сокращается, а
периоды нагревания и охлаждения не превышают нескольких
секунд.
Для среды, свободной от суспендированных твердых
частиц, поддержание температуры на уровне 150…160 °С
обеспечивает мгновенную стерилизацию.
Если в среде присутствуют твердые суспендированные
частицы, то оптимальная для стерилизации температура
должна иметь более низкое значение, поскольку требуется
дополнительное время для проникновения тепла внутрь
таких частиц. Это значение будет определяться природой
суспендированных частиц, а также допустимой в каждом
отдельном случае степенью начального изменения состава
среды.
Наиболее распространенной в таких случаях считается
температура стерилизации, равная 135 °С, а длительность
выдерживания от 5 до 15 мин.
Во всех случаях непрерывной стерилизации охлаждение
среды практически осуществляется в теплообменниках типа
труба в трубе или в противоточных пластинчатого типа, а
нагревание - путем инжектирования острого пара.
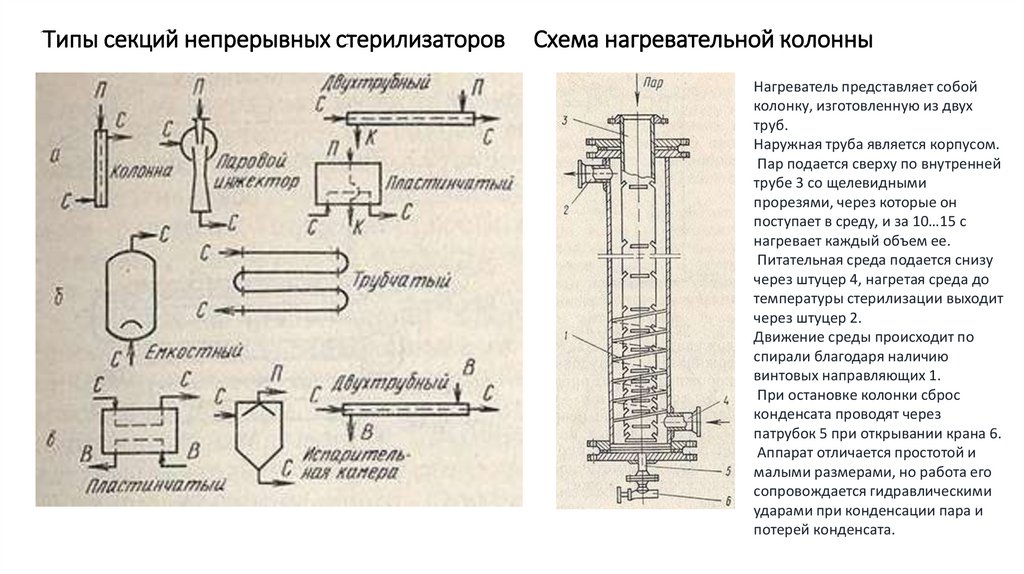
20. Типы секций непрерывных стерилизаторов Схема нагревательной колонны
Нагреватель представляет собойколонку, изготовленную из двух
труб.
Наружная труба является корпусом.
Пар подается сверху по внутренней
трубе 3 со щелевидными
прорезями, через которые он
поступает в среду, и за 10…15 с
нагревает каждый объем ее.
Питательная среда подается снизу
через штуцер 4, нагретая среда до
температуры стерилизации выходит
через штуцер 2.
Движение среды происходит по
спирали благодаря наличию
винтовых направляющих 1.
При остановке колонки сброс
конденсата проводят через
патрубок 5 при открывании крана 6.
Аппарат отличается простотой и
малыми размерами, но работа его
сопровождается гидравлическими
ударами при конденсации пара и
потерей конденсата.
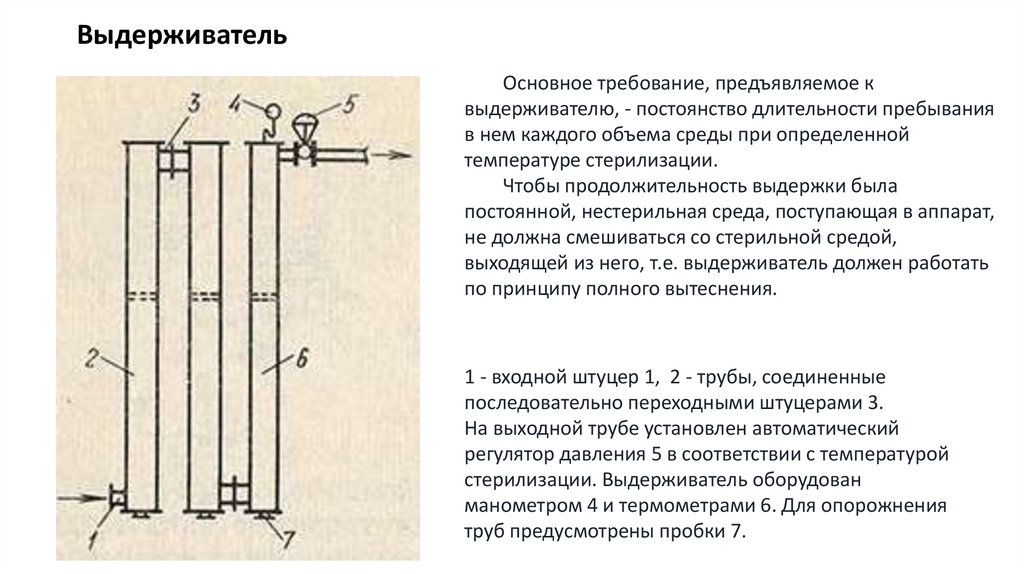
21. Выдерживатель
Основное требование, предъявляемое квыдерживателю, - постоянство длительности пребывания
в нем каждого объема среды при определенной
температуре стерилизации.
Чтобы продолжительность выдержки была
постоянной, нестерильная среда, поступающая в аппарат,
не должна смешиваться со стерильной средой,
выходящей из него, т.е. выдерживатель должен работать
по принципу полного вытеснения.
1 - входной штуцер 1, 2 - трубы, соединенные
последовательно переходными штуцерами 3.
На выходной трубе установлен автоматический
регулятор давления 5 в соответствии с температурой
стерилизации. Выдерживатель оборудован
манометром 4 и термометрами 6. Для опорожнения
труб предусмотрены пробки 7.
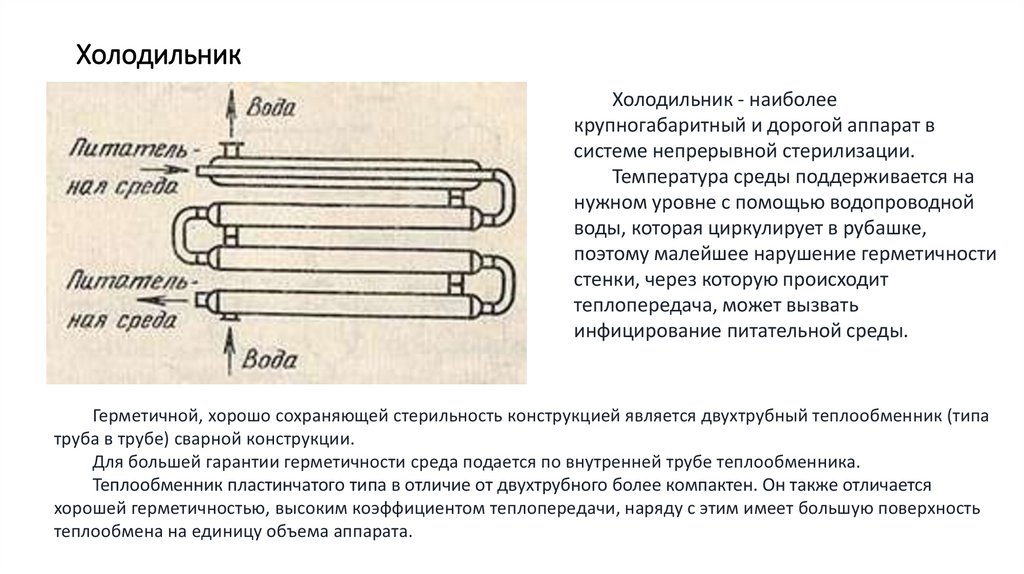
22. Холодильник
Холодильник - наиболеекрупногабаритный и дорогой аппарат в
системе непрерывной стерилизации.
Температура среды поддерживается на
нужном уровне с помощью водопроводной
воды, которая циркулирует в рубашке,
поэтому малейшее нарушение герметичности
стенки, через которую происходит
теплопередача, может вызвать
инфицирование питательной среды.
Герметичной, хорошо сохраняющей стерильность конструкцией является двухтрубный теплообменник (типа
труба в трубе) сварной конструкции.
Для большей гарантии герметичности среда подается по внутренней трубе теплообменника.
Теплообменник пластинчатого типа в отличие от двухтрубного более компактен. Он также отличается
хорошей герметичностью, высоким коэффициентом теплопередачи, наряду с этим имеет большую поверхность
теплообмена на единицу объема аппарата.
23. Преимущества непрерывной стерилизации
1.При непрерывном методе стерилизации каждый элементарный объем среды
(бесконечно малый объем, содержащий спору) находится при более высокой
температуре более короткое время;
2.
Благодаря более высоким температурам стерилизации и короткой экспозиции
(выдерживании) деструкция компонентов питательной cpеды минимальна;
3.
Процесс стерилизации всего объема питательной сред растянут во времени,
этим обеспечивается более равномерная загрузка котельной;
4.
Процесс легко контролируем и управляем;
5.
Отработанное тепло выделяется постоянно и равномерно, что обеспечивает
возможность его использования для получения горячей воды.














 Биология
Биология








