Похожие презентации:
Культуры животных клеток
1.
• Культуры животных клеток• Идея о том, что клетки тканей животных можно выделить из
организма и затем создать условия для роста и
воспроизводства их in vitro, возникла на базе концепции,
принадлежащей К. Бернару.
• Чуть позже, в 1885 г., Ру показал возможность сохранения вне
организма живых тканей на практике. Он в течение
нескольких дней поддерживал в жизнеспособном состоянии
нервную пластинку куриного эмбриона в теплом солевом
(физиологическом) растворе. Позднее, в 1897 г., Леб
поддерживал в жизнеспособном состоянии клетки крови и
соединительной ткани в пробирках с сывороткой и плазмой
крови. Льюнгрен (1898) показал возможность поддержания
эксплантатов кожи человека в жизнеспособном состоянии в
кислой среде с сохранением способности к реимплантации.
Джолли (1903) наблюдал деление клетки в висячей капле,
содержащей лейкоциты саламандры, а Биб и Эвинг (1906)
подтвердили это в экспериментах с лимфосаркомной тканью
собаки.
2.
• Продолжаяработы
Ру,
Росс
Гаррисон
усовершенствовал методику «висячей капли». Он
использовал небольшие кусочки ткани, отторгнутые
от медуллярной пластинки эмбриона лягушки и
внедренные в ее лимфатический тромб (сгусток
лимфы), и выдерживал их в виде капли на нижней
стороне покровного стекла, расположенного поверх
лунки в предметном стекле. В 1907 г. ему удалось
наблюдать с помощью такой «камеры» рост нервных
клеток в течение нескольких недель; он установил,
что скорость роста этих клеток составляет 20 мкм за
25 мин. Эксперименты Гаррисона были направлены
на получение ответов на вопросы, относящиеся к
физиологии нервных клеток лягушки, однако
воспроизводимая методика, которой он предложил,
была применена Берроузом для других клеток тканей
теплокровных животных. Этот исследователь в 1910
г. вместо лимфатического тромба использовал
сгусток плазмы курицы.
3.
• В 1913 г. Алексис Каррель применил плазму крови,обогащенную
эмбриональным
экстрактом.
Примененная
методика обеспечивала значительно большую вероятность
успеха, чем та, которую использовала Рид (1908), пытавшиеся
выращивать клетки костного мозга морской свинки на среде
определенного состава. Инкубация клеток сердца куриного
эмбриона была начала 17 января 1913 г. Пересев клеток
продолжил Эблинг, работая с ними 34 года. Поскольку Каррель
был хирургом, весьма сведущим в вопросах асептики, он смог
внести существенный вклад в культивирование клеток животных
in vitro.
• В ходе дальнейших работ был внесен ряд поправок в рецептуру
среды культивирования. В частности, Тирод модифицировал
раствор Рингера и в дополнение к куриной сыворотке и
эмбриональному экстракту стал использовать коагулят фибрина.
В этот же период был разработан очень существенный подход в
технике работы с клетками – трипсинизация – для
высвобождения клеток из тканевой матрицы. Однако эта
методика не находила признания до тех пор, пока в 1937 г.
Симмс и Стидлман не использовали ее для пассирования
клеток. Эта методика дает возможность успешно применять в
культурах индивидуальные клетки, а не ткани.
4.
• Впервые клоны клеток в культуре из одиночной клетки былиполучены Эрлом с сотрудниками в 1948 г.
• Первые суспензионные культуры клеток животных, полученные
в 1953 г. Оуенсом и сотрудниками, основывались на клетках
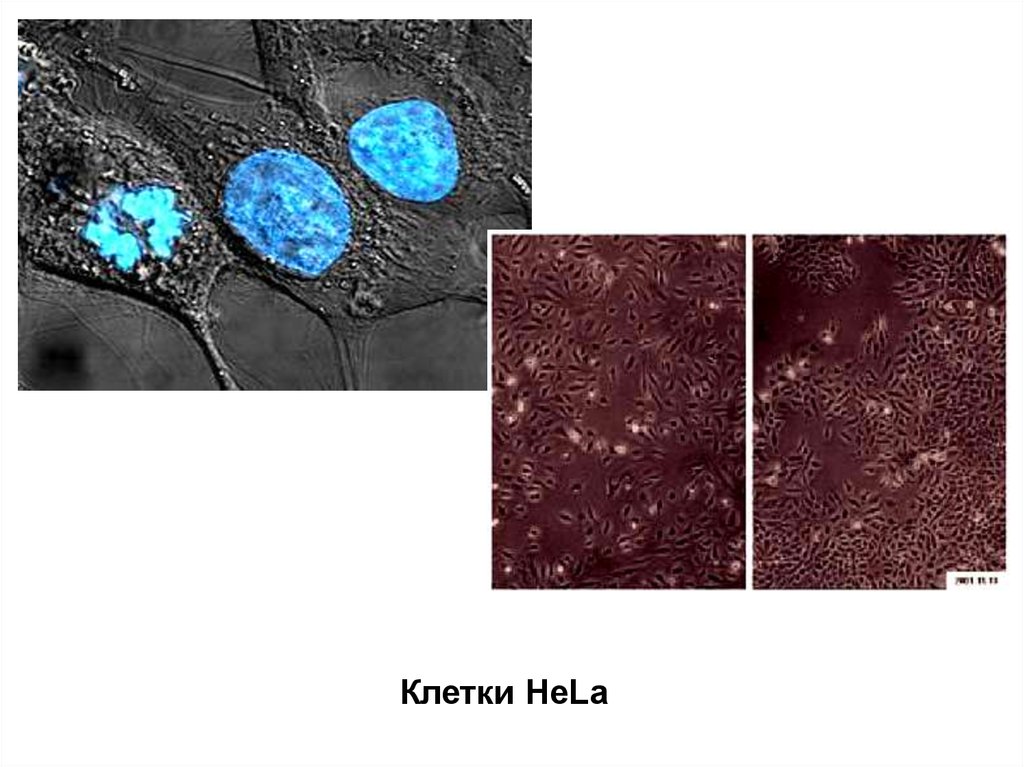
злокачественных тканей. Это – клетки HeLa, выделенные из
раковой опухоли шейки матки человека. Перевиваемая линия
клеток карциномы шейки матки была выделена еще в 1952 г.
Джеем с сотрудниками и используется в настоящее время во
многих лабораториях мира.
• Игл (1955) систематически исследовал пищевые потребности
клеток человека и мыши.
• До тех пор, пока в 1961 г. Хейфлик и Мурхед не выделили
линию диплоидных клеток человека (НDС) WI-38, считалось,
что один раз установившаяся клеточная линия имеет
неограниченное время жизни. Относительно линии WI-38 было
показано, что период ее существования в культуре
ограничивается приблизительно 50 генерациями. Перед
отмиранием популяции для клеток этой линии характерен
феномен старения. Однако при отмирании эти клетки оставались
диплоидными и не имели признаков злокачественных
изменений.
5.
• Предел, или лимит, Хейфлика – граница количества деленийсоматических клеток. Эта граница была найдена в культурах
всех полностью дифференцированных клеток человека и
других животных. Максимальное число делений различно в
зависимости от типа клеток и еще сильнее различается в
зависимости от организма. Для большинства человеческих
клеток предел Хейфлика составляет 52 деления.
• Последующий этап в истории культивирования диплоидных
клеток человека связан с установлением факта, что они
являются генетически стабильными и свободными от всех
известных латентных и онкогенных вирусов. Поэтому линии
диплоидных клеток человека разрешено применять для
получения продуктов, предназначаемых для людей. Эта догма
остается действующей и в настоящее время, хотя дальнейшие
исследования отчетливо показали присутствие в клетках,
выделенных из нормальных тканей, потенциальных
онкогенов, идентичных тем, которые найдены в таких
известных онкогенных вирусах, как вирус саркомы Рауса и
вирус саркомы Молони.
6.
• В настоящее время практически любые клетки человека иживотных могут быть введены в культуру и, тем самым,
служить средством и объектом во многих исследованиях.
Благодаря культивированию клеток возможности исследования
и диагностики расширяются почти беспредельно, так как
имеется возможность оценки не только морфологических и
биохимических изменений, но и изменений в поведении
клеток, их реакции на различные агенты, в том числе и на
лекарственные воздействия.
• Наиболее часто культивируются следующие элементы:
• соединительной ткани – фибробласты;
• скелетной – кость и хрящи;
• мышечной – скелетные, сердечные и гладкие мышцы;
• эпителиальной – печень, легкие, кожа, мочевой пузырь, почки,
молочная железа;
• нервной – глиальные клетки и нейроны (хотя они лишены
способности к пролиферации);
• эндокринной системы – гипофиз, надпочечники, клетки
островков Лангерганса;
• различные типы опухолевых клеток.
7.
Эндотелиоцит человека8.
Раковая клетка молочной железы человека9.
Эпителиоциты человека
Фибробласты крысы
10.
Кардиомиоциты крысы11.
• Гепатоциты бабуинаНейроны гиппокампа
12.
Клетки HeLa13.
Первичная культура почечной ткани обезьяны14.
Культура перевиваемой линии15.
Фибробластоподобные клетки в культуре ткани16.
• Наибольшее распространение получили культурыфибробластов. Широкое использование фибробластов
обусловлено не только легкостью их культивирования,
но и тем, что соединительная ткань, главным
клеточным элементом которой они являются,
составляет
значительную
часть
массы
тела.
Фибробласты in vitro сохраняют важнейшие черты,
свойственные клеткам в организме, а также
онтогенетические и индивидуально-генотипические
свойства организма-донора. Не существует другого
такого типа клеток, который в полной мере мог бы
представлять свойства клеток организма. Изменения,
которые возникают при введении фибробластов в
культуру, можно легко контролировать и свести к
минимуму при создании соответствующих условий.
• Гринбергом в 1978 г. была доказана возможность
экстраполяции
данных,
полученных
на
культивируемых фибробластах, на условия in vivo.
17.
• Культуральные системы животных клеток• По характеру и длительности существования культуры животных
клеток можно подразделить на первичные и перевиваемые.
• Первичной называют клеточную культуру, полученную
непосредственно от животного и имеющую ограниченный срок
существования. По прошествии определенного времени (20-30
суток) в клетках возникают явления неспецифической
дегенерации, что выражается в грануляции и вакуолизации
цитоплазмы, ошаривании клеток, утрате связи между ними и
твердым субстратом, на котором они выращивались.
Периодическая смена среды, изменение ее состава и другие
процедуры могут лишь несколько увеличить сроки жизни
первичной клеточной культуры, но не могут предотвратить ее
конечной деструкции и гибели. По всей вероятности, этот
процесс связан с естественным угасанием метаболической
активности
клеток,
выведенных
из-под
контроля
нейрогуморальных факторов, действующих в целостном
организме.
18.
• Лишь отдельные клетки или группы клеток на фонедегенерации большей части популяции могут сохранить
способность к росту и размножению. Эти клетки при
многократных перевивках дают начало перевиваемым
культурам клеток.
• Их
принято
разделять
на
перевиваемые
клетки,
характеризующиеся потенциальным бессмертием и, как
правило, гетероплоидным кариотипом (клеточные линии), и
полуперевиваемые клетки с диплоидным набором хромосом и
ограниченной
продолжительностью
жизни,
выгодно
сочетающие черты первичных и перевиваемых клеток.
• Первичные культуры после пересева становятся вторичными
культурами. В таких культурах также появляются клетки,
дающие начало диплоидным и постоянным культурам.
Культуры перевиваемых клеток, способные к автономному
существованию и бесконечно долгому размножению
называются трансформированными.
• Другим источником постоянных клеточных линий являются
злокачественные новообразования, клетки которых уже
трансформированы in vivo при развитии патологического
процесса.
19.
• Таким образом, различают 3 основных типа культурживотных клеток: первичные культуры, получаемые
практически из любого органа и существующие лишь
до первого пересева; диплоидные культуры, чаще
получаемые из эмбриональных тканей и сохраняющие
до 50 пересевов диплоидный набор хромосом, и
трансформированные постоянные гетероплоидные
культуры, способные к существованию вне организма
неограниченно долгое время.
• Кроме того, культуры тканей могут подразделяться по
виду животного, от которого они происходят; по типу
ткани-источника; по состоянию ткани на момент
извлечения (нормальные, опухолевые), по способу
выращивания (монослойные, суспензионные, на
микроносителях и т. п.).
• Главным фактором при выборе ткани или линии клеток
для дальнейшей работы является природа процесса,
который будет осуществляться с использованием этих
клеток.
20.
• Как правило, культуры, полученные из эмбриональныхтканей, характеризуются лучшей выживаемостью и
более активным ростом по сравнению с культурами из
соответствующих взрослых тканей. Причиной этого
является низкий уровень специализации и наличие в
эмбрионах
реплицирующихся
клетокпредшественников.
• Пролиферативная способность взрослых тканей ниже,
они
содержат
больше
неделящихся
специализированных клеток. Однако, несмотря на ряд
практических преимуществ эмбриональных клеток,
необходимо помнить, что эти клетки по ряду
параметров
отличаются
от
взрослых
клеток.
Результаты,
полученные
при
использовании
эмбриональных
клеток
не
всегда
возможно
экстраполировать на взрослый организм.
21.
• Получение клеточных линий на основе клеток• первичных и диплоидных культур
• Клетки первичной культуры обычно гетерогенны и
характеризуются малым пролиферативным пулом, но в
них наиболее полно представлены типы клеток той
ткани, откуда они были получены и четко
обнаруживается экспрессия ряда свойств, присущих
данной ткани. Однако первичная культура лишена
многих клеток, присутствующих в исходной ткани,
поскольку не все клетки способны выжить в условиях in
vitro.
• Первичные культуры клеток получают путем
стерильного удаления фрагмента ткани и его
механической или ферментативной дезагрегации.
22.
• В случае механической дезагрегации фрагментткани измельчают до кусочков размером около 1
мм и отмывают от эритроцитов раствором Хенкса
с антибиотиками. Дезагрегированные фрагменты
прикрепляются
к
субстрату
благодаря
собственной адгезивности, поверхности субстрата
или сгустку плазмы.
• Ферментативная
дезагрегация
(0,01-0,05
очищенный – 0,25% неочищенный трипсин, 2002000 ед/мл неочищенная коллагеназа) дает более
высокий выход клеток, хотя метод является
селективным,
поскольку
не
все
клетки
переживают диссоциацию. На практике наиболее
успешное получение первичных клеток из многих
тканей связано с использованием коллагеназы,
приводящим к снижению размера экспланта до
небольшого
кластера
клеток,
который
прикрепляется к субстрату и распластывается.
23.
• Культуры первичных клеток легко получить измногих тканей. Они существуют 20-30 суток и
дают начало диплоидным культурам. Какое-то
время диплоидные клетки экспоненциально
размножаются, но затем примерно через 6
месяцев скорость роста культуры снижается, а
через 10-12 месяцев клетки деградируют и
погибают. Это наблюдается примерно после 20-50
генераций (в зависимости от возраста тканейисточников
первичных
клеток
–
из
эмбриональной – 50, из взрослой – 20). В
некоторых случаях отдельные клетки выживают и
продолжают размножаться, что приводит к
установлению клеточной линии.
24.
• Отбор осуществляют при регулярной смене питательной среды,омывающей монослой. Смену среды производят регулярно, не
реже 1 раза в неделю. В течение первых 3 недель заменяют по 2030% объема среды, в течение следующих 3-4 недель – 50-60%,
позднее проводят полную замену среды.
• По мере смены среды клетки меняют морфологию. Часть клеток
ошаривается и отделяется от субстрата. Большинство клеток
стягивается к центру, и монослой приобретает звездчатый вид.
Сами клетки при этом удлиняются. Через 7-10 смен, как правило,
начинают появляться новые атипичные клеточные элементы,
имеющие в разных культурах разную морфологию. Именно они
наиболее часто дают начало жизнеспособным линиям
перевиваемых клеток.
• Таким образом, установление клеточных линий определяется
отбором клеток с повышенной активностью из популяций
первичных и диплоидных клеток.
25.
• Постоянные культуры• У полученных клеточных линий есть 2 пути: После нескольких
пересевов линия клеток 1. либо гибнет (ограниченная линия
клеток), 2. либо трансформируется и становится постоянной
клеточной линией. К настоящему времени существует около
500 постоянных клеточных линий, полученных от более чем 40
видов животных
• Появление постоянной линии клеток констатируется по
морфологическим изменениям (уменьшение размера клеток,
снижение их адгезивности, округление, увеличение ядерноцитоплазматического соотношения), по увеличению скорости
роста (время удвоения клеток снижается в 1,5-4 раза – 12 ч
вместо 36-48), по снижению зависимости от сыворотки и
возможности поддержания в более простых средах, по
снижению зависимости от субстрата и, следовательно, их
способности к росту в суспензии; по увеличению
гетероплоидности и анеуплоидности, а также по увеличению
опухолеродности. Однако, нормальные клетки, спонтанно
трансформируясь в постоянную линию, не становятся при этом
злокачественными (несмотря на некоторые черты сходства).
26.
• Таким образом, постоянные клеточныелинии
имеют
определенные
преимущества: высокая скорость роста,
возможность достижения более высокой
плотности
и,
следовательно,
более
высокого выхода биомассы; возможность
использования более дешевых сред;
способность к суспензионному росту.
• Но и недостатки – повышенная
хромосомная нестабильность, отклонение
от фенотипа донора, утрата специфических
маркеров.
27.
• Системы культивирования клеток• Существует
2
основных
системы
культивирования
клеток.
1. Непроточные культуры - тип культур, в
котором клетки вводят в фиксированный объем
среды. По мере роста клеток происходит
использование
питательных
веществ
и
накопление метаболитов, поэтому среда должна
периодически меняться, что приводит к
изменению
клеточного
метаболизма,
называемого
еще
и
физиологической
дифференцировкой. Со временем, в результате
истощения среды происходит прекращение
пролиферации клеток.
28.
• Увеличить продолжительность жизни непроточныхкультур
можно
несколькими
способами:
- прерывистый (часть культуры заменяется равным
объемом
свежей
среды);
- постоянный (объем культуры увеличивается с
постоянной низкой скоростью, а небольшие порции
клеток
периодически
удаляются);
- перфузионный (осуществляется постоянное поступление
свежей среды в культуру и одновременное удаление
равного объема использованной (бесклеточной) среды.
Перфузия может быть открытой, когда из системы
удаляется вся среда, и закрытой, когда удаляемая среда
проходит
через
дополнительный
сосуд,
где
восстанавливается ее рН и осуществляется аэрирование, и
возвращается в культуральный сосуд.
• Все системы непроточных культур характеризуются
накоплением отходов в той или иной форме и
непостоянством внешних условий.
29.
• 2. Проточные культуры обеспечивают истинныегомеостатические условия. Характеризующиеся
постоянством концентрации питательных веществ
и метаболитов, а также числа клеток. Гомеостаз
обусловлен постоянным вхождением среды в
культуру и одновременным удалением равного
объема среды с клетками. Такие системы
пригодны для суспензионных культур и
монослойных культур на микроносителях.
• Существует 2 основных способа культивирования
животных клеток: монослойные культуры и
суспензионные культуры.
• Суспензионные культуры предпочтительнее с
точки зрения увеличения выхода клеток.
30.
• Монослойныекультуры также обладают рядом
преимуществ:
1. Монослойные культуры могут быть применены к
любому типу клеток, что обеспечивает наибольшую
гибкость использования.
• 2. Легко провести полную замену среды и промыть
клетки перед добавлением свежей питательной среды.
Это важно в тех случаях, когда рост клеток идет в
одних условиях, а наработка продукта в других
условиях, например при переносе клеток из среды с
сывороткой в бессывороточную среду. Можно также
полностью удалять нежелательные компоненты.
3. Позволяют обеспечить высокую плотность клеток.
4. У многих клеток экспрессия требуемого продукта
идет эффективнее, если клетки прикреплены к
субстрату.
5. В некоторых случаях, например для пассирования
вирусов, требуются тесные межклеточные контакты.
31.
• Недостатками монослойных культур являются:• 1.
необходимость
большого
пространства;
2. возрастание стоимости и трудоемкости при увеличении
масштаба;
3. недостаточно эффективный контроль, обусловленный
трудностями отбора пробы и отсутствием информативности
визуального
анализа;
4. сложности в определении и контролировании рН,
концентрации кислорода и обеспечении гомогенности
культуры клеток.
• Существует много различных разновидностей этого способа
культивирования. Рассмотрим три основных направления:
• 1. Культивирование в плоских флаконах (матрацах).
2. Культивирование во вращающихся бутылях, когда в
каждый момент времени 15-20% поверхности бутыли
покрыто питательной средой, а клетки находятся
попеременно
то
в
среде,
то
в
воздухе.
3. Культивирование в колонках на микроносителях, в
качестве которых выступают плотно упакованные, не
смещающиеся стеклянные бусы диаметром 35 мм, стопка
пластин и др., а питательная среда омывает их, протекая
сверху вниз.
32.
33.
34.
35.
36.
37.
• Монослойные культуры• Большинство нетрансформированных клеток
млекопитающих могут расти только в виде
монослоя, будучи прикрепленными к субстрату –
к другим клеткам либо к стеклу (алюмоборосиликатное стекло типа пирекс), пластику
(полистирол,
полиэтилен,
поликарбонат,
поливинилхлорид, тефлон, целлофан и др. при
условии правильной обработки этих полимеров) пластиковая
поверхность
должна
быть
специально обработана, чтобы клетки могли к ней
прикрепиться, причем клетки эукариот не
прикрепляются
к
пластиковым
чашкам,
предназначенным для бактериальных культур)
или металлу – качественная медицинская
нержавеющая сталь или титан.
38.
Прикрепление клетки к субстратуЖивотные клетки в культуре в процессе деления
39.
• Поверхности клеток животных и поверхности традиционныхкультуральных сосудов из стекла и пластика, обладающие
высокой поверхностной энергией, несут отрицательные заряды.
Поэтому для прикрепления клеток необходимо обеспечить
поверхностный суммарный заряд субстрата, обеспечивающий
прикрепление клеток.
• Это может достигаться: 1) за счет электоростатического
взаимодействий и 2) за счет присутствия внеклеточного
биоматрикса.
• 1. Суммарный заряд поверхности субстрата (например, за счет
образования отрицательно заряженных карбоксильных групп)
может достигаться предварительным воздействием химическими
(окисляющие
агенты)
и
физическими
факторами
(высоковольтный разряд, облучение УФ и др.), что облегчает
электростатическое прикрепление клеток.
• 2. Поверхность культурального сосуда может быть также
покрыта веществом, облегчающим прикрепление клеток. К
природным субстратам, на которых растут клетки относится
коллаген. Другими излюбленными субстратами являются
желатин и фибронектин. Возможно использование для этих
целей полиаминокислот (поли-D-лизин), а также присутствие
двухвалентных катионов кальция и магния.
40.
• В 1990 году группой японских ученых был разработан субстратдля
культивирования
клеток
на
основе
поли-Nизопропилакриламида (ПНИПА), испытывающего фазовый
переход из нерастворимого в растворимое в воде состояние при
температуре около 33 °С, называемой нижней критической
температурой сольватации (НКТС).
• При температуре 37 °С полимер находится в нерастворимом
состоянии, что позволяет использовать его в качестве твердого
субстрата
для
культивирования
клеток.
Понижение
температуры культивирования ниже НКТС вызывает
гидратирование полимера и открепление клеток от поверхности
субстрата без применения протеолитических ферментов и
диссоциирующих агентов.
• Культивирование на термочувствительной поверхности
позволяет получать интактные культуры клеток и на
протяжении многих пассажей поддерживать специфическую
активность клеток.
41.
• Основным недостатком применяемых в настоящее времяметодик приготовления субстратов ПНИПА является
необходимость ковалентного связывания ПНИПА с
поверхностью для обеспечения устойчивой адгезии и роста
культур клеток. В настоящее время для приготовления
субстратов ПНИПА чаще всего используется метод
полимеризации мономеров при помощи электронного луча
высокой
энергии
непосредственно
на
поверхности,
предназначенной для культивирования клеток.
• К недостаткам данного метода также следует отнести ряд
ограничений
на
тип
покрываемой
поверхности,
необходимость проведения многократных промывок, для
удаления непрореагировавших токсичных для клеток
мономеров, а также то, что аппаратура, используемая для
формирования электронного луча высокой энергии,
недоступна большинству исследователей, работающих с
культурами клеток.
• Разработаны
также
методы
фотоиндуцируемой
полимеризации ПНИПА на поверхности полистирола, однако
данные методы также подразумевают проведение ряда
промывок и стерилизацию поверхности перед использованием
ПНИПА в качестве субстрата для культивирования клеток.
42.
• Монослойное культивирование осуществляют вофлаконах (флаконы Ру – самые большие
стационарные флаконы, поверхностью до 200 кв.см
или флаконах Колле) или пробирках для культуры
тканей, обеспечивающих поверхность роста 5-200
кв.см.
• Первичные клетки, которые делятся в культуре,
могут претерпевать так называемое контактное
торможение. Когда две клетки приближаются друг к
другу, то в зоне контакта прекращаются
специфические движения клеточной мембраны.
Первичные и другие нетрансформированные клетки,
следовательно, не могут расти друг над другом, и в
большинстве случаев достижение плотного монослоя
сопровождается прекращением клеточных делений.
Нетрансформированные клетки могут в течение
некоторого
времени
полностью
сохранять
жизнеспособность в таком покоящемся состоянии.
43.
• При достижении плотного монослоянаблюдается снижение распластывания
клеток и их ошаривание.
• Ослабленным контактным торможением
характеризуются
трансформированные
клетки, и такие клетки могут достигать
более высокой конечной плотности, потому
что эти клетки утрачивают зависящую от
плотности
регуляцию.
Трансформированные клетки способны
расти вплоть до полного истощения среды,
и если после этого не наступает смена
среды, то клетки быстро погибают.
44.
Раковые клетки продолжают растии после того, как заполнят всю
поверхность субстрата, образуя
мультислой
Линии клеток А431:
эпидермальной карциномы
человека. Стрелками
показаны места "нарастания"
клеток друг на друга
45.
• Клетки, трансформированные in vitro ретровирусом(вирус саркомы Рауса), несущим
температурочувствительную мутацию в онкогене.
• Округленная форма трансформированных клеток (34
°С)Те же клетки приобретают нормальную морфологию,
когда продукт онкогена инактивируется повышением
температуры (39 °С )
46.
• По мере роста клеточного монослоянетрансформированных клеток происходят
следующие изменения:
• клетки становятся более скученными и
менее распластанными, что приводит к
уменьшению доли клеточной поверхности,
обращенной к среде;
• среда
истощается
по
питательным
компонентам,
особенно
в
зоне,
непосредственно примыкающей к клеткам.
47.
• Еслииз
плотного
монослоя
нетрансформированных клеток удалить часть
пласта, то в клетках, находящихся по краям
удаленного участка, происходит стимуляция
синтеза ДНК и делений. В результате клетки
быстро зарастают освободившуюся поверхность.
48.
• Клеточную культуру перевивают последостижения ее плотного монослоя или
когда добавленный в среду индикатор
(обычно феноловый красный) меняет цвет с
ярко-красного до желто-оранжевого.
Формирование плотного монослоя миобластов
49.
Образование монослоя кератиноцитов из кожи лица
взрослых доноров на 1, 3, 6 сутки
50.
• Процесс подготовки клеточного монослоя котделению от стекла и формированию суспензии
вследствие
обработки
0,02%
раствором
химопсина в фосфатно-солевом буфере или 0,1%
трипсином и 0,01% ЭДТА происходит при
комнатной температуре (или 37 °С) в течение 515 минут в зависимости от типа культуры и ее
индивидуального
состояния.
Как
только
клеточный монослой достаточно разрыхляется и
начинает
отделяться
от
субстрата,
дезинтегрирующий раствор сливают, а в сосуды
заливают определенное количество ростовой
среды. Этой средой тщательно смывают клетки
со стенки сосуда и легким пипетированием
способствуют образованию гомогенной взвеси.
51.
• После чего клетки центрифугируют при200-400 – 1000 об/мин около 5 мин, и
осадок отслоенных клеток ресуспендируют
в свежей питательной среде. Оптимальная
концентрация клеток в исходной посевной
суспензии составляет 1-3х105 кл/мл. Однако
можно и просто полученную взвесь после
подсчета числа клеток разводить ростовой
средой до посевной дозы.
• Такие подходы используют не только для
культивирования клеток в монослое, но и
для перевода их в суспензию.
52.
• Помимо стационарного монослойного культивированияиспользуют и динамическое.
• «Роллерные культуры» - метод культивирования, при котором
клеточный монослой располагается по всей цилиндрической
поверхности
горизонтально
вращающихся
сосудов
и
периодически омывается питательной средой. В силу
определенных причин некоторое количество клеток может в
отдельных случаях быть взвешено в культуральной среде. В
подобном варианте культуру клеток называют роллерносуспензионной.
• Для роллерного культивирования используются специальные
стеллажно-ярусные аппараты для вращения бутылей или
барабаны. Большое значение имеет скорость вращения бутылей.
Она не должна быть слишком большой, чтобы не
препятствовать прикреплению клеток, но и не слишком низкой,
так как длительное нахождение клеток в газовой фазе ухудшает
условия их питания. Рекомендуется в течение первых 30 мин
после засева клеток обеспечить высокую скорость вращения
флаконов (1,0 об/мин) для равномерного распределения клеток,
затем перевести их на более низкую скорость вращения (20
об/час).
53.
• Посевная концентрация в 1 мл средысоставляет для клеток HeLa, L - 60-80 тыс.,
для диплоидных клеток 100-200 тыс., для
первичных культур - 200-300 тыс. Объем
ростовой среды должен составлять 1/10,
1/20 часть объема роллерного флакона.
• Роллерный
метод
культивирования
позволяет получить большие количества
клеток. Преимуществом роллерных культур
по
сравнению
с
традиционными
стационарными культурами является, в
частности,
более
экономичное
использование питательных сред.
54.
• Суспензионное культивирование• В 1953 г. Оуенс с сотрудниками получили первые
суспензионные культуры животных клеток, которые
удобнее использовать для наращивания клеточной
массы.
• Как правило, клетки, отделившиеся от субстрата, на
котором они росли, неспособны к росту в суспензии и
быстро деградируют. Но если некоторые клетки
культивировать во вращающемся флаконе (2 об\мин),
не дающем возможности прикрепления клеток к
поверхности, в среде, содержащей метилцеллюлозу,
предотвращающую
агрегацию
клеток,
можно
получить жизнеспособные суспензионные клеточные
штаммы. Метилцеллюлоза в концентрации 0,1-0,2%
обладает максимальным протективным действием на
взвешенные клетки, т.к. ее молекулы образуют
вокруг клеток защитный слой препятствующий не
только
агрегации,
но
повреждениям
при
перемешивании.
55.
• Иногда этого бывает достаточно для получениясуспензионной культуры, но обычно требуются
специальные сосуды для культивирования суспензий и
использование среды с дефицитом ионов кальция и
магния с последующим длительным периодом
адаптации,
сопровождающимся
различными
манипуляциями,
предотвращающими
возврат
к
монослою. Перемешивание осуществляют лопастными
магнитными мешалками (100-200 об/мин) и круговыми
качалками (15-40 об/мин). Для предотвращения
оседания клеток на стенки сосудов производят их
силиконирование, поскольку силиконовое покрытие в
силу своей гидрофобности препятствует прикреплению
клеток.
56.
• Однако такие манипуляции при введенииклеток в суспезию необходимы не во всех
случаях.
Некоторые
клетки
(трансформированные
клетки,
кроветворные клетки и асцитные опухоли)
способны расти как на субстрате, так и в
суспензии в зависимости от солевого
состава среды культивирования.
• А культуры лимфоцитов вообще не
обнаруживают тенденции к адгезии к
поверхности субстрата и выживают на дне
культивационного сосуда под тонким слоем
среды.
57.
• Суспензионные культуры лучше растут внутриограниченного диапазона концентраций клеток и
в том случае, когда сосуд наполнен средой
наполовину. Для обеспечения этих условий
необходимо каждый день, или – в случае
медленно растущих культур – через день, удалять
половину суспензии через боковое горлышко и
добавлять равный объем свежей среды.
• Суспензионные культуры потребляют в 2-7 раз
больше глюкозы, чем монослойные, выделяя в
результате потребления глюкозы токсичную
молочную кислоту. В этом случае целесообразно
добавлять в среду культивирования инсулин (от
40 до 200 ед/л), что изменяет соотношение между
количеством поглощенной глюкозы и выделенной
молочной кислоты.
58.
• Максимальный рост клеток в суспензии наблюдаютпри рН 7,0-7,2. Питательные среды, применяемые для
выращивания клеток в суспензии, не отличаются от
сред, используемых для выращивания клеточных
линий в однослойной культуре. Чаще всего при
культивировании клеток в суспензиях применяют
среду Игла с двукратной концентрацией аминокислот
и витаминов.
• Недостаток кислорода ведет к появлению грануляции
цитоплазмы, клетки теряют правильную округлую
форму. При небольшом избытке кислорода клетки
имеют хорошо очерченную, правильную, округлую
форму, и становятся очень крупными при
повреждающем
действии избытка кислорода.
Оптимальная концентрация кислорода для различных
клеточных культур находится в пределах от 9 до 17%.
При концентрации кислорода выше 20% происходит
ингибирование
клеточного
роста
вследствие
угнетения метаболизма.
59.
• Суспензионное культивирование дает по меньшеймере 2-3-х кратную экономию питательных сред,
по сравнению с общепринятым стационарным
культивированием с полным исключением
дорогостоящих протеолитических ферментов и
буферных растворов. Кроме того суспензионные
культуры представляются предпочтительными с
точки зрения выхода клеток.
• Суспензионные культуры широко используется в
вирусологических
исследованиях
и
для
накопления
больших
количеств
вируссодержащего материала, при изготовлении
вакцин и диагностических препаратов.
60.
• Монослойное культивирование намикроносителях
• Сочетать положительные стороны монослойного
и суспензионного культивирования позволяет
использование системы с микроносителями.
Способ был предложен в 1967 г. Ван Везелом.
• Микроносители – мелкие твердые частицы
(поддерживаемые
в
суспензии
благодаря
перемешиванию), на которых клетки растут в
виде монослоя. Использование микроносителей
дает
клеткам,
обладающим
адгезивными
свойствами,
все
преимущества
крупномасштабных суспензионных культур.
61.
• Преимущества:• создание одинаковых контролируемых условий во
всем объеме сосуда;
• получение
высокой
плотности
клеточной
популяции (до нескольких млн в 1 мл) и
одновременное культивирование огромного числа
клеток;
• постоянный контроль за динамикой роста клеток;
• снижение контаминации с связи с сокращением
числа операций;
• экономия питательных сред;
• возможность
пассирования
клеток
без
трипсинизации
путем
добавления
новых
микроносителей и др.
62.
• Требования к микроносителям:
Микроносители не должны быть:
- токсичными,
- не сорбировать компоненты питательных сред и
продукты метаболизма клеток,
- должны иметь повехностный заряд или
обменную
емкость,
достаточную
для
прикрепления
клеток,
возможность
многократного использования.
63.
• Коммерческие классические микроносители имеют диаметр100-250 мкм и подразделяются на 6 основных групп:
• декстрановые микроносители поперечно сшитые
(Цитодекс 1), которые благодаря пористой структуре
пригодны для выращивания различных клеточных
линий, но имеют заряд, равномерно распределенный
по всему объему частицы и хорошо сорбируют белки и
низкомолекулярные компоненты питательной среды;
• декстрановые микроносители, но с несколько
сниженной способностью к сорбции субстрата
(Цитодекс 2);
• микроносители,
покрытые
коллагеном
или
желатином (Цитодекс 3) – также декстрановые
частицы, покрытые денатурированныи коллагеном или
перекрестно сшитым желатином;
64.
• полистиреновыемикроносители
(Биосилон,
цитосферес). Не имеют пористой структуры, что
предупреждает сорбцию питательной среды;
• стеклянные микроносители (Биогласс). Подобно
пластикатовым не имеют пористой структуры
ростовой поверхности;
• целлюлозные микроносители (ДЕ-53), имеющие
цилиндрическую форму с микрокристаллической
целлюлозной
матрицей
и
наиболее
часто
используемые для выращивания первичных и
диплоидных культур, которые имеют тенденцию
расти в виде гигантских агрегатов.
• Используемые в настоящее время микроносители на основе
микропористого желатина или пористого боросиликатного
стекла имеют емкость около 3000 кл/мн.
65.
• В противоположность суспензионным культурамклеток на микроносителях разработаны способы
инкапсулирования их в полимерные сферы
(полилизиновые, агарозные, альгинатные, из
полимерных смол), когда клетки, по-существу, не
испытывают того механического напряжения,
которое они должны проявлять в свободном виде.
Эти способы оказались выгодными для
культивирования гибридом в целях получения
моноклональных антител. Диаметр микрокапсул,
размер пор в них и их толщина могут быть
независимо проконтролированы в процессе
изготовления и оптимизированы для конкретного
типа клеток.
66.
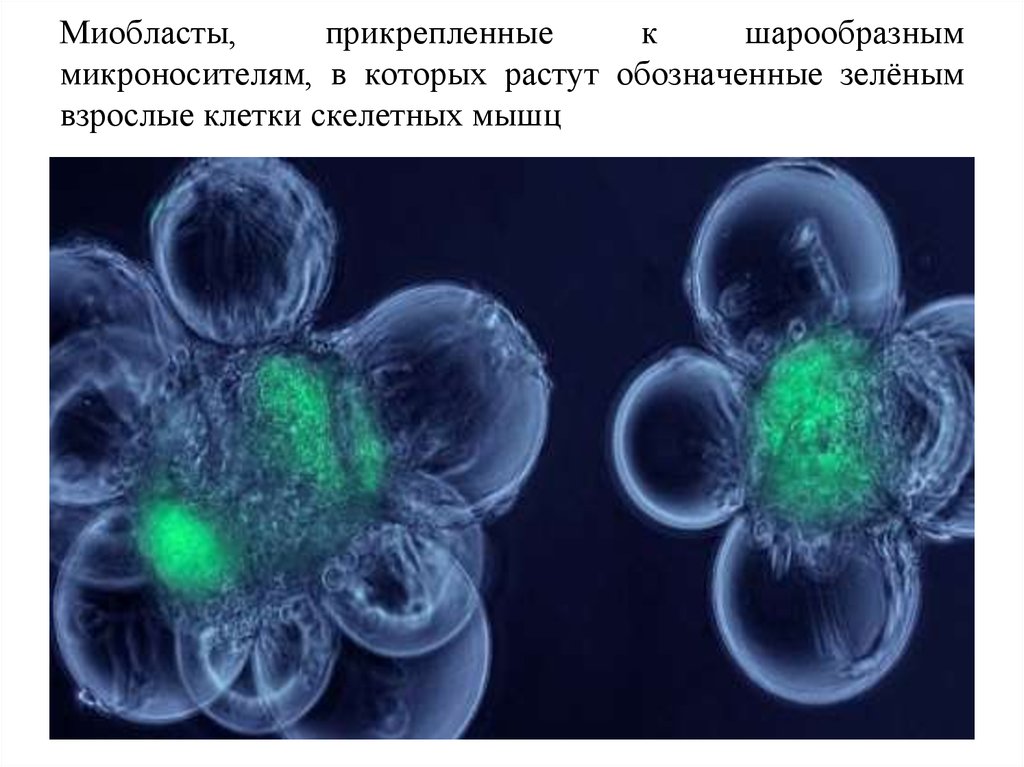
67. Миобласты, прикрепленные к шарообразным микроносителям, в которых растут обозначенные зелёным взрослые клетки скелетных мышц
68. Мультиклеточные опухолевые сфероиды (аденокарцинома человека MCF-7) в альгинат-хитозановых микрокапсулах.
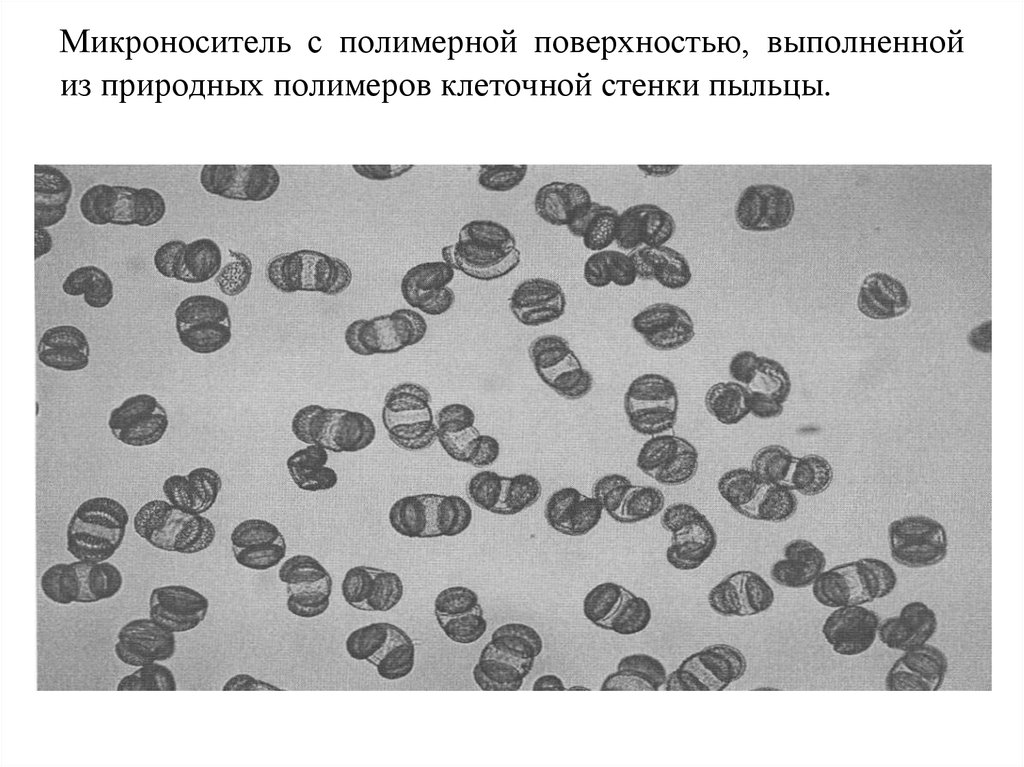
69. Микроноситель с полимерной поверхностью, выполненной из природных полимеров клеточной стенки пыльцы.
70.
• Питательные среды и условия культивирования• После извлечения клеток из ткани или органа
культуральная среда должна обеспечивать все внешние
условия, которые клетки имели in vivo. Это обеспечивает
выживание клеток, их пролиферацию и дифференцировку.
Внеклеточная среда должна обеспечивать клетки
питательными и гормональными факторами, т.е. обладать
всем необходимым для роста и выживания клеток.
• Культуры клеток животных и человека предъявляют
определенные требования к жидкой (питательная среда),
газообразной (концентрация газов) и твердой (поверхность
субстрата) фазе.
• Питательная
среда
представляет
собой
раствор
определенного
состава,
к
которому
добавляются
компоненты
неидентифицированного
биологического
происхождения (плазма, сыворотка крови, тканевые
экстракты и т.д.).
71.
• Основу питательных сред составляют солевыерастворы. Минеральные компоненты в этих
растворах подобраны так, что раствор выполняет
буферные функции, поддерживая постоянный
кислотно-щелочной баланс среды в процессе
культивирования.
• Постоянство рН среды является одним из
главных требований условий культивирования.
• Для приготовления питательных сред обычно
используются солевые растворы Эрла и Хенкса.
Эти растворы, как и фосфатносолевой буфер
Дульбекко и Фогта используются также для
орошения и промывки клеток при пассировании
культур, выделении клеточных линий и других
манипуляциях с культурами клеток.
72.
• Другимважным
условием
культивирования
является
осмотическое давление. Оно определяется числом молей
осмотически активных частиц (ионов и неионизированных
молекул) растворенных веществ на 1 кг растворителя
(осмоляльность) или на 1 литр раствора (осмолярность). В
разбавленных водных растворах эти величины близки.
• Диапазоны рН и осмоляльности, при которых происходит
размножение клеток, узки и варьируют в зависимости от типа
клеток.
• Для поддержания рН в большинстве сред используется
бикарбонатный буфер. Растворы могут содержать малое
количество бикарбонатного буфера (раствор Хенкса), они
предназначены для поддержания рН в плотно закрытых сосудах. В
других (растворе Эрла) бикарбоната больше, они используются в
системах с повышенным парциальным давлением СО2.
• Если культивирование ведется вне СО2-инкубатора, где рН
поддерживать труднее, необходимы альтернативные буферные
системы. Хорошим буфером является HEPES 4-(2-оксиэтил)-1пиперазинэтансульфоновая кислота. HEPES легко растворим в
воде, не связывает двухвалентные катионы, не цитотоксичен до
концентрации 0.05 М. Применяется в концентрациях 0.01- 0.03 М.
73.
• Стандартные среды для культур животных клеток• Среды Игла MEM (minimal essential medium) и BME (basal
medium, Eagle). Чаще используется МЕМ. Она содержит
минеральные вещества, аминокислоты (13 незаменимых), 6
водорастворимых витаминов, холин и инозит, выполняющие
роль углеводородного субстрата. МЕМ используется только с
сывороткой, так как в ней отсутствуют биотин, витамин В12,
ионы железа и микроэлементы. Основа раствор Эрла.
• Среда Дульбекко DME или DMEM (двойная модификация
среды Игла). Используется при культивировании клеток
различных типов, в том числе нетрансформированных клеток и
гибридом. Является основой для бессывороточных сред.
Содержит двойную концентрацию аминокислот, глицин, серин,
пируват, железо. При использовании этой среды необходим
инкубатор с 10% концентрацией СО2.
• Среда Искова IMDM модификация среда Дульбекко.
Добавлены незаменимые аминокислоты, биотин, витамин В12,
селенит натрия. В среду введен HEPES и уменьшены
концентрации NaCl и NaHCO3. Среда бессывороточная, обычно
используется для культивирования лимфоцитов и кроветворных
клеток.
74.
• Среда МакКоя 5А и серия сред RPMI. Среда МакКоя 5Аразработана в 1958 году для поддержания клонального
роста клеток карциносаркомы Уолкера 256 в присутствии
сыворотки, а затем уже других первичных культур и
различных клеточных линий. Обычно производится в
модификации Ивката и Грейса (RPMI) и предназначена
для культивирования лейкоцитов в присутствии
сыворотки, часто применяется и для культивирования
гибридом. Концентрация СО2 в атмосфере при
культивировании 5%.
• Среда 199 разработана в 1950 году для культивирования
фрагментов сердца из эмбриона цыпленка. Для среды
характерны широкий спектр питательных веществ и
невысокая их концентрация. Используется без добавок,
как поддерживающая для первичных клеток, а с
сывороткой
как
ростовая
среда
для
быстро
размножающихся клеток.
75.
• Нормальные, сохраняющие специфические функцииклетки на стандартных средах не размножаются (если
они не трансформированы). Для оптимизации роста
клеток обычно добавляют 5-20% фетальной
(эмбриональной) сыворотки.
• Сыворотка представляет собой чрезвычайно сложную
смесь мелких и крупных молекул, способных как
вызывать, так и тормозить рост клеток.
• К главным функциям сыворотки относятся:
• обеспечение
гормональными
факторами,
стимулирующими рост клеток и их функции;
• обеспечение
факторами
прикрепления
и
распластывания клеток;
• обеспечение транспортными белками, переносящими
гормоны, минеральные вещества, липиды и т.д.
76.
• Белки сыворотки, прямо и специфически участвующие встимуляции клеточного деления, называются факторами роста.
• Большинство ростовых факторов присутствуют в сыворотке в
неопределяемых следовых количествах. Некоторые из этих
факторов специфичны для клеток на определенной стадии
дифференцировки, действие других не ограничено каким-либо
одним типом клеток. Один и тот же тип клеток может быть
стимулирован различными ростовыми факторами. Например,
фибробласты размножаются в ответ на фактор роста
фибробластов, фактор роста эпидермиса, фактор роста,
синтезируемый тромбоцитами и соматомедины. Все эти вещества
являются митогенами (стимулируют митоз).
• Другим важным фактором роста практически для всех типов
клеток является гормон инсулин. Из других гормонов наиболее
часто
применяются
глюкокортикоиды
(гидрокортизон,
дексаметазон), стероиды (эстрадиол, тестостерон, прогестерон) и
гормоны щитовидной железы (трииодтиронин).
• Гормоны стимулируют или подавляют рост в зависимости от
типа клеток и их плотности. Глюкокортикоиды, например,
влияют на пролиферацию клеток, изменяя их чувствительность к
факторам роста.
77.
• Для переноса низкомолекулярных факторов(витаминов, аминокислот, липидов и других)
необходимы транспортные белки. В этой роли
выступает альбумин. Транспорт железа
обеспечивает трансферрин, и поверхность
большинства
культивируемых
клеток
содержит рецепторы для этого белка.
• К факторам прикрепления и распластывания
клеток относятся содержащиеся в сыворотке
коллаген и фибронектин, ά-глобулиновая
сывороточная
фракция
фетуин.
Более
специализированы хондронектин (адгезия
хондроцитов)
и
ламинин
(адгезия
эпителиальных клеток).
78.
• Культивирование клеток в присутствии сывороткиобнаруживает и ряд недостатков:
• для большинства тканей сыворотка не является
физиологической жидкостью, с которой они
контактировали в исходной ткани. Например,
сыворотка вызывает рост фибробластов, но тормозит
рост эпидермальных кератиноцитов;
• сыворотка может быть цитотоксичной, так как
содержит полиаминоксидазу, действующую на
полиамины (спермин, спермидин), являющиеся
продуктами секреции быстро пролиферирующих
клеток;
• значительная вариабельность состава сывороток
разных партий;
• сыворотки
могут
содержать
недостаточное
количество специфических ростовых факторов, что
вызывает необходимость добавления их к культурам
клеток.
79.
• В настоящее время предпринимаются попытки создания иприменения бессывороточных питательных сред, в
которых сыворотка заменяется смесью гормонов
(инсулин, трансферрин, глюкокортикоиды и др.) и
ростовых факторов. Эти среды необходимы, если
требуется избежать присутствия чужеродного белка и изза высокой стоимости эмбриональной сыворотки
крупного рогатого скота. Бессывороточные среды имеют
определенные
преимущества:
улучшение
воспроизводимости результатов вследствие большей
стабильности состава среды; снижение риска заражения
культуры вирусами, грибами, микоплазмами; облегчение
очистки продуктов клеточного метаболизма; отсутствие
цитотоксичности сыворотки. Однако в настоящее время
бессывороточные среды имеют существенные недостатки:
добавление в дешевую среду гормонов и факторов роста
делает ее такой же дорогой, как среда с сывороткой.
Кроме того, чаще всего бессывороточные среды пригодны
для
ограниченного
числа
клеток,
т.е.
узко
специализированы.
80.
• Следовательно, оптимизация состава питательных среддля культур животных клеток развивается в двух
направлениях – разработка сред, требующих внесения
природных
добавок
(сыворотки,
эмбриональные
экстракты и др.), и создание сред химически
определенного состава.
• В настоящее время наиболее широко применяются среды,
содержащие источники энергии (углеводы) и азота;
незаменимые аминокислоты; витамины; неорганические
соли – источники макро- и микроэлементов, включая
селенит; нуклеозиды; жиры и жирорастворимые
компоненты;
гормоны
(инсулин,
трансферрин,
глюкокортикоиды,
эстроген,
андроген,
тироксин,
трииодтиронин); ростовые факторы (фактор роста,
синтезируемый
тромбоцитами,
фактор
роста
фибробластов, фактор роста эпидермиса), а также
сыворотку (до 20%) и в ряде случаев некоторые другие
добавки (бактопептон, триптозофосфат и т. п.).
81.
• Одна из проблем, возникающих при попыткахполучить культуры одиночных клеток или
культуры клеток с низкой плотностью (100
кл\мл), заключается в том, что в этих условиях
клетки погибают или растут очень медленно. В
результате подробных исследований была
разработана концепция “кондиционированной
среды”. Кондиционированная среда – это среда, в
которой концентрация метаболитов находится на
таком уровне, что наступает равновесие между
выходом метаболитов из клеток в среду и
обратным захватом этих метаболитов клетками.
82.
• Культивирование клеток и тканейбеспозвоночных
• Интерес
к
клеточным
культурам
беспозвоночных связан с разнообразием и
оригинальностью роста и метаморфоза.
• С другой стороны, при широкомасштабном
промышленном получении энтомопатогенных
препаратов целесообразнее для получения
больших количеств вирусного материала
использовать живые клетки насекомых-хозяев,
чем их личиночные стадии.
83.
• Первые попытки культивирования клетокнасекомых были предприняты в начале 20-го
века. Однако среди ученых длительное время
было
распространено
мнение,
что
выращивание клеток беспозвоночных в
культуре не имеет практического значения. По
этой причине исследования в области
культуры
клеток
насекомых
велись
недостаточно активно.
• Прогресс в получении клеточных линий
насекомых был последовательно обеспечен
трудами В. Трагера в конце 30-х годов
текущего столетия, С. Вьятта (1956), Т. Д. С.
Грейса (1962).
84.
• Интенсивные исследования проблемы началисьименно в 60-х гг., когда Грейс, модифицировав
среду Вьятта, получил первые четыре стабильные
перевиваемые линии из тканей яичников
эвкалиптового шелкопряда.
• В 1976 г. уже насчитывалось более 120
перевиваемых линий клеток насекомых, а к 1985
г. их количество превысило 200.
• Для получения культуры клеток и тканей
беспозвоночных
используют
эмбрионы,
имагинальные диски и органы насекомых,
гомоциты, яичники, жировые тела.
85.
• Лучшие источники для получения культивируемых клеток личинки и куколки насекомых.• Методика получения первичных культур клеток насекомых
достаточно отработана. Она включает следующие этапы:
стерилизация поверхности насекомых и подлежащих
культивированию тканей; диссоциация клеток; пересадка их на
питательную среду.
• Срок жизни первичных клеточных культур ограничен. Через
определенное время культура стареет, что проявляется в
грануляции цитоплазмы, сморщивании и округлении клеток,
потери связей между клетками и твердым субстратом.
• Клеточные культуры насекомых имеют ряд преимуществ по
сравнению с клетками млекопитающих как объект
биотехнологических
производств:
возможность
культивирования при комнатной температуре, дешевизна
культуральных сред, отсутствие необходимости в CO2
инкубаторах, высокая плотность в культуре и др.
86.
• Среды для культивирования клеток и тканейнасекомых сильно варьируют по составу. При
составлении
питательных
сред
часто
руководствуются данными по составу гемолимфы,
различающейся у разных видов насекомых. В
настоящее время предложено более 50 вариантов
питательных сред для культивирования клеток
беспозвоночных. Все эти среды отличаются от сред
для клеток млекопитающих наличием органических
кислот, повышенным содержанием аминокислот и
более высоким осмотическим давлением. Ни одна
из этих сред ни пригодна для поддержания культур
клеток всех видов беспозвоночных, т.е. не является
универсальной.
• Наиболее часто используют среды Митсухаси и
Марамороша (среда ММ), Шилда и Санга (среда
М3), Шнейдера; Эхальера и Оганесяна (среда D22), IPL-41 и другие. Фирма Sigma (США) выпускает
указанные среды в сухом виде.
87.
• Культурыклеток
беспозвоночных
животных также представляют огромный
интерес для изучения молекулярных
механизмов
взаимодействия
хозяинпаразит, роли мобильных генетических
элементов в адаптации беспозвоночных к
стрессовым ситуациям окружающей среды,
регуляции действия генов в клетках
высших
организмов
и
клеточных
механизмов дифференцировки и т.д.
88.
• Биореакторы для культур клеток• Клетки животных во многом отличаются от микробных и
растительных клеток, имеющих клеточные стенки: они
медленнее растут, у них большая чувствительность к
ранению и пузырькам воздуха. Эти свойства клеток
определяют выбор системы перемешивания и аэрации,
которые не должны создавать стрессовых условий для
культуры.
• Перемешивание должно быть гомогенным, чтобы избежать
градиентов температуры и рН, повышенных концентраций
субстрата и продуктов. При этом необходимо учитывать
высокий
уровень
травматизма
клеток.
Обычно
перемешивание осуществляется большими лопастными
мешалками при низких скоростях. Также используют
пневматическое (воздушное) перемешивание в эрлифтных
реакторах или гидравлическое перемешивание с помощью
внешних насосов в реакторах с взвешенной твердой фазой
(fluidized bed reactors).
89.
• Для предотвращения повреждения клеток пузырькамивоздуха уменьшают объем подаваемой газовой смеси,
используют поверхностную продувку или аэрацию через
мембраны. При сокращении объема подаваемого газа
необходимо увеличить в нем концентрацию кислорода.
Оптимальное снабжение кислородом, азотом, и углекислым
газом создается с помощью систем перемешивания газов.
• Выращивание животных клеток можно осуществлять в
периодической ( batch), периодической с подпиткой ( fedbatch) или непрерывной ( continuous) культуре.
• Из-за низкой продуктивности, связанной с медленным
ростом, для клеток животных предпочтителен непрерывный
процесс
культивирования
с
удержанием
клеток
(перфузионная система). Это приводит к большей плотности
культуры клеток и большему контакту с ними среды, что
увеличивает продуктивность. Для удержания биомассы и
предотвращения ее выноса с культуральной жидкостью
используют различные системы фильтрации, например,
роторные или вращающиеся фильтры.
90.
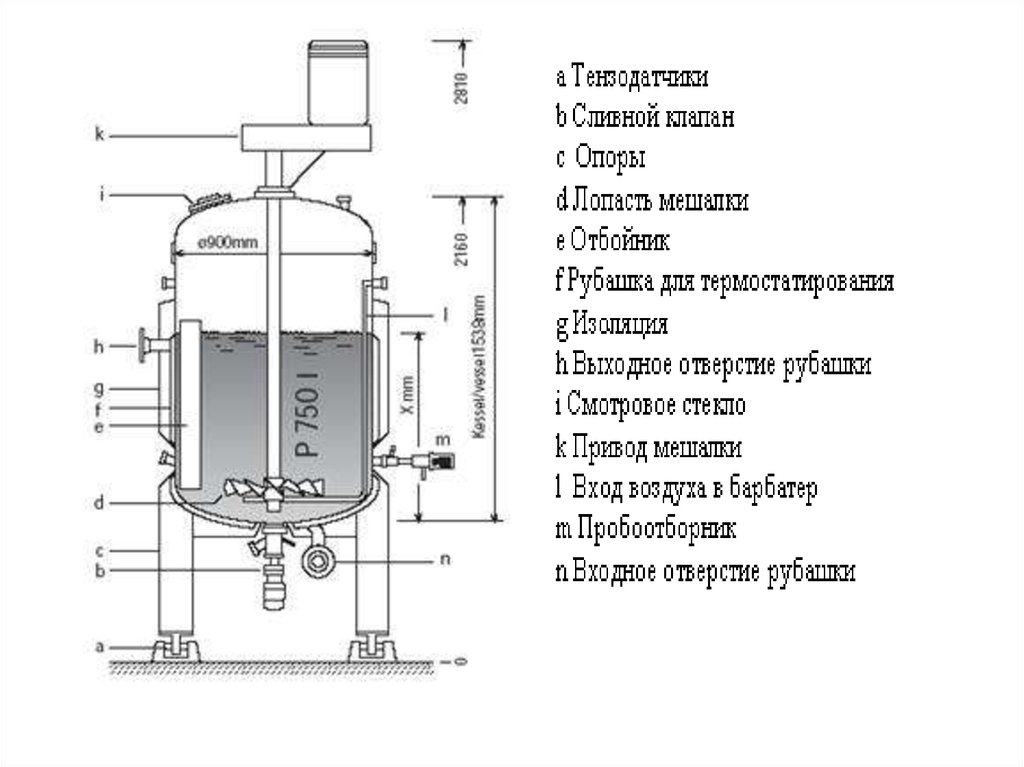
• Клеточный ферментер (компанияBioengineering)
• Клеточный ферментер представляет собой
резервуар с мешалкой. Он доступен в пилотном и
производственном масштабе (общим объемом до
2000 л). Снабжен лопастными мещалками.
• Культивирование может быть стационарным,
стационарным
с
подпиткой,
а
также
непрерывным.
Реактор
используется
для
культивирования взвеси клеток или клеток,
иммобилизованных на микроносителях. Для
задержания
биомассы
при
непрерывном
культивировании можно использовать роторные
или спиральные фильтры.
• Встроенное устройство пробоотбора обеспечивает
стерильный
отбор
контагиозных
клеток
(например, для производства вирусов).
91.
92.
• Эрлифтный ферментер• В этих ферментерах перемешивание осуществляется
потоком воздуха, а не лопастью мешалки, обеспечивая
эффективный массоперенос и низкие силы рассечения.
Для контроля за циркуляцией жидкости устанавливают
вытяжную трубу, направляющую поток пузырьков по
центру. Распределение газа может осуществляться с
помощью перфорированных, пористых или гидрофобных
трубок. Если клетки могут повредиться пузырьками газа,
установивают систему безпузырьковой аэрации через
силиконовые трубочки.
• Биореакторы доступны как лабораторные, так и
промышленные. Последние имеют широкую верхнюю
часть, действующую как сепаратор газов.
• Культивирование
может
быть
стационарным,
стационарным с подпиткой или непрерывным. Эрлифтные
ферментеры подходят для культивирования суспензий
клеток, включая клетки насекомых.
93.
94.
• Многие клетки млекопитающих растут только будучиприкрепленными к поверхности. Такие опорнозависимые
клетки иммобилизуют на микроносителях. Если носитель
пористый, клетки могут расти внутри него, при этом они
защищены от раневого стресса, что позволяет использовать
более высокие скорости перемешивания и продувки в
процессе культивирования.
• Биореакторы,
которые
поддерживают
носители
с
иммобилизованными клетками в состоянии суспензии,
называются реакторами с взвешенной твердой фазой
(fluidized bed reators).
• Обычно в этих реакторах присутствует три фазы – твердая,
жидкая и газообразная. Для непрерывного культивирования с
удержанием
биомассы
используется
специально
разработанная система сепарации. Она состоит из различных
камер и обеспечивает полное задержание частиц при
перфузионных процессах. Перемешивание достигается с
помощью продувки. Это обеспечивает низкий раневой стресс
и равномерный массоперенос.
95.
• Биореакторы с взвешенной твердой фазой рекомендуютсядля
клеток
на
микроносителях,
для
клеток,
чувствительных к раневому стрессу, для заключенных в
капсулу клеток и для продуцирования целевых
метаболитов в долговременной культуре клеток.
96.
• Для опорнозависимых клеток можно также использоватьбиореактор с фиксированной твердой фазой (fixed bed
reactor), в котором клетки и их носители захватываются в
закрепленную подложку. Эта система не нуждается в
сепарационных приемах для удаления жидкой фазы. Раневой
стресс и повреждение клеток пузырьками газа минимальны.
• В процессе культивирования через фиксированную подложку
циркулирует насыщенная кислородом среда. Поэтому длина
подложки является критическим параметром, поскольку
обеспечение
культуры
кислородом
и
питательными
веществами может быть недостаточным. В больших реакторах
эту проблему можно решить с помощью радиально
распространяющегося потока. Среда, обогащенная продуктами
метаболизма, удаляется непрерывно или периодически.
• В таких реакторах выращивают нуждающиеся в имобилизации
и чувствительные к ранению клетки. Система подходит и для
долговременного выращивания культур клеток с продуктами
метаболизма.
97.
98.
• Мембранный ферментер• Мембранный ферментер состоит из внутренней и внешней
камер, которые разделены диализной мембраной. Мембрана
обеспечивает безпузырьковую продувку и задержание
биомассы при непрерывном культивировании. С помощью
мембранной технологии токсические (низкомолекулярные)
метаболиты удаляются, а (высокомолекулярные) соединения
удерживаются во внутренней камере. Перемешивание в
каждой из камер осуществляется мешалкой. Среда и воздух
поставляются во внешнюю камеру.
• Биореактор
сконструирован
для
непрерывного
культивирования, но может быть также использован в
стационарных и стационарных с подпиткой процессах. также
могут выращиваться в этом биореакторе В таких реакторах
также возможно выращивание взвешенных клеток, а также
клеткок на микроносителях.























































































 Биология
Биология








