Похожие презентации:
Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
«Кемеровский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО КемГМУ Минздрава России)
Кафедра фармацевтической и общей химии
ХИМИЯ
Тема лекции: Адсорбционные равновесия и
процессы на подвижных и неподвижных
границах раздела.
Классификация, свойства, устойчивость
дисперсных систем
Пинчук Л.Г. д-р с.-х. наук, профессор
2019
2.
ПЛАН ЛЕКЦИИ1. Адсорбция, поверхностная энергия,
поверхностное натяжение,
поверхностно активные вещества.
2. Адсорбция неэлектролитов, ионная
адсорбция.
3. Биологическая роль адсорбции,
строение биологических мембран.
4. Дисперсные системы,
классификация, виды устойчивости,
диализ
3.
1. Поверхностные явления –процессы, на границе раздела
фаз, в межфазном поверхностном
слое, возникающие при
взаимодействии сопряженных
фаз, имеющих различный состав и
строение.
Поверхность раздела фаз –
граничная область между фазами
4.
Адсорбция (лат. ad - на, при; sorbeo-поглощаю) - вид сорбции, связаный
с увеличением концентрации
растворенного вещества (абсорбат)
у поверхности раздела двух фаз
вследствие нескомпенсированности
сил межмолекулярного
взаимодействия.
Десорбция - процесс, обратный
адсорбции
5.
Сорбция – гетерогенный процесссамопроизвольного поглощения
твёрдым телом или жидкостью веществ
из окружающей среды.
Сорбент твёрдое тело или жидкость,
поглощающие вещества.
Сорбат - поглощаемое вещество.
Сорбция
- обратимая
- необратимая. При обратимой на
границе раздела фаз
устанавливается равновесие
6.
Поверхностная энергия избыток энергии, возникающейна границе раздела фаз, за
счет нескомпенсированности
сил межмолекулярного
взаимодействия.
Адсорбция - экзотермический
процесс
7.
Удельная свободная поверхностнаяэнергия (σ) - поверхностное натяжение
на границе жидкости с ее парами –
свободная поверхностная энергия
Гиббса (Gs, Дж)
Gs = Ϭ • S,
где S – площадь поверхности раздела
фаз [м2]
Ϭ – коэффициент
пропорциональности - поверхностное
натяжение [ Дж·м2 ]
8.
Поверхностное натяжение (Ϭ) на поверхности раздела фаззависит от:
- природы растворителя;
- температуры;
- давления газовой фазы;
- природы и концентрации
растворенного вещества
9.
Изотерма поверхностногонатяжения – зависимость
поверхностного натяжения
растворов от концентрации
растворенного вещества при
постоянной температуре
10.
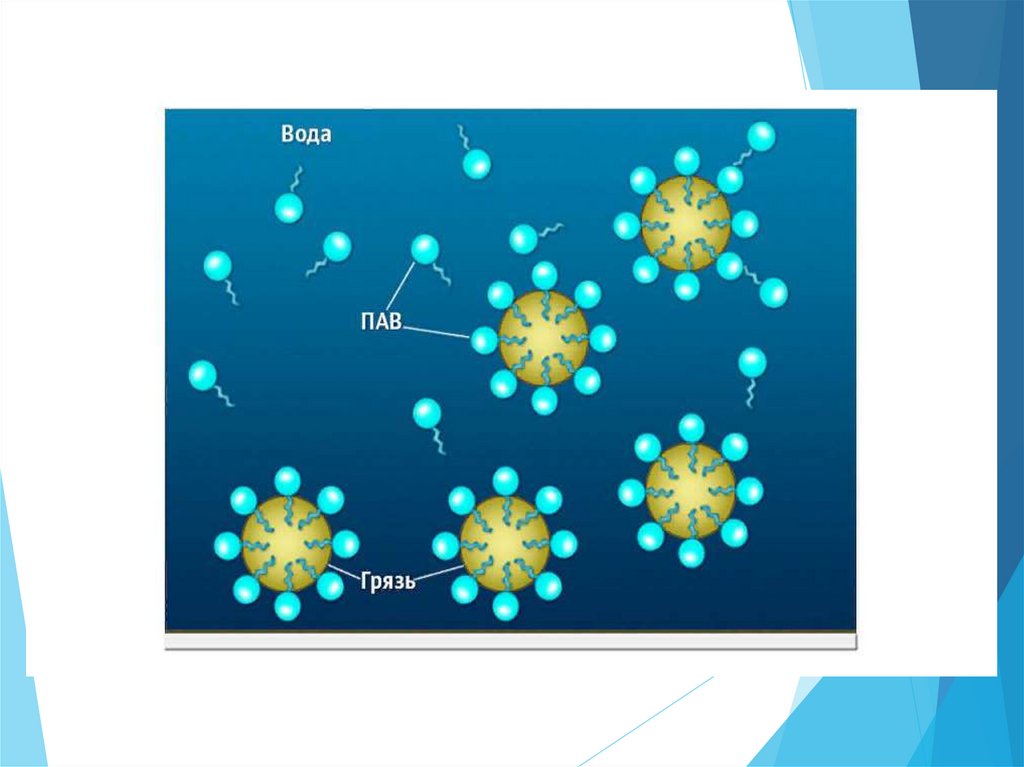
Поверхностно-активные вещества(ПАВ) - понижают поверхностное
натяжение растворителя (органические
спирты, кислоты, амины, фенолы).
Поверхностно – инактивные
вещества (ПИВ) – повышают
поверхностное натяжение (сильные
электролиты).
Поверхностно-неактивные вещества
(ПНВ) - не изменяют поверхностное
натяжение (сахароза и др.)
11.
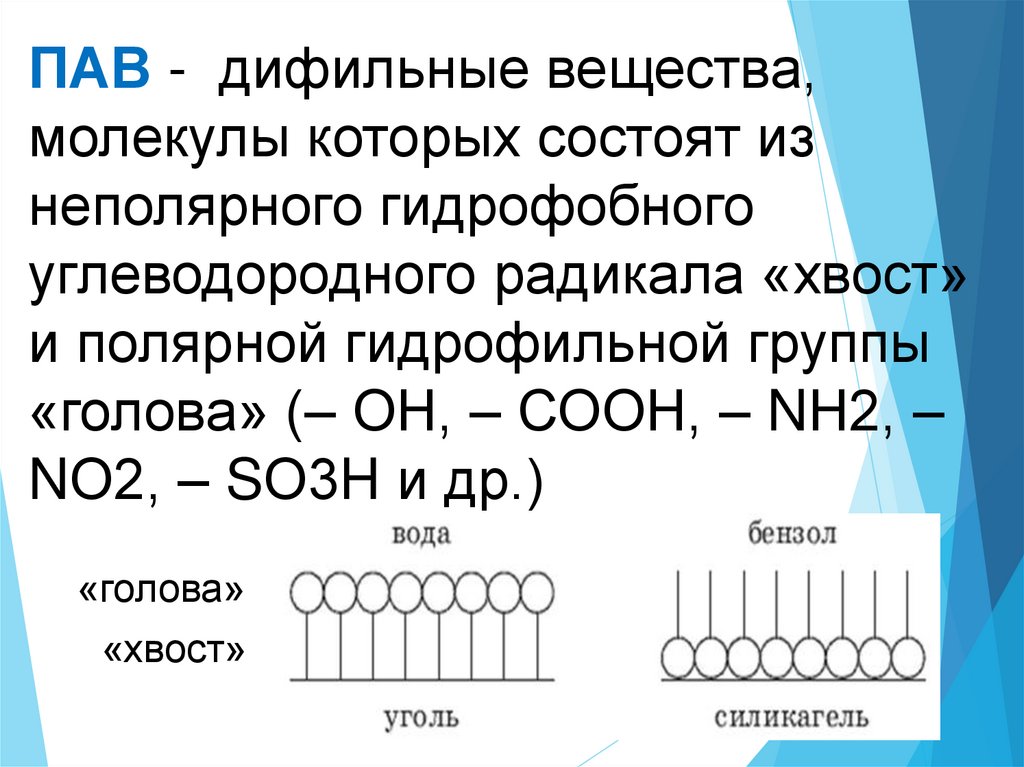
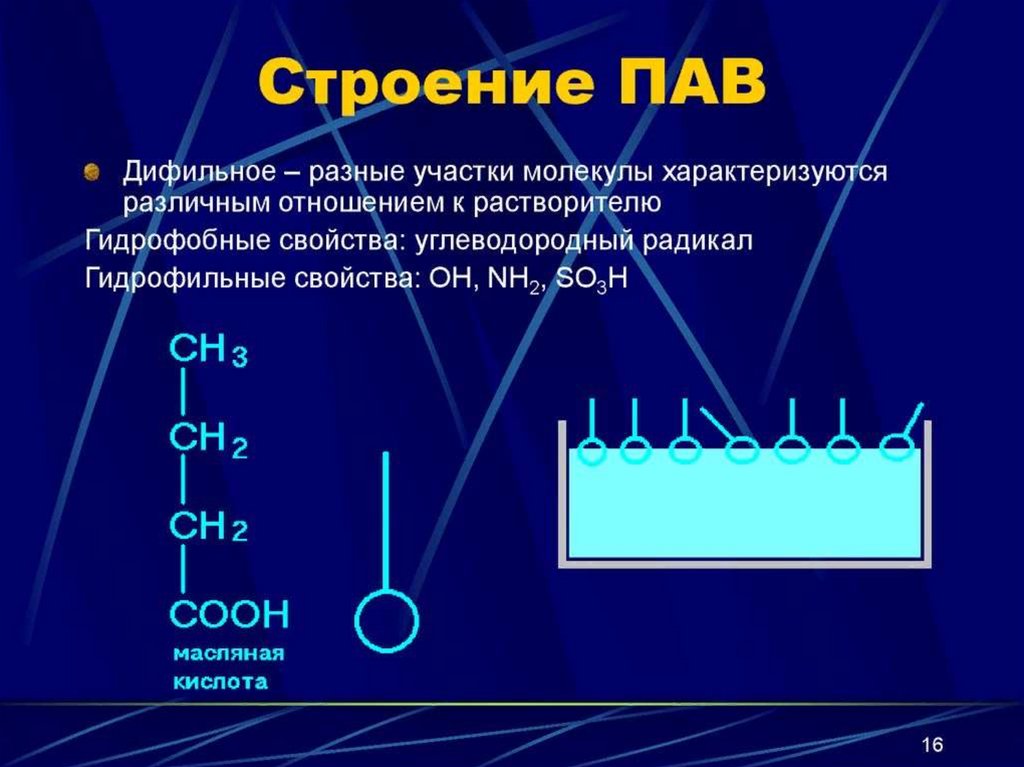
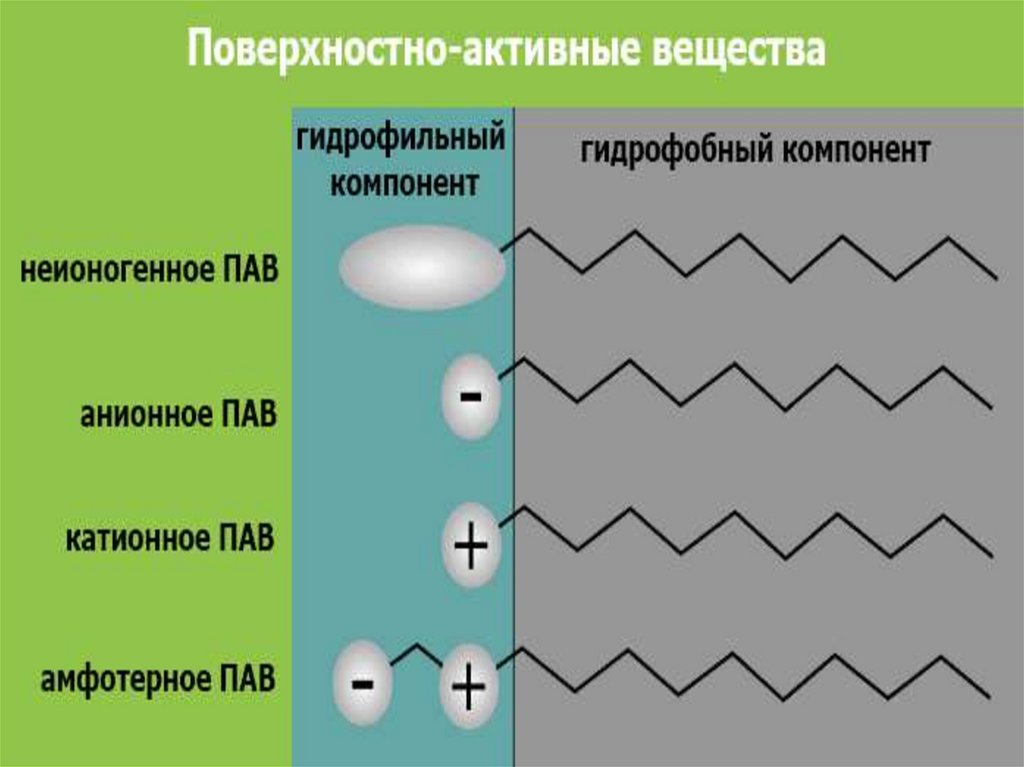
ПАВ - дифильные вещества,молекулы которых состоят из
неполярного гидрофобного
углеводородного радикала «хвост»
и полярной гидрофильной группы
«голова» (– ОН, – СООН, – NН2, –
NО2, – SО3H и др.)
«голова»
«хвост»
12.
13.
14.
15.
Правило Дюкло – Траубе:поверхностная активность
веществ одного и того же
гомологического ряда при
увеличении углеводородной
цепи на группу –СН2–
возрастает в 3,2 раза
16.
17.
2. Адсорбция неэлектролитов(адсорбируются молекулы) – молекулярная
адсорбция.
Зависит от:
- природа растворителя - чем лучше среда
растворяет адсорбтив , тем слабее
адсорбция;
- степень дисперсности адсорбента: чем
выше дисперсность, тем больше удельная
поверхность, тем сильнее адсорбция;
- концентрация адсорбтива в растворе;
- температура: с повышением температуры
адсорбция уменьшается;
18.
Адсорбция из растворов сильныхэлектролитов (ионная адсорбция)
Характеризуется:
- высокой избирательностью - на твёрдом
адсорбенте преимущественно
адсорбируются ионы , входящие в
состав адсорбента , или имеющие общую
с адсорбентом группу;
- многозарядные ионы адсорбируются
сильнее однозарядных;
- при одинаковых зарядах легче
адсорбируются ионы с большим радиусом
19.
Ионообменная адсорбция процесс, в которомадсорбент и раствор
обмениваются между собой
в эквивалентных
количествах одноименно
заряженными ионами
20.
Иониты - вещества, замещающие своиионы на одноимённо заряженные
(органические и неорганические).
Различают:
- Катиониты - замещаются катионы
- Аниониты - замещаются анионы
Применение медицине:
- При консервировании крови (удаление
ионов Са2+);
- При беззондовой диагностике
кислотности желудочного сока;
- При детоксикации организма
21.
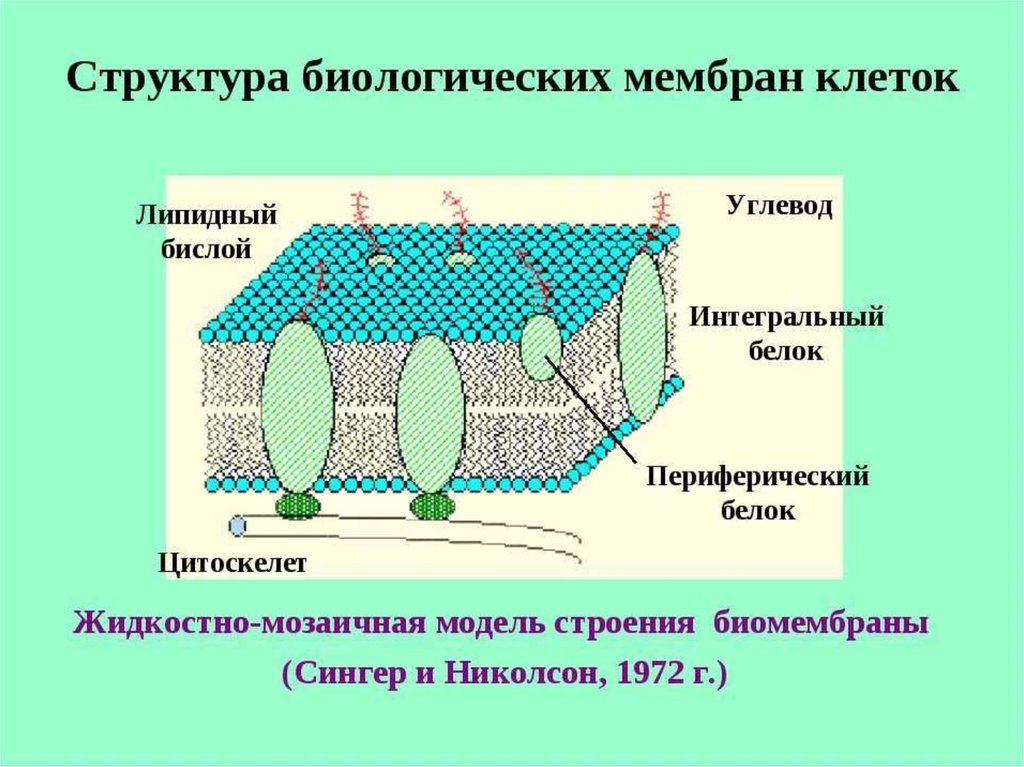
3. Биологическая мембрана –жидкостно мозаичная модель:
бислой фосфолипидов, в
отдельных местах насквозь
пронизан молекулами белков
(интегральные белки) - поры,
через которые проходят
водорастворимые вещества
22.
23.
Биологическая роль адсорбции• усвоение вещества в организме
начинается с адсорбции;
• при катализе субстрат адсорбируется
на поверхности фермента;
• адсорбционная терапия для удаления
токсинов из пищеварительного тракта
(энтеросорбция), из крови (гемосорбция);
• взаимодействие лекарственных
препаратов с рецепторами биомембран;
• Хроматография
24.
4. Дисперсные системы гетерогенная системы, вкоторых одно вещество в
раздробленном (дисперсном)
состоянии - дисперсная фаза
(ДФ) равномерно распределено
в массе (обьеме) другого
вещества - дисперсионная
среда
25.
Классификацияпо агрегатному состоянию
дисперсионной среды
Аэрозоли - газообразная (дым, смог,
туман).
Лиозоли - жидкая (пены, эмульсии
(молоко), суспензии).
Солидозоли - твердая (пемза,
сплавы).
26.
По размеру частиц ДФ:Истинные растворы (ионномолекулярные системы)
а < 10 9 м
- устойчивы,
- прозрачны,
- фильтруются,
- пропускают свет,
- не видимы в ультрамикроскоп
27.
Грубодисперсные системыа> 10 -7 м
- неустойчивы,
- непрозрачны,
- не проходят через бумажный
фильтр,
- рассеивают и отражают свет,
- видимы в обычный
микроскоп
28.
Коллоидные растворыа = 10-9 - 10-7 м
- относительно устойчивы,
-прозрачны,
- фильтруются,
- рассеивают свет (конус
Тиндаля),
- видимы в ультрамикроскоп
29.
Гидрофильные коллоиды структурная единица ДФ молекула ВМС (однородные,гомогенные).
Гидрофобные коллоиды структурная единица ДФ мицелла.
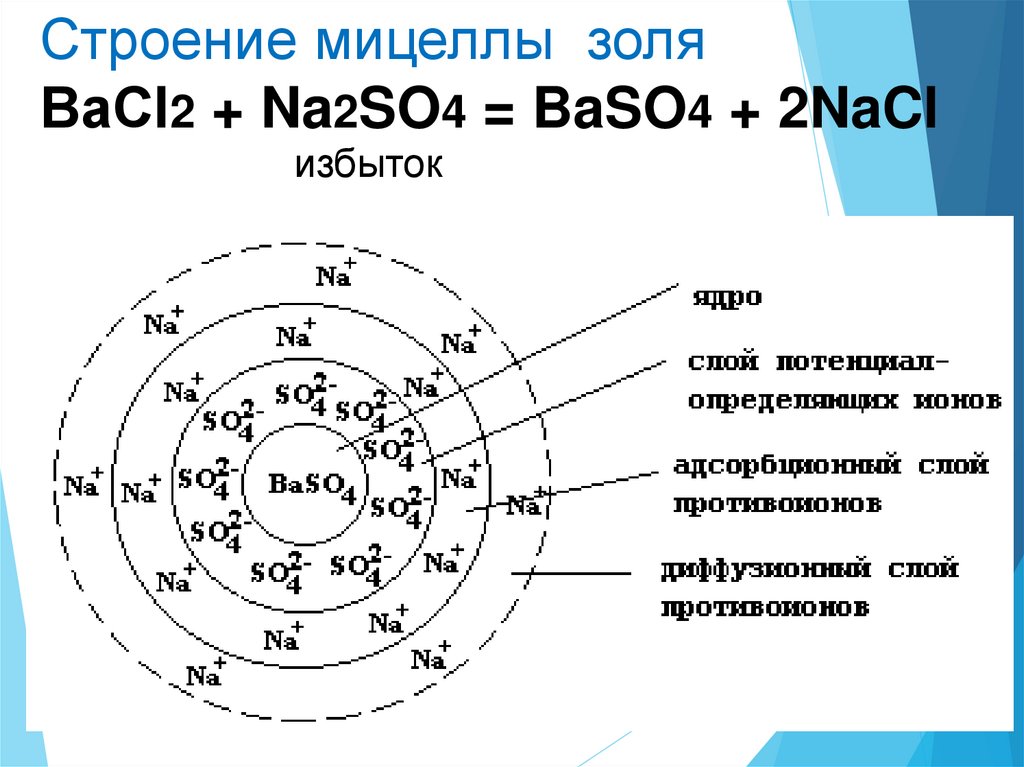
30.
Строение мицеллы золяВаСl2 + Na2SO4 = BaSO4 + 2NaCl
избыток
31.
АgNO3 + KJ = AgJ + KNO3избыток
32.
33.
Коллоидные растворы неустойчивые системы, вследствиебольшой межфазной поверхности.
Устойчивость дисперсных систем
способность сохранять свое
состояние и свойства неизменными
с течением времени.
Виды устойчивости:
- кинетическая (седиментационная)
- агрегативная
34.
Кинетическая(седиментационная)
устойчивость - способность
частиц дисперсной фазы
оставаться во взвешенном
состоянии (броуновское
движение, энергия теплового
движения, диффузия)
35.
Агрегативная устойчивость способность системы сохранять степеньдисперсности, противостоять агрегации
частиц дисперсной фазы.
При нарушении частицы дисперсной
фазы образуют агрегаты, достигающие
размеров, при которых сила тяжести
превышает энергию теплового движения.
Дисперсная фаза оседает или всплывает
в зависимости от соотношения
плотностей дисперсной фазы и
дисперсионной среды
36.
Пептизация - электролиты,адсорбируясь на
поверхности коллоидных
частиц, способствуют
растворению осадка с
образованием золя
37.
Факторы аграгативнойустойчивости
- Электрический заряд
мицеллы (молекулы ВМС)
- Диффузный слой мицеллы
(гидратная оболочка
молекулы ВМС)
38.
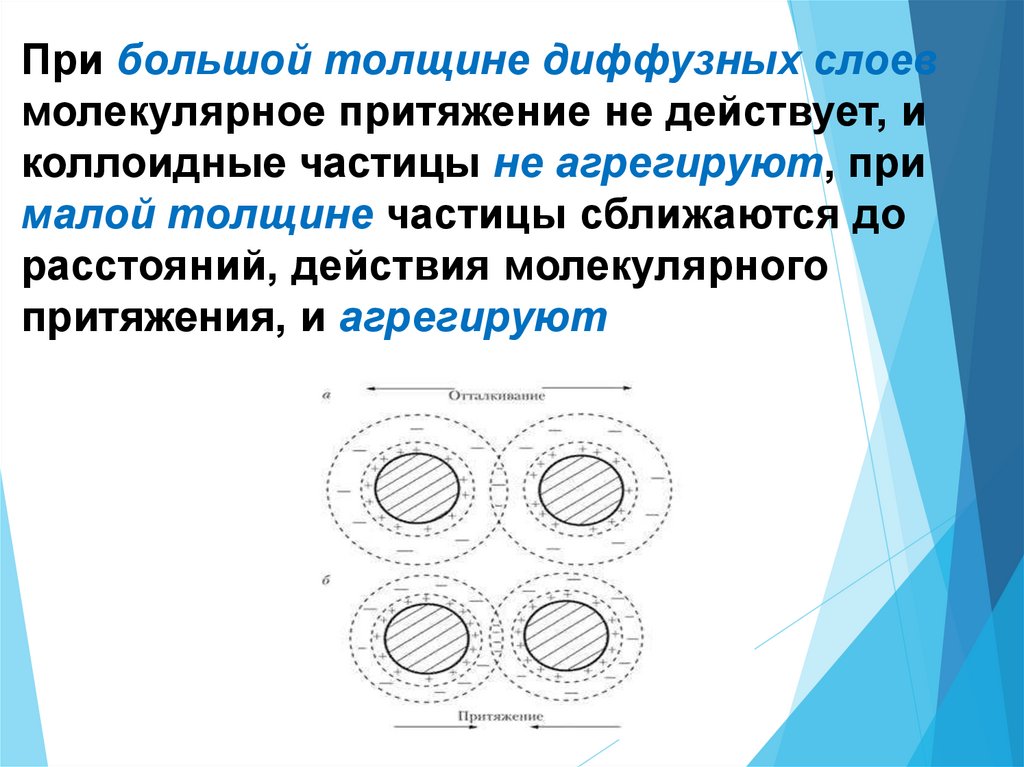
При большой толщине диффузных слоевмолекулярное притяжение не действует, и
коллоидные частицы не агрегируют, при
малой толщине частицы сближаются до
расстояний, действия молекулярного
притяжения, и агрегируют
39.
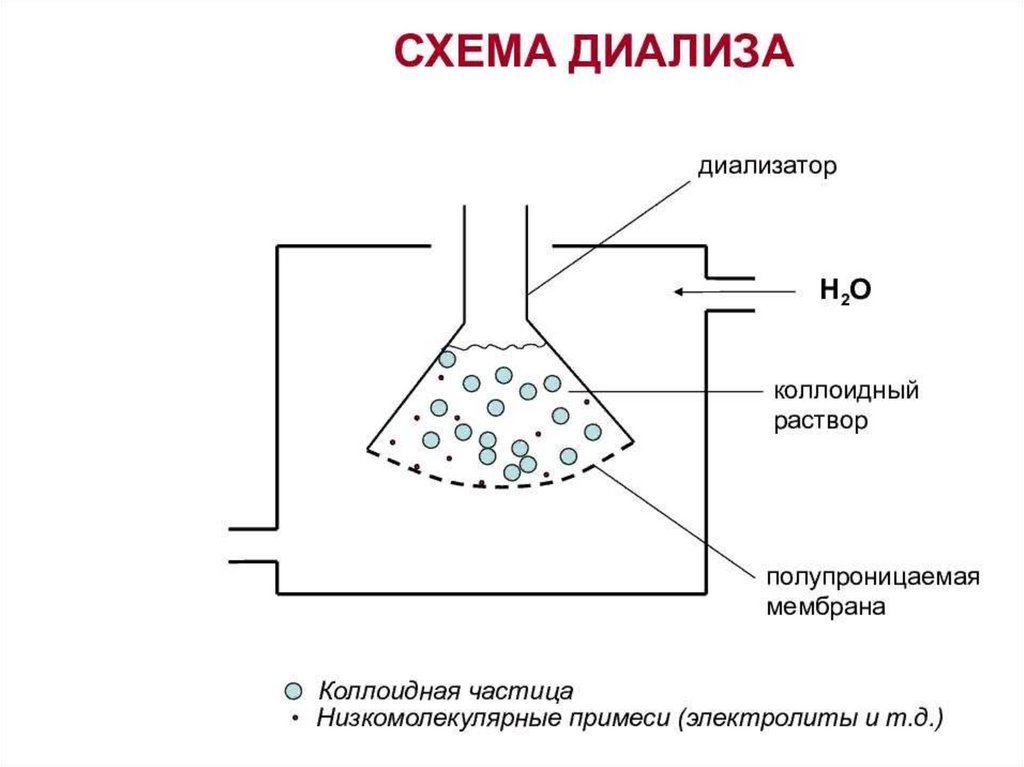
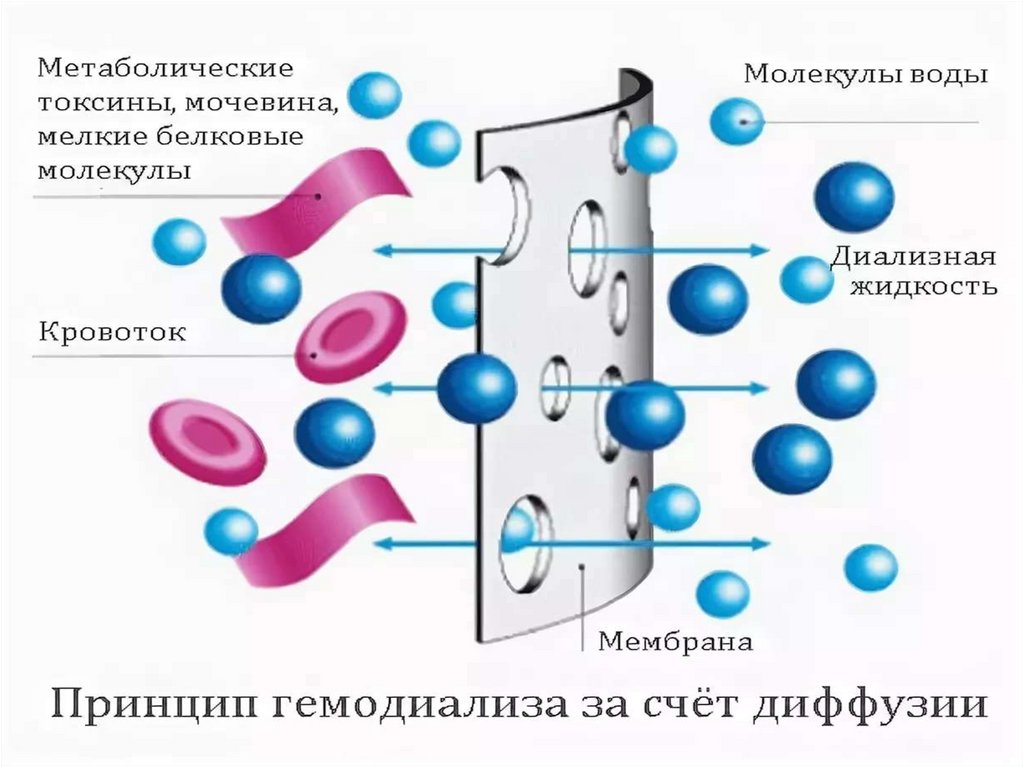
Коагуляция (от лат. "coagulatio" свертывание, сгущение) следствиеагрегации коллоидных частиц.
Факторы, взывающие коагуляцию:
- концентрирование дисперсной
фазы,
- диализ,
- механическое воздействие,
- изменение температуры,
- различными видами излучений,
- добавлением электролитов
40.
41.
42.
43.
44.
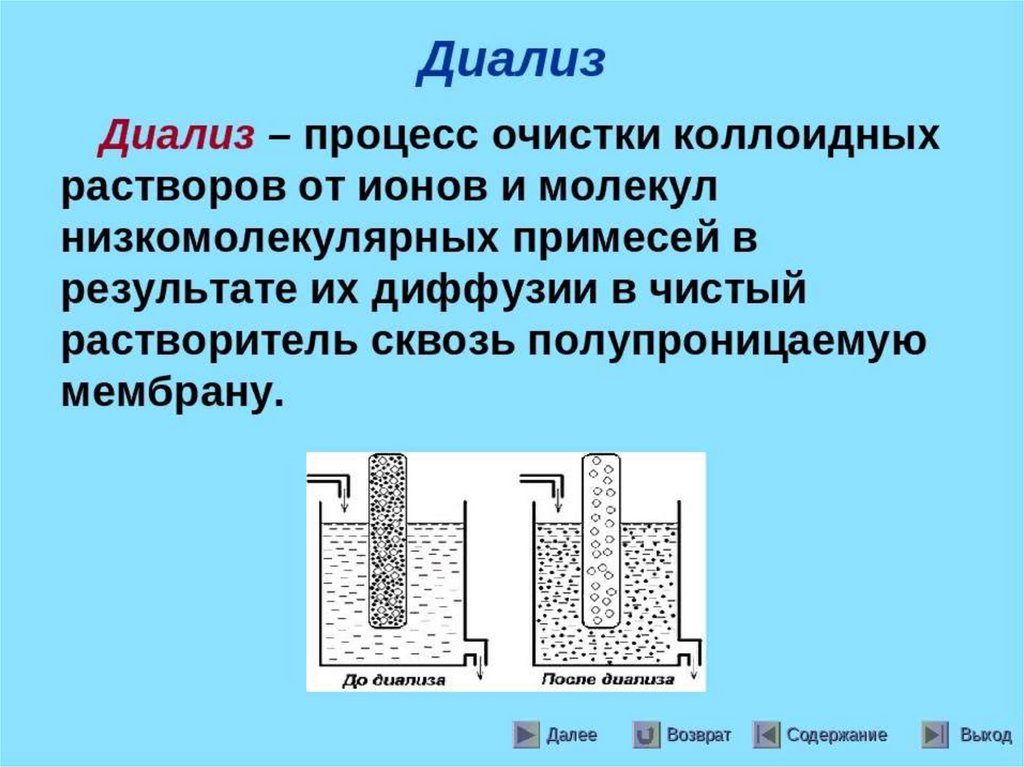
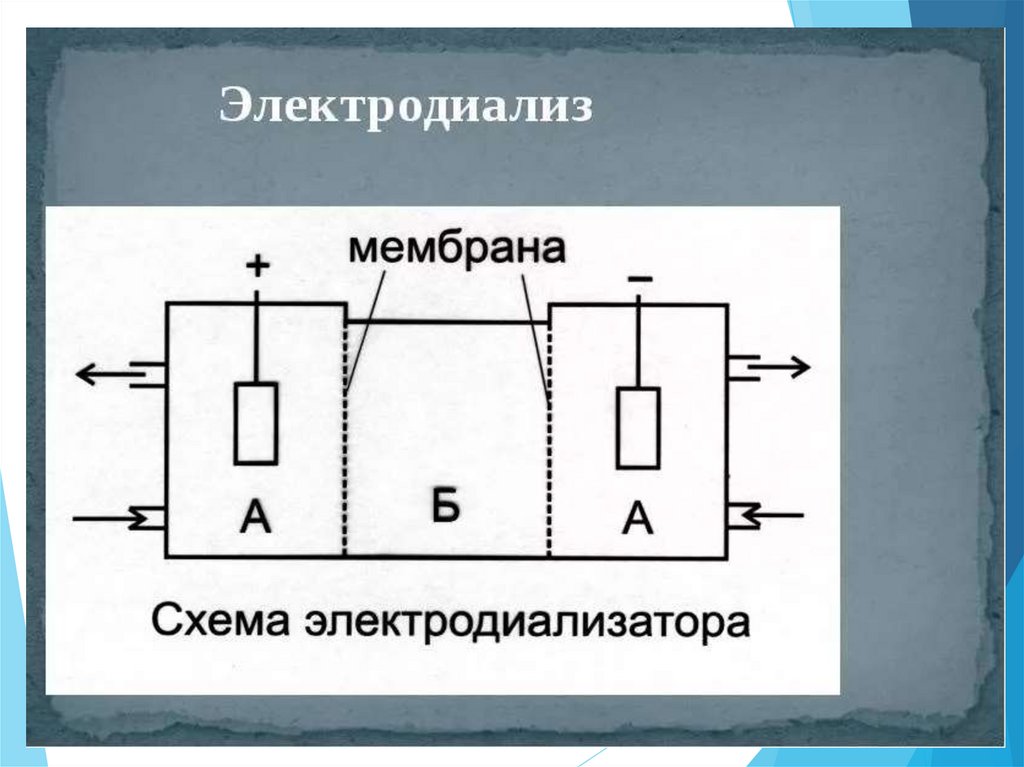
Электродиализ - метод очисткижидких дисперсных систем от
примесей низкомолекулярных
веществ, растворенных в
дисперсионной среде.
Основан на ускорении
диффузии ионов через
мембрану под действием
электрического поля
45.
46.
БЛАГОДАРЮЗА ВНИМАНИЕ!



































 Химия
Химия








