Похожие презентации:
Классификация и свойства неорганических соединений
1. Классификация и свойства неорганических соединений
*Домбровская С.Е.
СПб АППО
2. Классификация неорганических соединений
*Оксиды*Гидроксиды
*Соли
*Другие бинарные соединения
*
3. Оксиды
* Образованы двумя химическимиэлементами
* Один из элементов кислород,
имеющий степень окисления -2
Примеры: MgO, H2O
*
4. Классификация оксидов
*Несолеобразующие (безразличные):NO, CO, N2O
*Солеобразующие:
1) Основные
2) Кислотные
3) Амфотерные
*
5.
Оксидами являются обавещества в паре
1) MgO и H2O2
2) Na2O2 и BaO
3) Mn2О7 и N2O3
4) F2О и P2O5
6. Свойства основных оксидов
*Реагируют с кислотами:MgO + H2SO4 = MgSO4 + H2O
*Реагируют с кислотными оксидами:
CaO + CO2 = CaCO3
*Некоторые реагируют с водой (оксиды
щелочных и щелочно-земельных
металлов):
Na2O + H2O = 2NaOH
*
7. Свойства кислотных оксидов
*Реагируют со щелочами:CO2 + 2NaOH = Na2CO3 + H2O
*Реагируют с основными оксидами:
P2O5 + 3CaO = Ca3(PO4)2
*Большинство реагирует с водой:
SO3 + H2O = H2SO4
*
8. Свойства амфотерных оксидов
Амфотерность – двойственность свойств*Реагируют с кислотами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
*Реагируют со щелочами:
Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O (при
сплавлении)
*
9. Гидроксиды
*Основания (щелочии
нерастворимые в воде)
NaOH, Mg(OH)2
*Амфотерные гидроксиды
Zn(OH)2 , Al(OH)3
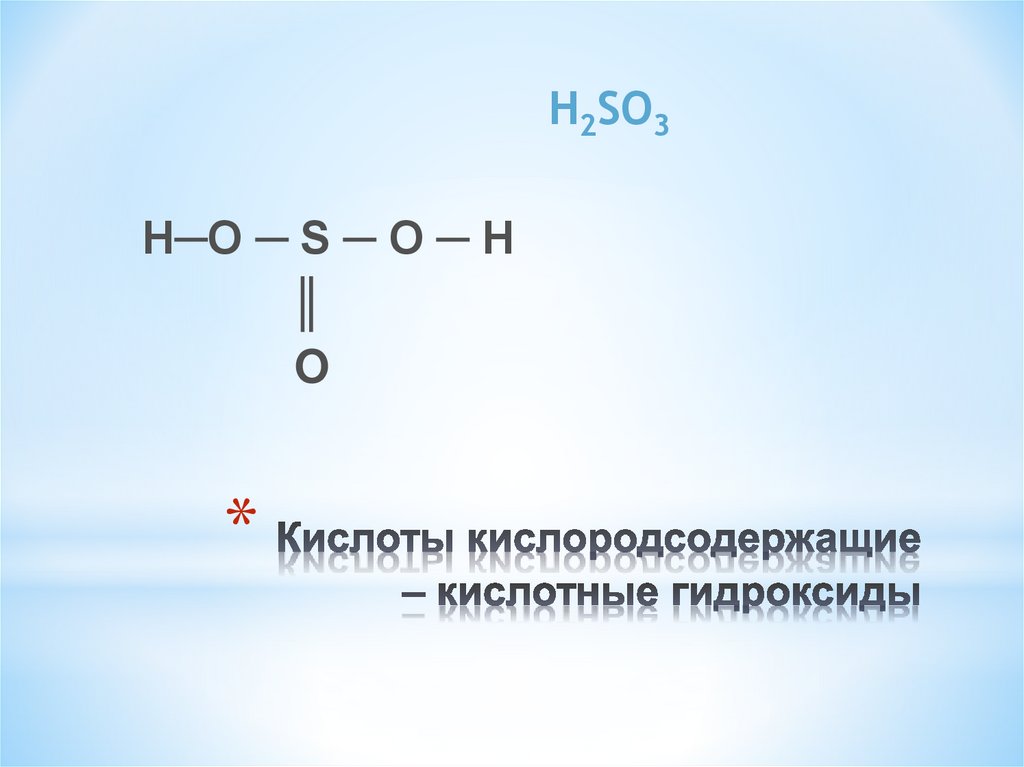
* Кислоты кислородсодержащие
H2SO3
*
10. Кислоты кислородсодержащие – кислотные гидроксиды
H2SO3H─O ─ S ─ O ─ H
║
O
*
11.
Термин «Гидроксид»означает
«гидратированный
оксид», т.е. оксид
присоединивший воду
12. Щелочи и большинство кислородсодержащих кислот
Образуются при взаимодействиисоответствующего оксида с водой
Na2O +H2O = 2NaOH
SO2 + H2O = H2SO3
*
13. Нерастворимые в воде основания и амфотерные гидроксиды
Разлагаются при нагревании:Mg(OH)2 = MgO +H2O
Zn(OH)2 = ZnO +H2O
*
14. Свойства щелочей
* Реагируют с кислотами:2NaOH + H2SO4 = Na2SO4 + 2H2O
* Реагируют с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
* Реагируют с растворами солей, если выпадает
осадок:
2NaOH+ CuSO4 = Cu(OH)2↓ + Na2SO4
* Реагируют с металлами, образующими
амфотерные оксиды и гидроксиды:
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + Н2
*
15. Нерастворимые в воде основания
*Реагируют с кислотами:Mg(OH)2 + 2HNO3 = Mg(NO3)2 +2H2O
*Разлагаются при нагревании:
Mg(OH)2 = MgO +H2O
*
16. Кислотные гидроксиды – кислородсодержащие кислоты
* Реагируют с основаниями:KOH + HNO3 = KNO3 + H2O
* Реагируют с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
* Реагируют с металлами, стоящими в ряду
напряжений до водорода:
Mg + H2SO4 = MgSO4 + H2
* Реагируют с солями:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
*
17. Амфотерные гидроксиды
*Реагируют с кислотами, проявляясвойства оснований:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
*Реагируют со щелочами, проявляя
свойства кислот:
Al(OH)3 + NaOH = Na[Al(OH)4]
*
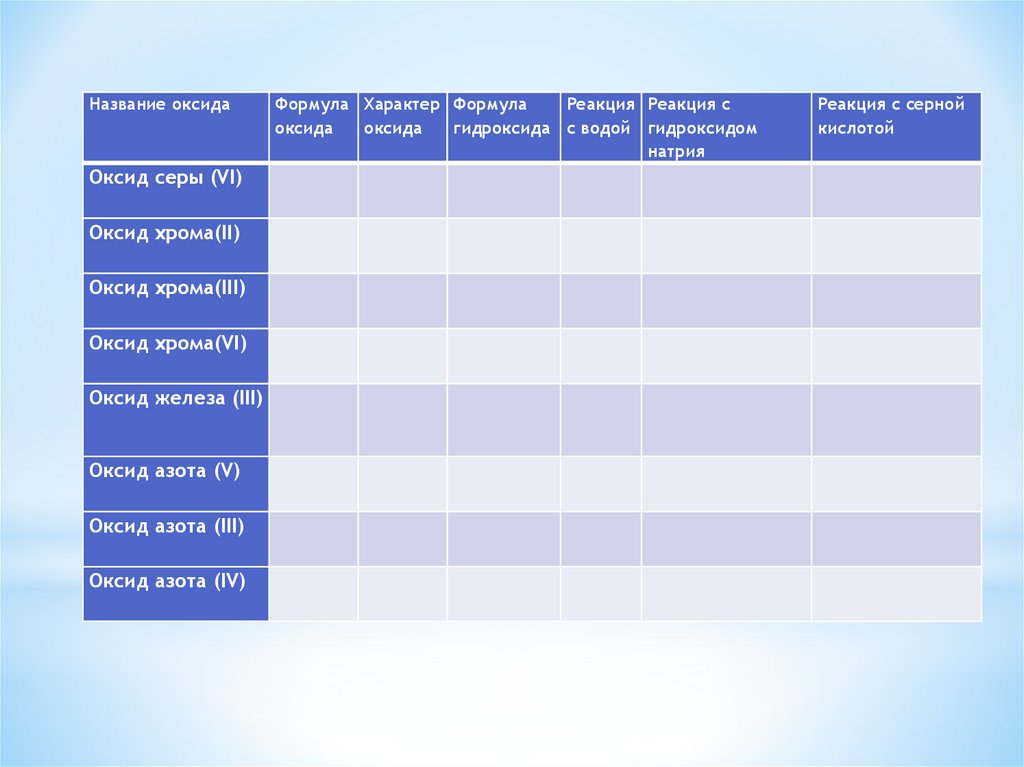
18.
Название оксидаОксид серы (VI)
Оксид хрома(II)
Оксид хрома(III)
Оксид хрома(VI)
Оксид железа (III)
Оксид азота (V)
Оксид азота (III)
Оксид азота (IV)
Формула Характер Формула
Реакция Реакция с
оксида
оксида
гидроксида с водой гидроксидом
натрия
Реакция с серной
кислотой
19. Соли
*Наиболее многочисленныйкласс веществ
*Отличаются друг от друга по
цвету и растворимости в воде
*
20. Классификация солей
* Средние соли – продукты полнойнейтрализации оснований кислотами
3NaOH + H3PO4 = Na3PO4 + 3H2O
* Кислые – продукты неполной
нейтрализации кислоты основанием
H3PO4 + NaOH = NaH2PO4 + H2O
* Основные - продукты неполной
нейтрализации основания кислотой
Fe(OH)2 + HCl = Fe(OH)Cl + H2O
*
21. Классификация солей
*Двойные соли – соли, содержащиедва катиона
KAl(SO4)2
*Смешанные соли – соли,
содержащие два аниона
Ca(OCl)Сl
*Комплексные соли – соли,
содержащие комплексные анионы
Na[Al(OH)4]
*
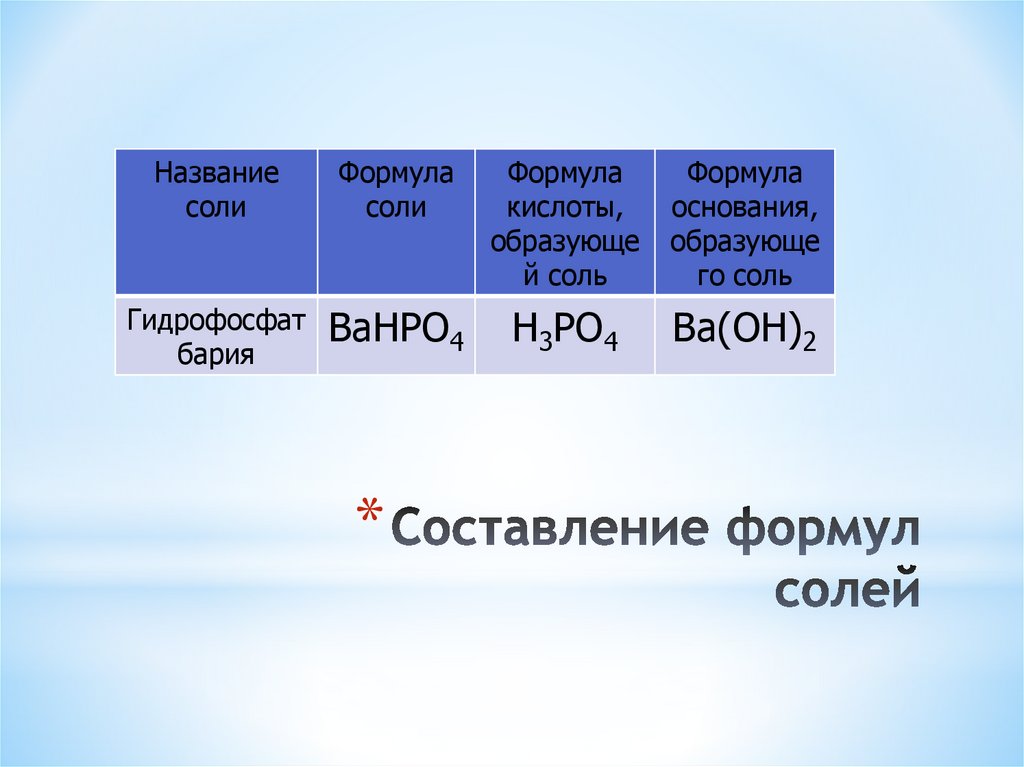
22. Составление формул солей
Названиесоли
Формула
соли
Формула
кислоты,
образующе
й соль
Формула
основания,
образующе
го соль
Гидрофосфат
бария
BaHPO4
H3PO4
Ba(OH)2
*
23. Способы получения средних солей – кислотно-основные взаимодействия
* Основания + кислота:3NaOH + H3PO4 = Na3PO4 + 3H2O
* Основный оксид + кислота:
MgO + H2SO4 = MgSO4 + H2O
* Кислотный оксид + щелочь:
SO3 + 2NaOH = Na2SO4 + H2O
* Кислотный оксид + основный оксид:
SO3 + Na2O = Na2SO4
*
24. Способы получения средних солей
*Соль + кислота:BaCl2 + H2SO4 = BaSO4↓ + 2HCl
*Раствор соли + раствор соли:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
*Раствор соли + раствор щелочи:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
*
25. Способы получения средних солей
*Металл + неметалл:Mg + S = MgS
*Металл + раствор соли:
Mg + CuSO4 = MgSO4 + Cu
*Металл + кислота:
Mg + H2SO4 = MgSO4 + H2
*
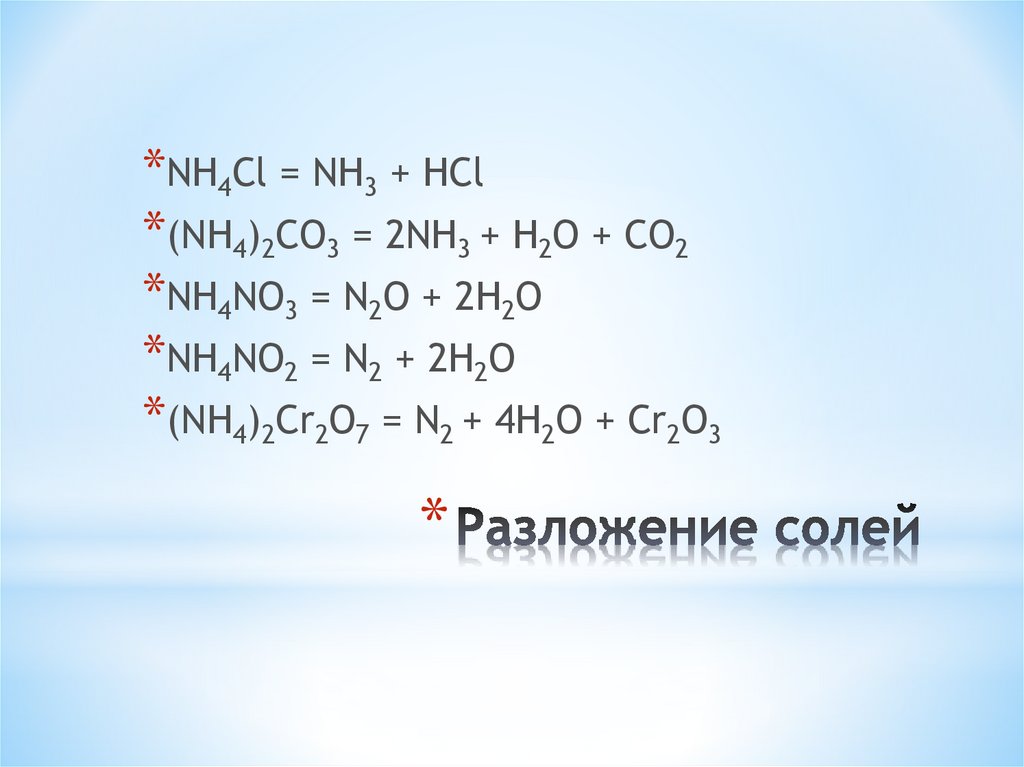
26. Разложение солей
* Разложение карбонатов 2 группы главнойподгруппы:
CaCO3 = CaO + CO2
* Разложение нитратов:
2NaNO3 = 2NaNO2 +O2
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
* Разложение других солей:
2KMnO4 = K2MnO4 + MnO2 + O2
2KClO3 = 2KCl + 3O2
*
27. Разложение солей
*NH4Cl = NH3 + HCl*(NH4)2CO3 = 2NH3 + H2O + CO2
*NH4NO3 = N2O + 2H2O
*NH4NO2 = N2 + 2H2O
*(NH4)2Cr2O7 = N2 + 4H2O + Cr2O3
*
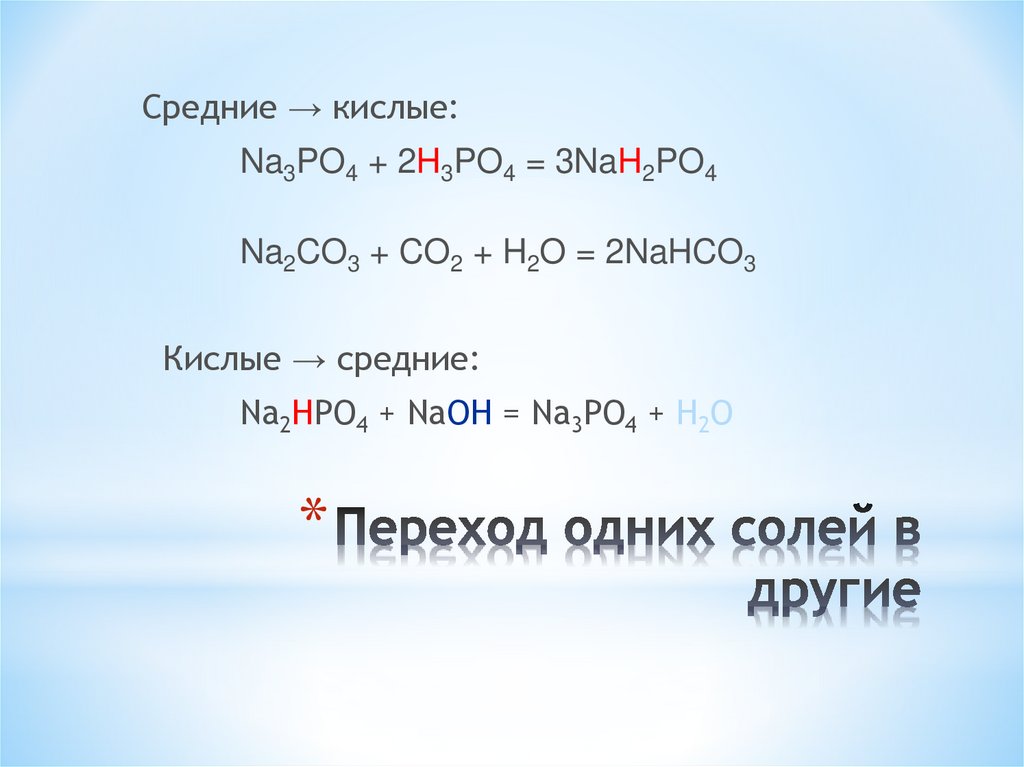
28. Переход одних солей в другие
Средние → кислые:Na3PO4 + 2H3PO4 = 3NaH2PO4
Na2CO3 + CO2 + H2O = 2NaHCO3
Кислые → средние:
Na2HPO4 + NaOH = Na3PO4 + H2O
*
29. Переход одних солей в другие
Средние→ основные:CuCl2 + NaOH = CuOHCl + NaCl
Основные → средние:
CuOHCl + HCl = CuCl2 + H2O
*
30. ЕГЭ № 34
*Смешали 78,4 г 25%-ногораствора ортофосфорной
кислоты и 560 г 5%-ного
раствора гидроксида калия.
Вычислите массовые доли
солей в растворе после
реакции.
*
31. Другие бинарные соединения
*Пероксиды (H2O2, Na2O2)*Летучие водородные
соединения неметаллов (HCl,
SiH4)
*Карбиды, нитриды, силициды
и др. (Al4C3, Ca3N2, Mg2Si)
*
32.
Спасибо завнимание!



























 Химия
Химия








