Похожие презентации:
Биохимия соединительной ткани
1. Биохимия соединительной ткани
Лекцию читает д.б.н., доценткафедры биохимии Е.А. Рыскина
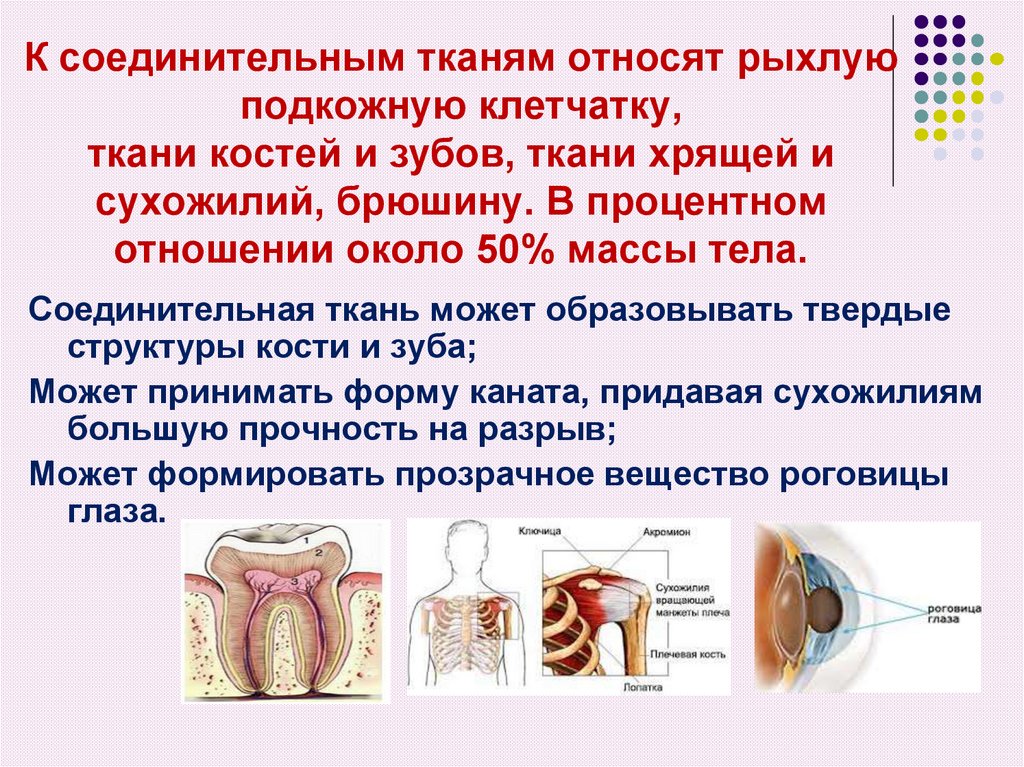
2. К соединительным тканям относят рыхлую подкожную клетчатку, ткани костей и зубов, ткани хрящей и сухожилий, брюшину. В
процентномотношении около 50% массы тела.
Соединительная ткань может образовывать твердые
структуры кости и зуба;
Может принимать форму каната, придавая сухожилиям
большую прочность на разрыв;
Может формировать прозрачное вещество роговицы
глаза.
3. Функции соединительной ткани
1. Опорная – образует каркас внутренних органов;2. Трофическая – обеспечивает ткани питательными
веществами (транспорт и обмен метаболитов,
органических веществ, солей и воды);
3. Защитная – создают барьер для вредных веществ
и влияния внешней среды;
4. Пластическая – регенерация при травмах и
повреждениях;
5. Структурная - образование структуры
способствующей функционированию тканей и
органов.
4. Особенностью строения соединительной ткани является то, что внеклеточный матрикс занимает больше место, чем сами клетки.
Внеклеточный матрикс выполняет разные функции:Является универсальным «биологическим клеем»;
Участвует в регуляции водно-солевого обмена;
Участвует в регенерации органов после
повреждений (фибробласты);
Регулирует обмен веществ между кровью и тканями;
Осуществляет хранение и запасание
энергетического материала (адипоциты);
Защищает от инфекций (плазматические клетки,
нейтрофилы, макрофаги).
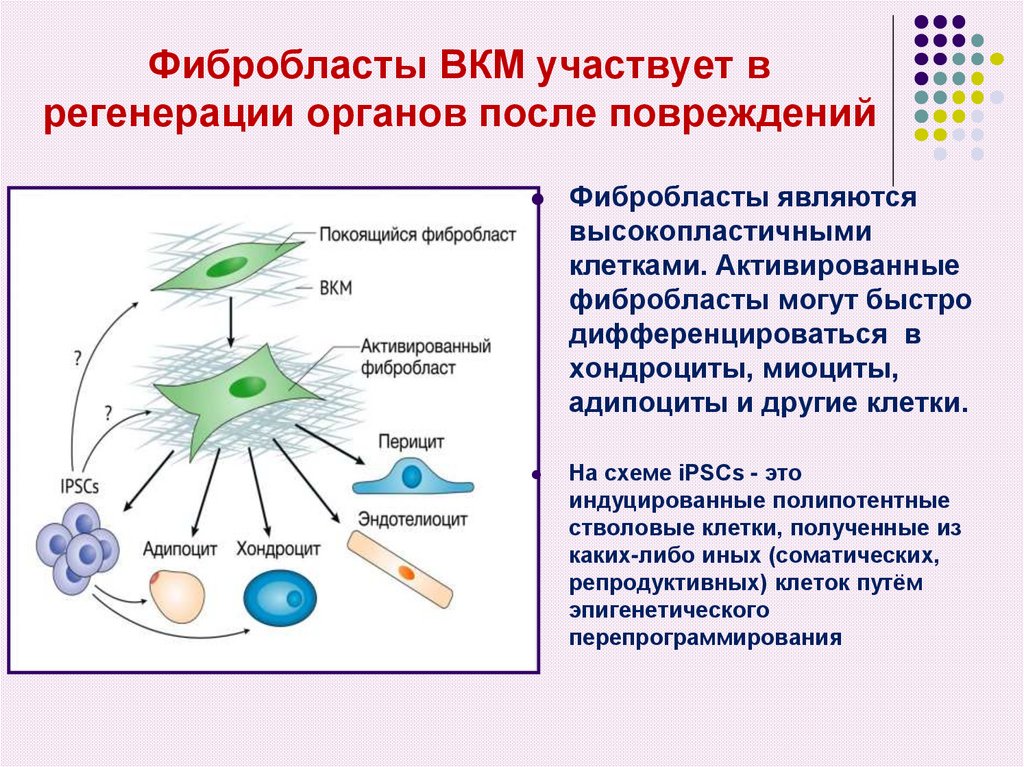
5. Фибробласты ВКМ участвует в регенерации органов после повреждений
Фибробласты являютсявысокопластичными
клетками. Активированные
фибробласты могут быстро
дифференцироваться в
хондроциты, миоциты,
адипоциты и другие клетки.
На схеме iPSCs - это
индуцированные полипотентные
стволовые клетки, полученные из
каких-либо иных (соматических,
репродуктивных) клеток путём
эпигенетического
перепрограммирования
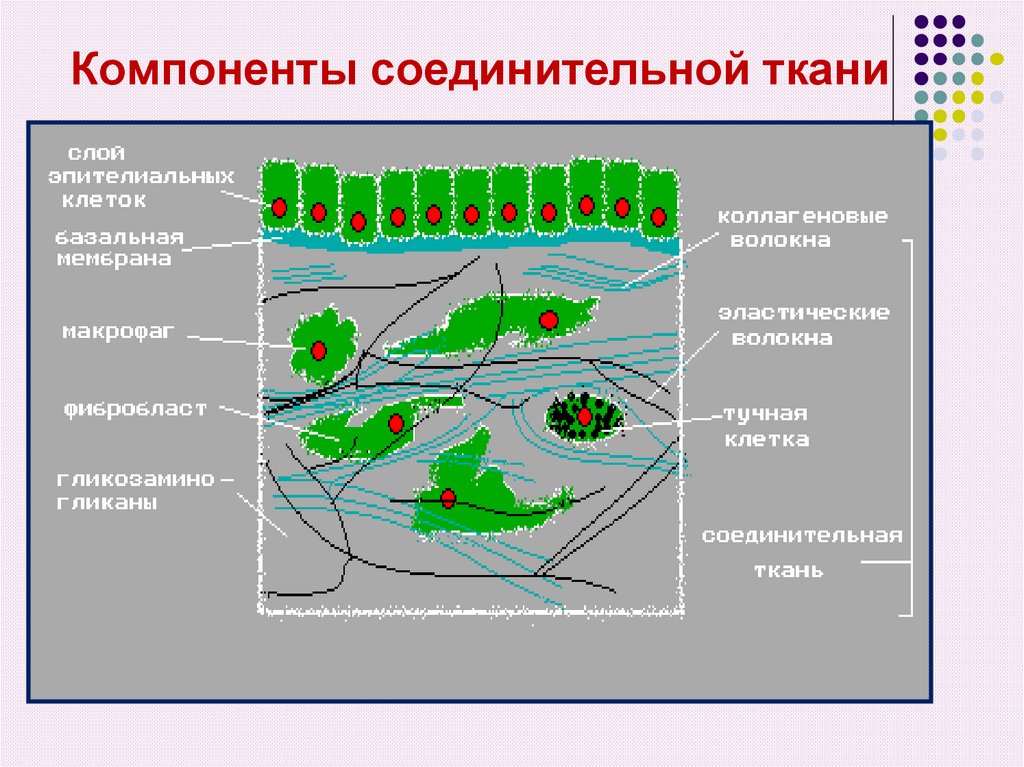
6. Компоненты соединительной ткани
7. Внеклеточный матрикс (ВКМ) соединительной ткани:
1. Имеет сложный химический состав, содержитразнообразные белки и полисахариды, в
образовании которых участвуют бластные клетки
соединительной ткани (фибро-, хондро-,
остеобласты).
2. Специфическое взаимодействие этих молекул
обеспечивает образование высокоупорядоченной
трехмерной структуры внеклеточного матрикса.
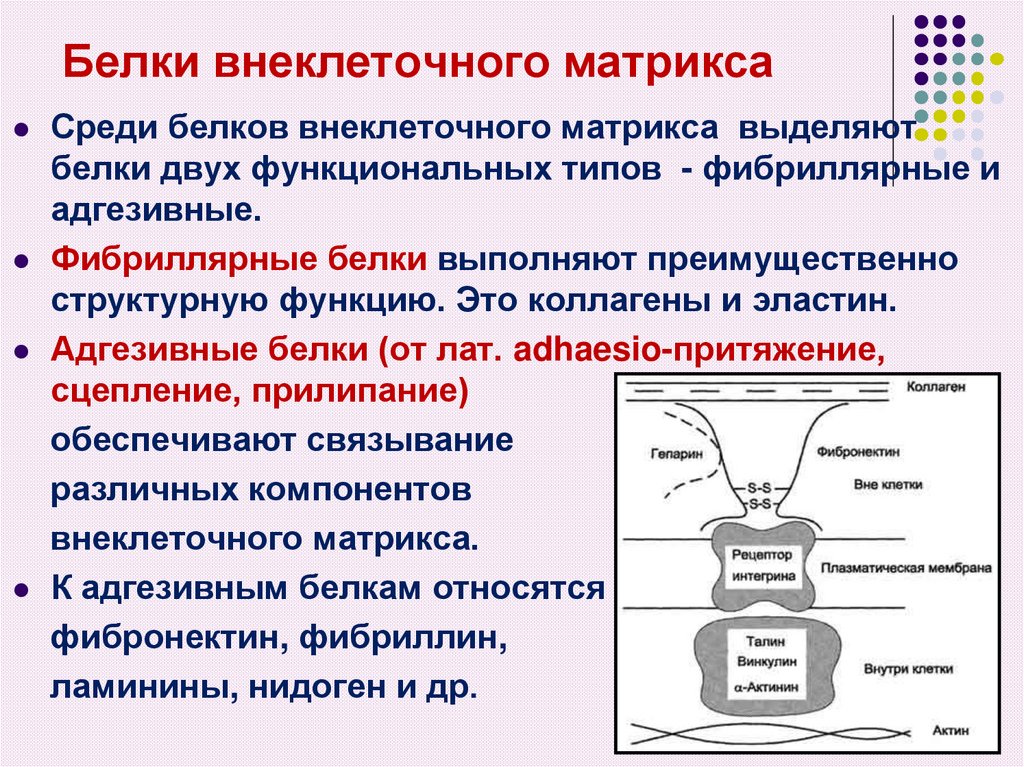
8. Белки внеклеточного матрикса
Среди белков внеклеточного матрикса выделяютбелки двух функциональных типов - фибриллярные и
адгезивные.
Фибриллярные белки выполняют преимущественно
структурную функцию. Это коллагены и эластин.
Адгезивные белки (от лат. adhaesio-притяжение,
сцепление, прилипание)
обеспечивают связывание
различных компонентов
внеклеточного матрикса.
К адгезивным белкам относятся
фибронектин, фибриллин,
ламинины, нидоген и др.
9. Протеогликаны внеклеточного матрикса
Протеогликаны вместе с коллагеном и эластиномобразуют основу ВКМ. Это высокомолекулярные
сложные белки, включающие белковый (5-10%) и
углеводный (90-95%) компоненты.
Углеводный компонент
представлен
гликозамингликанами,
которые построены
из дисахаридных
фрагментов.
10.
11. Коллаген – основной структурный белок соединительной ткани
Коллагены составляют приблизительно 30% общегоколичества белка в организме, синтезируется
бластными клетками соединительной ткани.
В настоящее время идентифицировано более 20
типов коллагенов, которые кодируются
отдельными генами и составляют семейство
коллагенов.
12. Строение молекул коллагенов
Молекулы коллагенов имеюттрехспиральную структуру, полученную при
скручивании трех полипептидных α – цепей.
Отдельные цепи связаны между собой
водородными связями. Количество
аминокислот в каждой α – цепи около 1000.
13. Особенности аминокислотного состава коллагена
Полипептидная цепь коллагена состоит изповторяющихся триплетов:
[Гли-Х-Y],
где Гли – глицин, Х и Y могут быть любые
аминокислоты, но чаще всего:
Х - пролин или аланин
Y - гидроксипролин или гидроксилизин
Таким образом, коллаген содержит 33% глицина
На рисунке аминокислотные остатки
глицина окрашены в черный цвет,
а остатки других аминокислот
в белый.
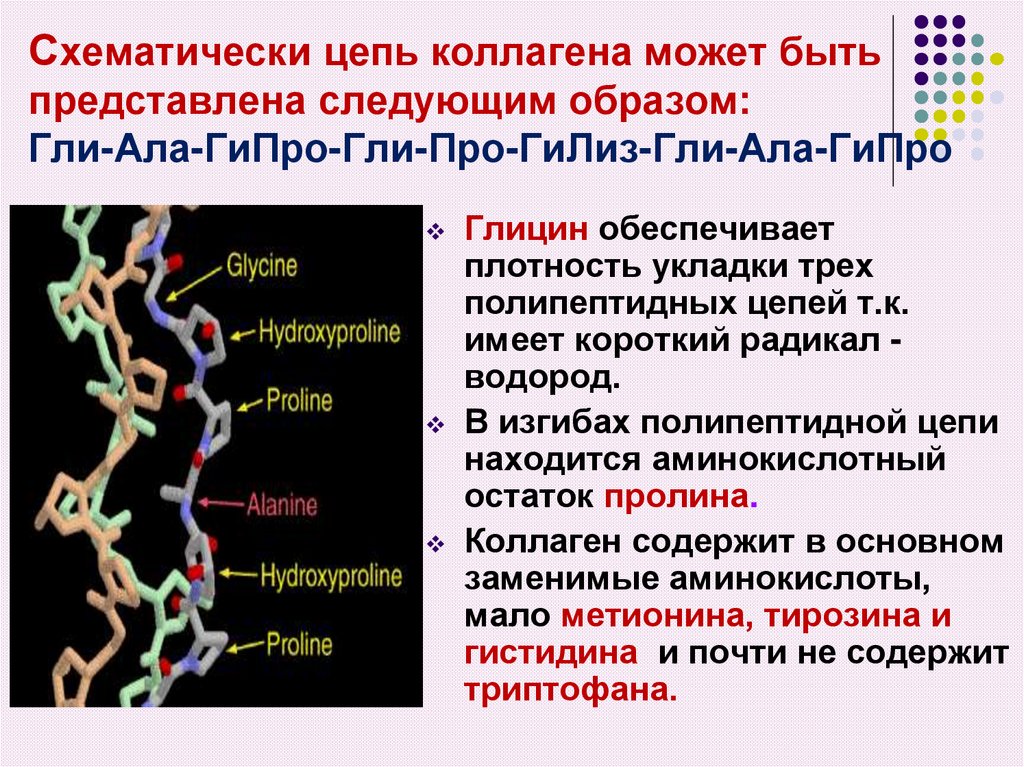
14. Схематически цепь коллагена может быть представлена следующим образом: Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро
Глицин обеспечиваетплотность укладки трех
полипептидных цепей т.к.
имеет короткий радикал водород.
В изгибах полипептидной цепи
находится аминокислотный
остаток пролина.
Коллаген содержит в основном
заменимые аминокислоты,
мало метионина, тирозина и
гистидина и почти не содержит
триптофана.
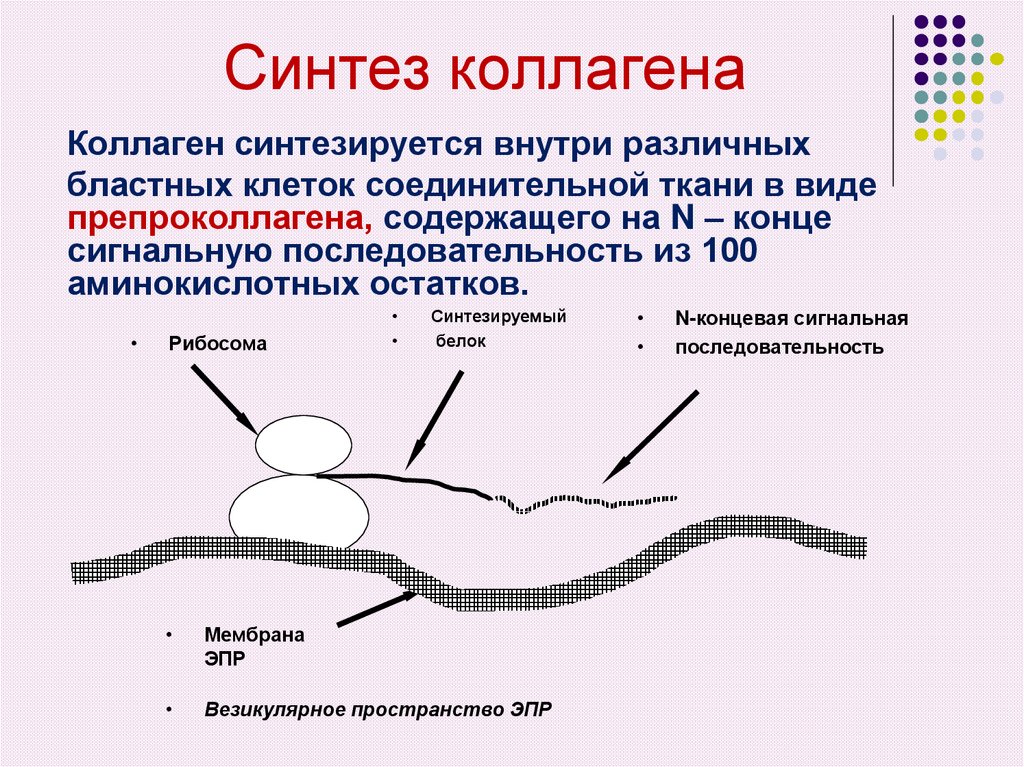
15. Синтез коллагена
Коллаген синтезируется внутри различныхбластных клеток соединительной ткани в виде
препроколлагена, содержащего на N – конце
сигнальную последовательность из 100
аминокислотных остатков.
Рибосома
Синтезируемый
белок
Мембрана
ЭПР
Везикулярное пространство ЭПР
N-концевая сигнальная
последовательность
16. Созревание коллагена
После синтеза цепи коллагена следует сложныймногоступенчатый процесс - созревания коллагена
Включает 2 этапа:
- внутриклеточный
- внеклеточный
На первом этапе происходит пострансляционная
модификация аминокислотных остатков
полипептидных цепей препроколлагена
Во втором этапе – образуются зрелые коллагеновые
волокна
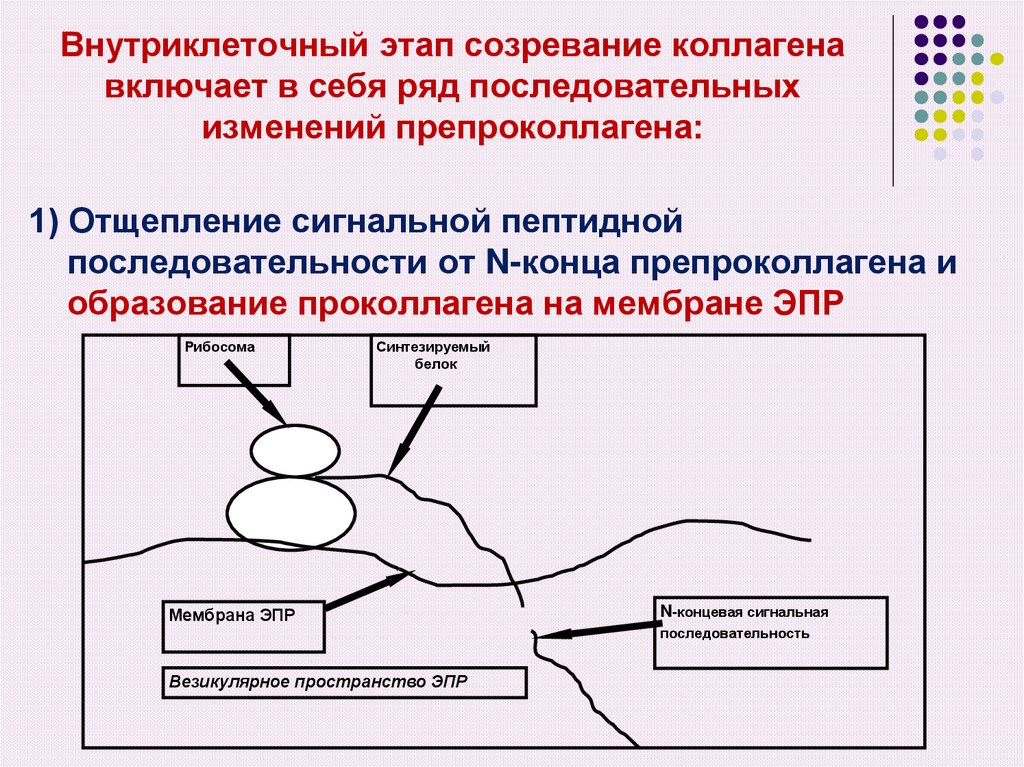
17. Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений препроколлагена:
1) Отщепление сигнальной пептиднойпоследовательности от N-конца препроколлагена и
образование проколлагена на мембране ЭПР
Рибосома
Синтезируемый
белок
Мембрана ЭПР
N-концевая сигнальная
последовательность
Везикулярное пространство ЭПР
18. 2) Гидроксилирование пролина и лизина проколлагена катализируют ферменты гидроксилазы
Рибосома
Мембрана ЭПР
Синтезируемый
белок
ОН
ОН
ОН
Везикулярное пространство ЭПР
Гидроксипролин (ГиПро) далее участвует в образовании
водородных связей в тройной спирали коллагена
Гидроксилизин (ГиЛиз) участвует в образовании сшивок между
молекулами коллагена
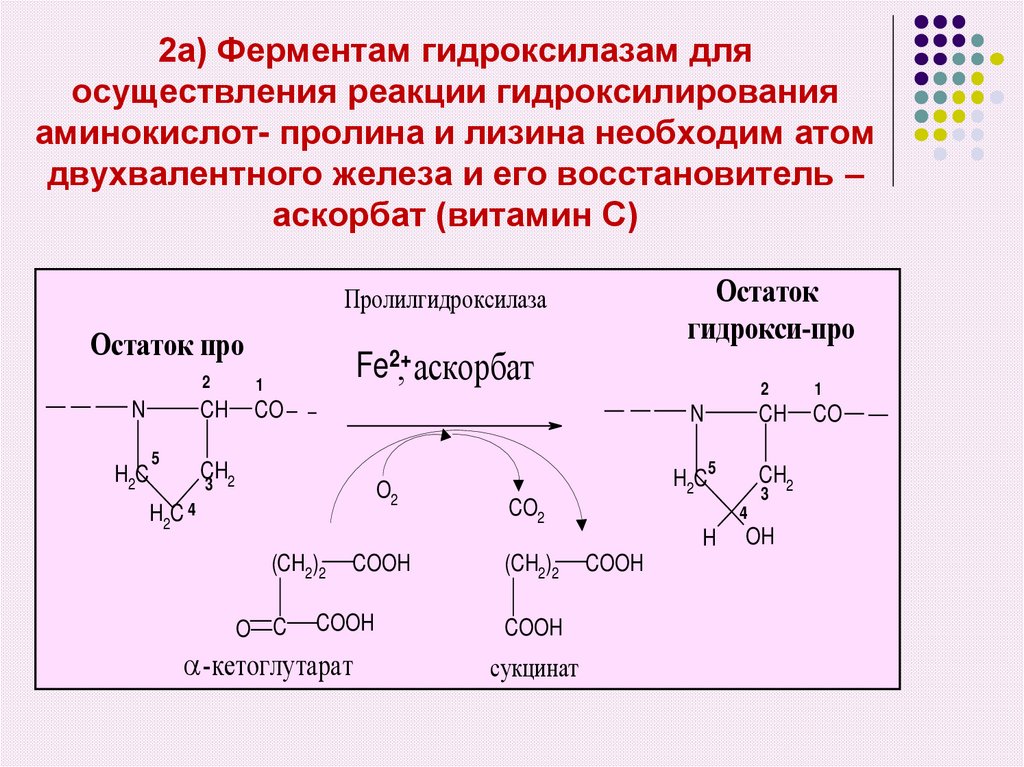
19. 2а) Ферментам гидроксилазам для осуществления реакции гидроксилирования аминокислот- пролина и лизина необходим атом
двухвалентного железа и его восстановитель –аскорбат (витамин С)
Остаток
гидрокси-про
Пролилгидроксилаза
Остаток про
N
H2C
5
Fe2+, аскорбат
2
1
CH
CO
N
CH
3 2
O2
C4
H2
H2C
5
CO2
O C
COOH
COOH
-кетоглутарат
(CH2)2
COOH
сукцинат
1
CH
CO
CH2
3
4
H
(CH2)2
2
COOH
OH
20. 3) Гликозилирование гидроксилизина под действием гликозилтрансфераз (присоединение углеводного компонента)
Углеводные компоненты связываются с гидроксилиномО - гликозидными связями. Чаще всего углеводными компонентами
являются глюкоза или дисахарид галактозилглюкоза.
21. 4) Формирование тройной спирали проколлагена
Каждая α – цепь проколлагена соединяетсяводородными связями с двумя другими α –
цепями проколлагена за счет гидроксипролина.
Образуются дисульфидные связи внутри- и
между полипептидных цепей. Дисульфидные
связи возникают между аминокислотными
остатками цистеина на С- и N- концах
проколлагена. Может дополнительно
гликозилироватся проколлаген.
Проколлаген
секретируется из клетки в
межклеточный матрикс
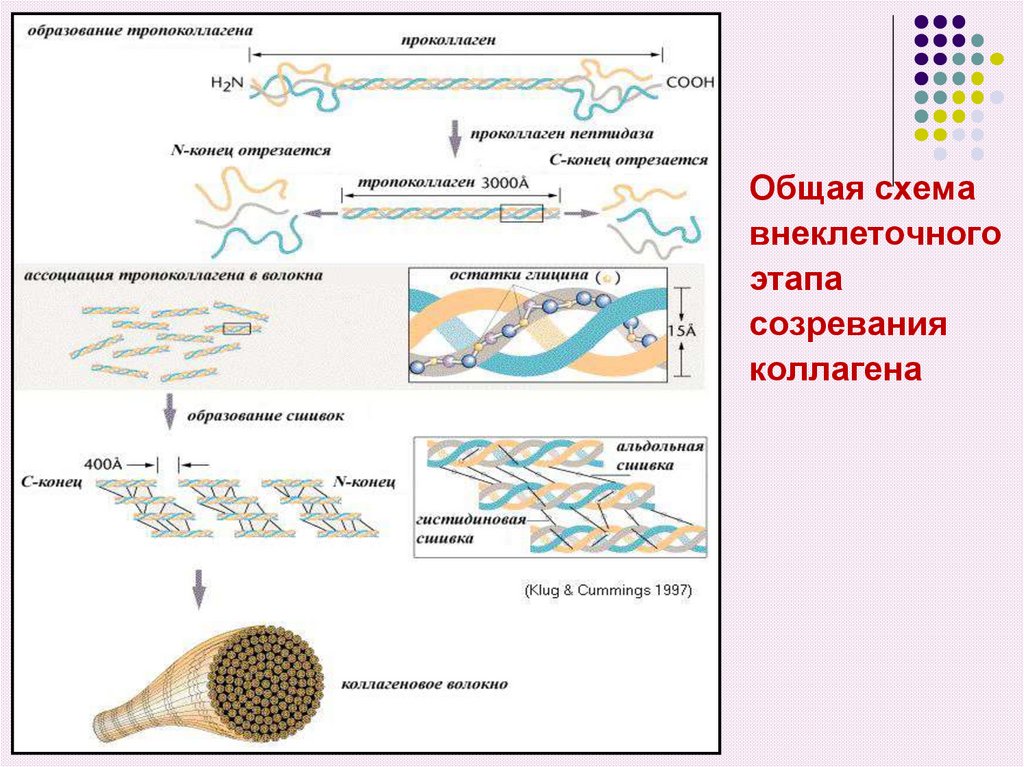
22. Внеклеточный этап созревания коллагена включает в себя ряд последовательных изменений проколлагена
1) Отщепление N – и С – концевых пептидов отпроколлагена под действием специфических
протеиназ приводит к образованию тропоколлагена
23. 2) Формирование фибрилл коллагена
Из сформировавшихся молекул тропоколлагенапроисходит сборка коллагеновых фибрилл, в которых
одна нить тропоколлагена сдвинута по отношению к
другой примерно на ¼ своей длины. На стыках
молекулы тропоколлагена не примыкают друг другу
вплотную, между ними остается просвет длиной в 3540 нм. В твердых тканях эти просветы выполняют
роль центров минерализации
Такое расположение
повышает прочность
фибрилл коллагена
на растяжение
24. 3) Стабилизация и укрепление фибрилл коллагена
Гидроксипролин и гидроксилизин играют важнуюроль в образовании фибрилл.
ОН – группы гидроксипролина соседних цепей
тропоколлагена образуют водородные связи,
укрепляющую структуру фибрилл
Радикалы лизина, гидроксилизина и аллизина
обеспечивают поперечные сшивки (связи) между
молекулами тропоколлагена
25.
Образование аллизинаДля создания укрепляющих сшивок фермент
лизилоксидаза катализирует реакцию превращения
аминогрупп отдельных лизильных и
гидроксилизильных остатков в альдегидные
группы и образование аллизина в тропоколлагене
Остаток лизина
Остаток аллизина
NH
H
C
лизилоксидаза,
(CH2)4
NH
Cu2+
H
NH2
C
O
(CH2)3
C
H
O
C
O2
O
NH3+ H2O
C
26.
Возникшие альдегидные производные(аллизины) участвуют в образовании
ковалентных связей, которые
стабилизируют фибриллы коллагена.
Альдольная сшивка –
аллизин + аллизин
Альдиминная сшивка –
лизин + аллизин
Образуются сшивки между молекулами
тропоколлагена, стабилизирующие
фибриллы коллагена
27.
28. На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок,
которые изображены в виде стрелокТрехспиральные
молекулы
тропоколлагена
Гидроксигруппы
Внутри и
межмолекулярные
сшивки
Углеводные
компоненты
29.
Общая схемавнеклеточного
этапа
созревания
коллагена
30. Коллагеновые фибриллы формируют коллагеновые волокна разной толщины Фибриллы укладываются параллельно друг другу и далее
объединяются в коллагеновое волокно31. Уникальные свойства коллагенов
Коллагеновые волокна обладают огромнойпрочностью и практически нерастяжимы. Они
могут выдерживать нагрузку в 10 000 раз
превышающую их собственный вес.
Именно поэтому большое количество
коллагеновых волокон, состоящих из
коллагеновых фибрилл, входит в состав кожи,
сухожилий, хрящей и костей
32. Катаболизм коллагена
Распад нативного коллагена происходитмедленно под действием коллагеназы (Znзависимой). Коллагеназа расщепляет
пептидные связи между остатками глицина и
лейцина в трех цепях тропоколлагена.
Образующиеся фрагменты спонтанно
денатурируют и становятся доступными для
действия других протеолитических
ферментов.
33. Основной маркер распада коллагена
Важнейший метаболитом характеризующимскорость распада коллагена является
гидроксипролин.
Повышение содержания гидроксипролина в плазме
крови и в моче свидетельствует о нарушениях
созревания коллагена. 85-90% этой аминокислоты
освобождается в результате гидролиза белка.
Нарушения синтеза и распада коллагена может
приводить к развитию паталогий (коллагенозы и
фиброзы).
С- и N- пептиды, образующиеся при распаде
коллагена могут служить маркерами распада
коллагена I типа.
34. Типы коллагена
В настоящее время известно около 20 различныхтипов коллагена, различающихся по первичной и
пространственной структурам, по функциям,
локализации в организме и биологической роли
Различают два основных типа цепей коллагена:
α1 и α2,
а также четыре разновидности цепи α1:
α1(I), α1(II), α1(III), α1(IV).
Для обозначения каждого вида коллагена
пользуются формулой,
Например: коллаген I типа - [α1(I)]2 α2
35. Наиболее распространенные типы коллагенов
ТипФормула
Распределение
в тканях
Характерные
особенности
Кожа, сухожилия,
кости, дентин
1%-гидроксипролина
13%-пролина
Мало гликозилирован
I
[α1(I)]2 α2
II
[α1(II)]3
Хрящи
>1% гидроксилизина
Сильно гликозилирован
III
[α1(III)]3
Кожа, матка,
десна,
кровеносные
сосуды
Много гидроксипролина
Мало гидроксилизина
Мало гликозилирован
IV
[α1(IV)]2 α2
Базальные
мембраны
Очень много
гидрокcипролина
Мало аланина
Почти полностью
гликозилирован
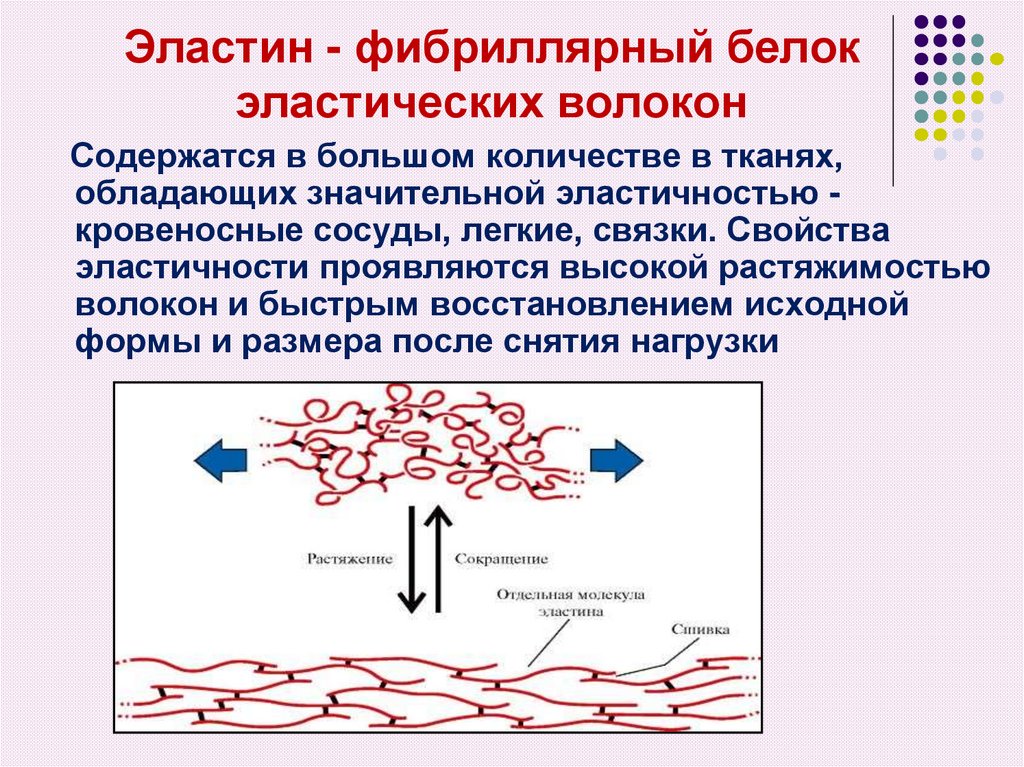
36. Эластин - фибриллярный белок эластических волокон
Содержатся в большом количестве в тканях,обладающих значительной эластичностью кровеносные сосуды, легкие, связки. Свойства
эластичности проявляются высокой растяжимостью
волокон и быстрым восстановлением исходной
формы и размера после снятия нагрузки
37. Особенности аминокислотного состава эластина
Эластин – гликопротеин с молекулярной массой70 кД, содержит много гидрофобных
аминокислот – глицина (25%), аланина (20%),
лизина, валина, лейцина и пролина.
Наличие гидрофобных радикалов препятствует
созданию вторичной и третичной структуры, в
результате молекулы эластина принимают
различные конформации в межклеточном
матриксе
38. Структура эластина
Нативные волокна эластина сединяются в тяжи с помощьюжестких поперечных сшивок – десмозина и изодесмозина, а
также лизиннорлейцина. В образовании этих сшивок
участвуют остатки аллизина и лизина двух, трех и четырех
пептидных цепей. Связывание полипептидных цепей
десмозинами формирует резиноподобную сеть.
39. Неколлагеновые белки межклеточного матрикса
К этой группе белков относятся адгезивные белки,такие как фибронектин, ламинин, нидоген,
интегрины и другие белки.
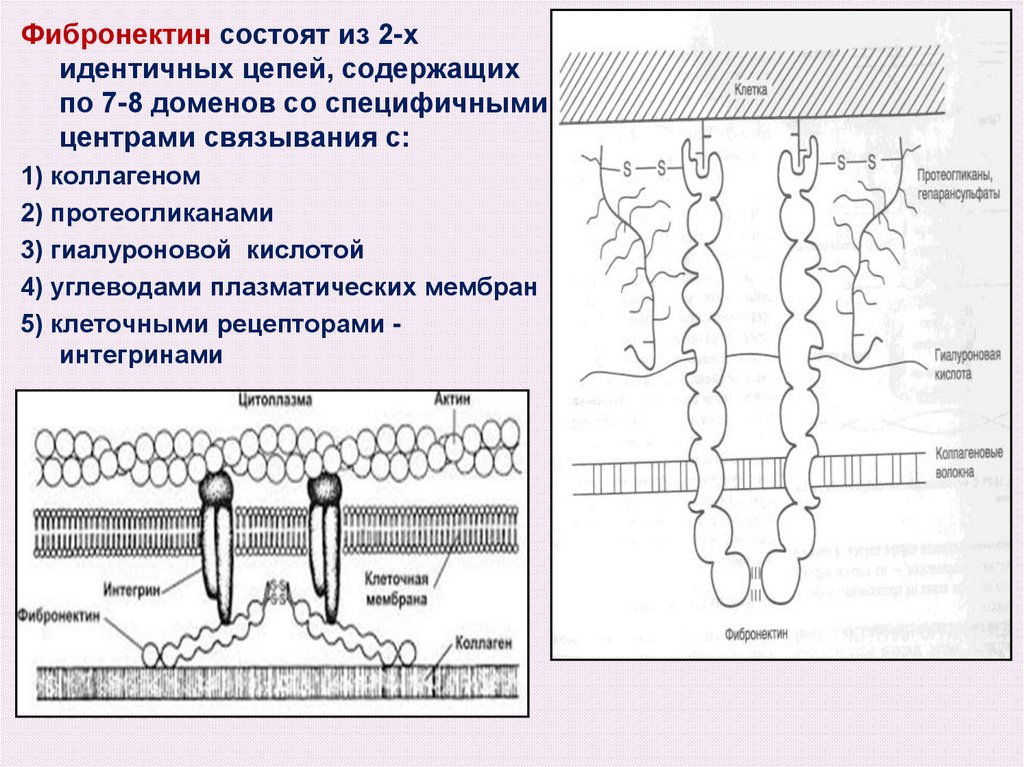
Фибронектин – адгезивный белок, выполняющий
интегрирующую роль в организации ВКМ и
регуляторную роль в дифференцировки и делении
фибробластов. Фибронектин называют
«молекулярным клеем», синтезируется, в основном,
фибробластами.
Содержит последовательность Арг-Гли-Асп (RGD) c
помощью которой он может присоединятся к
интегринам - клеточным рецепторам и может
передавать информацию как внутрь, так и наружу
клеток.
40.
Фибронектин состоят из 2-хидентичных цепей, содержащих
по 7-8 доменов со специфичными
центрами связывания с:
1) коллагеном
2) протеогликанами
3) гиалуроновой кислотой
4) углеводами плазматических мембран
5) клеточными рецепторами интегринами
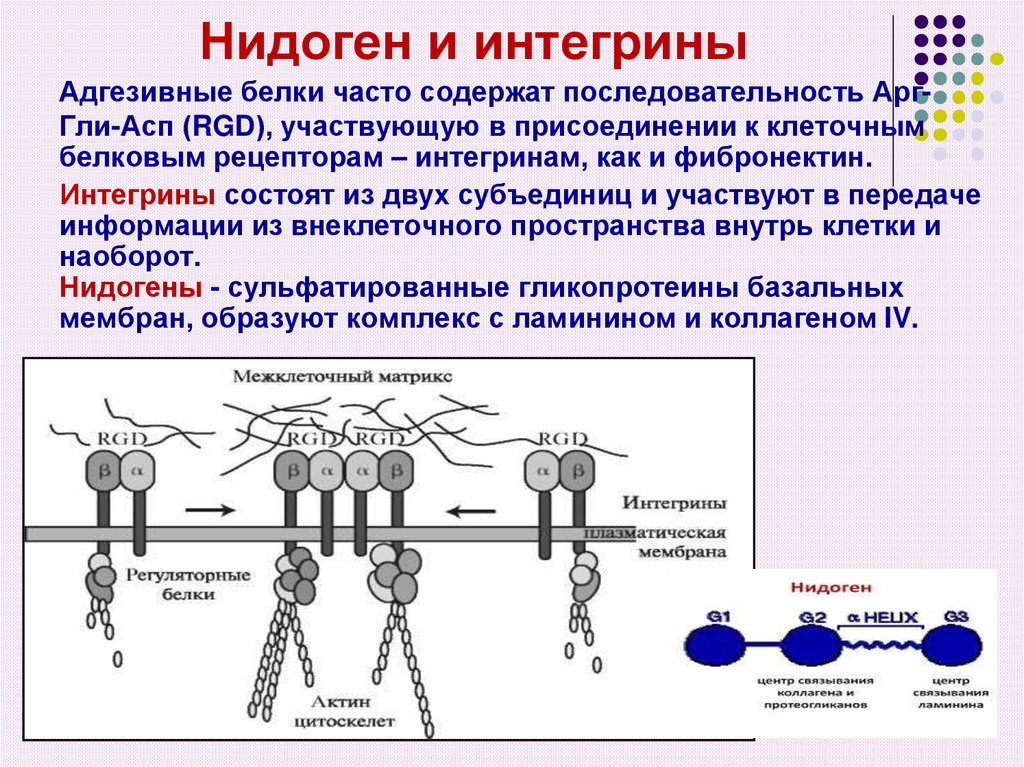
41. Нидоген и интегрины
Адгезивные белки часто содержат последовательность АргГли-Асп (RGD), участвующую в присоединении к клеточнымбелковым рецепторам – интегринам, как и фибронектин.
Интегрины состоят из двух субъединиц и участвуют в передаче
информации из внеклеточного пространства внутрь клетки и
наоборот.
Нидогены - сульфатированные гликопротеины базальных
мембран, образуют комплекс с ламинином и коллагеном IV.
42. Ламинины – распространенные гликопротеины базальных мембран, отделяющих соединительную ткань от эпителия
Ламинины содержит несколько центровсвязывания с разными молекулами
межклеточного матрикса и рецепторами клеток.
Связывают компоненты базальных мембран коллаген IV, эластин, нидоген, протеогликаны,
фибронектин.
N-концевые группы ламинина могут присоединять
кальций и образовывать сетевидные структуры с
помощью кальций-зависимого взаимодействия.
Ламинины выступают в роли факторов адгезии,
роста и дифференцировки клеток.
43. Ламинин состоит из трех полипептидных цепей (a и 2-х β цепей), которые укладываются в пространстве в крестообразную форму
44. Фибриллин
Это гликопротеин , который необходим дляобразования эластичных волокон в
соединительной ткани. Фибриллин
секретируется во внеклеточный матрикс
фибробластами и включается в
нерастворимые микрофибриллы, которые,
по-видимому, обеспечивают основу для
отложения эластина.
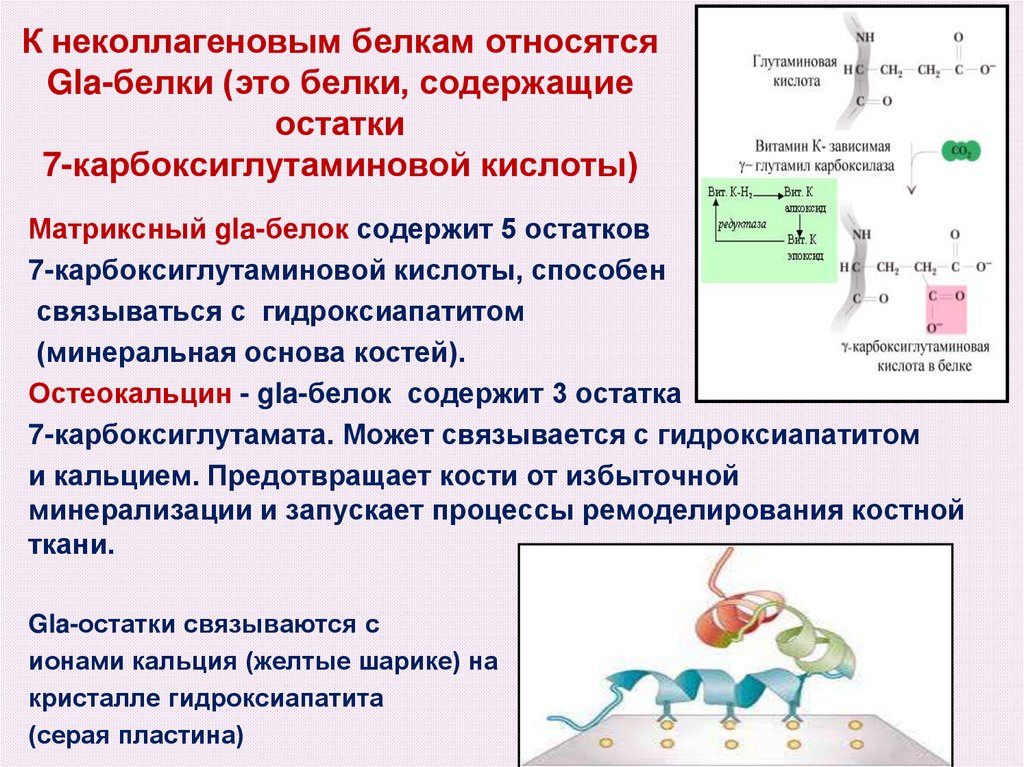
45. К неколлагеновым белкам относятся Gla-белки (это белки, содержащие остатки 7-карбоксиглутаминовой кислоты)
Матриксный gla-белок содержит 5 остатков7-карбоксиглутаминовой кислоты, способен
связываться с гидроксиапатитом
(минеральная основа костей).
Остеокальцин - gla-белок содержит 3 остатка
7-карбоксиглутамата. Может связывается с гидроксиапатитом
и кальцием. Предотвращает кости от избыточной
минерализации и запускает процессы ремоделирования костной
ткани.
Gla-остатки связываются с
ионами кальция (желтые шарике) на
кристалле гидроксиапатита
(серая пластина)
46. Протеогликаны
Молекулы протеогликанов участвуют в сборкемежклеточного матрикса, облегчают фиксацию клеток и
регулируют их рост. Протеогликаны могут образовывать
комплексы с коллагеном, адгезивными и другими белками,
защищая их своими углеводными компонентами от
действия ферментов. Протеогликаны участвуют в
регуляции активности сигнальных молекул и делятся на
большие (аггрекан и версикан) и малые (декорин, бигликан).
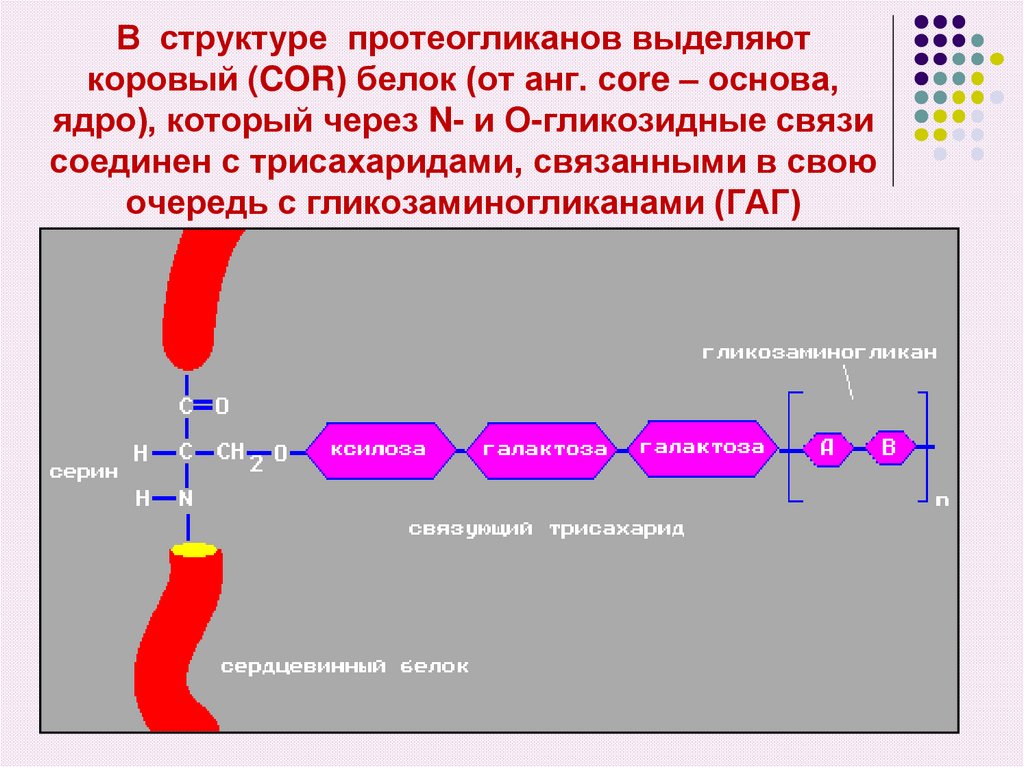
47.
В структуре протеогликанов выделяюткоровый (COR) белок (от анг. сore – основа,
ядро), который через N- и О-гликозидные связи
соединен с трисахаридами, связанными в свою
очередь с гликозаминогликанами (ГАГ)
48. В протеогликанах к гиалуроновой кислоте прикрепляется коровый белок, а к нему гликозаминогликаны
Гиалуроновая кислота - полимер, состоящий изостатков D-глюкуроновой кислоты и Nацетилглюкозамина (около 25.000
дисахаридов), является связующей при
образовании агрегатов протеогликанов
Гликозами
Гликозаминогликаны – гетерополисахариды,
ногликаны
состоящие из повторяющихся дисахаридов, в
(ГАГ)
состав которых могут входить глюкуроновая
кислота и N-ацетилглюкозамин или N –
ацетилгалактозамин.
В составе протеогликанов входят
сульфатированные и несульфатированные
ГАГ. Самые распространенные
сульфатированные ГАГ в организме человека –
хондроитинсульфаты, кератинсульфаты и Коровый белок
дерматансульфаты.
49. Хондроитинсульфат построен из глюкуроновой кислоты и сульфатированного N–ацетилгалактозамина
50. Дисахаридный фрагмент дерматансульфата
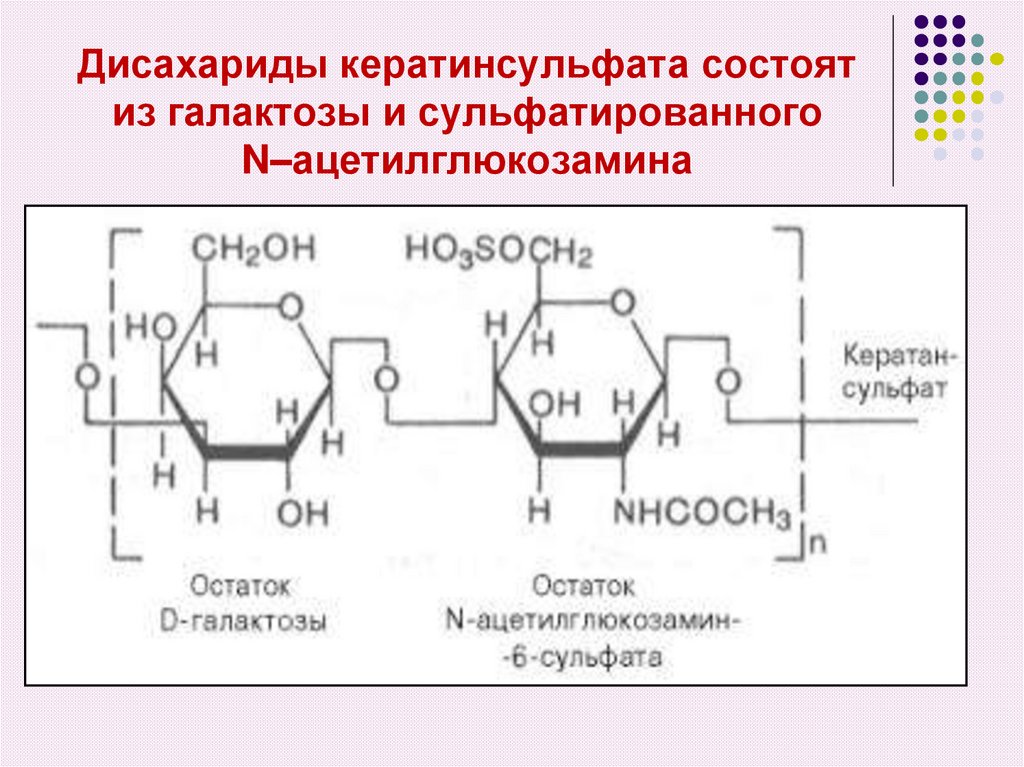
51. Дисахариды кератинсульфата состоят из галактозы и сульфатированного N–ацетилглюкозамина
52. Функции гликозаминогликанов
- участвуют в организации межклеточногоматрикса, являются основным скрепляющим
веществом
- взаимодействуют с клеточными мембранами,
обеспечивая межклеточные коммуникации
- образуют гелеподобную среду, в которой
погружены фибриллярные и адгезивные белки.
- могут связывать большое количество воды,
сильно набухают, тем самым придают
внеклеточному матриксу высокую вязкость
(желеобразные свойства).
53. Метаболизм протеогликанов
Синтез протеогликанов начинается с синтеза коровогобелка в клетках соединительной ткани, далее к нему
присоединяются ГАГ, синтезированные в аппарате
Гольджи и образовавшийся протеогликан выходит из
клетке в внеклеточный матрикс.
Распад протеогликанов происходит в внеклеточном
матриксе соединительной ткани под действием ферментов
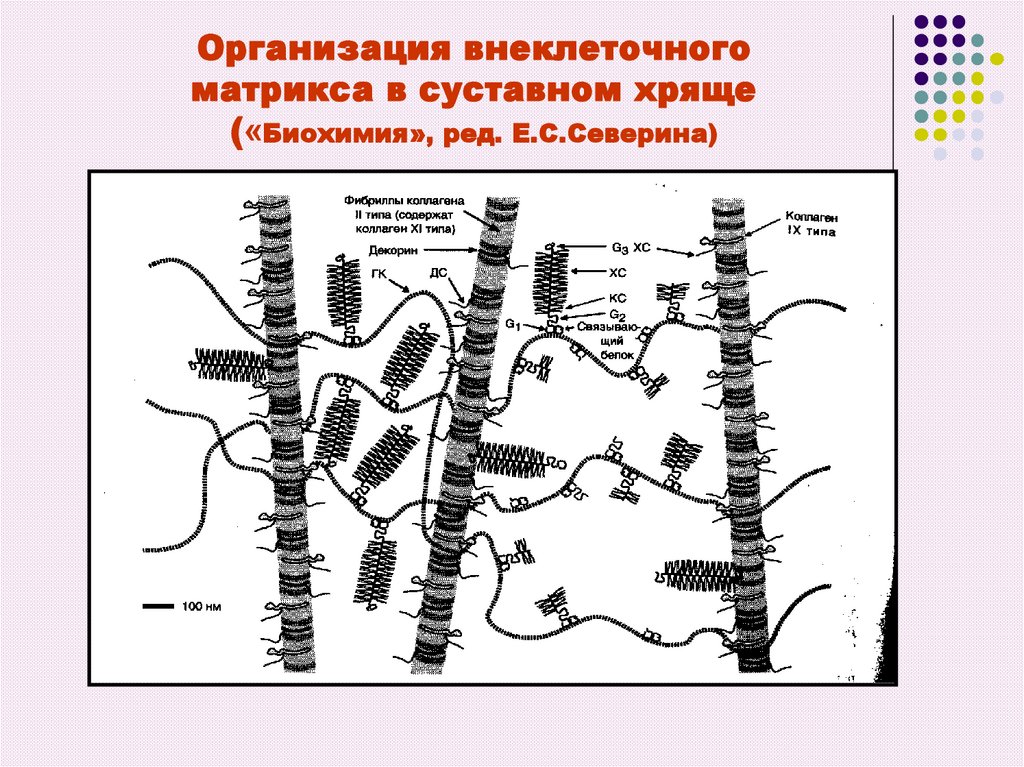
54. Организация внеклеточного матрикса в суставном хряще («Биохимия», ред. Е.С.Северина)
55. Коллагеновые болезни (нарушение обмена коллагена) Несовершенный остеогенез – мутации в гене, кодирующем синтез коллагена I.
Самая неблагоприятная замена глицина на другуюаминокислоту – не образуется нормальная тройная спираль коллагена.
Признаки: ломкость костей, аномалии зубов, треугольная форма лица,
гиперподвижность суставов, голубые склеры.
Болезнь Книста – дефект коллагена II – укорочение цепей. Укорочение и
деформация конечностей, тугоподвижность суставов, кифосколиоз,
миопия высокой степени.
Синдром Вагнера – дефект коллагена II в стекловидном теле
синтезируется половина молекулы коллагена – прогрессирующая миопия,
отслойка сетчатки, патология суставов.
Синдром Элерса-Данло – дефект коллагена III, нарушается формирование
всего коллагенового волокна с соответствующими нарушениями
формирования скелета, зубного ряда и т.д. У этих больных коллаген
отличается необычайно высокой растворимостью, в результате
изменений в соединительной ткани больные обладают хрупкой кожей и
чрезмерно подвижными суставами.
Синдром Альпорта – дефект коллагена IV - нарушение образования
базальных мембран. Поражения почек, гематурия и протеинурия.








































 Биология
Биология








