Похожие презентации:
Электрокинетические явления. Коагуляция
1.
Кафедра общей и медицинской химииЛекция
Электрокинетические явления.
Коагуляция.
1
2.
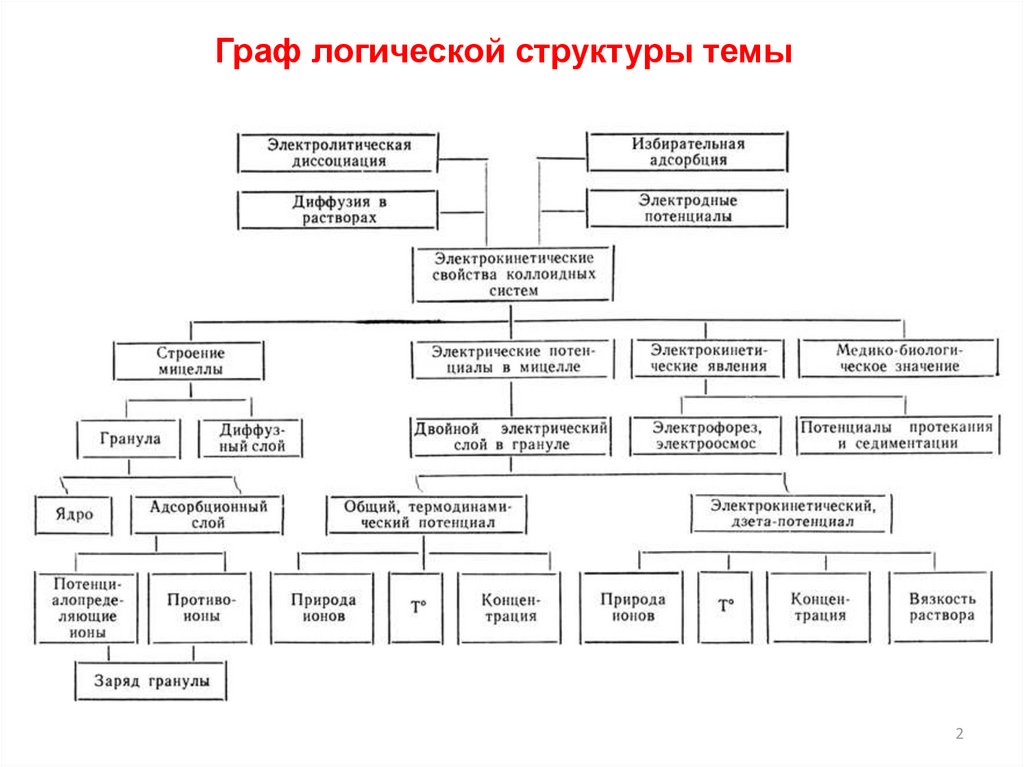
Граф логической структуры темы2
3. Двойной электрический слой
Наличие у частиц дисперсных систем электрическогозаряда было открыто ещё в 1808 году профессором
Московского университета Ф.Ф. Рейссом при изучении
явлений, которые получили названия электрофорез и
электроосмос.
Очевидно, что причина этих электрокинетических
явлений ( которые мы подробно рассмотрим) заключена в
противоположности знаков заряда твёрдой фазы и
жидкости.
С современной точки зрения заряд на коллоидных
частицах лиозолей, проявляющийся при электрофорезе,
обусловлен наличием двойного электрического слоя.
4.
Двойной электрический слойДвойным электрическим слоем (ДЭС) – называется
упорядоченное распределение противоположно заряженных
частиц на межфазной границе.
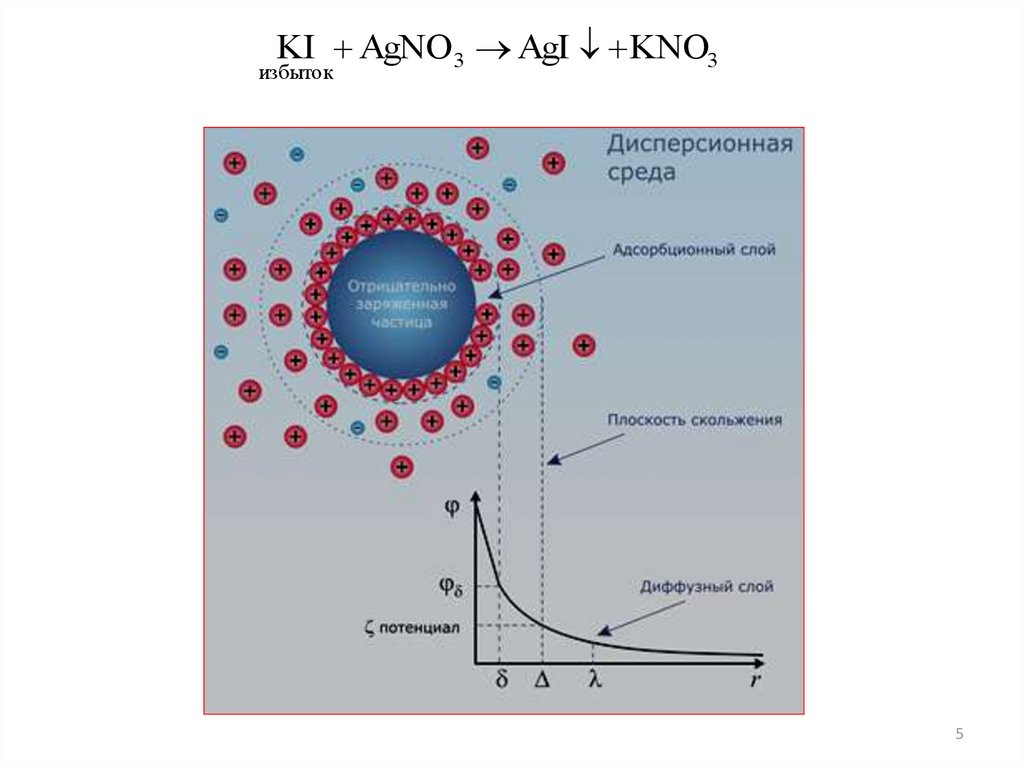
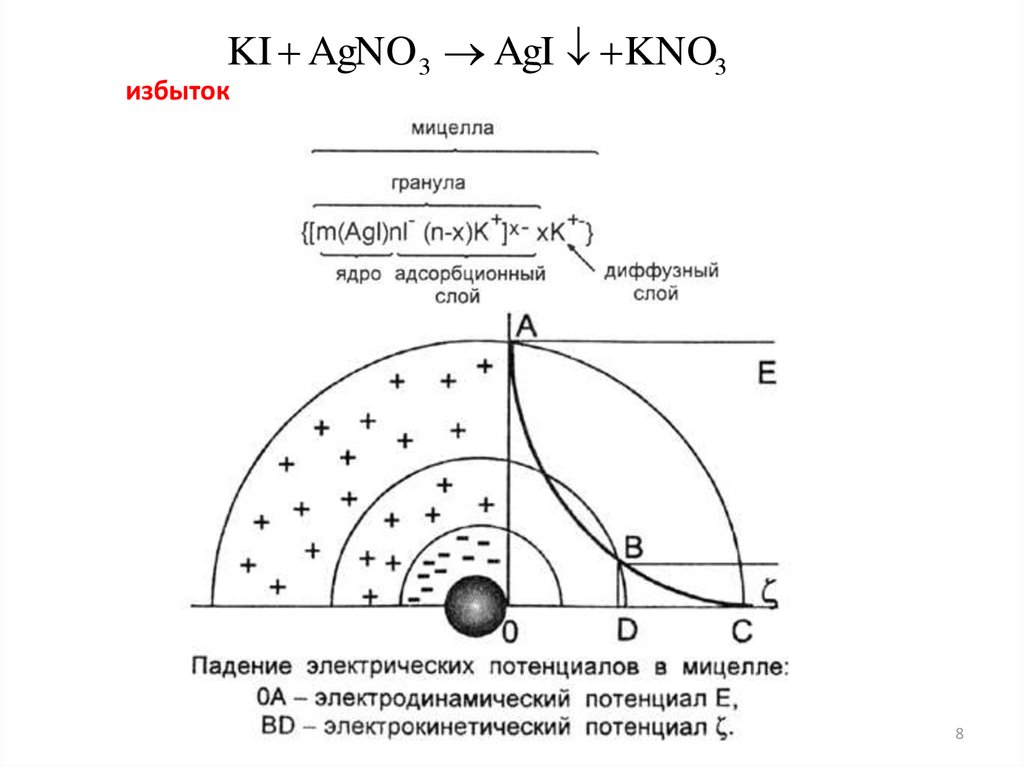
Рассмотрим возникновение ДЭС при образовании золя AgI.
Сливаем два раствора AgNO3 и KI, причём один обязательно
в избытке:
KI AgNO 3 AgI KNO3
избыток
Явления, приводящие к образованию ДЭС на поверхности
частицы дисперсной фазы:
1. Избирательная адсорбция (по правилу Панета –Фаянса).
Адсорбируется I-, находящийся в растворе в избытке и
входящий в состав кристаллической решётки AgI (агрегат).
В результате его адсорбции на поверхности образуется
отрицательный заряд и возникает φ –потенциал
(электродинамический). Ионы I- называются
потенциалопределяющими. Образуется ядро.
5.
KI AgNO 3 AgI KNO3избыток
5
6.
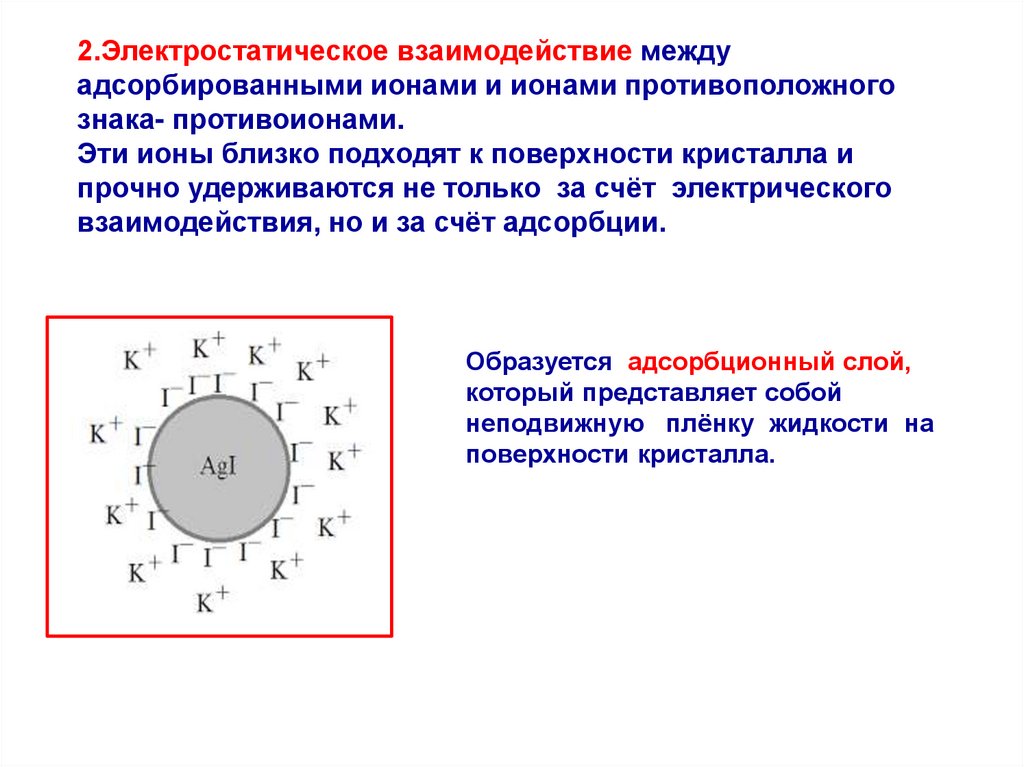
2.Электростатическое взаимодействие междуадсорбированными ионами и ионами противоположного
знака- противоионами.
Эти ионы близко подходят к поверхности кристалла и
прочно удерживаются не только за счёт электрического
взаимодействия, но и за счёт адсорбции.
Образуется адсорбционный слой,
который представляет собой
неподвижную плёнку жидкости на
поверхности кристалла.
7.
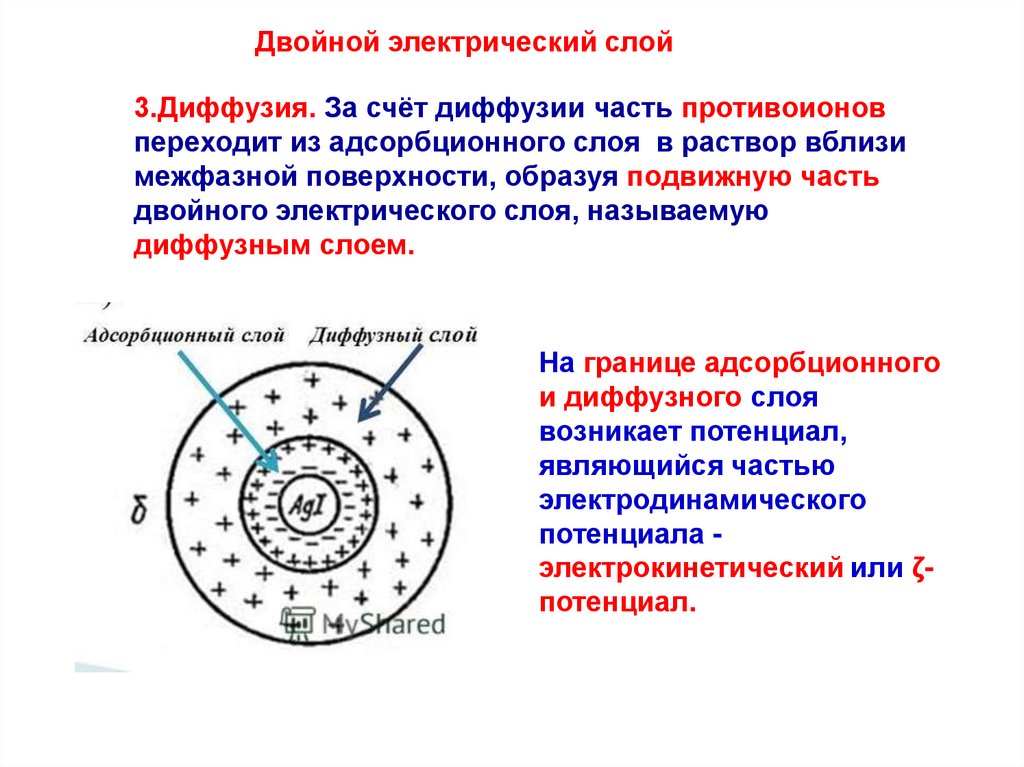
Двойной электрический слой3.Диффузия. За счёт диффузии часть противоионов
переходит из адсорбционного слоя в раствор вблизи
межфазной поверхности, образуя подвижную часть
двойного электрического слоя, называемую
диффузным слоем.
На границе адсорбционного
и диффузного слоя
возникает потенциал,
являющийся частью
электродинамического
потенциала электрокинетический или ζпотенциал.
8.
KI AgNO 3 AgI KNO3избыток
8
9.
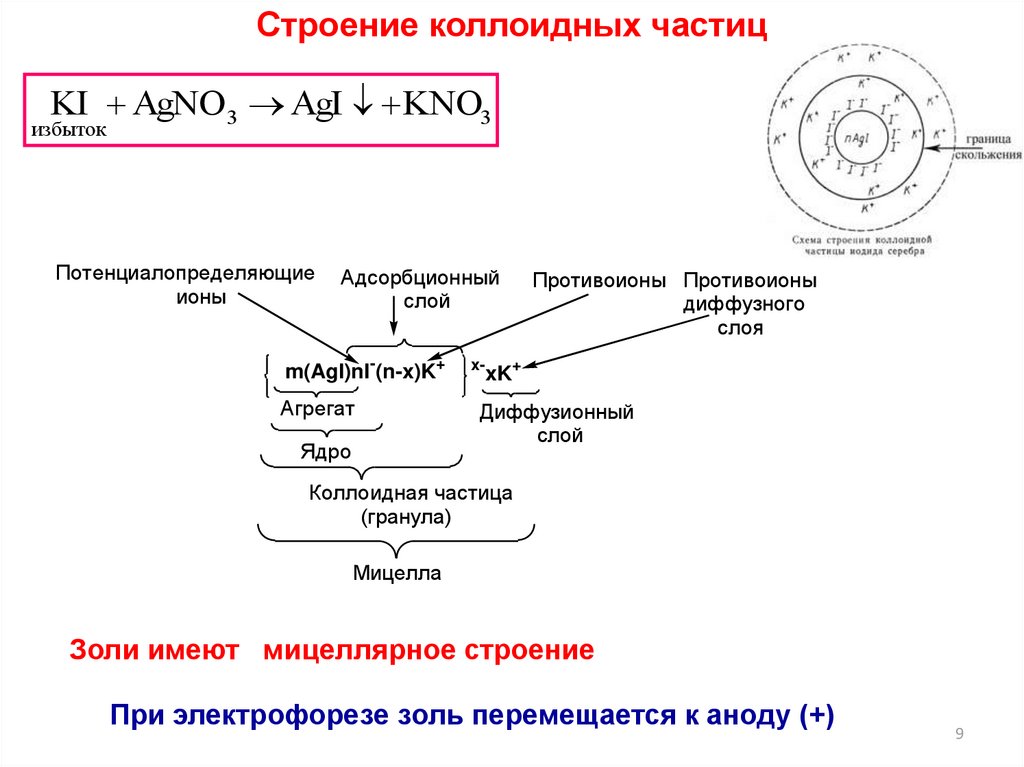
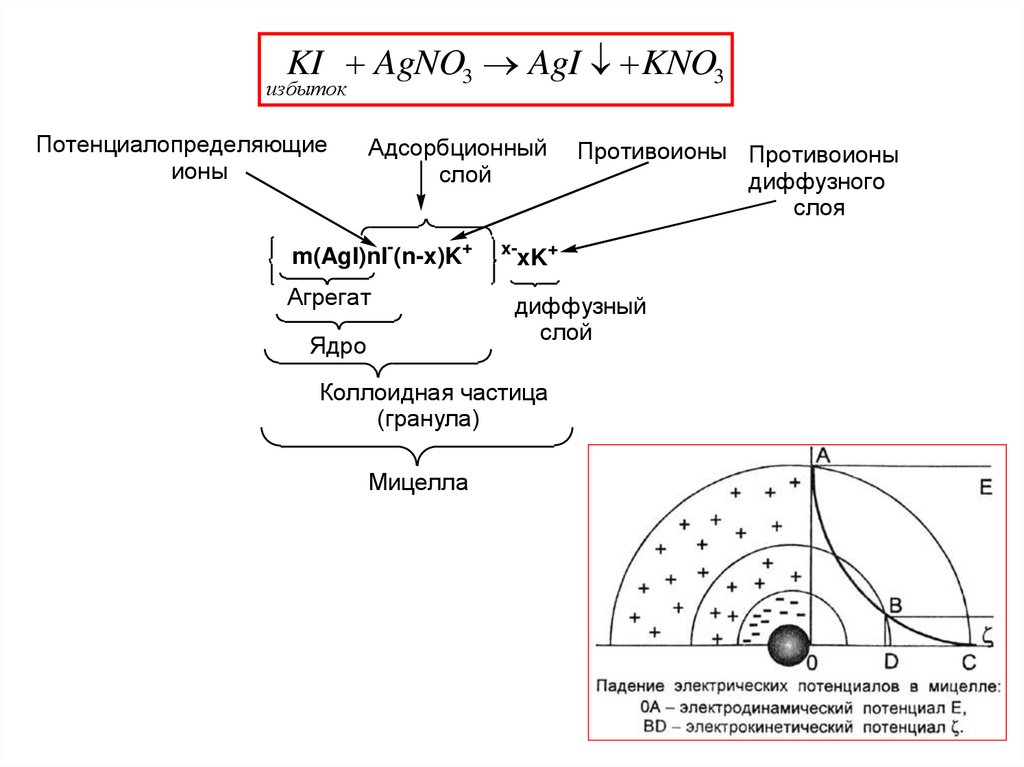
Строение коллоидных частицKI AgNO 3 AgI KNO3
избыток
Потенциалопределяющие
ионы
Адсорбционный
слой
m(AgI)nI-(n-x)K+
Агрегат
Ядро
x-
Противоионы Противоионы
диффузного
слоя
xK+
Диффузионный
слой
Коллоидная частица
(гранула)
Мицелла
Золи имеют мицеллярное строение
При электрофорезе золь перемещается к аноду (+)
9
10.
KI AgNO3 AgI KNO3избыток
Потенциалопределяющие
ионы
Адсорбционный
слой
m(AgI)nI-(n-x)K+
Агрегат
Ядро
x-
Противоионы Противоионы
диффузного
слоя
xK+
диффузный
слой
Коллоидная частица
(гранула)
Мицелла
10
11.
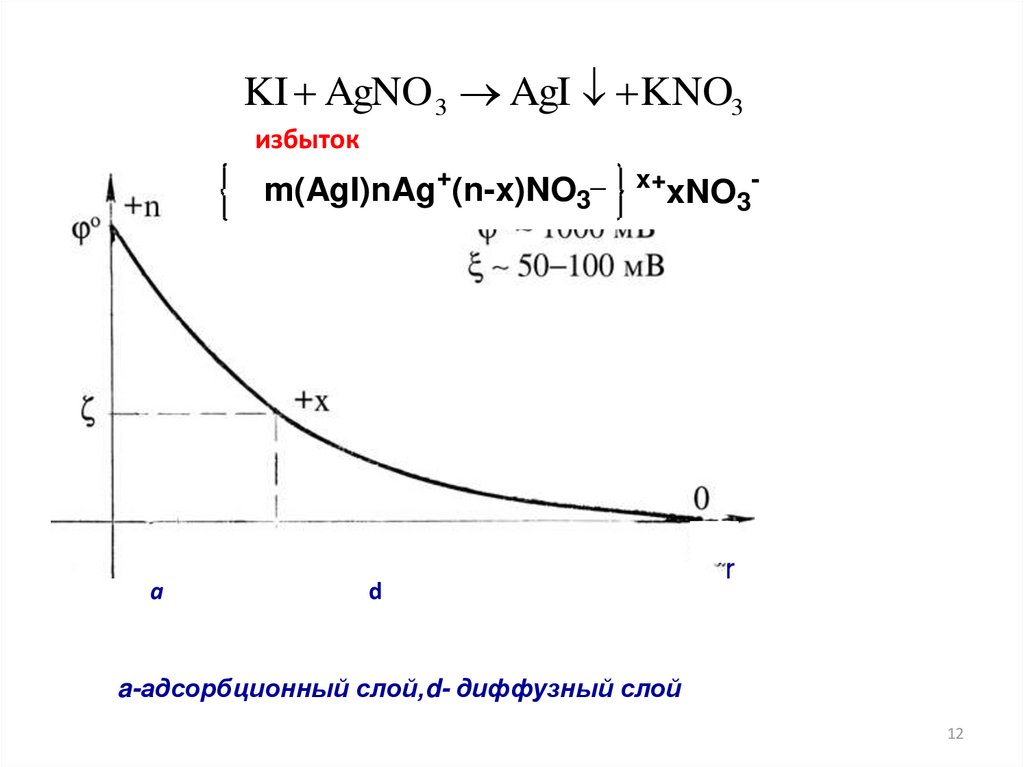
KI AgNO 3 AgI KNO3избыток
Потенциалопределяющие
ионы
Адсорбционный
слой
Противоионы
m(AgI)nAg+(n-x)NO3_
x+
Агрегат
Диффузный
слой
Ядро
Противоионы
диффузионного
слоя
xNO3-
Коллоидная частица
(гранула)
Мицелла
При электрофорезе золь перемещается к катоду (-)
11
12.
KI AgNO 3 AgI KNO3избыток
m(AgI)nAg+(n-x)NO3_
a
x+
xNO3-
d
r
a-адсорбционный слой,d- диффузный слой
12
13.
1. Электродинамический (электростатический) потенциалφ потенциал, соответствующий заряду потенциалопределяющих
ионов.
(определяет знак заряда гранулы!!!!)
2. Электрокинетический или ζ-потенциал - разность потенциалов
между подвижной (диффузной) и неподвижной (адсорбционной)
частью двойного электрического слоя.
Определяет величину заряда гранулы!!!!
Может быть обнаружен и измерен только при движении
дисперсной фазы относительно дисперсионной среды
Дзета-потенциал предохраняет гранулы от слипания, то есть
от коагуляции
13
14.
Формула мицеллы золя золота1) Реакции восстановления
2KAuO 2 3HCHO K 2CO3 2Au 3HCOOK KHCO3 H 2O
m[Au]nAuO (n x)K
2
x
xK .
15.
2. Реакции восстановления8KMnO 4 Na 2S2 O3 H 2 O 8MnO 2 3K 2SO 4 3Na 2SO 4 2KOH
m[MnO ]nMnO
2
4
(n x)K
мицелла MnO2
(при электрофорезе движется к аноду)
x
xK
15
16.
3.Реакции двойного обменаBa ( NO3 ) 2 K 2SO4 BaSO 4 2KNO3
избыток
m[BaSO ]nBa
4
2
2(n x)NO3
2x
3
2xNO
движется
к катоду
Ba ( NO3 ) 2 K 2SO4 BaSO 4 2KNO3
избыток
m[BaSO ]nSO
4
2
4
2(n x)K
2x
2xK
движется
к аноду
16
17.
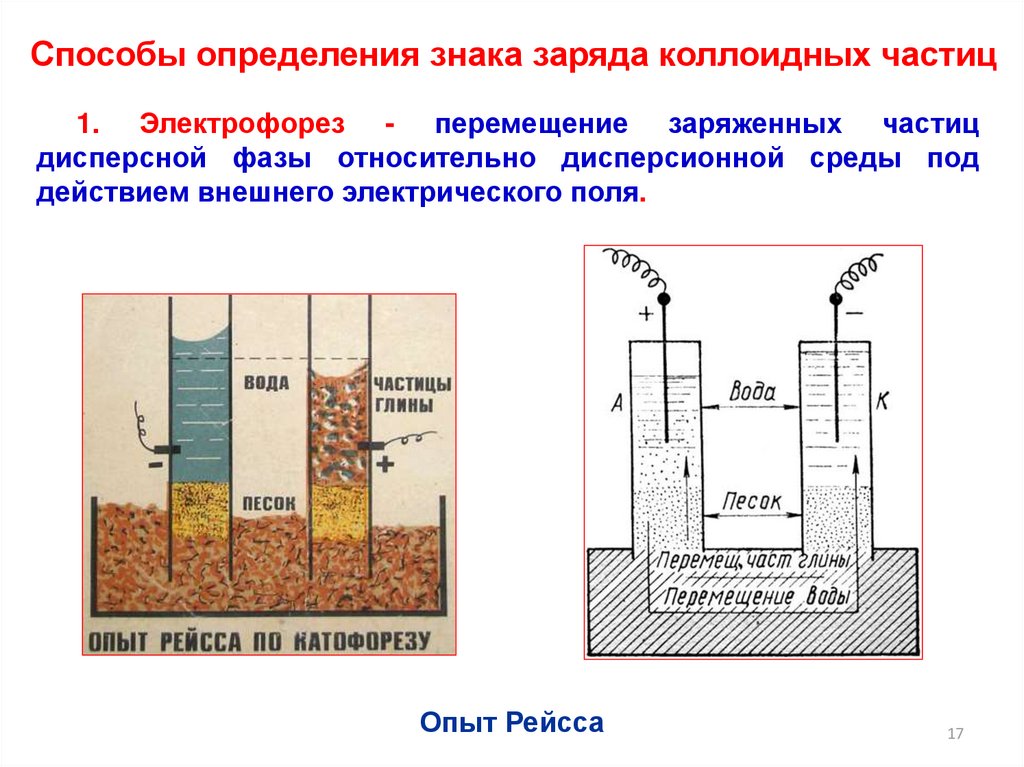
Способы определения знака заряда коллоидных частиц1. Электрофорез - перемещение заряженных частиц
дисперсной фазы относительно дисперсионной среды под
действием внешнего электрического поля.
Опыт Рейсса
17
18.
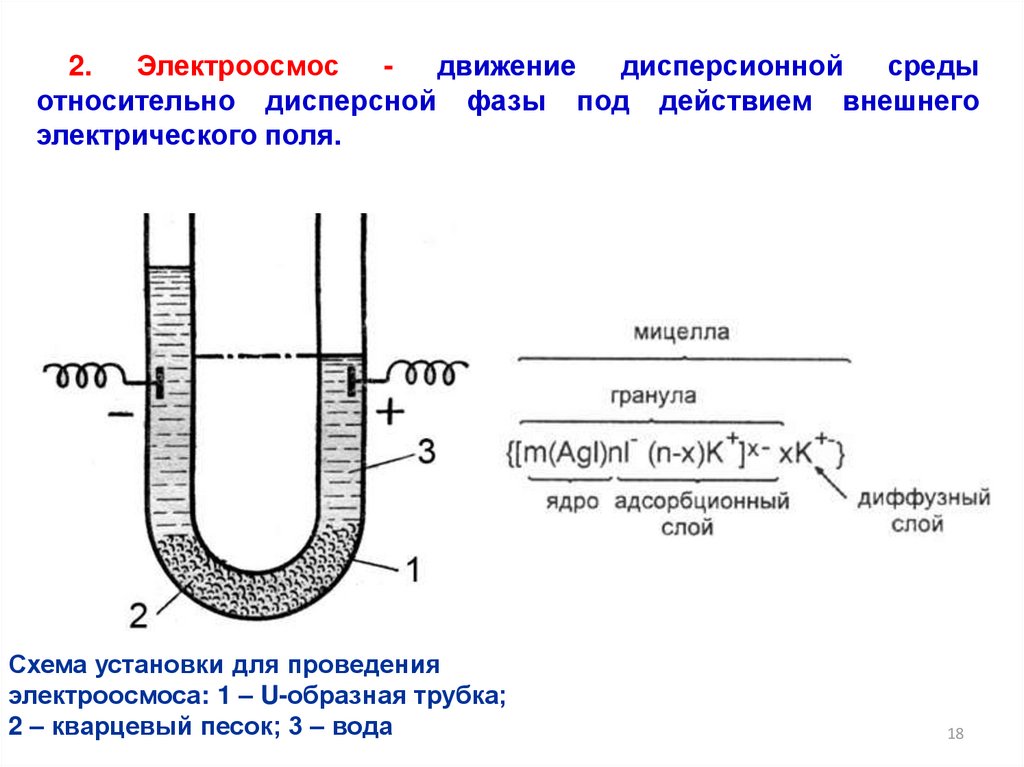
2.Электроосмос
движение
дисперсионной
среды
относительно дисперсной фазы под действием внешнего
электрического поля.
Схема установки для проведения
электроосмоса: 1 – U-образная трубка;
2 – кварцевый песок; 3 – вода
18
19.
3. По порогам коагуляции(Правило знака и валентности - Шульце-Гарди)
Коагуляцию коллоидных растворов вызывают любые ионы,
которые имеют знак заряда, противоположный заряду гранул.
Коагулирующее действие ионов (γ) тем сильнее, чем выше заряд
иона-коагулянта и пропорционально заряду в шестой степени:
1 : 2 : 3 1 : 2 : 3 1 : 64 : 729
6
6
6
или
Спор1 : Спор2 : Спор3
1 1 1
6 : 6 : 6 729 : 11 : 1
1 2 3
19
20.
4. Электрофоретический зондСостоит из спаянных медной и цинковой пластинок.
При погружении в коллоидный раствор пластинка меди
заряжается отрицательно, цинка - положительно.
Частицы положительно заряженных золей будут осаждаться на
медной пластинке, а возле цинкового электрода появится
тонкая светлая полоска
У отрицательно заряженного коллоида будет наблюдаться
обратное явление: светлая полоска растворителя появится у
медного электрода.
Отрицательно заряженный золь
берлинской лазури образует у медной
пластинки прозрачный слой
Zn(+)
Сu(-)
У цинковой пластинки появляется
интенсивно синяя окраска
20
21.
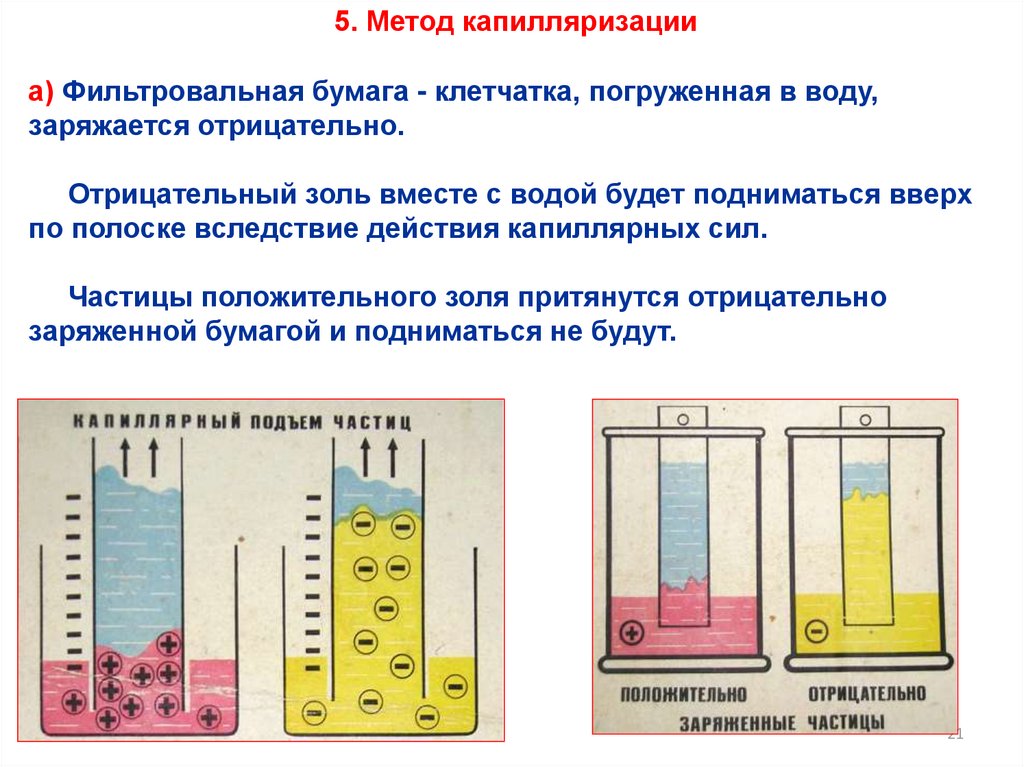
5. Метод капилляризацииа) Фильтровальная бумага - клетчатка, погруженная в воду,
заряжается отрицательно.
Отрицательный золь вместе с водой будет подниматься вверх
по полоске вследствие действия капиллярных сил.
Частицы положительного золя притянутся отрицательно
заряженной бумагой и подниматься не будут.
21
22.
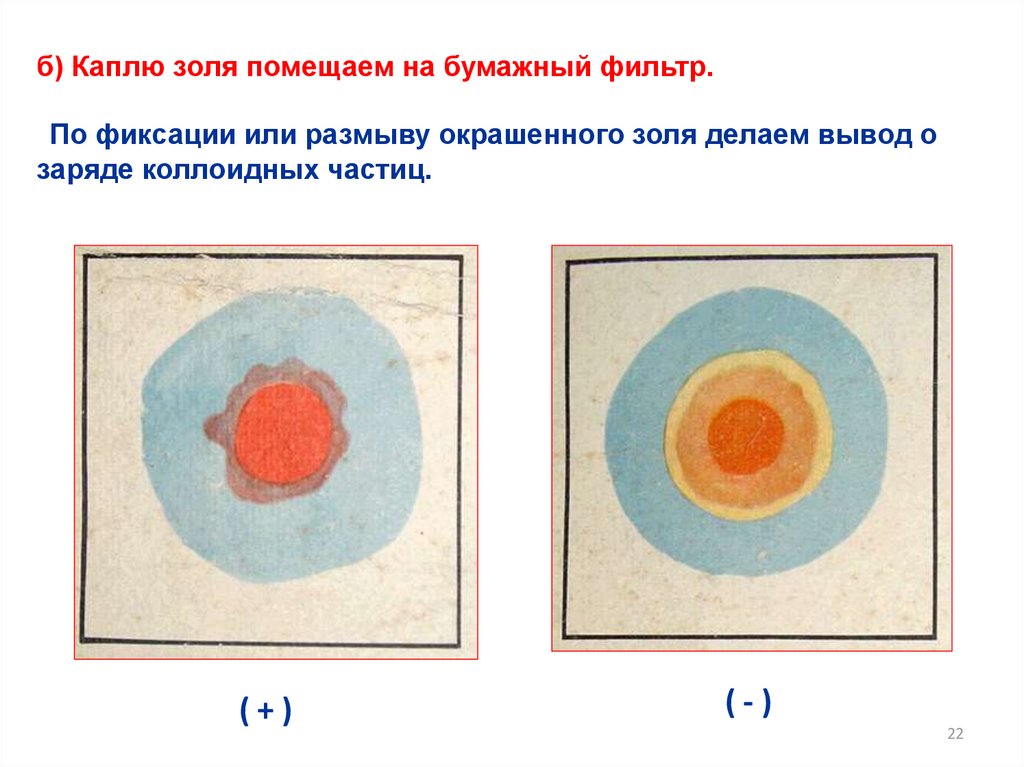
б) Каплю золя помещаем на бумажный фильтр.По фиксации или размыву окрашенного золя делаем вывод о
заряде коллоидных частиц.
(+)
(-)
22
23.
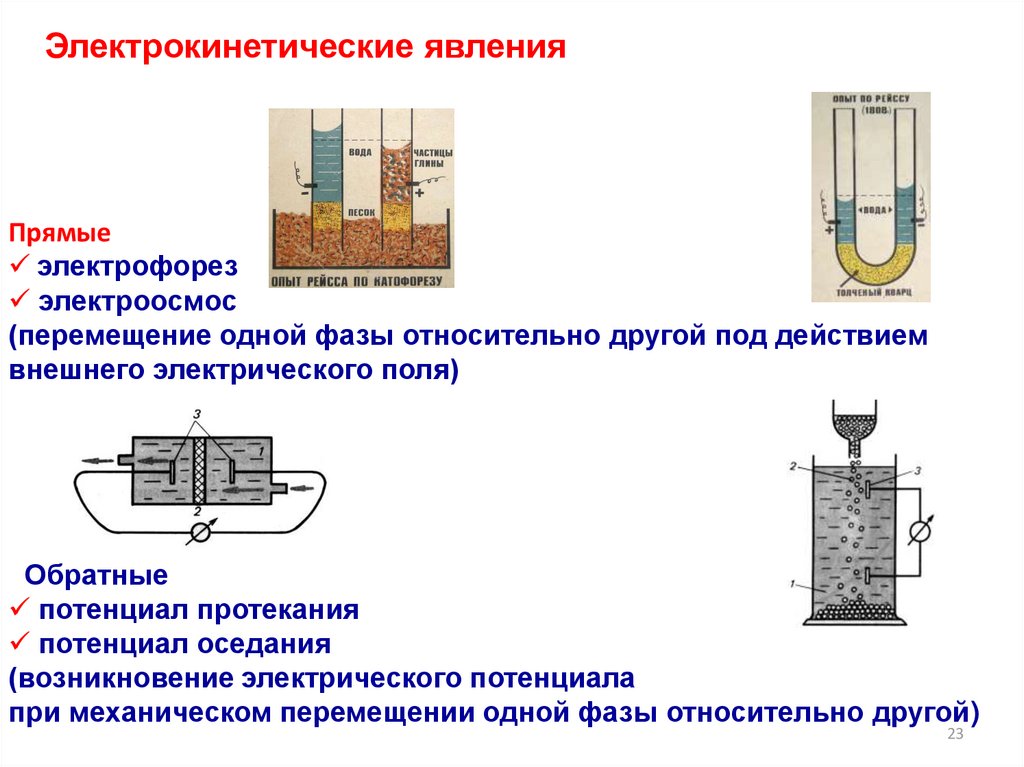
Электрокинетические явленияПрямые
электрофорез
электроосмос
(перемещение одной фазы относительно другой под действием
внешнего электрического поля)
Обратные
потенциал протекания
потенциал оседания
(возникновение электрического потенциала
при механическом перемещении одной фазы относительно другой)
23
24.
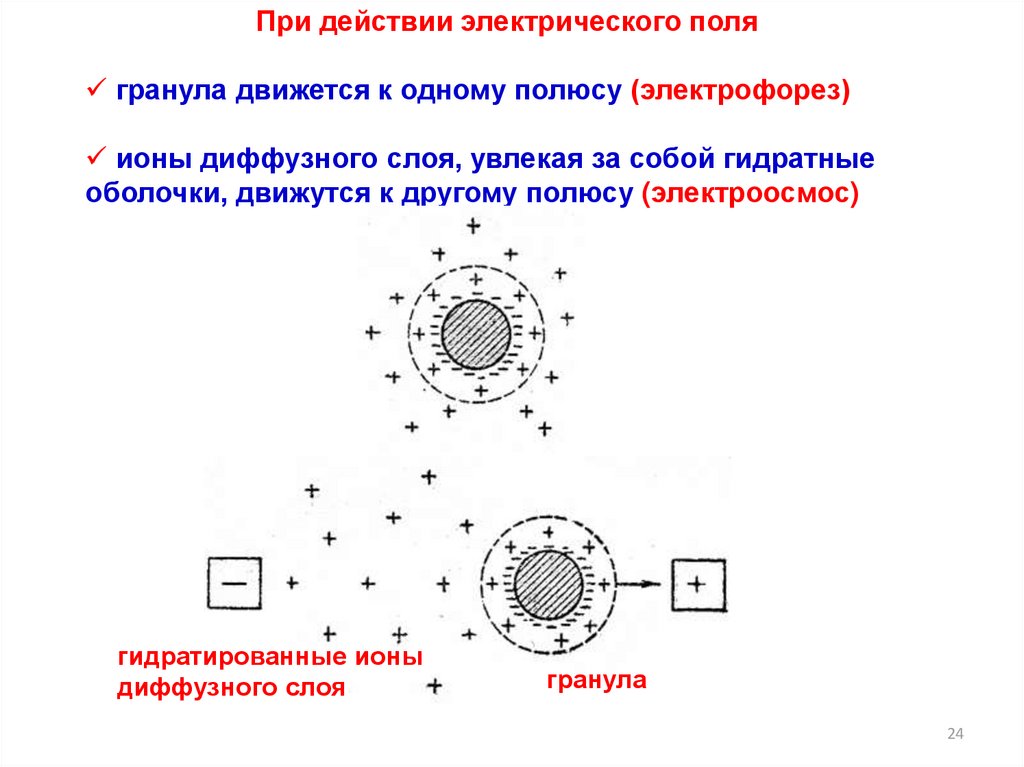
При действии электрического полягранула движется к одному полюсу (электрофорез)
ионы диффузного слоя, увлекая за собой гидратные
оболочки, движутся к другому полюсу (электроосмос)
гидратированные ионы
диффузного слоя
гранула
24
25.
Электрофорез- движение заряженных частиц дисперсной фазы относительно
неподвижной дисперсионой среды под действием внешнего
электрического поля.
1809 г. Ф.Ф. Рейсс изучал электрофорез на глине. Он показал, что при
наложении разности электрического потенциала на электроды,
опущенные в заполненные водой стеклянные трубки, воткнутые в кусок
сырой глины, жидкость в трубке с положительным полюсом мутнела, а в
трубке с отрицательным полюсом вода оставалась прозрачной.
25
26.
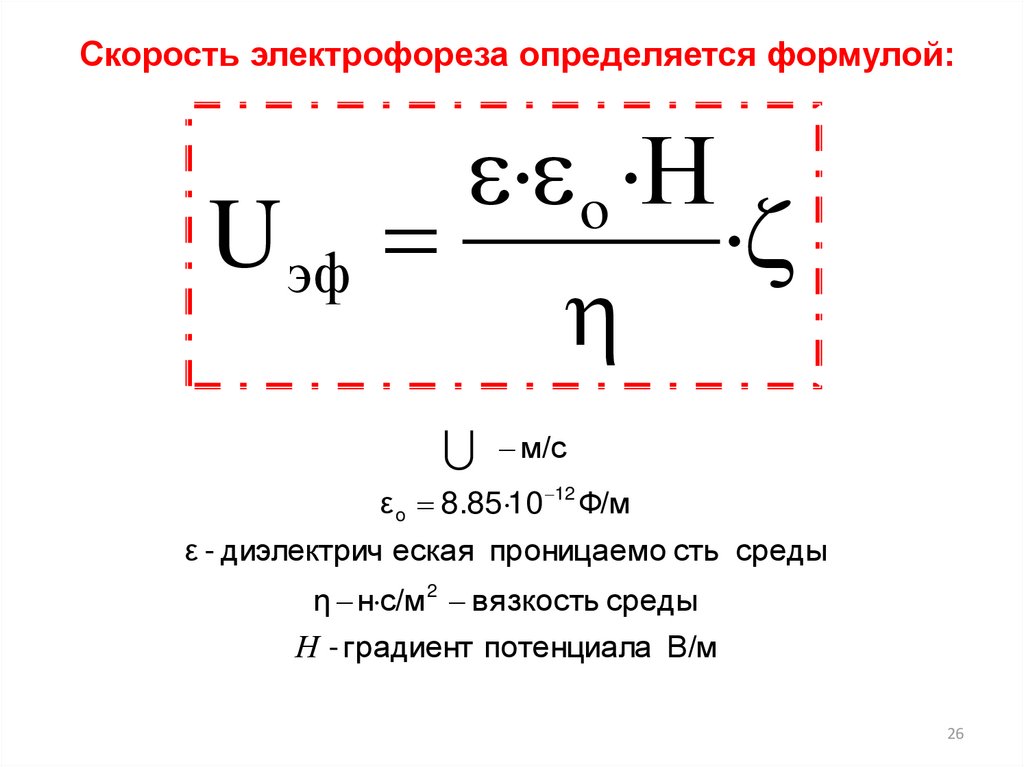
Скорость электрофореза определяется формулой:U эф
· o ·Н
·
м/с
ε o 8.85·10 12 Ф/м
ε - диэлектрич еская проницаемо сть среды
η н·с/м 2 вязкость среды
Н - градиент потенциала В/м
26
27.
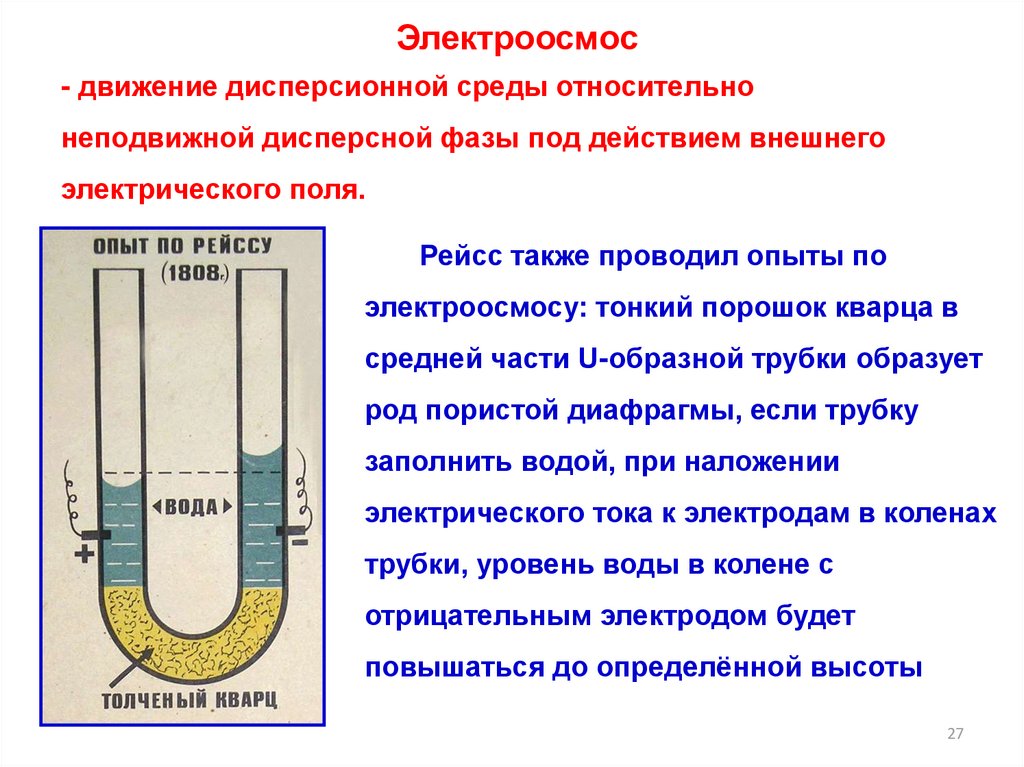
Электроосмос- движение дисперсионной среды относительно
неподвижной дисперсной фазы под действием внешнего
электрического поля.
Рейсс также проводил опыты по
электроосмосу: тонкий порошок кварца в
средней части U-образной трубки образует
род пористой диафрагмы, если трубку
заполнить водой, при наложении
электрического тока к электродам в коленах
трубки, уровень воды в колене с
отрицательным электродом будет
повышаться до определённой высоты
27
28.
Скорость электроосмоса определяется формулой:· o ·I
Vэо
·
o 8.85·10
12
Ф/м
-удельная электропроводность
28
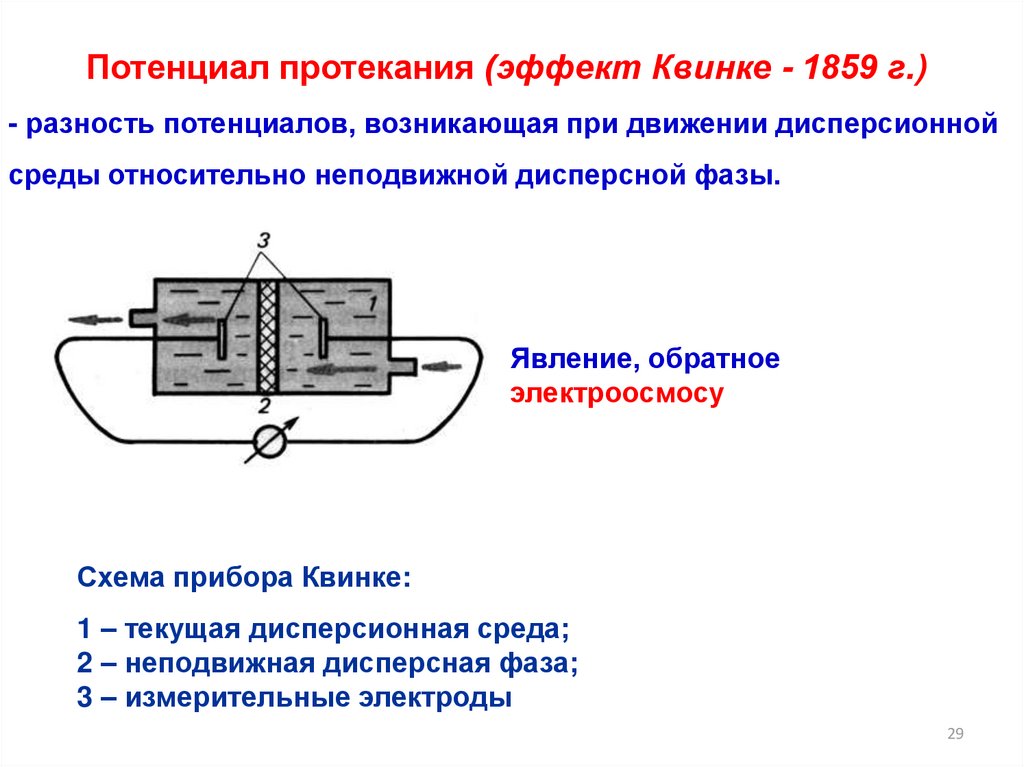
29.
Потенциал протекания (эффект Квинке - 1859 г.)- разность потенциалов, возникающая при движении дисперсионной
среды относительно неподвижной дисперсной фазы.
Явление, обратное
электроосмосу
Схема прибора Квинке:
1 – текущая дисперсионная среда;
2 – неподвижная дисперсная фаза;
3 – измерительные электроды
29
30.
E пот.протек.ε·εo·P
χ·η
Е - потенциал протекания
Р - давление
-удельная электропроводность
30
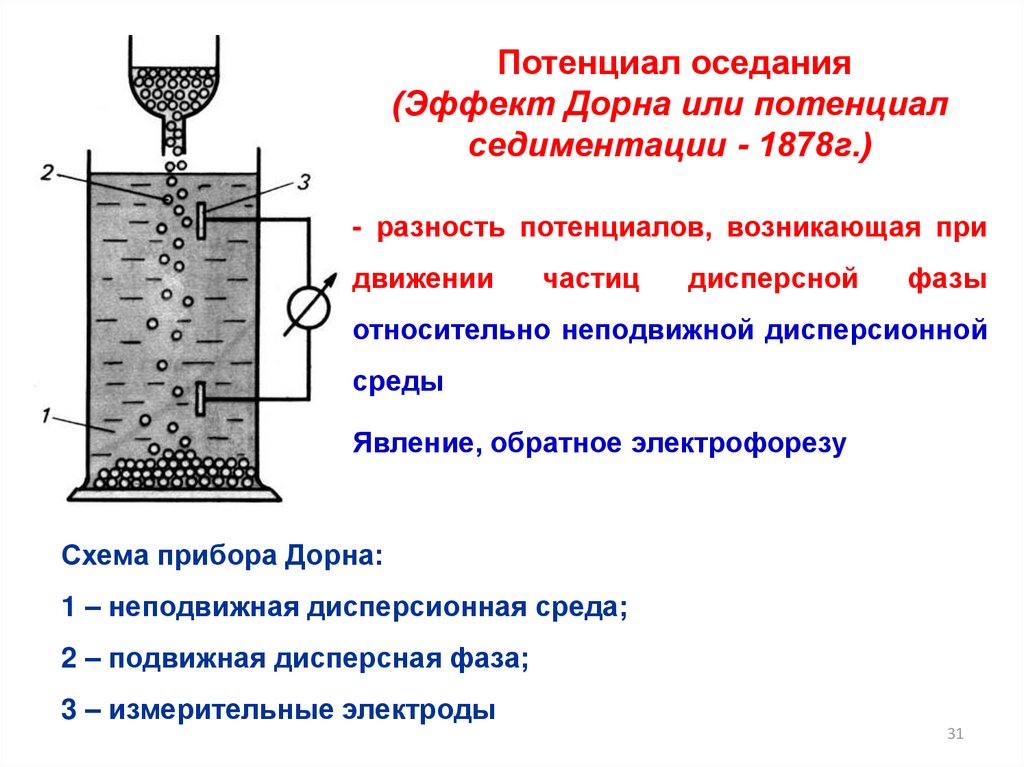
31.
Потенциал оседания(Эффект Дорна или потенциал
седиментации - 1878г.)
- разность потенциалов, возникающая при
движении
частиц
дисперсной
фазы
относительно неподвижной дисперсионной
среды
Явление, обратное электрофорезу
Схема прибора Дорна:
1 – неподвижная дисперсионная среда;
2 – подвижная дисперсная фаза;
3 – измерительные электроды
31
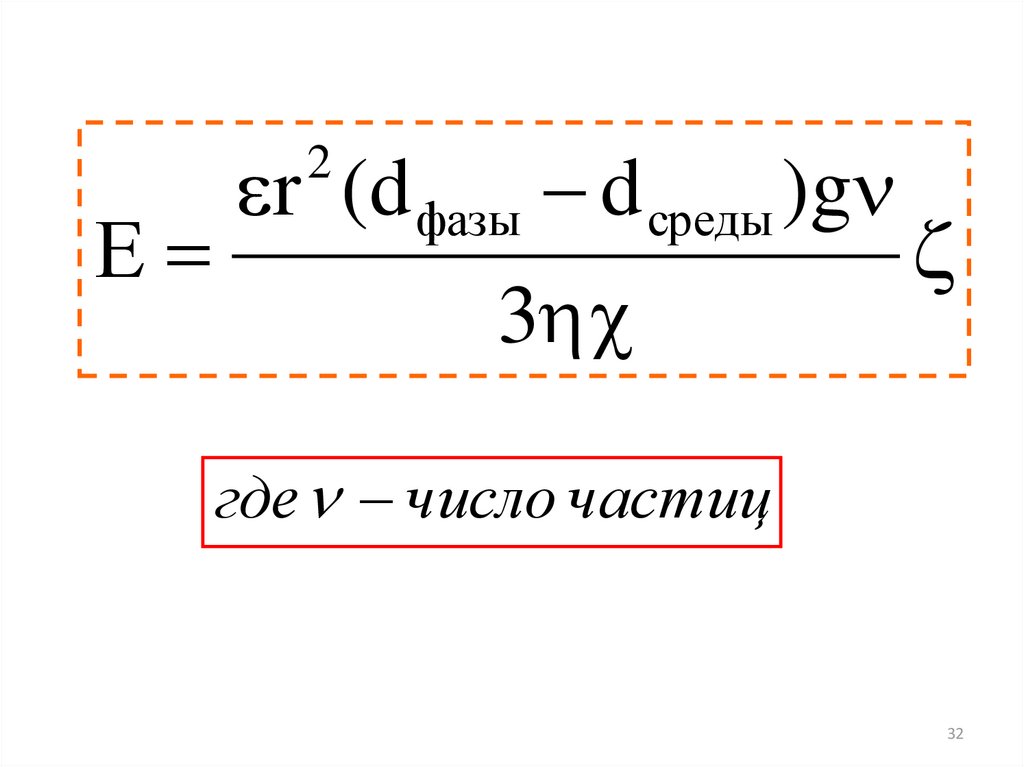
32.
r (d фазы d среды )g2
Е
3
где число частиц
32
33.
Значение электрофоретических явлений1. Разделение и анализ смесей макромолекул
(белков сыворотки крови, спинномозговой жидкости,
мочи )
2. Определение изоэлектрической точки белков
3. Очистка лечебных сывороток
4. Определение заряда поверхности костной
ткани (электроосмос)
33
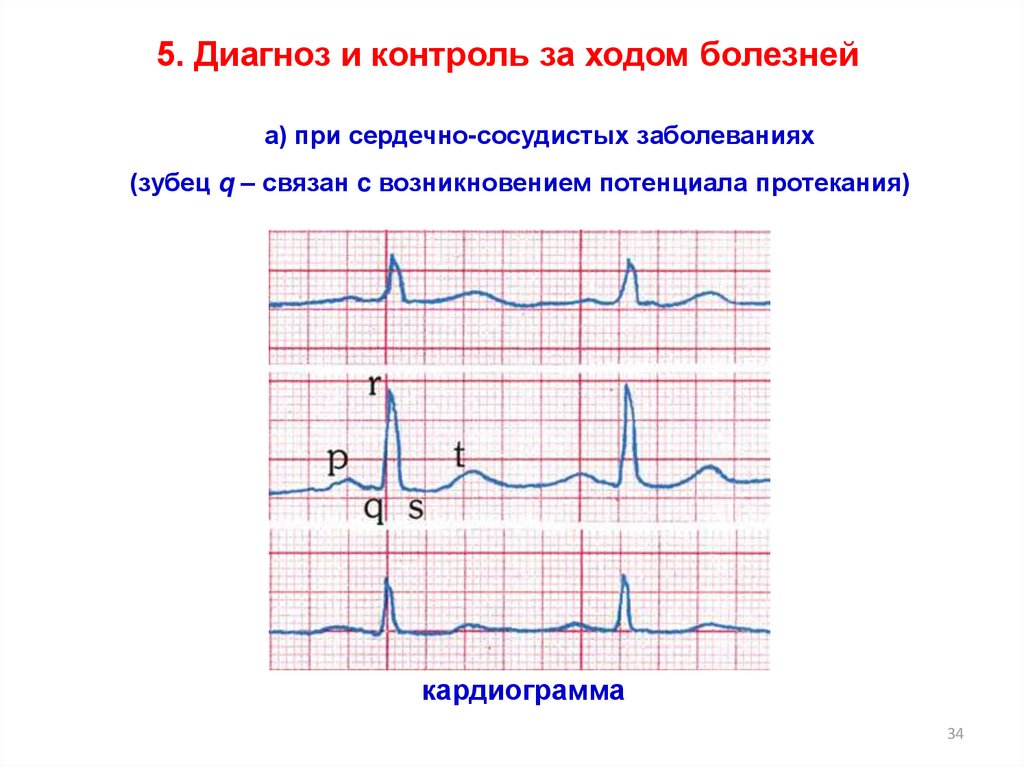
34.
5. Диагноз и контроль за ходом болезнейа) при сердечно-сосудистых заболеваниях
(зубец q – связан c возникновением потенциала протекания)
кардиограмма
34
35.
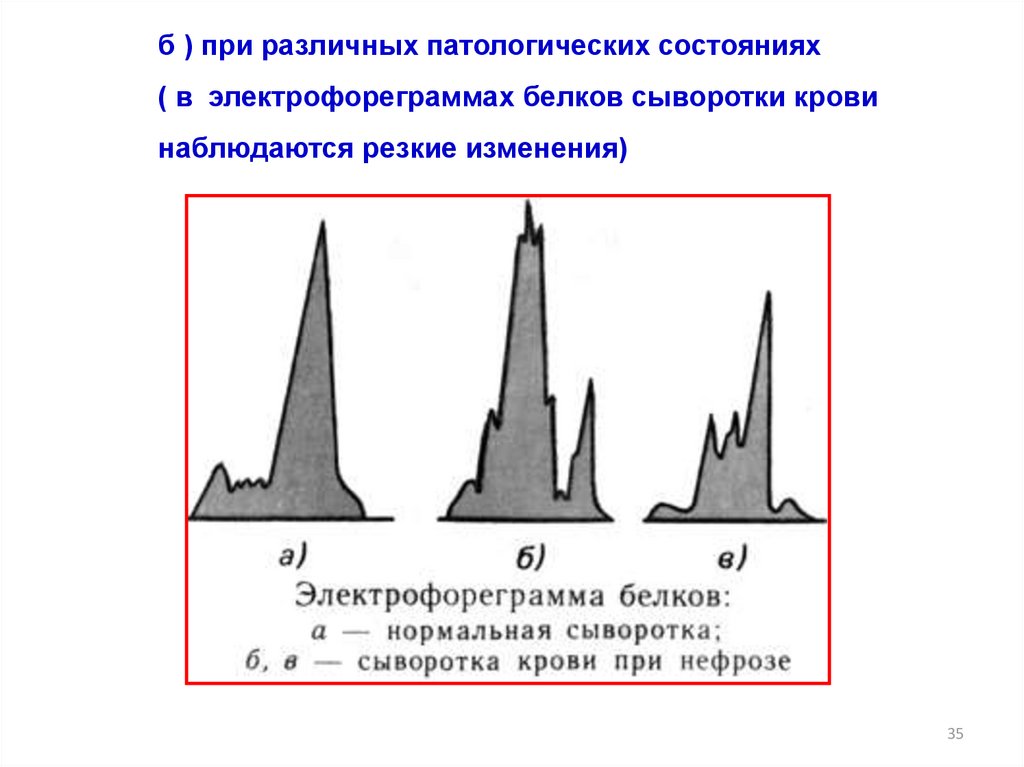
б ) при различных патологических состояниях( в электрофореграммах белков сыворотки крови
наблюдаются резкие изменения)
35
36.
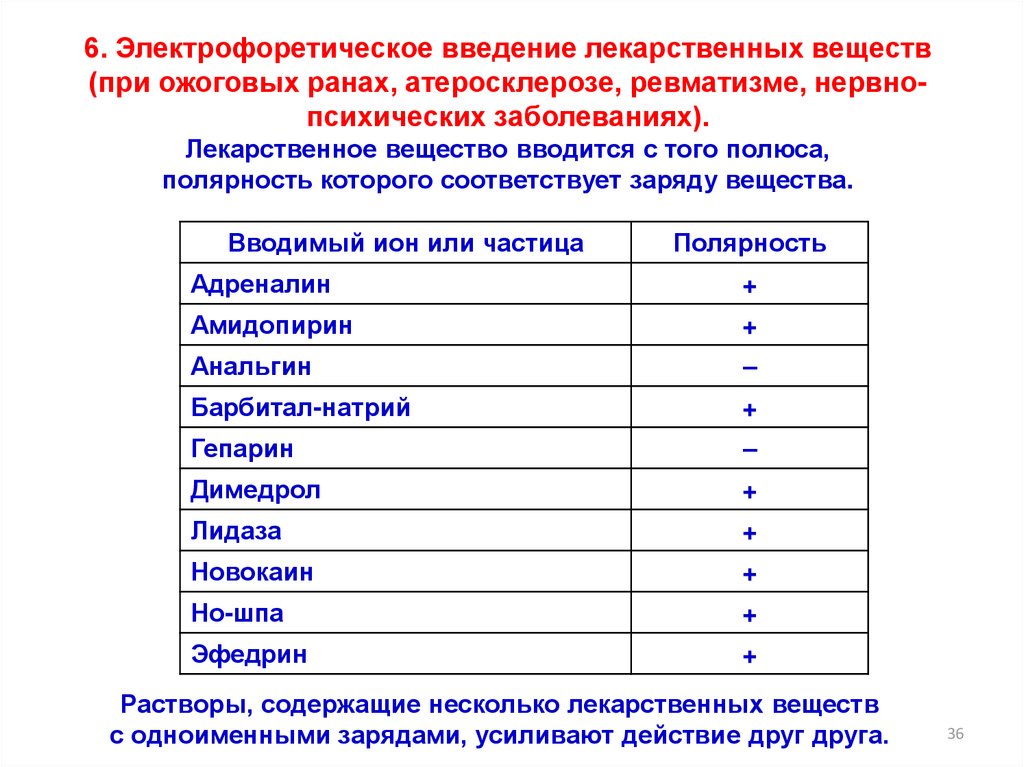
6. Электрофоретическое введение лекарственных веществ(при ожоговых ранах, атеросклерозе, ревматизме, нервнопсихических заболеваниях).
Лекарственное вещество вводится с того полюса,
полярность которого соответствует заряду вещества.
Вводимый ион или частица
Полярность
Адреналин
+
Амидопирин
+
Анальгин
–
Барбитал-натрий
+
Гепарин
–
Димедрол
+
Лидаза
+
Новокаин
+
Но-шпа
+
Эфедрин
+
Растворы, содержащие несколько лекарственных веществ
с одноименными зарядами, усиливают действие друг друга.
36
37.
При электрофорезе следуетприменять те вещества,
которые хорошо диссоциируют,
при этом:
Повышается фармакологическая активность лекарственного
вещества:
Лекарственное вещество в количествах, в 8-10 раз меньших
нормы, дает такой же терапевтический эффект;
Снижается или исключается побочное действие лекарств;
Лекарственное вещество вводится непосредственно
в ткани очага поражения;
Фармакологическая активность сохраняется несколько суток
(за счет создания депо лекарства).
37
38.
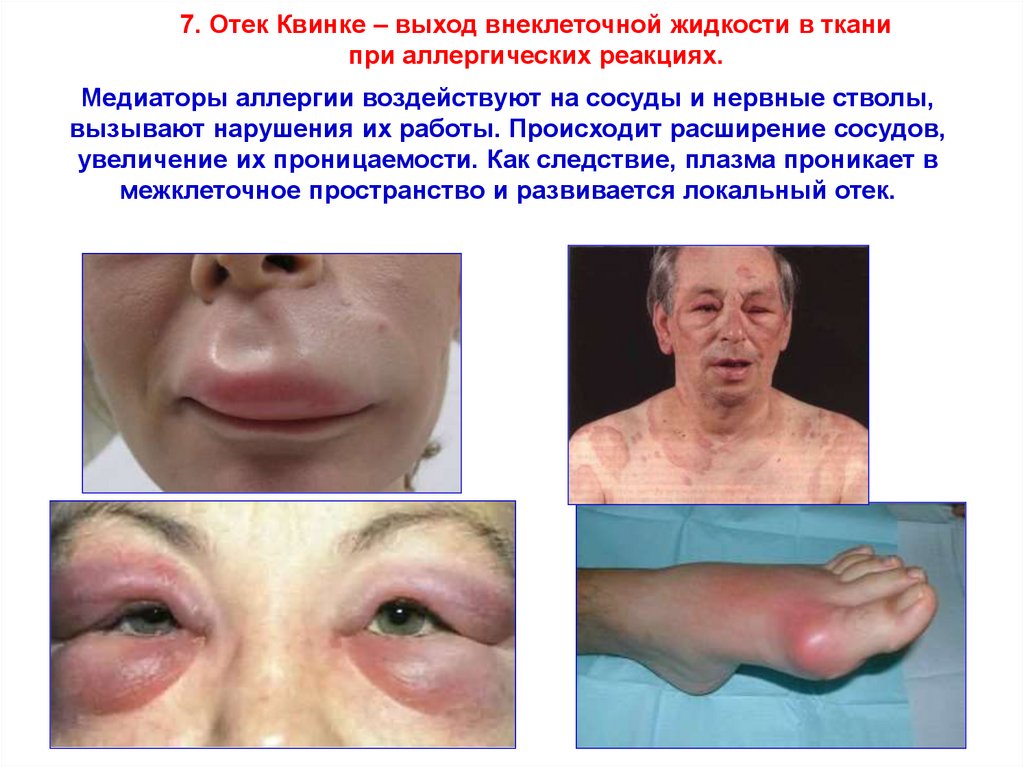
7. Отек Квинке – выход внеклеточной жидкости в тканипри аллергических реакциях.
Медиаторы аллергии воздействуют на сосуды и нервные стволы,
вызывают нарушения их работы. Происходит расширение сосудов,
увеличение их проницаемости. Как следствие, плазма проникает в
межклеточное пространство и развивается локальный отек.
38
39.
Использование в промышленности и народномхозяйстве:
для борьбы с топочными дымами
при изготовлении посуды, резиновых изделий
нанесении металлических покрытий на изделия сложных
профилей
для интенсификации добычи нефти
для осушки торфа
пропитки пористых материалов - древесины
при разведке полезных ископаемых (по потенциалам
протекания)
39
40.
Для понижения уровня грунтовых вод (электроосмос)Схема установки для обезвоживания
грунтов методом электроосмоса:
1 – глубинный насос;
2 – скважина со вставленным в нее
металлическим фильтром;
3 – генератор постоянного тока;
40
4 – металлический стержень
41.
NB!!!При транспортировке жидкого топлива потенциалы
протекания и седиментации могут быть причиной
пожаров и взрывов.
41
42.
Устойчивость и коагуляция коллоидных растворовУстойчивость дисперсных систем - способность сохранять
свое состояние и свойства неизмененными с течением времени.
Основные научные работы относятся
к коллоидной химии:
механизм стабилизации лиофобных золей
под действием коагулянтов;
дифференциальное уравнение
растворения
коллоидных
(диссолюции);
скорости
частиц
хемотаксис (явление движения низших
организмов и подвижных клеток высших
животных
к
определенным
хим.
раздражителям или от них - 1928);
вынужденный синерезис в студнях (1924);
Песков
Николай Петрович
структурная вязкость золей желатины и
агар-агара.
(18.01.1880-15.06.1940)
явления
и
факторы
кинетической
и
42
агрегативной устойчивости лиофобных золей;
43.
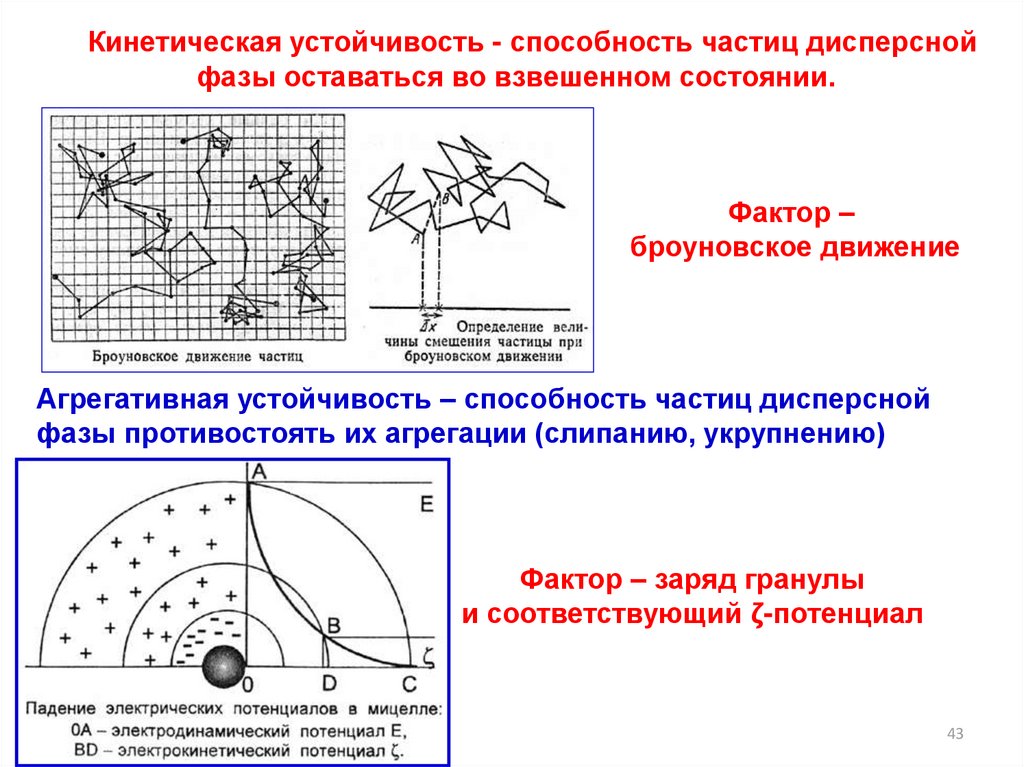
Кинетическая устойчивость - способность частиц дисперснойфазы оставаться во взвешенном состоянии.
Фактор –
броуновское движение
Агрегативная устойчивость – способность частиц дисперсной
фазы противостоять их агрегации (слипанию, укрупнению)
Фактор – заряд гранулы
и соответствующий ζ-потенциал
43
44.
Теория устойчивости гидрофобных дисперсных системДФЛО (Б.В. Дерягин, Л.Д.Ландау, Э Фервей, Я. Овербек)
Согласно этой теории, между любыми частицами при их
сближении возникает расклинивающее давление
разделяющей жидкой прослойки в результате действия
сил притяжения и отталкивания.
Состояние системы зависит от баланса энергии
притяжения и энергии отталкивания.
Преобладание энергии отталкивания приводит к
устойчивости системы, а преобладание сил притяжения –
к нарушению агрегативной устойчивости, к коагуляции
45.
Теория устойчивости гидрофобных дисперсныхсистем ДФЛО
Энергия притяжения обусловлена силами это Вандер-Ваальса и изменяется обратно пропорционально
квадрату расстояния между частицами ( действуют
на близких расстояниях).
А силы отталкивания носят электростатический
характер и возникают, когда перекрываются
диффузные слои при сближении частиц.
Суммарное расклинивающее давление зависит от
преобладания какого-либо из взаимодействий.
46.
Расклинивающее давлениеЧлен-корреспондент АН СССР
(с 1946). Окончил Московский
университет (1922). С 1935
работает в Институте
физической химии АН СССР
ввел понятие
расклинивающего давления
тонких прослоек
Дерягин
Борис Владимирович
( 09.08.1902-16.05.1994)
теоретически обосновал
влияние перекрытия ионных
атмосфер на расклинивающее
давление жидких прослоек
46
47.
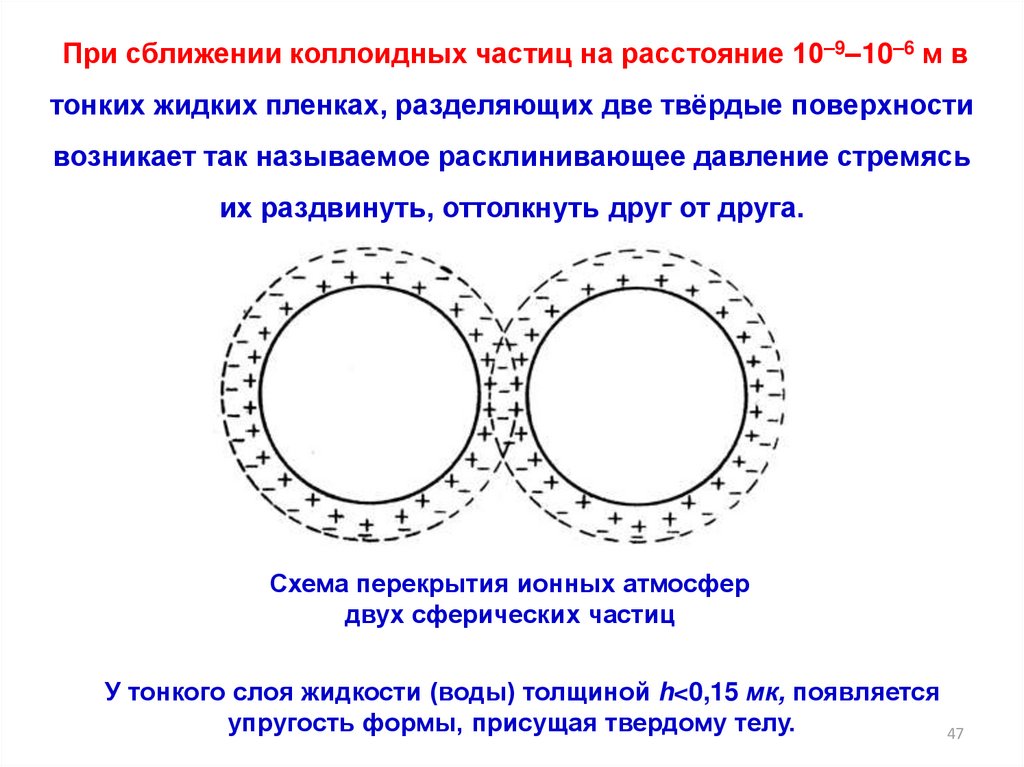
При сближении коллоидных частиц на расстояние 10–9–10–6 м втонких жидких пленках, разделяющих две твёрдые поверхности
возникает так называемое расклинивающее давление стремясь
их раздвинуть, оттолкнуть друг от друга.
Схема перекрытия ионных атмосфер
двух сферических частиц
У тонкого слоя жидкости (воды) толщиной h<0,15 мк, появляется
упругость формы, присущая твердому телу.
47
48.
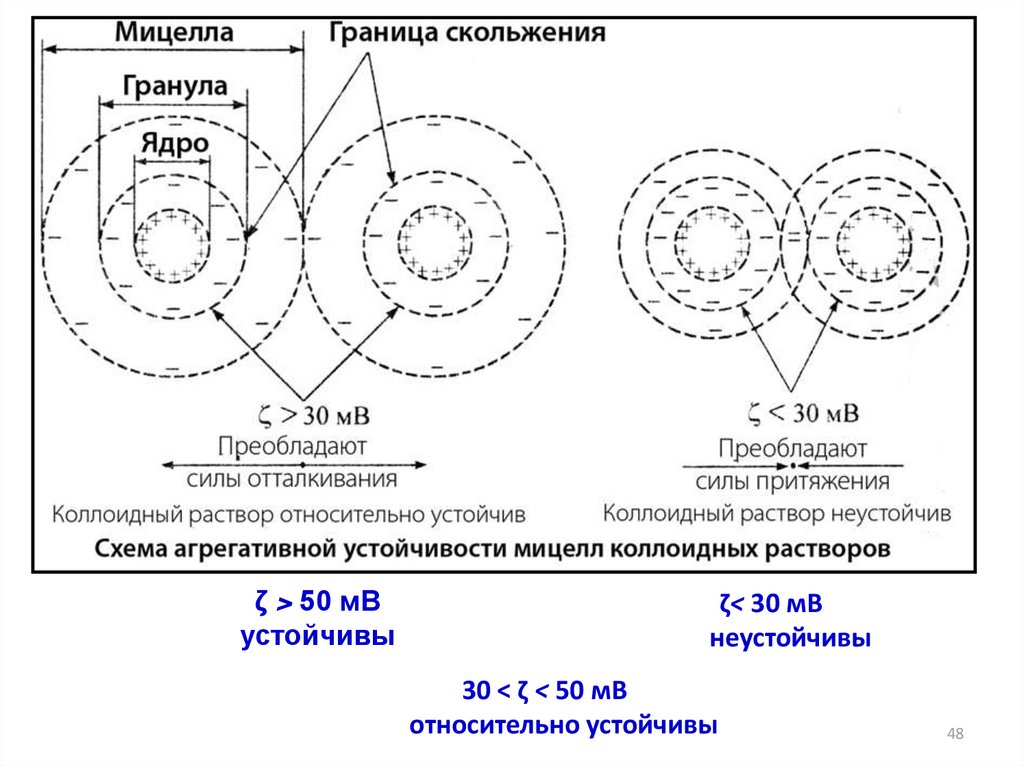
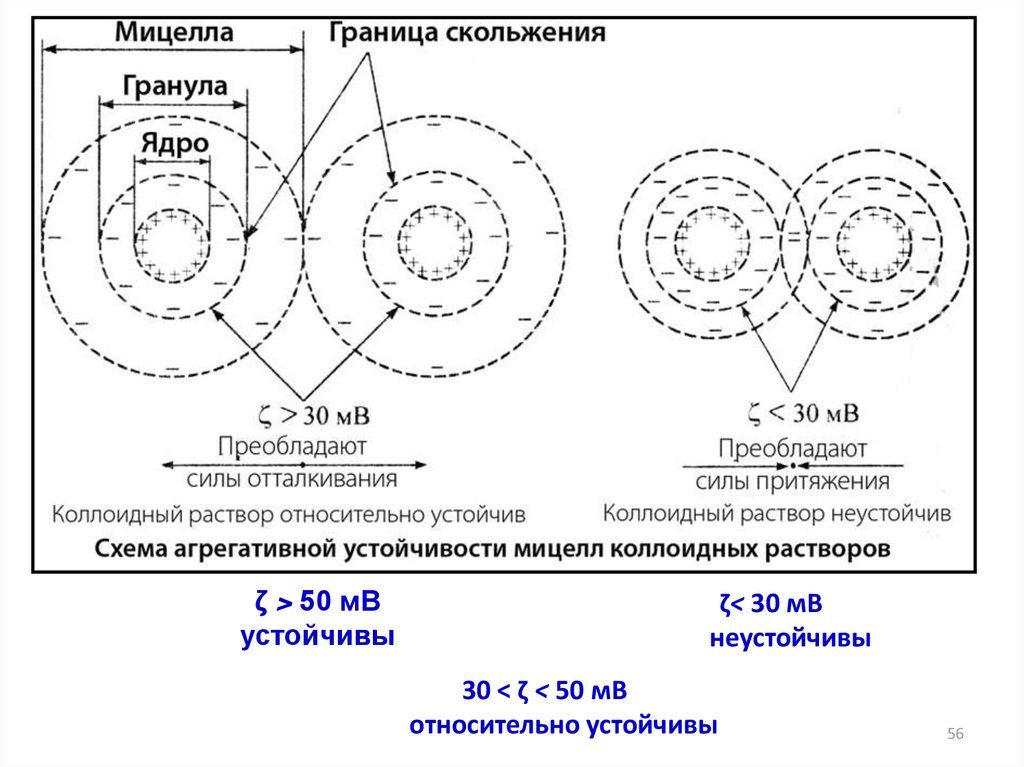
ζ > 50 мВустойчивы
ζ< 30 мВ
неустойчивы
30 < ζ < 50 мВ
относительно устойчивы
48
49.
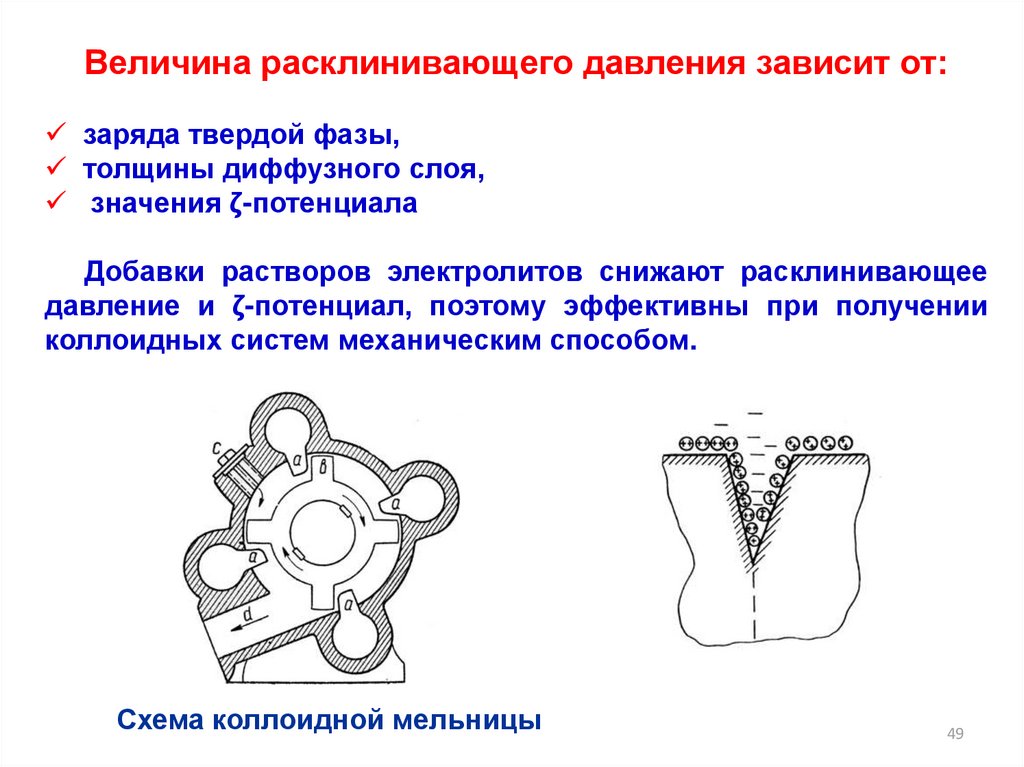
Величина расклинивающего давления зависит от:заряда твердой фазы,
толщины диффузного слоя,
значения ζ-потенциала
Добавки растворов электролитов снижают расклинивающее
давление и ζ-потенциал, поэтому эффективны при получении
коллоидных систем механическим способом.
Схема коллоидной мельницы
49
50.
Коагуляция50
51.
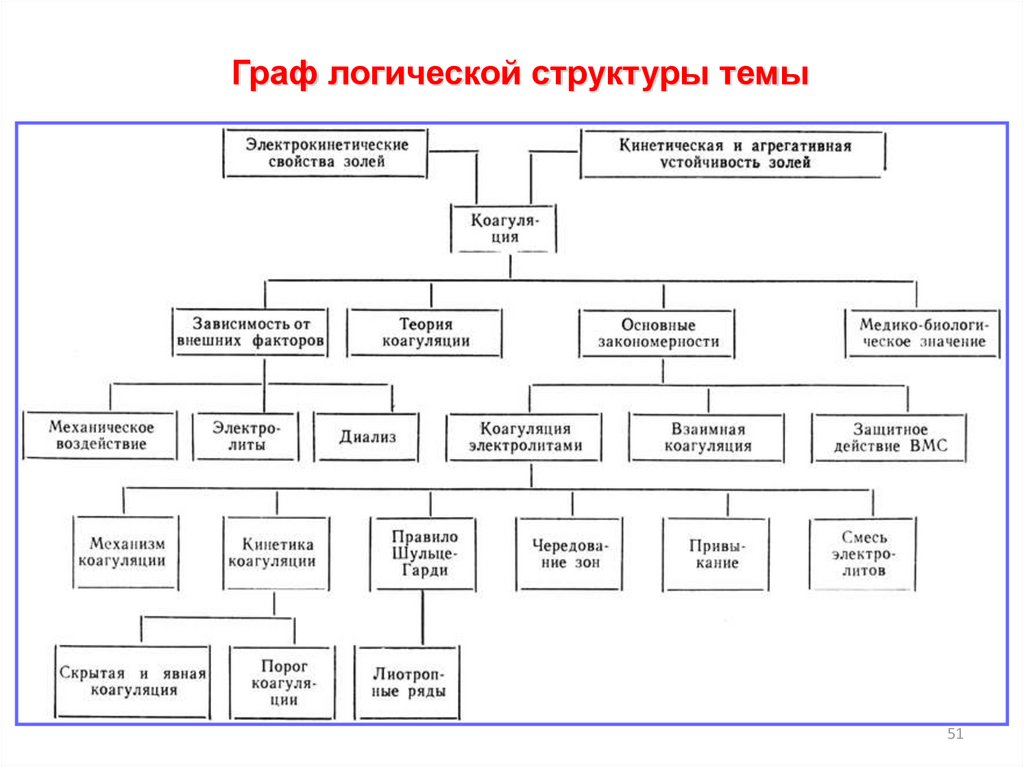
Граф логической структуры темы51
52.
Коагуляция- потеря агрегативной устойчивости, приводящая к укрупнению
частиц с последующей седиментацией.
Факторы, вызывающие коагуляцию:
Добавление электролита.
Температура (нагревание и охлаждение);
Механическое воздействие;
Длительный диализ;
Ультрафильтрация;
Пропускание электрического тока;
Увеличение концентрации золя;
Добавление противоположно заряженного золя;
52
53.
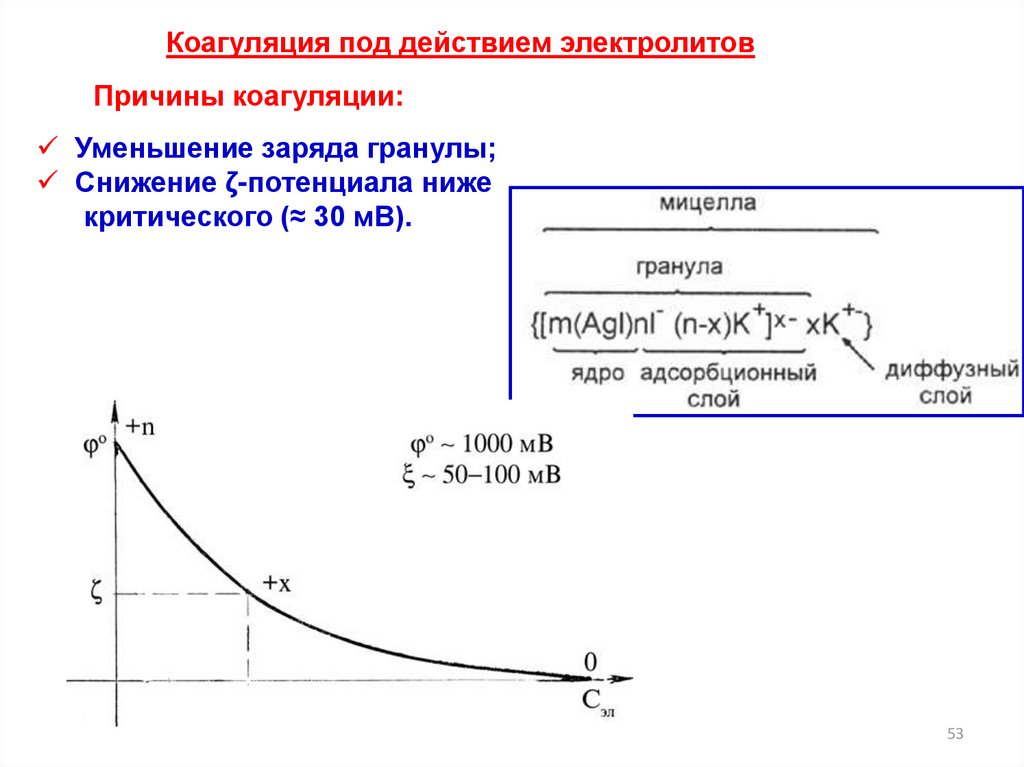
Коагуляция под действием электролитовПричины коагуляции:
Уменьшение заряда гранулы;
Снижение ζ-потенциала ниже
критического (≈ 30 мВ).
53
54.
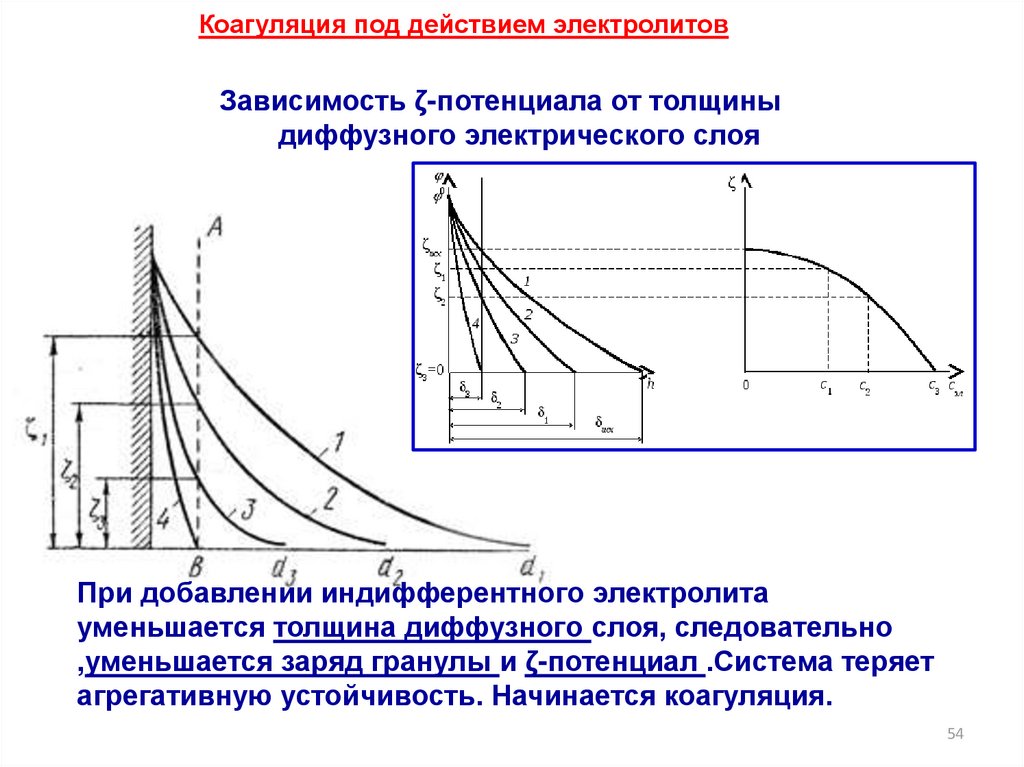
Коагуляция под действием электролитовЗависимость ζ-потенциала от толщины
диффузного электрического слоя
При добавлении индифферентного электролита
уменьшается толщина диффузного слоя, следовательно
,уменьшается заряд гранулы и ζ-потенциал .Система теряет
агрегативную устойчивость. Начинается коагуляция.
54
55.
Толщина диффузного слоя рассчитывается по формуле:d
· o ·R·T
2
2F ·
или
d
const
где ионнаясила раствора
1 ( C1·z2 C2z2 ...)
1
2
2
C концентрация иона;
z заряд иона
55
56.
ζ > 50 мВустойчивы
ζ< 30 мВ
неустойчивы
30 < ζ < 50 мВ
относительно устойчивы
56
57.
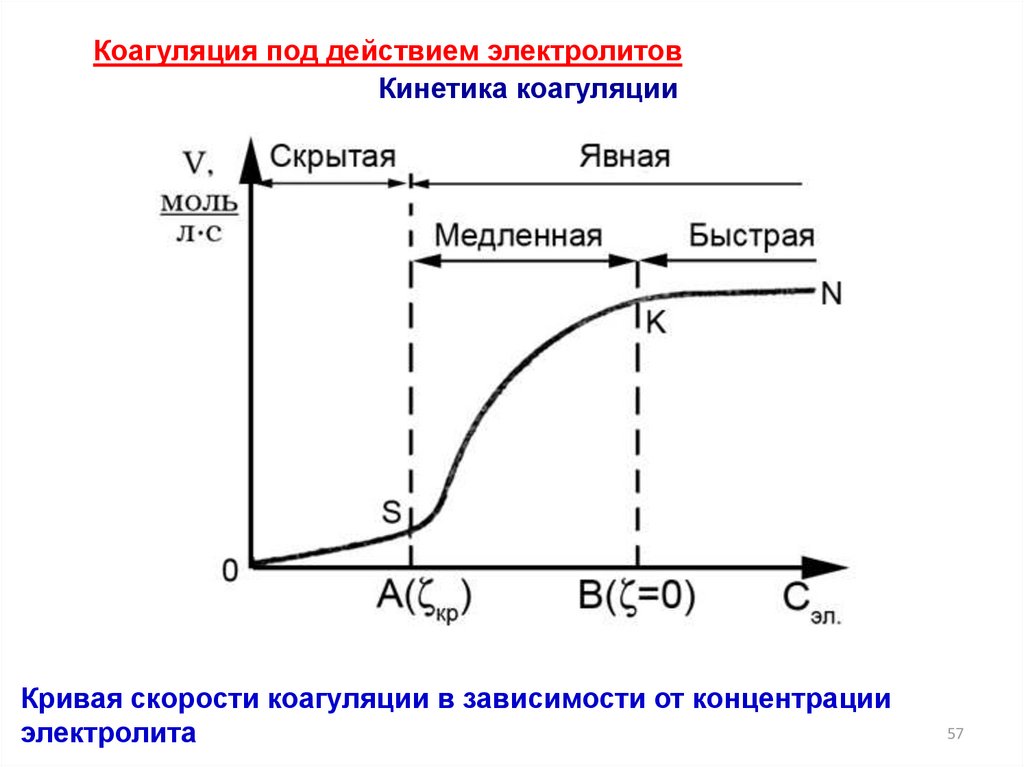
Коагуляция под действием электролитовКинетика коагуляции
Кривая скорости коагуляции в зависимости от концентрации
электролита
57
58.
Скрытая коагуляция –фиксируется только спомощью приборов, визуально раствор остается
прозрачным
ζ > 30 мВ
Медленная коагуляция – скорость зависит от
концентрации электролита, не все соударения
эффективны
ζ < 30 мВ
Явная коагуляция – визуально наблюдается
помутнение раствора
ζ < 30 мВ
Быстрая коагуляция – скорость коагуляции не
зависит от концентрации электролита (гранула имеет
нулевой заряд), все столкновения коллоидных частиц
эффективны и заканчиваются их объединением
(укрупнением)
ζ= 0
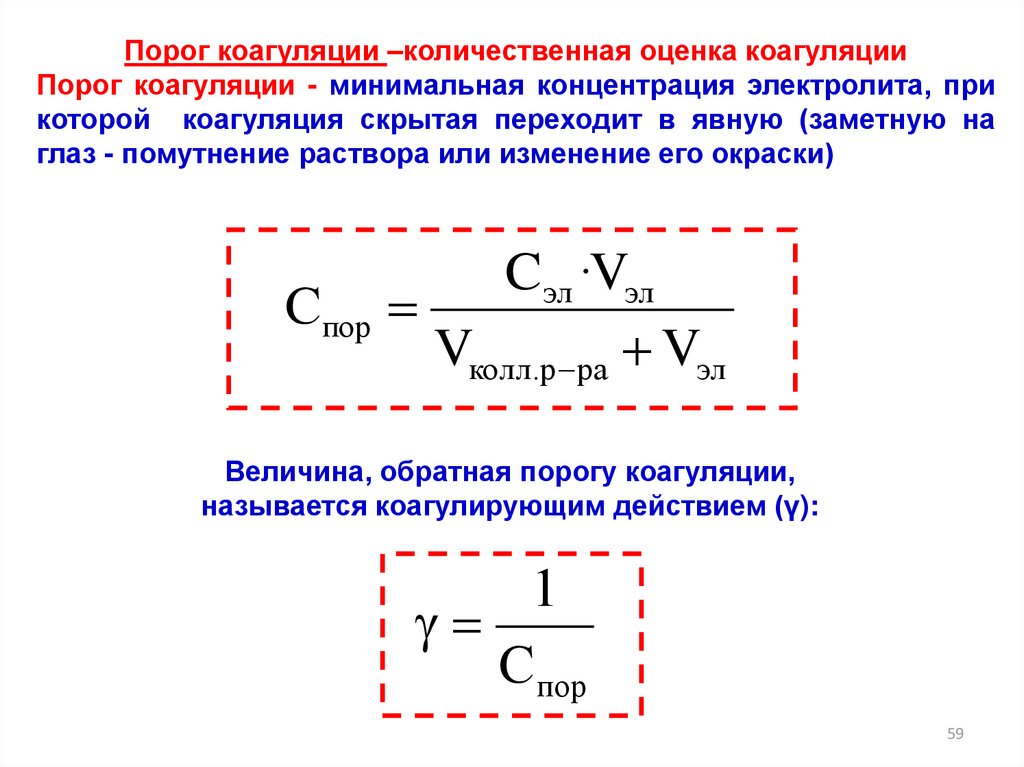
59.
Порог коагуляции –количественная оценка коагуляцииПорог коагуляции - минимальная концентрация электролита, при
которой коагуляция скрытая переходит в явную (заметную на
глаз - помутнение раствора или изменение его окраски)
Спор
Cэл ·Vэл
Vколл.р ра Vэл
Величина, обратная порогу коагуляции,
называется коагулирующим действием (γ):
1
Cпор
59
60.
Правило знака и валентности (Шульце-Гарди)Знака:
Коагуляцию коллоидных растворов вызывают
имеющие знак заряда, противоположный заряду гранулы.
m[AgI]nAg (n x)I
x
xI
ионы,
Заряда:
Коагулирующее действие ионов пропорционально заряду
иона-коагулянта в шестой степени:
1 : 2 : 3 1 : 2 : 3 1 : 64 : 729
6
6
6
или:
Пороги коагуляции обратно пропорциональны заряду ионакоагулянта в шестой степени:
С пор1 : С пор2 : С пор3
1 1 1
6 : 6 : 6 729 : 11 : 1
1 2 3
60
61.
Правило Шульце–Гарди носит приближенный характер.Приготовить золь с абсолютно одинаковыми свойствами
невозможно
Для катионов К+, Ва2+, А13+, отношение порогов коагуляции их
хлоридов при действии на отрицательно заряженный золь As2S
соответственно равно
С KCl : С ВаС1 2 : С AlCl3 49,5 : 0,69 : 0,093 (ммоль/л)
или, принимая порог коагуляции иона алюминия за единицу,
С K : С Ва 2 : С Al3 540 : 7,4 :1.
По порогам коагуляции можно определить знак заряда золя!
Некоторые органические однозарядные основания, например
катионы морфина, обладают более сильным коагулирующим
действием, чем двухзарядные ионы, поскольку обладают более
высокой адсорбцией.
61
62.
ЗадачаПороги коагуляции при добавлении различных электролитов
к золю берлинской лазури составили соответственно:
С NaCl 1.41 ммоль/л
С Na 2SO 4 0.022 ммоль/л
С Na3PO4 0.002 ммоль/л
Определить знак заряда золя. Нарисовать схему мицеллы.
62
63.
Решение1. Предположим, что золь заряжен отрицательно.
Коагулирующее действие должны оказывать катионы (ионы
Na+), т.е. пороги коагуляции должны отличаться в 2 и в 3 раза.
С NaCl 1.41 ммоль/л
С Na 2SO 4 0.022 ммоль/л
С Na3PO4 0.002 ммоль/л
2. Предположим, что золь заряжен положительно.
Коагулирующее действие должны оказывать анионы (ионы CI-,
SO42- и PO43- ), т.е. пороги коагуляции должны отличаться в ~730,
~ 64 и ~ 11 раз.
СCI : CSO 2 : CPO 3 1.41: 0.022 : 0.002
4
4
СCI : CSO 2 : CPO 3 705 :11:1
4
4
63
64.
Видим, что во втором случаенаблюдается достаточно близкое
совпадение с правилом Шульце–
Гарди. Следовательно, хлорид
железа был взят в избытке!!!
3K 4 Fe(CN ) 6 4 FeCI3 Fe4 Fe(CN ) 6 3 12 KCI
(избыток)
m( Fe Fe(CN )
4
6 3
nFe3 3(n x)Cl
3x
3xCl
64
65.
Zn(+)Если же взять избыток
Сu(-)
гексацианоферрата (II) калия, золь
зарядится отрицательно!!!
3K 4 Fe(CN ) 6 4 FeCI3 Fe4 Fe(CN ) 6 3 12 KCI
(избыток)
m( Fe Fe(CN )
4
6 3
4
n Fe(CN)6 4(n x)K
4 x
4xK
65
66.
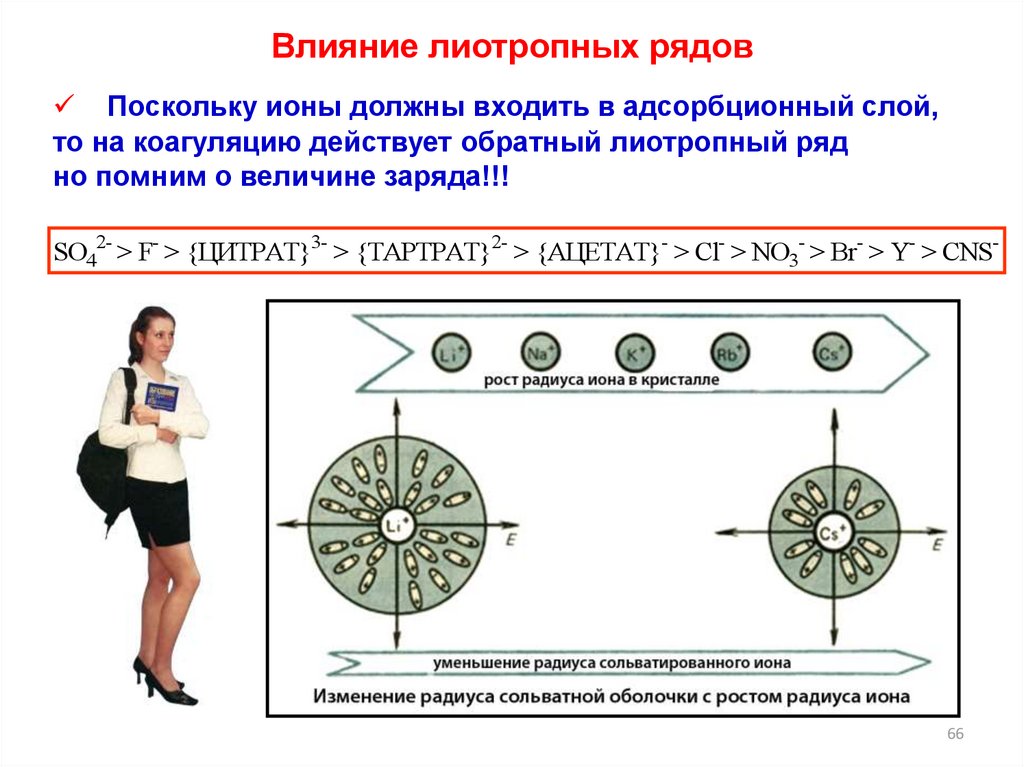
Влияние лиотропных рядовПоскольку ионы должны входить в адсорбционный слой,
то на коагуляцию действует обратный лиотропный ряд
но помним о величине заряда!!!
SO42- > F- > {ЦИТРАТ}3- > {ТАРТРАТ}2- > {АЦЕТАТ}- > Cl- > NO3- > Br- > Y- > CNS-
66
67. Особые случаи коагуляции
68.
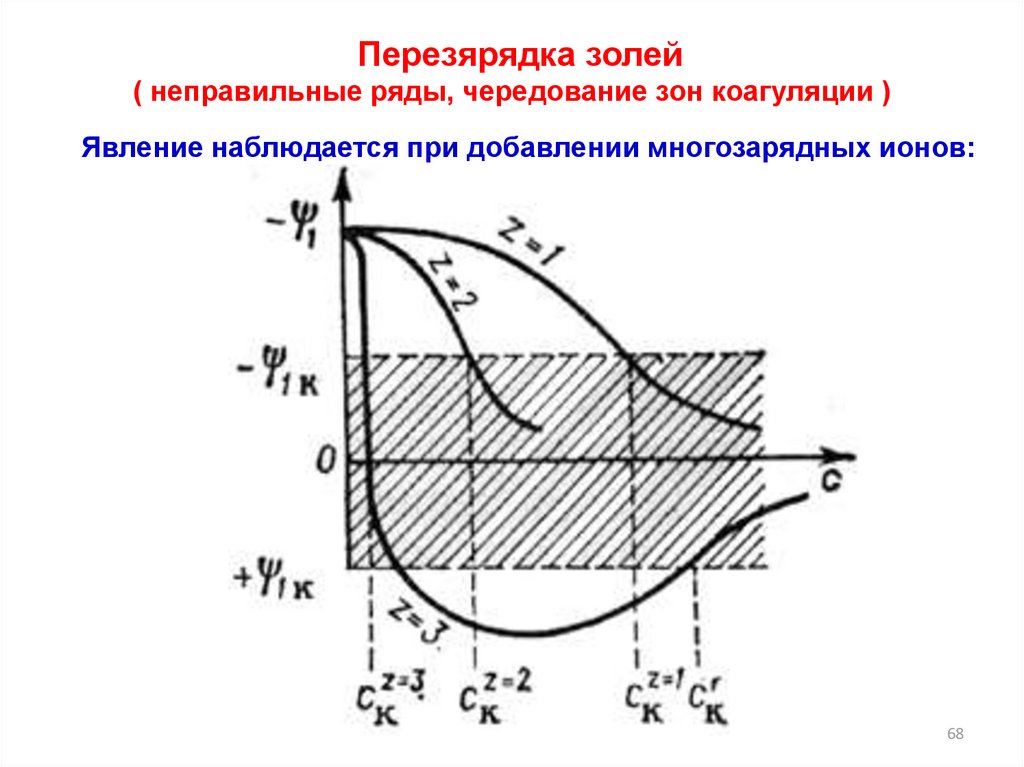
Перезярядка золей( неправильные ряды, чередование зон коагуляции )
Явление наблюдается при добавлении многозарядных ионов:
68
69.
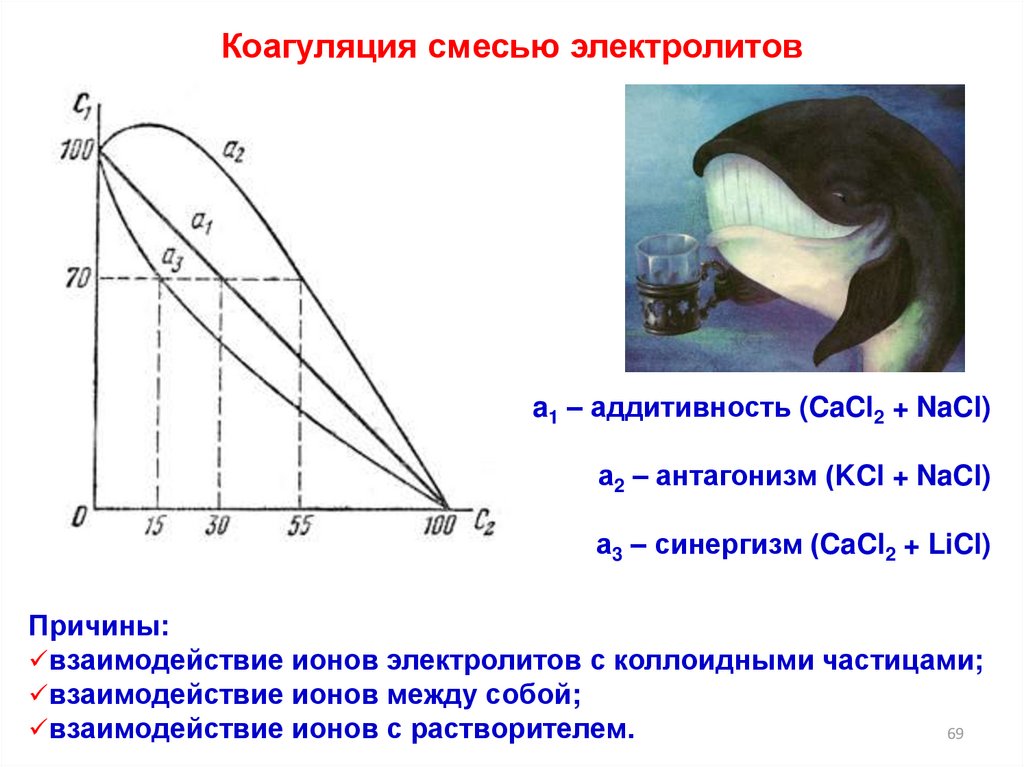
Коагуляция смесью электролитовa1 – аддитивность (CaCl2 + NaCl)
а2 – антагонизм (KCl + NaCl)
а3 – синергизм (CaCl2 + LiCl)
Причины:
взаимодействие ионов электролитов с коллоидными частицами;
взаимодействие ионов между собой;
взаимодействие ионов с растворителем.
69
70.
Аддитивность - это суммирование коагулирующего действияионов, вызывающих коагуляцию.
(коагулирующие ионы не взаимодействуют химически между
собой)
Антагонизм - это ослабление коагулирующего действия одного
электролита в присутствии другого.
(коагулирующие ионы связываются в в прочный комплекс либо
выпадают в осадок)
Рb2+ + 2Сl– = РbСl2↓
Синергизм - это усиление коагулирующего действия одного
электролита в присутствии другого.
(между электролитами происходит химическое взаимодействие, в
результате которого образуется многозарядный ион)
FeCl3 + 6KCNS → K3[Fe(CNS)6] + 3KCl
70
71.
При введении различных лекарственных веществ в организм(в виде инъекций) следует предварительно убедиться в том, что
эти вещества не являются синергистами, чтобы избежать
возможной коагуляции.
71
72.
При очистке промышленных вод следует учитыватьантагонизм вводимых электролитов, препятствующий
разрушению коллоидных загрязнений.
72
73.
Взаимная коагуляцияx
{ }
x
{ }
При смешивании двух золей с противоположными зарядами
частиц наблюдается взаимная коагуляция.
Взаимная коагуляция положительного золя Fe(OH)3 и
отрицательного золя As2S3.
73
74.
Строение мицеллы при полной и частичнойкоагуляции при смешивании разных по заряду
золей хлорида серебра
{(m AgCl) nAg+ (n-x)NO3- }+ x xNO3{(mAgCl) yСl- (y-z)K+ }- z zK+
1. Частичная - n > y
{(m1 + m2 + y) (AgCl) (n – y)Ag+ (n – y – q)NO3- }+ q qNO3-
2. Полная коагуляция – n=y
(m1 + m2 + n)AgCl↓
74
75.
Привыкание золя- превышение порога коагуляции при добавлении электролита
к золю небольшими порциями.
Причины:
образование пептизатора
адсорбция ионов, приводящая к повышению заряда частиц
75
76.
При инъекциях электролита в мышечную ткань или кровьчеловека необходимо вводить его постепенно, медленно, чтобы
не вызвать коагуляцию биологических коллоидных систем.
При медленном введении (капельница) электролит успевает
уноситься с током крови и диффундировать в соседние ткани,
поэтому пороговая концентрация не достигается и коагуляция
не наступает.
Это явление в живых тканях объясняется "привыканием".
76
77.
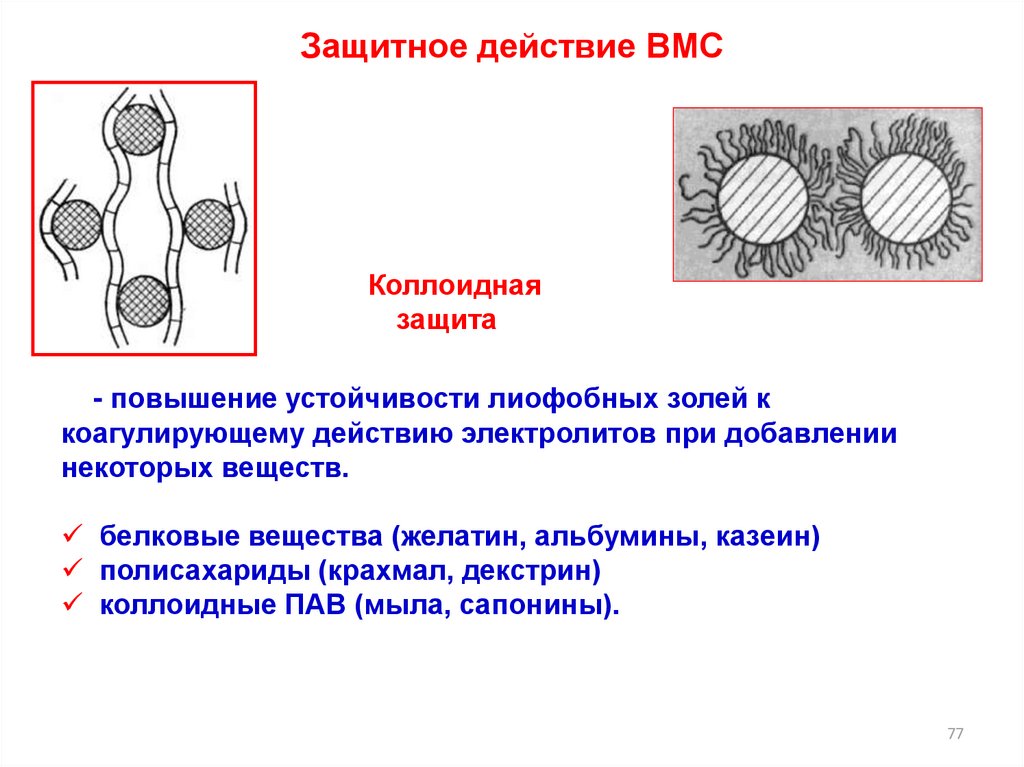
Защитное действие ВМСКоллоидная
защита
- повышение устойчивости лиофобных золей к
коагулирующему действию электролитов при добавлении
некоторых веществ.
белковые вещества (желатин, альбумины, казеин)
полисахариды (крахмал, декстрин)
коллоидные ПАВ (мыла, сапонины).
77
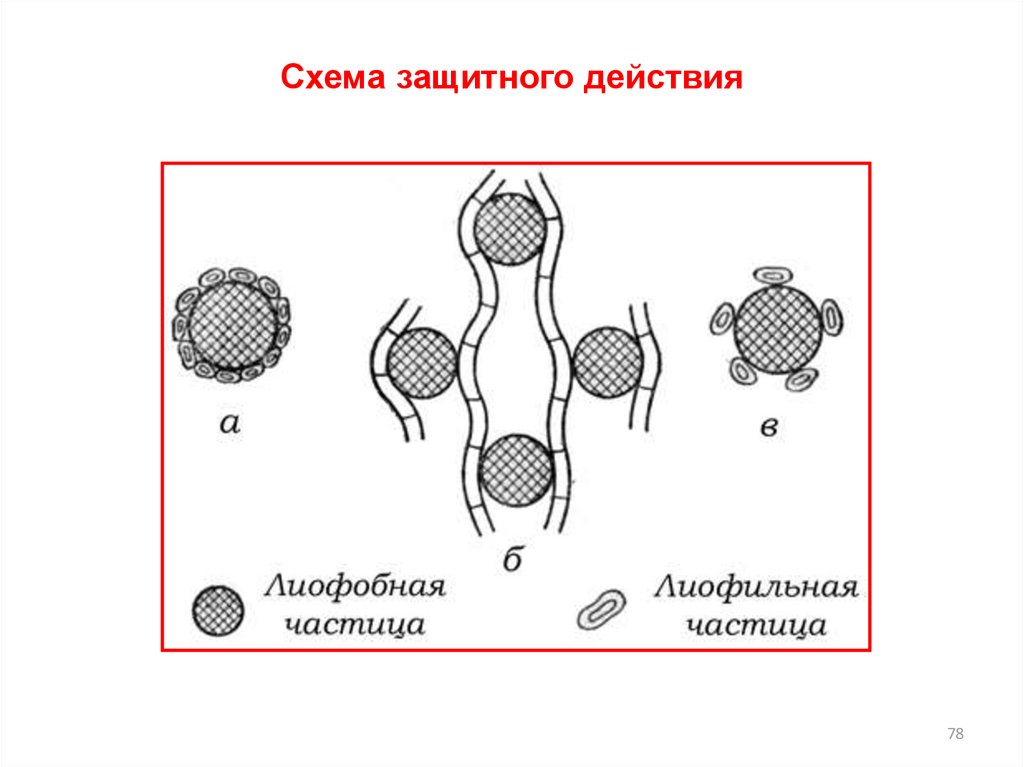
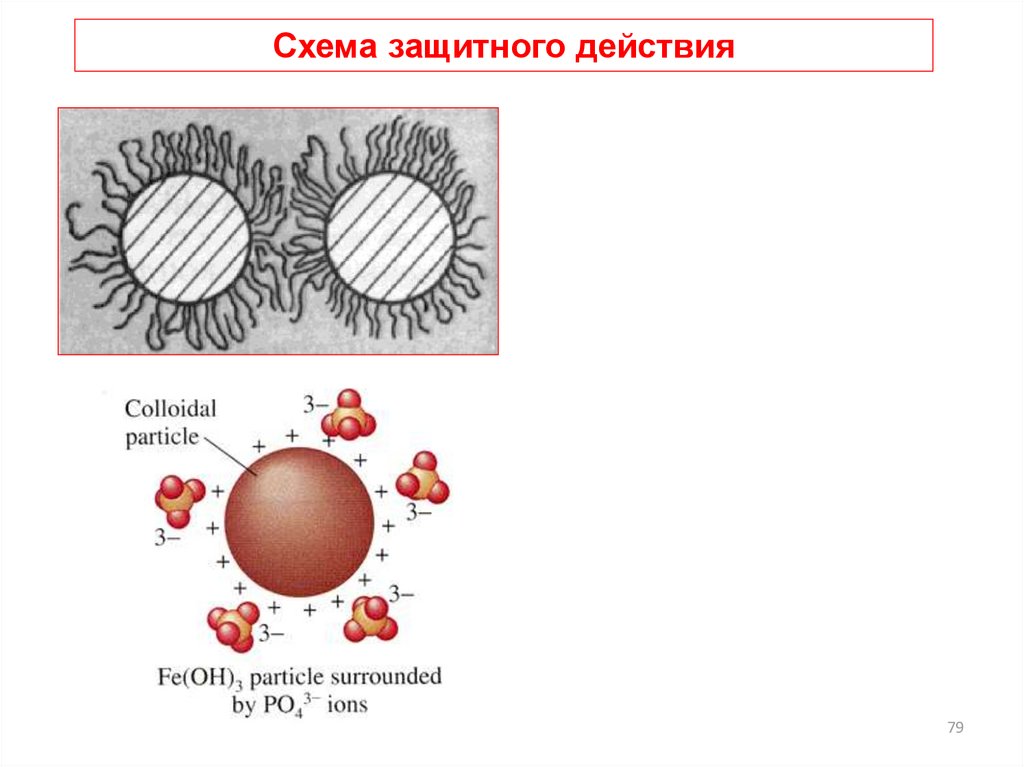
78. Схема защитного действия
7879.
Схема защитного действия79
80.
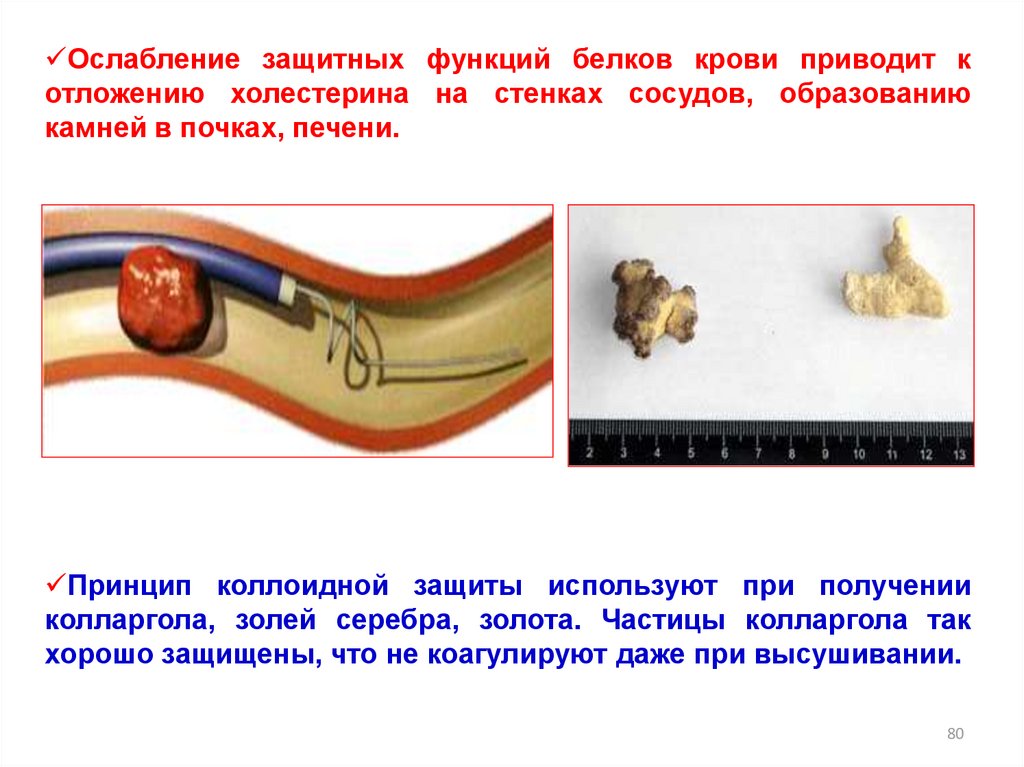
Ослабление защитных функций белков крови приводит котложению холестерина на стенках сосудов, образованию
камней в почках, печени.
Принцип коллоидной защиты используют при получении
колларгола, золей серебра, золота. Частицы колларгола так
хорошо защищены, что не коагулируют даже при высушивании.
80
81.
Золотое число- масса (в мг) сухого ВМС, защищающего 10 мл
золя красного золота от коагуляции при
добавлении к нему
1 мл 10 % раствора NaCl.
10% NaCl 1 мл
10 мл
Золь Au
крахмал
желатин
81
82.
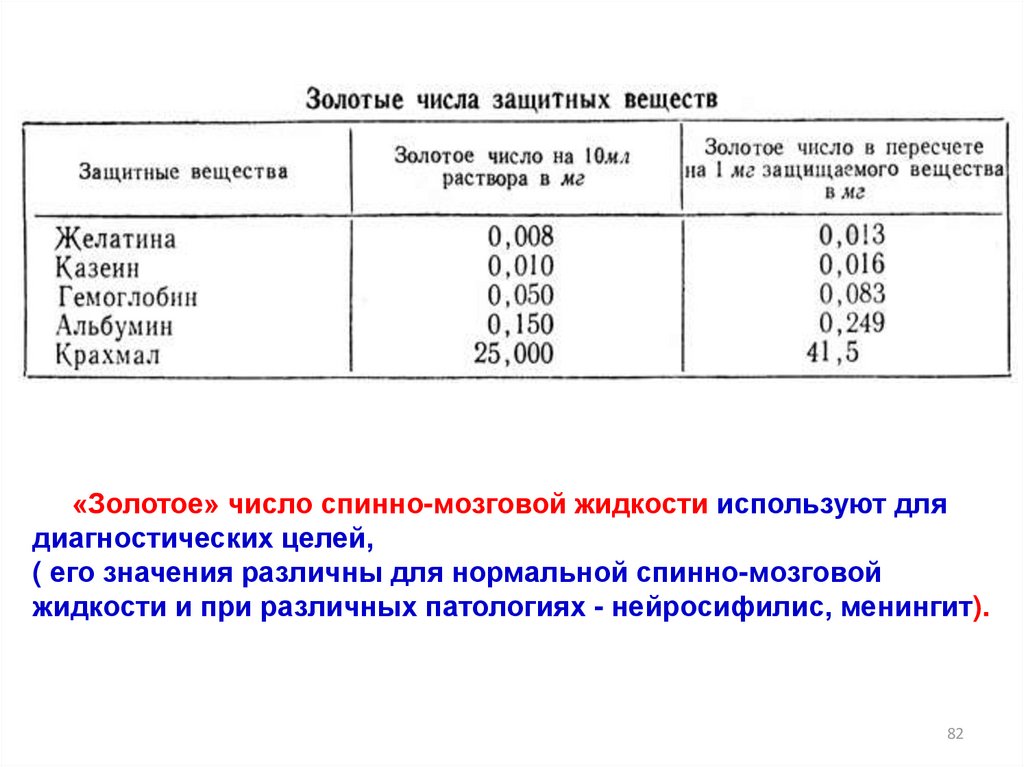
«Золотое» число спинно-мозговой жидкости используют длядиагностических целей,
( его значения различны для нормальной спинно-мозговой
жидкости и при различных патологиях - нейросифилис, менингит).
82
83.
Сенсибилизация (флокуляция)- агрегирование частиц дисперсной фазы в лиофобных золях и
суспензиях под действием небольших количеств ВМС.
Макромолекулы
взаимодействуют
одновременно
с
несколькими мицеллами коллоидного раствора образуя
крупные флокулы (рыхлые хлопья), которые оседают или
всплывают – в зависимости от их плотности.
Флокулянты - хорошо растворимые в дисперсионной среде
ВМС, имеющие гибкие макромолекулы с большой молекулярной
83
массой.
84.
Значение коагуляции1. Учет коагуляции при введении
растворов
солей
в
живые
организмы
(физиологический
раствор 0,9 % NaCI нельзя заменить
изотоническим раствором MgSO4)
2. Определение СОЭ - скорости
оседания эритроцитов.
(норма - 10-12 мм/час)
84
85.
3. Удаление ионов Са2+ при консервированиидонорской крови.
- добавление цитрата натрия
- декальцинирование методом ионного обмена
Противосвертывающее действие основано
на том, что цитрат натрия связывает
участвующие в процессе свертывания ионы
кальция в нерастворимый цитрат кальция.
Но!!!!! Применять его в организме нельзя!!!!
Резко нарушается возбудимость нервномышечного
аппарата,
для
нормальной
деятельности которого нужны ноны кальция.
85
86.
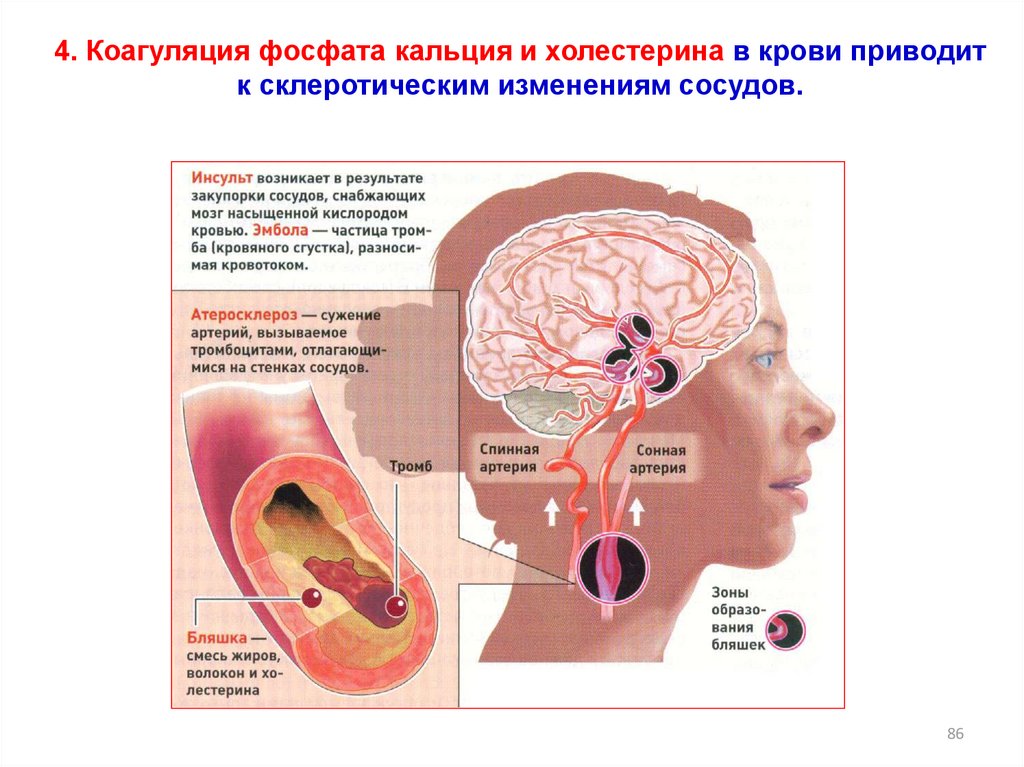
4. Коагуляция фосфата кальция и холестерина в крови приводитк склеротическим изменениям сосудов.
86
87.
5. Формирование структуры почв.Образование плодородных дельт в устьях рек
Большой Нил
Голубой Нил
Образование плодородной дельты при их слиянии
87













































 Химия
Химия








