Похожие презентации:
Растворы электролитов
1. Растворы электролитов
05.11.20222. Электролитическая диссоциация – процесс распада молекул электролитов на ионы под воздействием полярных молекул растворителя.
С. Аррениус (1887),И.А. Каблуков, В.А. Кистяковский
Электролиты –
вещества, растворы и расплавы
которых проводят электрический ток
(с полярной и резкополярной
ковалентной связью).
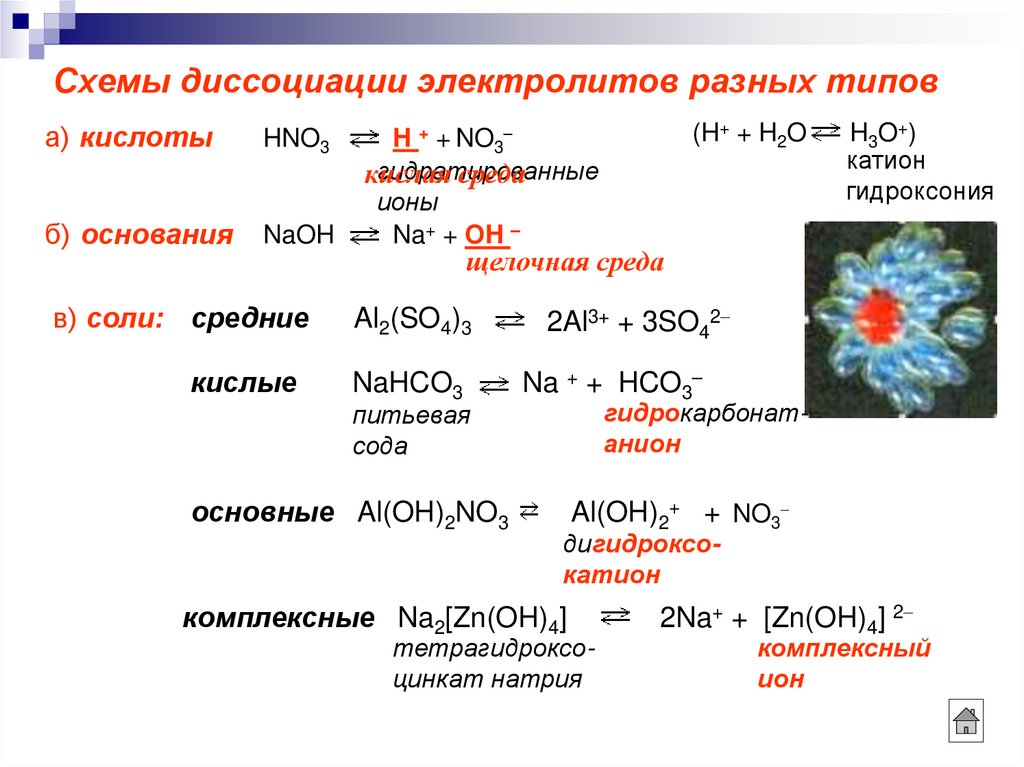
3. Схемы диссоциации электролитов разных типов
а) кислотыHNO3
б) основания
NaOH
H + + NO3
гидратированные
кислая
среда
ионы
Na+ + OH –
(H+ + H2O
H3O+)
катион
гидроксония
щелочная среда
в) соли: средние
Al2(SO4)3
кислые
NaHCO3
питьевая
сода
основные Al(OH)2NO3
2Al3+ + 3SO42
Na + + HCO3
гидрокарбонатанион
Al(OH)2+ + NO3
дигидроксокатион
комплексные Na2[Zn(OH)4]
тетрагидроксоцинкат натрия
2Na+ + [Zn(OH)4] 2
комплексный
ион
4.
Степень диссоциации ( ) –отношение количества диссоциированных частиц
к общему количеству электролита.
nn дисс.
общ. (в долях или %)
Электролиты
сильные > 30%
большинство растворимых солей,
щелочи (кроме NH4OH),
кислоты (HJ, HBr, HCl, HNO3, H2SO4, HClO4 и др.)
средней силы 3%< <30%
H3PO4, H2SO3, HF и др.
слабые < 3%
труднорастворимые гидроксиды и соли;
NH4OH;
H2S, H2CO3 и др.;
H2O.
5. Значения водородного числа и pH в разных средах
Среданейтральная [H+] = [OH–]
pH = 7
кислая
[H+] > [OH–]
pH < 7
щелочная
[H+] < [OH–]
pH > 7
Водородный показатель pH –
отрицательный десятичный логарифм
концентрации H+.
pH = –lg [H+]
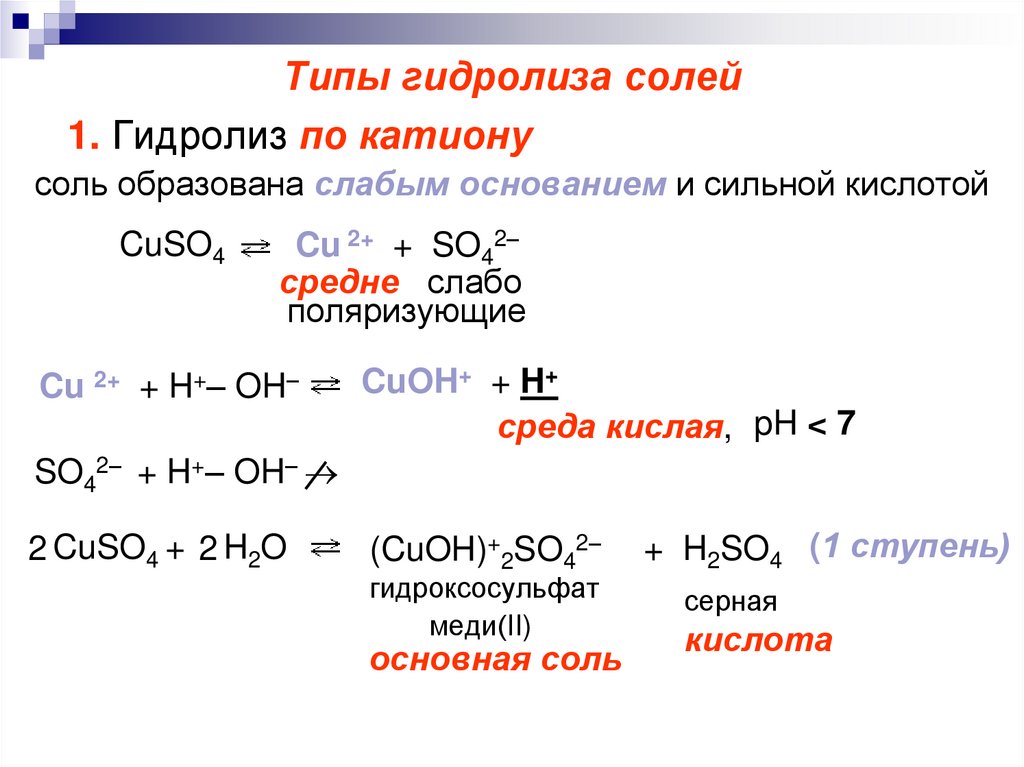
6. Типы гидролиза солей
1. Гидролиз по катионусоль образована слабым основанием и сильной кислотой
CuSO4
Cu 2+ + SO42–
средне слабо
поляризующие
Cu 2+ + H+– OH–
CuOH+ + H+
среда кислая, pH < 7
SO42– + H+– OH–
2 CuSO4 + 2 H2O
(CuOH)+2SO42–
гидроксосульфат
меди(II)
основная соль
+ H2SO4 (1 ступень)
серная
кислота
7.
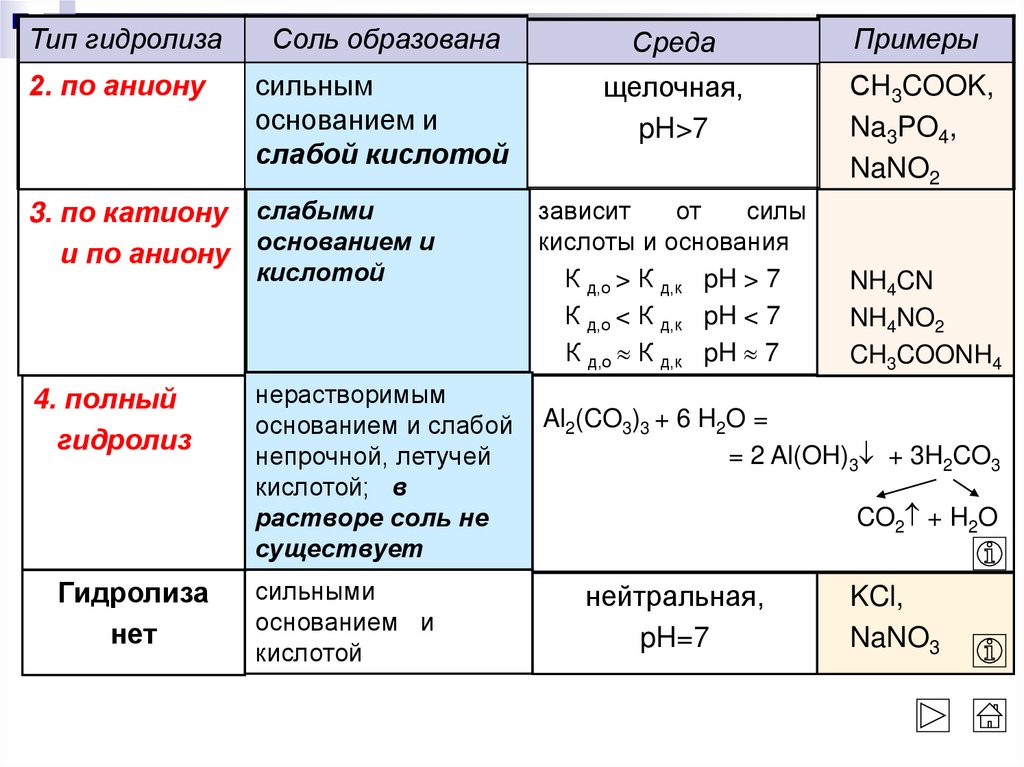
Тип гидролизаСоль образована
Среда
Примеры
2. по аниону
сильным
основанием и
слабой кислотой
щелочная,
pH>7
СH3COOK,
Na3PO4,
NaNO2
3. по катиону слабыми
и по аниону основанием и
кислотой
4. полный
гидролиз
Гидролиза
нет
нерастворимым
основанием и слабой
непрочной, летучей
кислотой; в
растворе соль не
существует
сильными
основанием и
кислотой
зависит
от
силы
кислоты и основания
К д,о > К д,к pH > 7
К д,о < К д,к pH < 7
К д,о К д,к pH 7
NH4CN
NH4NO2
CH3COONH4
Al2(CO3)3 + 6 H2O =
= 2 Al(OH)3 + 3H2CO3
CO2 + H2O
нейтральная,
pH=7
KCl,
NaNO3
8.
раствор FeCl2среда ?
кислая
цвет лакмуса ?
раствор CH3COONa
Среда ?
щелочная
цвет
фенолфталеина ?





 Химия
Химия








