Похожие презентации:
Кислород. Химия – 8 класс
1. Кислород
Химия – 8 классКислород
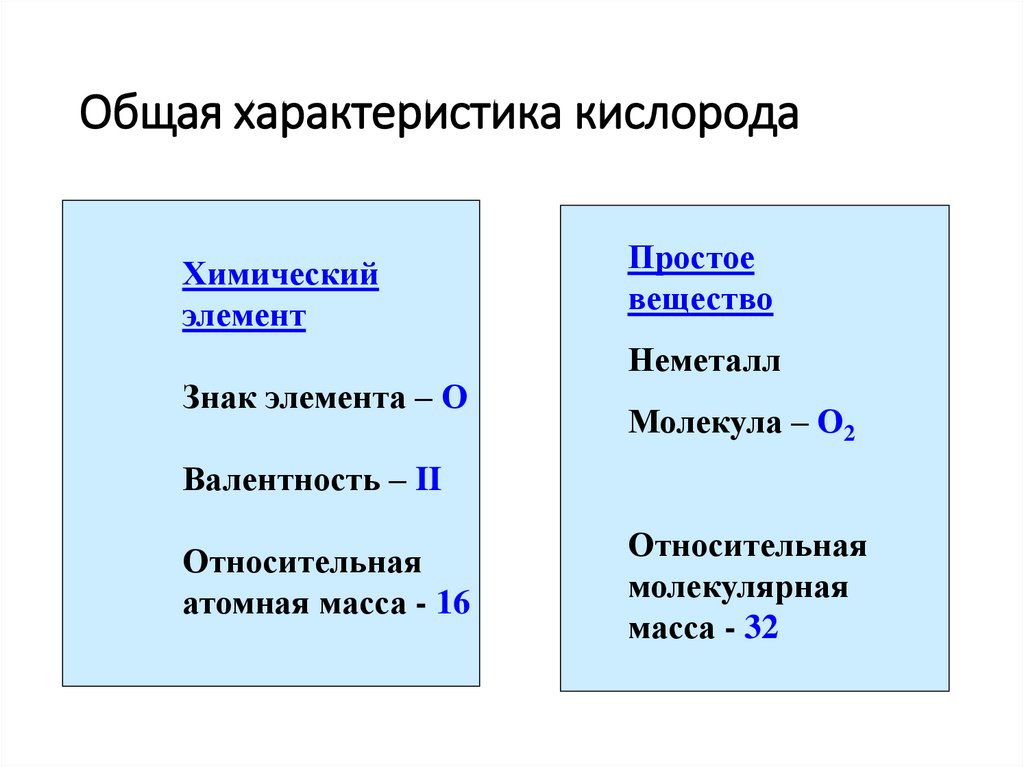
2. Общая характеристика кислорода
Химическийэлемент
Знак элемента – О
Простое
вещество
Неметалл
Молекула – О2
Валентность – II
Относительная
атомная масса - 16
Относительная
молекулярная
масса - 32
3. Кислород как элемент и простое вещество
4. В земной коре его 49% по массе, в гидросфере – 89% по массе.5. В составе воздуха (в виде простого вещества) – 20-21% по объёму.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
Кислород является самым распространённым элементом нашей
планеты. По весу на его долю приходится примерно половина общей
массы всех элементов земной коры.
21.11.2022
3
4. Кислород в природе
• Вода• Воздух
• Песок
• Глина
• Минералы
• Растения
• Животные
• Человек
Кислород – самый
распространенный
элемент на земле
•Н20
•O2
•SiO2
•Al2O3
•CaCO3
•C6H12O6
5. Знать! АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
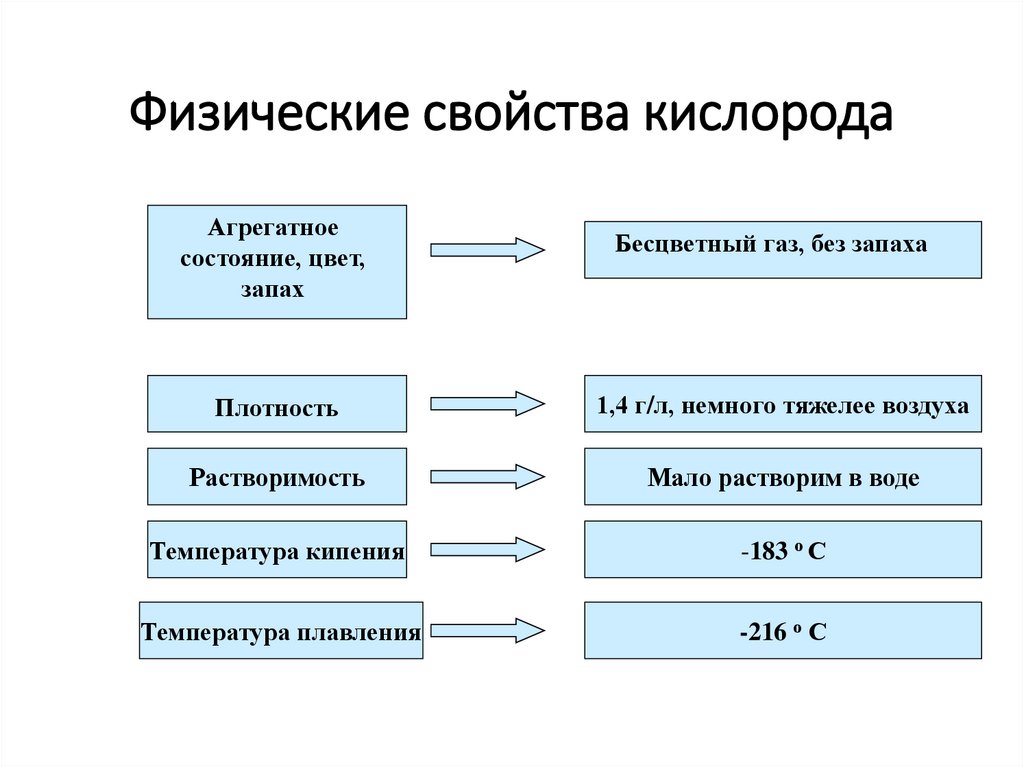
6. Физические свойства кислорода
Агрегатноесостояние, цвет,
запах
Бесцветный газ, без запаха
Плотность
1,4 г/л, немного тяжелее воздуха
Растворимость
Мало растворим в воде
Температура кипения
-183 о С
Температура плавления
-216 о С
7. Химические свойства кислорода
• При взаимодействии кислорода со многими простыми исложными веществами образуются оксиды- реакция
ОКИСЛЕНИЯ
• Оксиды – это сложные вещества, состоящие из двух
элементов, один из которых кислород.
• Реакции окисления,
в которых выделяются
теплота и свет,
называются
реакциями горения.
7
8. Химические свойства
Взаимодействие веществ с кислородом называется окислением.С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех
реакциях (кроме взаимодействия со фтором) кислород - окислитель.
1. Озон неустойчив:
O3 O2 + O
2. Сильный окислитель:
2KI + O3 + H2O 2KOH + I2 + O2
Качественная реакция на озон(синеет крахмальная бумажка)
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает
микроорганизмы.
С неметаллами
C + O2 CO2
S + O2 SO2
H2 + O2 H2O
P+ O2 P 2O5
21.11.2022
С металлами
Mg + O2 MgO
Cu + O2 –t CuO
Уравнять уравнениея
Со сложными веществами
4FeS2 + 11O2 2Fe2O3 +
8SO2
2H2S + 3O2 2SO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
5
9. Проверь себя:
Составь уравнения реакций горения:•Фосфора
•Углерода
•Магния
•Натрия
•Серы
•Железа
•Метана СН4
РАССТАВИТЬ КОЭФФИЦИЕНТЫ
10. Реакции горения
• 4P + 5O2 = 2P2O5• C + O2 = CO2
• 2Mg + O2 = 2MgO
• 4Na + O2 = 2Na2O
• 3Fe + 2O2 = Fe3O4
• СH4 + 2O2 = CO2 + 2H2O
11.
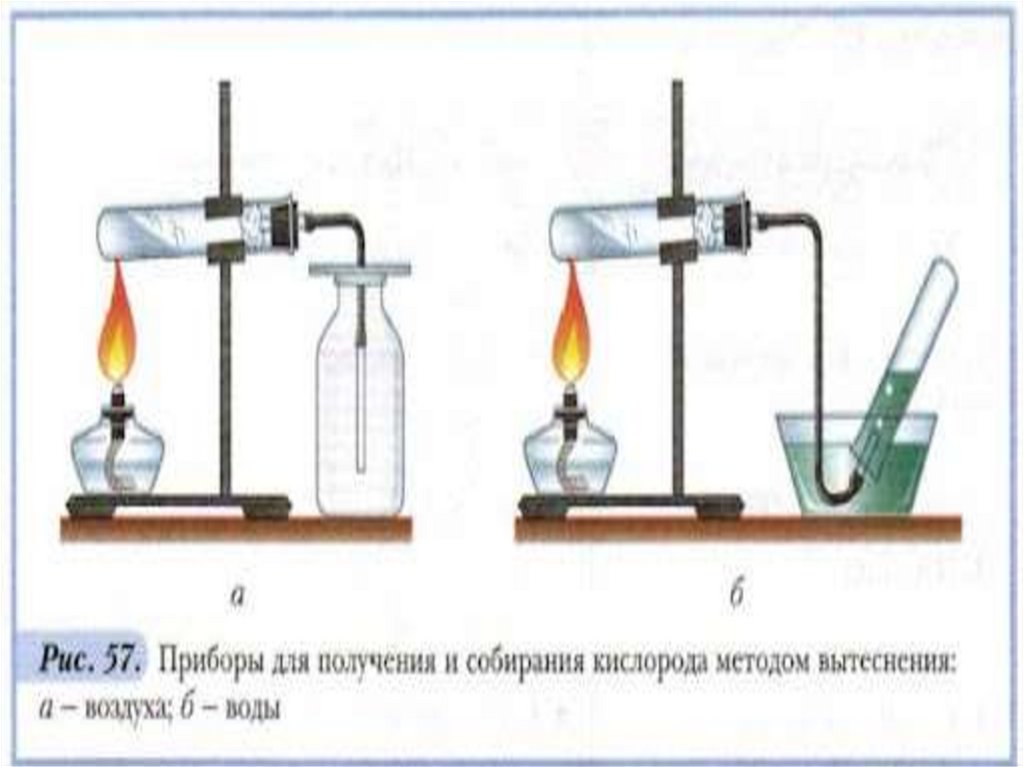
Промышленный способ (перегонкажидкого воздуха).
Лабораторный способ
(разложение некоторых
кислородосодержащих веществ)
2KClO3 –t ;MnO2 2KCl + 3O2
2H2O2 –MnO2 2H2O + O2
Перманганата калия при нагревании:
2KMnO4 –t K2MnO4 + MnO2 + O2
Разложение этой соли идёт при
нагревании её выше 2000 С.
21.11.2022
11
12.
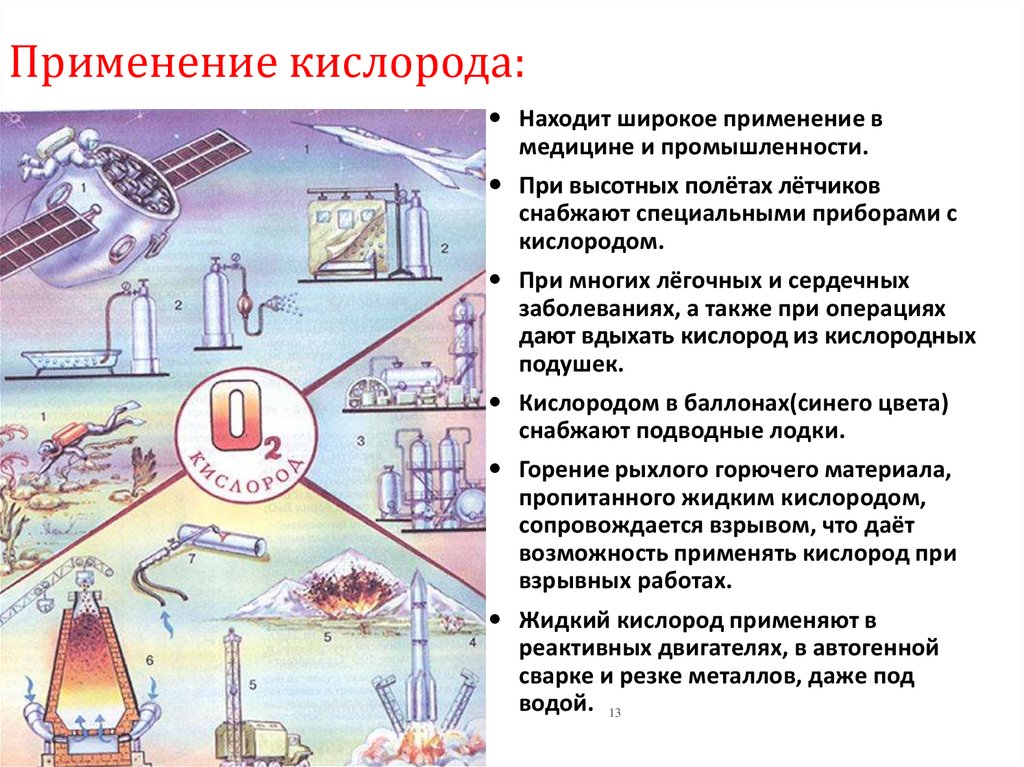
13. Применение кислорода:
Находит широкое применение вмедицине и промышленности.
При высотных полётах лётчиков
снабжают специальными приборами с
кислородом.
При многих лёгочных и сердечных
заболеваниях, а также при операциях
дают вдыхать кислород из кислородных
подушек.
Кислородом в баллонах(синего цвета)
снабжают подводные лодки.
Горение рыхлого горючего материала,
пропитанного жидким кислородом,
сопровождается взрывом, что даёт
возможность применять кислород при
взрывных работах.
21.11.2022
Жидкий кислород применяют в
реактивных двигателях, в автогенной
сварке и резке металлов, даже под
водой. 13
14. Заключение
•На этом уроке мы узнали о кислороде –элементе и простом веществе,
•О физических свойствах кислорода,
•О химических свойствах кислорода,
•О том, что такое оксиды,
•О том, что такое реакции окисления и
горения.
•Впереди у нас новые открытия!










 Химия
Химия








