Похожие презентации:
Количество вещества. Моль. Молярная масса
1. Тема урока «Количество вещества. Моль. Молярная масса»
2.
Химия — это наука о веществах,их свойствах и превращениях.
3. Химия – это наука о веществах. Как измерять вещество? В каких единицах?
• Масса измеряется в граммах, килограммах, тоннах• Длина – в сантиметрах, метрах, километрах
• Объём - в литрах, метрах куб.
• Для измерения вещества была выбрана особая
единица, в которой как бы соединились число
молекул и масса вещества.
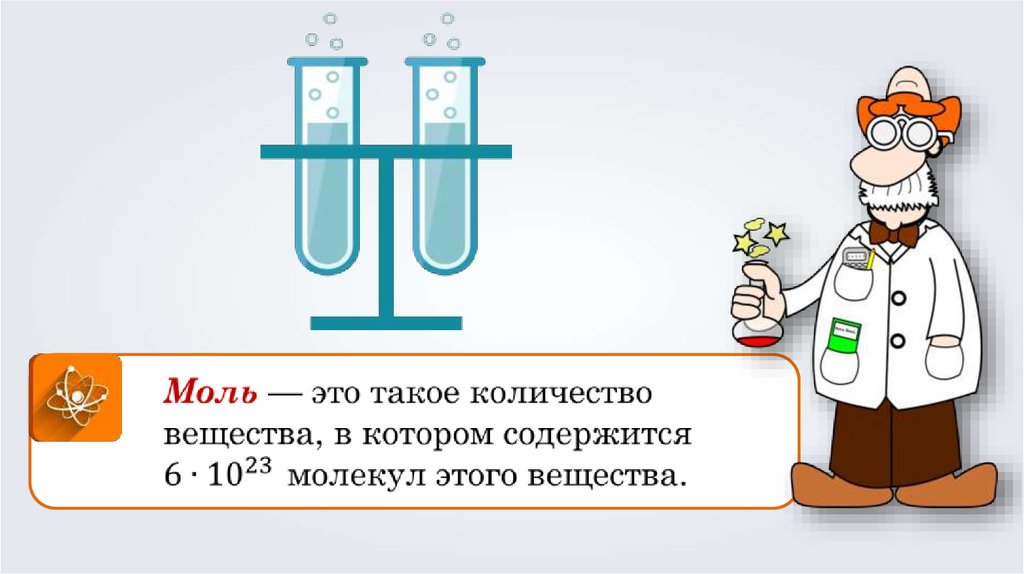
• Эта единица названа МОЛЬ
4.
КГRei-artur
км
5.
веществомолекула
6.
Как отмерить 1 моль вещества?1г
1г
1г
Необходимо взять столько граммов
вещества, какова относительная
атомная или относительная
молекулярная масса этого вещества.
7. Химия – это наука о веществах. Как измерять вещество? В каких единицах?
• Масса измеряется в граммах, килограммах, тоннах• Длина – в сантиметрах, метрах, километрах
• Объём - в литрах, метрах куб.
• Для измерения вещества была выбрана особая
единица, в которой как бы соединились число
молекул и масса вещества.
• Эта единица названа МОЛЬ
8.
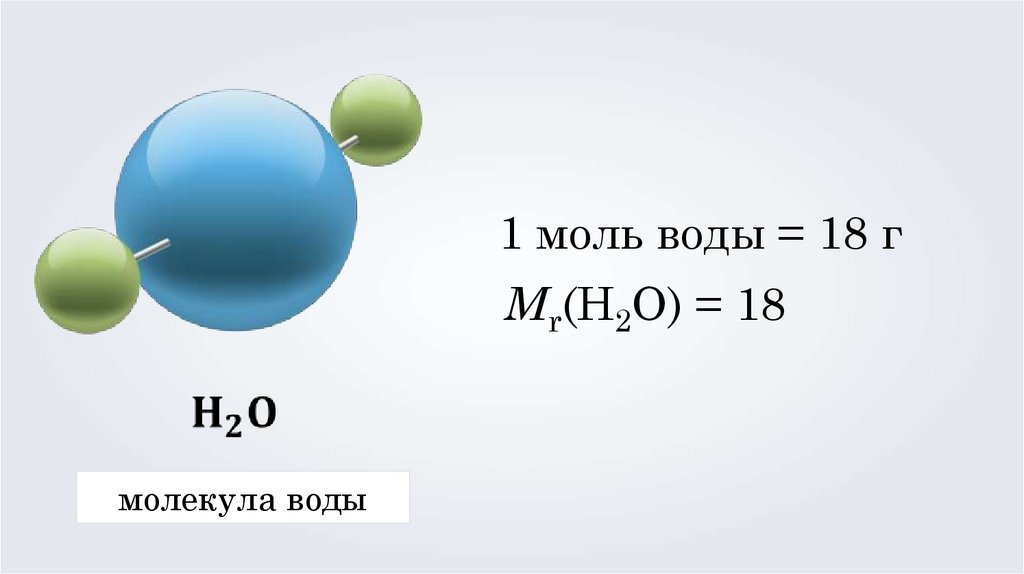
1 моль воды = 18 гMr(H2O) = 18
молекула воды
9.
1 моль кислорода = 32 гMr(O2) = 32
молекула кислорода
10. Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная атомная масса Аr или относительная
молекулярная масса Мr вещества1 моль воды = 18г, т.к. Мr (Н2О) = 18;
1 моль кислорода = 32г, т.к. Мr (О2) = 32;
1 Моль железа =
Соответственно 0,5 моль имеет массу вдвое меньше:
0,5 моль воды = ;
0,5 моль кислорода =
0,5 моль железа =
11.
12.
При одинаковых температуреи давлении в равных объёмах
идеальных газов содержится
одинаковое число молекул.
NA – постоянная Авогадро.
Лоренцо Авогадро
(1776 – 1856 гг.)
13.
14.
15.
16.
Число молекул (N)17.
Число молекул (N)18.
М — молярная массаM = 1 г/моль
М (Н2) = 2 г/моль
М (FeS) = 88 г/моль
М (Fe) = 56 г/моль
М (S) = 32 г/моль
19.
М — молярная массаM = 1 г/моль
М (Н2) = 2 г/моль
М (FeS) = 88 г/моль
М (Fe) = 56 г/моль
М (S) = 32 г/моль
киломоль: 1 кмоль = 1000 моль
миллимоль: 1 ммоль = 0,001 моль
20.
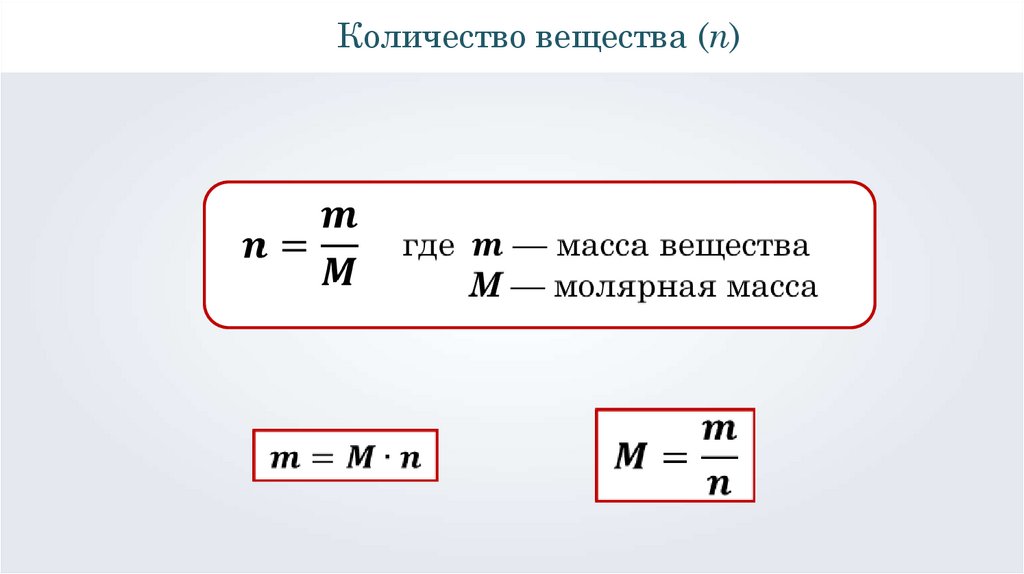
Количество вещества (n)21.
Молярная масса — физическаявеличина, которая равна отношению
массы вещества к его количеству.
22. Задание. Заполните таблицу.
Вещество Молярная Количестмасса
во
вещества
СО2
Н2SO4
О3
АI2О3
Масса
Число
моле
кул
0,5 моль
24,5 г
12*10 23
2 моль



















 Химия
Химия








