Похожие презентации:
Алюминий. «Серебро из глины»
1. АЛЮМИНИЙ
2. «Серебро из глины»
Немецкий учёный Ф. Велер(1827 г.) получил алюминий
при нагревании хлорида
алюминия со щелочными
металлами калий и натрий.
А.Сент-Клер Девиль.
Впервые получил
алюминий
промышленным
способом (1855г.).
3. Из истории открытия
В период открытия алюминия металл был дороже золота.Англичане хотели почтить
богатым подарком великого
русского химика Д.И Менделеева,
подарили ему химические весы, в
которых одна чашка была
изготовлена из золота, другая - из
алюминия. Чашка из алюминия
стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только
учёных, но и промышленников и
даже императора Франции.
4. АЛЮМИНИЙ. нахождение в природе
Алюмосиликаты:Глина –
Al2O3*nSiO2*mH2O
Бокситы – Al2O3*nH2O
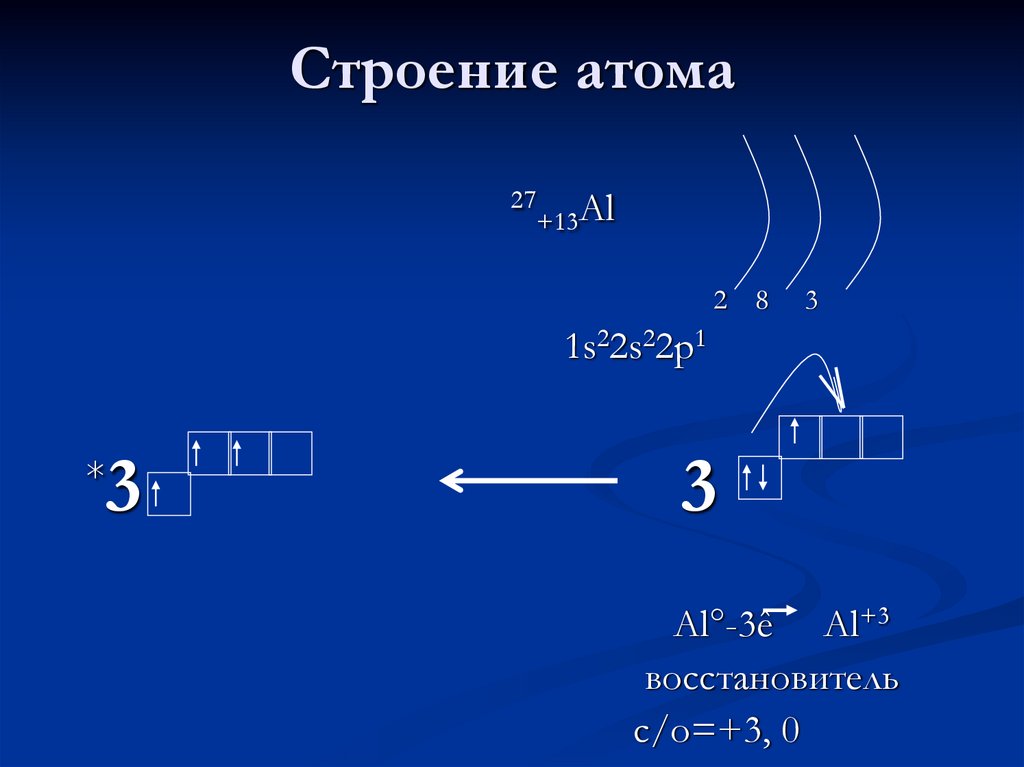
5. Строение атома
27+13Al
2 8
3
1s22s22p1
*
3
3
Al°-3ê Al+3
восстановитель
с/о=+3, 0
6. ФИЗИЧЕСКИЕ СВОЙСТВА
Al-серебристо-белый металлМягкий, пластичный (легко
вытягивается в проволоку и
раскатывается в листы),
легкий (плотность
2,7г/см3)
Хорошо проводит тепло и
электрический ток
Температура плавления 660°С
Особо чистый Аl хорошо
отражает солнечные лучи
7. ХИМИЧЕСКИЕ СВОЙСТВА
Al – активный металл. Навоздухе всегда покрыт
пленкой Al2O3.
Поэтому при обычных
условиях не вступает во
взаимодействие с
другими веществами.
8. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
При обычных условияхВзаимодействие с
кислородом:
4Al+ 3O2 =2Al2O3 +Q
Взаимодействие с
галогенами:
2Al+ 3Br2 =2Al2Br3
При нагревании
Взаимодействие с
углеродом:
4Al+3C=Al4C3 (1500-1700°C)
Взаимодействие с серой:
2Al+3S= Al2S3 (150-170°C)
9. Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный отоксидной пленки)
Al +H2O=Al(OH)3 +H2
Подберите коэффициенты
10. Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный отоксидной пленки)
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами кислот
Al +HCl= AlCl3 + H2
Подберите коэффициенты
11. Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный отоксидной пленки)
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl3 + 3H2
Взаимодействует с растворами щелочей
Al+ NaOH + H2O=Na[Al(OH)4]+H2
тетрагидроксоалюминат
натрия
Подберите коэффициенты
12. Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный отоксидной пленки)
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl3 + 3H2
Взаимодействует с растворами щелочей
2Al+ 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
тетрагидроксоалюминат
натрия
13. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и HNO3
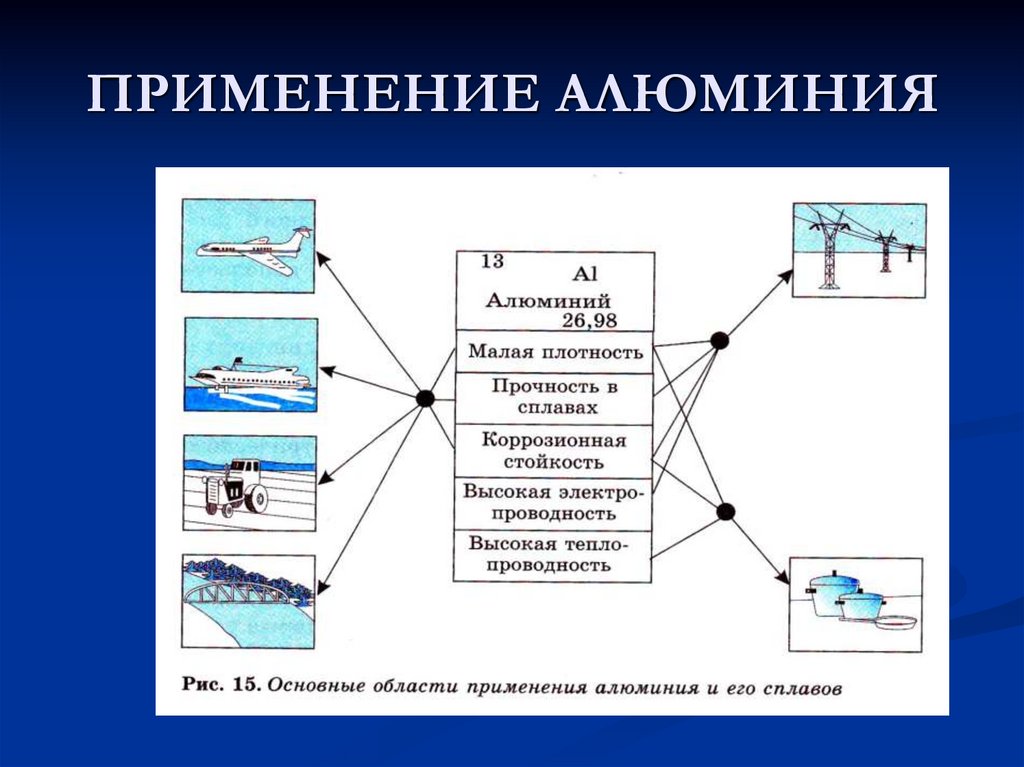
14. ПРИМЕНЕНИЕ АЛЮМИНИЯ
15. ПРИМЕНЕНИЕ АЛЮМИНИЯ
16. Металл будущего
Вывод: Обладая такими свойствами каклёгкость, прочность,
коррозионноустойчивость, устойчивость к
действию сильных химических реагентов алюминий нашёл большое занимают в
авиационном и космическом транспорте
применение во многих отраслях народного
хозяйства. Особое место алюминий и его
сплавы, электротехнике, а за ними будущее
нашей науки и техники.














 Химия
Химия








