Похожие презентации:
Окислительно-восстановительные методы. Часть 2
1.
Федеральное государственное бюджетное образовательноеучреждение высшего образования «Красноярский
государственный медицинский университет имени профессора В.Ф.
Войно-Ясенецкого» Министерства здравоохранения Российской
Федерации
Окислительновосстановительные методы
(2)
к.п.н. Агафонова И.П.
2.
Броматометрия3.
ТИТРАНТброматометрического титрования
0,1 моль/л
KBrO3
Первичный стандартный раствор (раствор с
приготовленным титром)
Не меняет свой титр в течение длительного времени
(около 6 месяцев).
Стандартизацию раствора проводят иодометрически:
2KBrO3 + 10KI + 12HCl → 5I2 + 3KCl + 6H2O,
Выделившийся иод титруют стандартным раствором
Na2S2O3
4.
Броматометрическое титрованиеоснованное на окислении
определяемого вещества броматом
в кислой среде
ВrОз- + 6Н+ + 6е→ Вr- +ЗН2О
основанное на окислении определяемого
вещества Br2, получаемый в реакции KBrO3 и
KBr в кислой среде
ВrОз- + 5 Вr- +6Н+ + 6е→ 3 Br2 +ЗН2О
бромометрия
5.
ИндикаторыМетиловый красный
Метиловый оранжевый
6.
Способ обнаружения конечной точкиброматометрического титрования
Прямое титрование
(KBrO3 , KBrO3 и KBr)
ВrОз- + Red → Вr- +…
избыт. ВrОзBr2
Изменение окраски
индикатора
Обратное брометрическое
титрование
Br2 + 2KI = I2 + 2KBr
избыток
ттитруют стандартным
раствором Na2S2O3
Появление желтого
окрашивания
обратимые
необратимые
7.
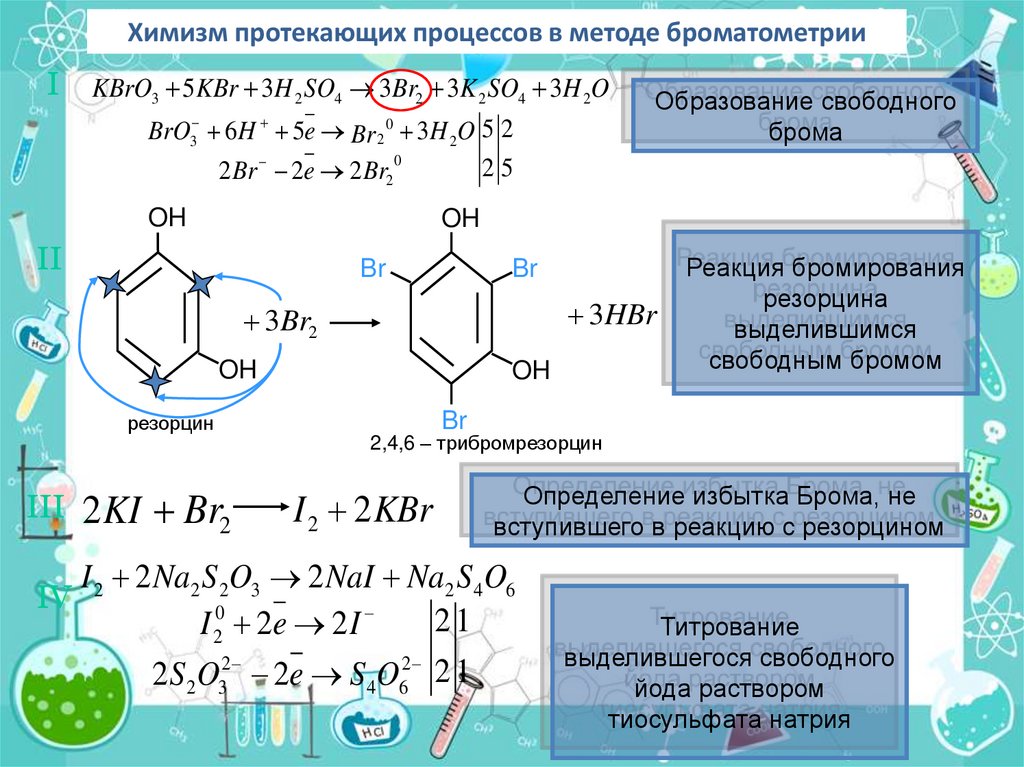
Химизм протекающих процессов в методе броматометрииI KBrO3 5KBr 3H 2 SO4 3Br2 3K 2 SO4 3H 2O
3
BrO 6 H 5e Br 2 3H 2O 5 2
0
25
2 Br 2e 2 Br2
0
OH
Образование свободного
брома
OH
II
Br
Br
3HBr
3Br2
OH
резорцин
III 2 KI Br2
OH
Реакция бромирования
резорцина
выделившимся
свободным бромом
Br
2,4,6 – трибромрезорцин
I 2 2 KBr
Определение избытка Брома, не
вступившего в реакцию с резорцином
I 2 Na2 S 2O3 2 NaI Na2 S 4O6
IV 2
21
I 20 2e 2 I
2S 2O32 2e S 4O62 2 1
Титрование
выделившегося свободного
йода раствором
тиосульфата натрия
8.
Этапы титрованияСнова
в темное
В темное
место на 10 минут
место на 10
минут
Na2S2O3
KI 5% (5 мл)
H2SO4 2 моль/л
(5 мл)
KBr (0,1 г)
KBrO3
(10 мл)
Этап I
Резорцин (5 мл)
Этап II
Этап III
9.
Формула для расчета массовой долирезорцина:
С%
(V( KBrO3 ) K П VNa2 S2O3 K П ) TKBrO3 / резорцин 100%
TKBrO3 / резорцин
m( резорцина )
CЭ ( KBrO3 ) M э ( резорцин)
1000
10.
НИТРИТОМЕТРИЯ11.
Применение12.
13.
ТИТРАНТнитритометрического титрования
0,1 моль/л
NaNO2
Вторичный стандартный раствор (раствор с
установочным титром)
Для стандартизации
раствора NaNO2
сульфаниловая кислота
Первичные стандартные растворы
перманганатометрического титрования
14.
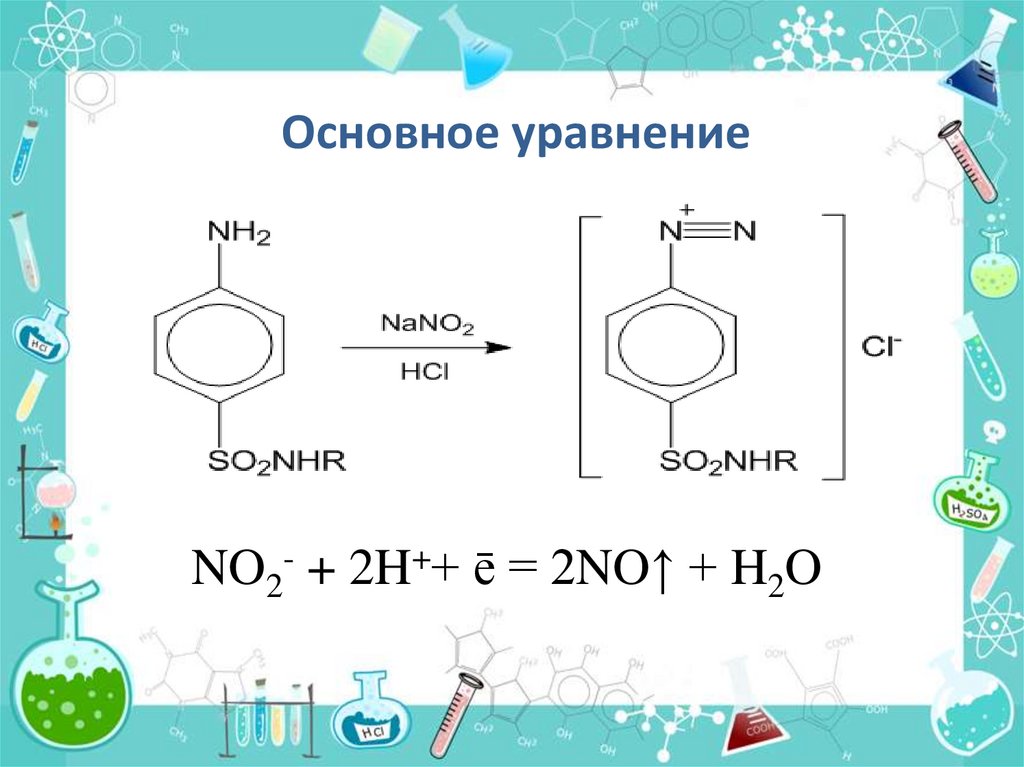
Основное уравнениеNO2- + 2H++ ē = 2NO↑ + H2O
15.
1) Стандартизация NaNO25NaNO2 + 2КМпО4 + 3H2SO4 → 5NaNO3 + 2MnSO4 +
+K2SO4 +3H2О
NO2- + H2O - 2e →NО3-+ 2H+
MnO4- + 8H+ + 5e →Mn2+ + 4H2O
2КМnО4 +10КI + 8H2SO4 → 2MnSО4 + 5I2 + 6K2SO4 +
+8Н2О
MnО4- + 8Н+ + 5е → Mn2+ + 4Н2О
2I- -2е- → I2°
I2 + 2Na2S2О3 → 2NaI + Na2S4O6
16.
Молярную концентрацию эквивалента растворанитрита натрия определяют по формуле:
17.
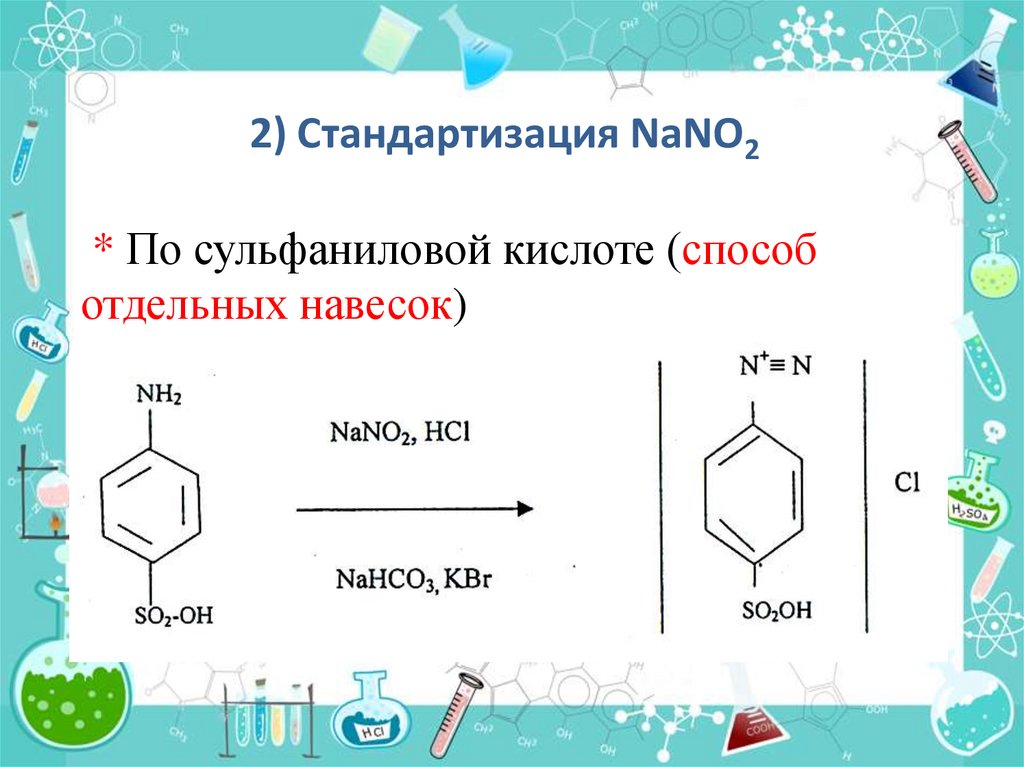
2) Стандартизация NaNO2* По сульфаниловой кислоте (способ
отдельных навесок)
18.
Молярную концентрацию эквивалентараствора нитрита натрия определяют по
формуле:
m
C ( NaNO )
M
сульфаниловой кислоты
2
сульфаниловой кислоты
1000
V
NaNO2
М (сульфаниловая кислота) = 173,19 г/моль
19.
Фиксирование точки эквивалентностивнешний индикатор:
-йодкрахмальная
бумага;
- раствор
флавокридина
гидрохлорида и др. )
внутренний индикатор
- тропеолин 00;
-тропеолин 00 в смеси с
метиленовым синим;
-тропеолин 00 в смеси с
нейтральный красный и
др.)
электрометрическими методами
20.
Фиксирование точки эквивалентностиВнешний индикатор
Титруемый раствор
йодокрахмальная бумага
IИзбыток NaNO2
I2
крахмал
21.
Фиксирование точки эквивалентностиВнутренний индикатор
Тропеолин 00
КРАСНЫЙ
ЖЕЛТЫЙ
смесь тропеолина 00 с метиленовым синим
КРАСНО-ФИОЛЕТОВЫЙ
ГОЛУБОЙ
смесь тропеолина 00 с нейтральный красный
МАЛИНОВЫЙ
СИНИЙ
22.
Условия титрования- температура не более 18-200С;
- титрование при рН<7;
- введение катализатора - бромида
калия;
- медленное титрование в конце.



















 Химия
Химия








