Похожие презентации:
Свойства растворов высокомолекулярных соединений
1. Свойства растворов ВМС
2.
ПЛАН1. Характеристика и классификация ВМС.
2. Свойства растворов ВМС
3. Нарушение устойчивости растворов ВМС.
3.
Высокомолекулярные соединения (ВМС) – это вещества, молекулыкоторых состоят из большого числа химически связанных атомов и имеют
высокую молярную массу M > 5000 г/моль.
Молекулы ВМС представляют собой длинные цепи, состоящие из
многократно повторяющихся группировок атомов (-CH2-CH2-)n, которые
формируются из большого числа мономерных звеньев -CH2-CH2-,
соединенных между собой химическими связями, поэтому их называют
макромолекулами.
Классификация ВМС
Основные виды классификации ВМС
состав
природа
неорганические естественные
органические
искусственные
синтетические
структура
линейные (одномерные)
плоскостные (двухмерные)
объемные (трехмерные)
4.
К неорганическим полимерам с цепным строением следует отнестипластическую серу, алюмосиликаты, поликремниевые кислоты.
Класс органических полимеров многочисленен.
К ним относятся природные полимеры:
- углеводороды (натуральный каучук);
- углеводы (целлюлоза, агар-агар, гуммиарабик, гликоген, крахмал);
- белки (альбумин, миозин, гемоглобин, желатин);
- нуклеиновые кислоты (ДНК, РНК).
К искусственным полимерам относят ВМС, полученные путем
специальной химической обработки природных полимеров.
В настоящее время в технике и быту широко используются
синтетические высокомолекулярные продукты (синтетические каучуки,
пластмассы, синтетические волокна, смолы, лаки, краски и т.д.
Биополимеры – это высокомолекулярные вещества, обеспечивающие
жизнедеятельность живых систем.
К ним относятся: белки, нуклеиновые кислоты (ДНК и РНК),
полисахариды – целлюлоза, крахмал, гликоген.
5.
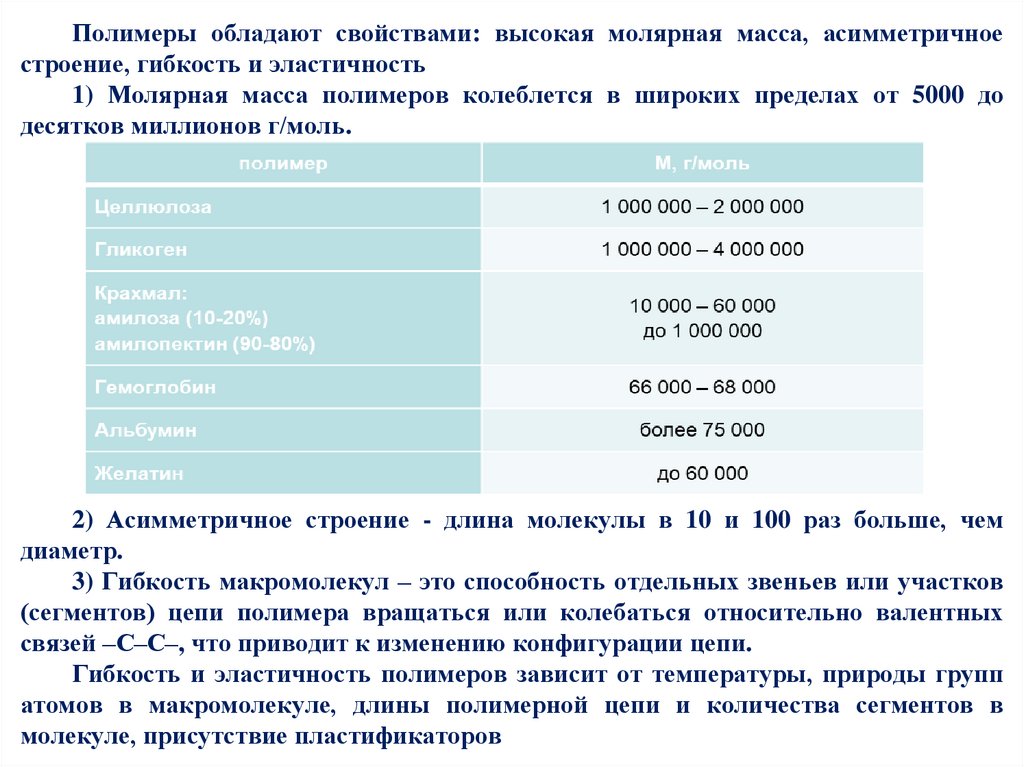
Полимеры обладают свойствами: высокая молярная масса, асимметричноестроение, гибкость и эластичность
1) Молярная масса полимеров колеблется в широких пределах от 5000 до
десятков миллионов г/моль.
2) Асимметричное строение - длина молекулы в 10 и 100 раз больше, чем
диаметр.
3) Гибкость макромолекул – это способность отдельных звеньев или участков
(сегментов) цепи полимера вращаться или колебаться относительно валентных
связей –С–С–, что приводит к изменению конфигурации цепи.
Гибкость и эластичность полимеров зависит от температуры, природы групп
атомов в макромолекуле, длины полимерной цепи и количества сегментов в
молекуле, присутствие пластификаторов
6.
2. Свойства растворов ВМСПри растворении ВМС наблюдается процесс сольватации –
взаимодействие молекул растворителя с соответствующими группами
полимера с образованием сольватных оболочек.
Если между полимером и растворителем нет сродства, то получить
раствор ВМС невозможно.
Если растворитель вода, то процесс называется гидратацией.
- Полимеры образуют истинные растворы, в которых частицами
дисперсной фазы являются макромолекулы, что обусловлено их
асимметричностью и мощной сольватной оболочкой.
Из-за отсутствия физической поверхности раздела между дисперсной
фазой и средой - система гомогенна .
- В концентрированных растворах полимеров появляется вероятность
столкновения макромолекул, что приводит к образованию ассоциатов за
счет взаимодействия между участками, лишенными сольватных оболочек.
- Ассоциаты существуют кратковременно, распадаются и вновь
образуются в различных участках объема системы и не являются
постоянными кинетическими единицами.
Растворы ВМС являются истинными растворами, проявляющими
общие свойства с растворами низкомолекулярных соединений.
7.
Свойства растворов ВМС общие с истинными растворами НМССамопроизвольность образования
- при образовании раствора ВМС система переходит из гетерогенного
состояния (сухой полимер – растворитель) в гомогенное (истинный
раствор полимера), что приводит к уменьшению поверхностной энергии
(∆G < 0) и увеличению энтропии;
растворение
полимеров
экзотермический
процесс,
т.к.
сопровождается сольватацией (гидратацией) соответствующих групп
атомов, и ∆Н системы < 0
Термодинамическая устойчивость
С термодинамической точки зрения самопроизвольное протекание
процесса обеспечивают энтальпийный (∆H < 0) и энтропийный (∆S > 0)
факторы.
Устойчивость растворов ВМС обусловлена их гомогенностью и
отсутствием стремления системы к уменьшению поверхностной энергии, а
также
самопроизвольным
образованием
растворов,
которое
сопровождается уменьшением свободной энергии (∆G < 0).
Обратимость
Обратимость – это способность растворов ВМС обратимо изменять
свои свойства при изменении определенных факторов (концентрации,
температуры, давления, рН среды и т.д.).
8.
Свойства растворов ВМС общие с коллоиднымирастворами
- Одинаковая степень дисперсности
- Малая скорость диффузии
- Не способность макромолекул проникать через
полупроницаемые мембраны
Особые свойства растворов ВМС
• Аномально высокая вязкость
• Более
высокое
осмотическое
давление,
чем
рассчитанное по уравнению Вант-Гоффа
• Защитное действие ВМС по отношению к коллоидным
растворам
• Явление коацервации
• Способность к желатинированию (структурированию)
9.
Основные причины высокой вязкости растворов ВМС :- длинные разветвленные макромолекулы не способны
ориентироваться в одном слое текущей жидкости, попадая в
слои, текущие с меньшей скоростью, они замедляют течение
жидкости, что приводит к увеличению вязкости;
- в результате сольватации макромолекул в растворах
уменьшается доля свободного растворителя, что приводит к
уменьшению текучести раствора;
- в концентрированных растворах ВМС макромолекулы
образуют внутренние структуры, иммобилизирующие часть
растворителя, что приводит к резкому повышению вязкости.
Вязкость - мера сопротивления среды движению.
Вязкость растворов ВМС зависит:
- от концентрации вещества в растворе,
- от давления,
- от свойств и температуры растворителей.
10.
Осмотическое давление. В растворе ВМС осмотически активнымичастицами являются не макромолекулы, а их сегменты. Чем больше
гибкость полимера, тем больше сегментов и соответственно выше
осмотическое давление раствора.
Зависимость осмотического давления от концентрации для растворов НМС (1) и
растворов ВМС (2)
Уравнение Галлера
Росм = RТ/М · С + βС2
где β – коэффициент, учитывающий гибкость и форму макромолекулы в
растворе.
Онкотическое давление - часть осмотического давления крови,
создаваемая растворенными в ней белками.
11.
Свойства растворов полиэлектролитовПолиэлектролиты
это
высокомолекулярные
соединения,
макромолекулы которых содержат полярные ионогенные группы.
Полиэлектролиты способны диссоциировать в растворах на ионы.
Изоэлектрическое состояние
Белки содержат группы как кислотного, так и основного характера,
поэтому они относятся к полиамфолитам.
Знак заряда макромолекулы зависит от количества и природы
свободных функциональных групп, рН среды
Состояние, при котором число разноименных зарядов в белковой
молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю,
называется изоэлектрическим.
Значение
рН
раствора,
соответствующее
изоэлектрическому
состоянию, называется изоэлектрической точкой (pI).
В среде с pH < pI ионизация карбоксильных групп подавлена и белок
приобретает положительный заряд.
В среде pH > pI карбоксильные группы депротонированы и белок
заряжается отрицательно.
12.
Набухание - увеличение объема и массы ВМС во временипри его взаимодействии с растворителем.
Процесс набухания происходит в две стадии:
1. Сольватационная, с поглощением малого количества
растворителя. Процесс экзотермичен.
ΔН < 0, ΔS ≈ 0, однако ΔН > ТΔS и ΔG < 0.
2. Поглощение большого количества жидкости.
ΔН ≈ 0, ΔS > 0, поэтому ТΔS > 0 и ΔG ≈ - ТΔS < 0.
Процесс набухания самопроизвольный.
Неограниченное - заканчивается растворением.
Процесс идёт самопроизвольно с увеличением энтропии
системы.
Ограниченное - не переходящее в растворение.
Заканчивается образованием эластичного студня.
13.
где m0, m - массы и v0, v - объём исходной и набухшей ВМС.Степень набухания полимера зависит от:
- природы полимера и растворителя;
- наличия посторонних электролитов;
- температуры;
- степени гидратации аниона
CNS->I->Br->NO3->Cl->H2O>CH3COO->CrO42->F->SO42слева направо – набухание подавляется
- рН среды (степень набухания белка минимальна в области ИЭТ).
Тиксотропия – это свойство концентрированных растворов ВМС
обратимо изменять вязкость под влиянием механического
воздействия.
14.
3. НАРУШЕНИЕ УСТОЙЧИВОСТИ РАСТВОРОВ ВМС.Коацервация – это разделение раствора ВМС на концентрированный и
разбавленный растворы.
Коацервация происходит при изменении температуры или состава раствора,
обусловлена понижением взаимной растворимости компонентов раствора.
На первой стадии коацервации из двух макромолекул, объединенных одной
диффузной
оболочкой,
образуется
первичная
коацерватная
(ультрамикроскопическая) капля.
Образование первичной ультрамикроскопической капли
На второй стадии из роя первичных капель образуется вторичная капля,
видимая в обычный микроскоп. Раствор разделяется на концентрированный и
разбавленный.
Вторичная коацерватная капля
При смешивании растворов противоположно заряженных белков
наблюдается комплексная коацервация, протекающая с большей
скоростью.
15.
Застудневание (желатинирование) - потеря текучести растворов ВМС.Студни или гели - нетекучие структурированные системы,
образующиеся в результате взаимодействия между макромолекулами
полимеров или коллоидными частицами.
Процесс застудневания зависит от размера, формы, природы
макромолекул, концентрации, температуры, наличия электролитов, рН
раствора и т.д.
SO42- > F- > CrO42- > CH3COO- > Cl- > NO3- > Br- > I- > CNSСтепень гидратации иона уменьшается
Застудневание усиливается
Высаливание - процесс выделения биополимеров из раствора под
действием концентрированных растворов солей.
SO42->F->CrO42->CH3COO->Cl->NO3->Br->I->CNSLi+>Na+>K+>Mg2+>Ca2+
Слева на право – высаливающий эффект усиливается
Синерезис – процесс разделения гелей и студней на две фазы.
Патологически опухоли в организме, а также секреция желёз
рассматривают как проявление синерезиса.














 Химия
Химия








