Похожие презентации:
Elektrochemische Elemente
1.
Elektrochemische Elemente1
2.
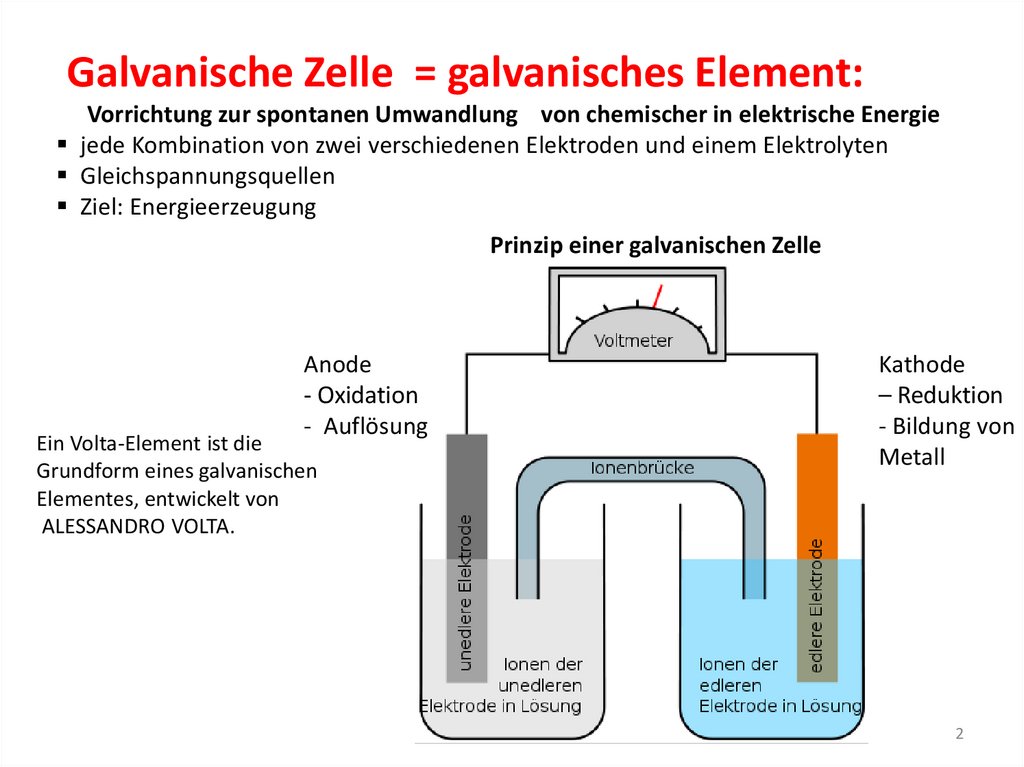
Galvanische Zelle = galvanisches Element:Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie
jede Kombination von zwei verschiedenen Elektroden und einem Elektrolyten
Gleichspannungsquellen
Ziel: Energieerzeugung
Prinzip einer galvanischen Zelle
Anode
- Oxidation
- Auflösung
Ein Volta-Element ist die
Grundform eines galvanischen
Elementes, entwickelt von
ALESSANDRO VOLTA.
Kathode
– Reduktion
- Bildung von
Metall
2
3.
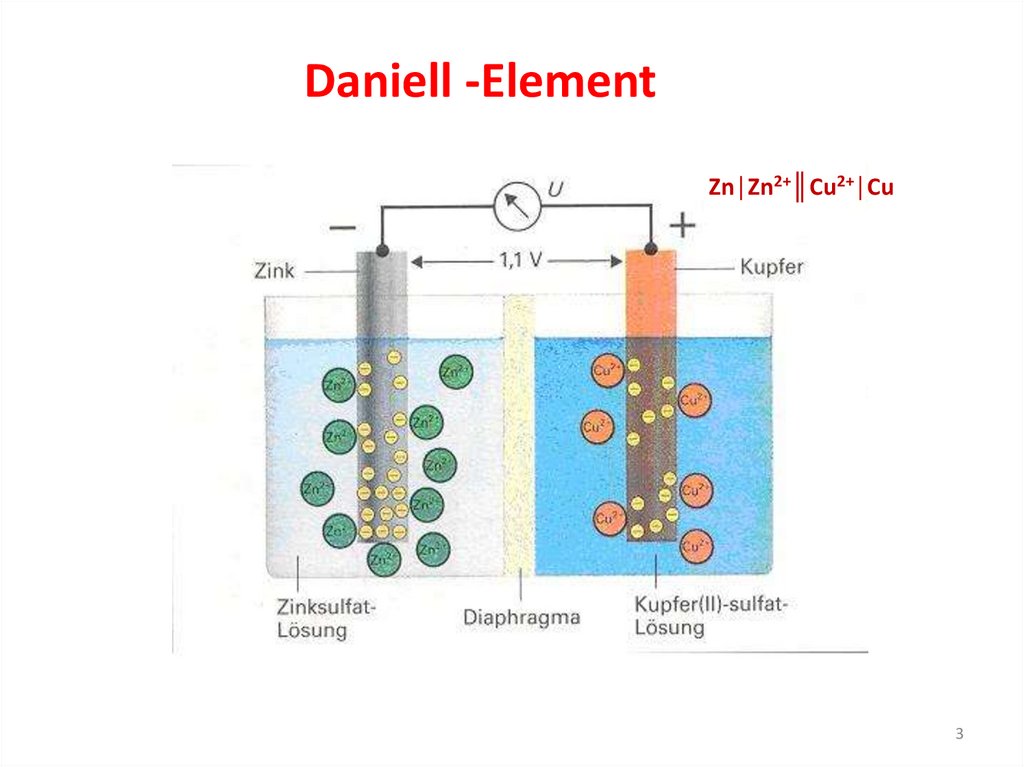
Daniell -ElementZn│Zn2+║Cu2+│Cu
3
4.
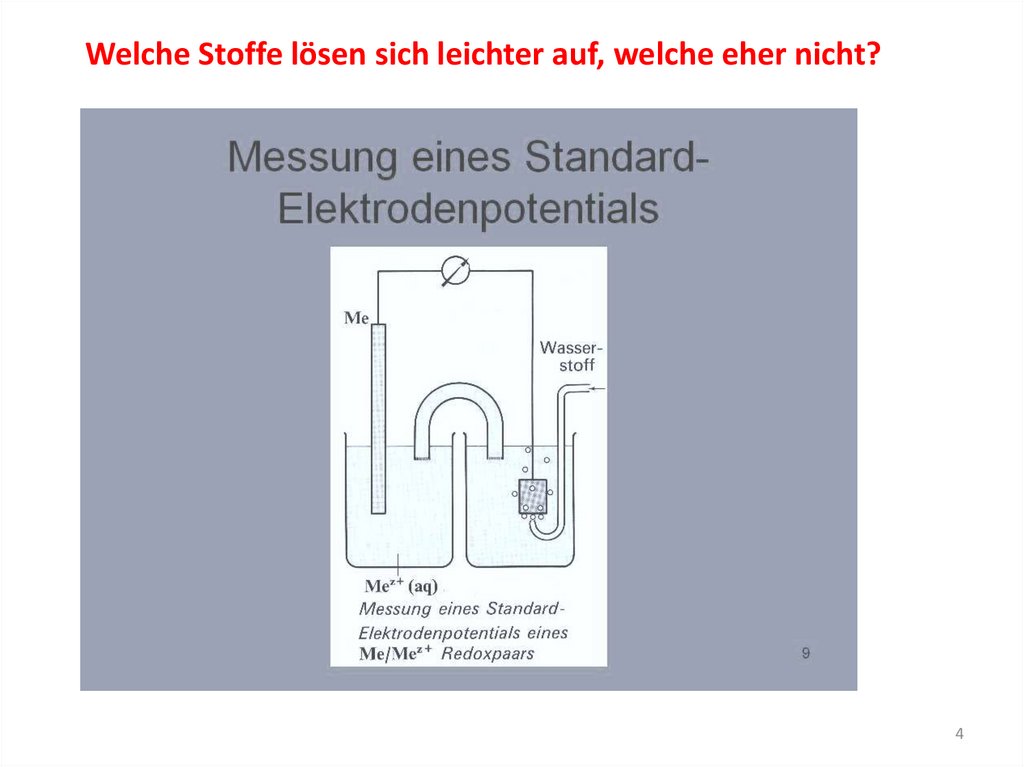
Welche Stoffe lösen sich leichter auf, welche eher nicht?4
5.
56.
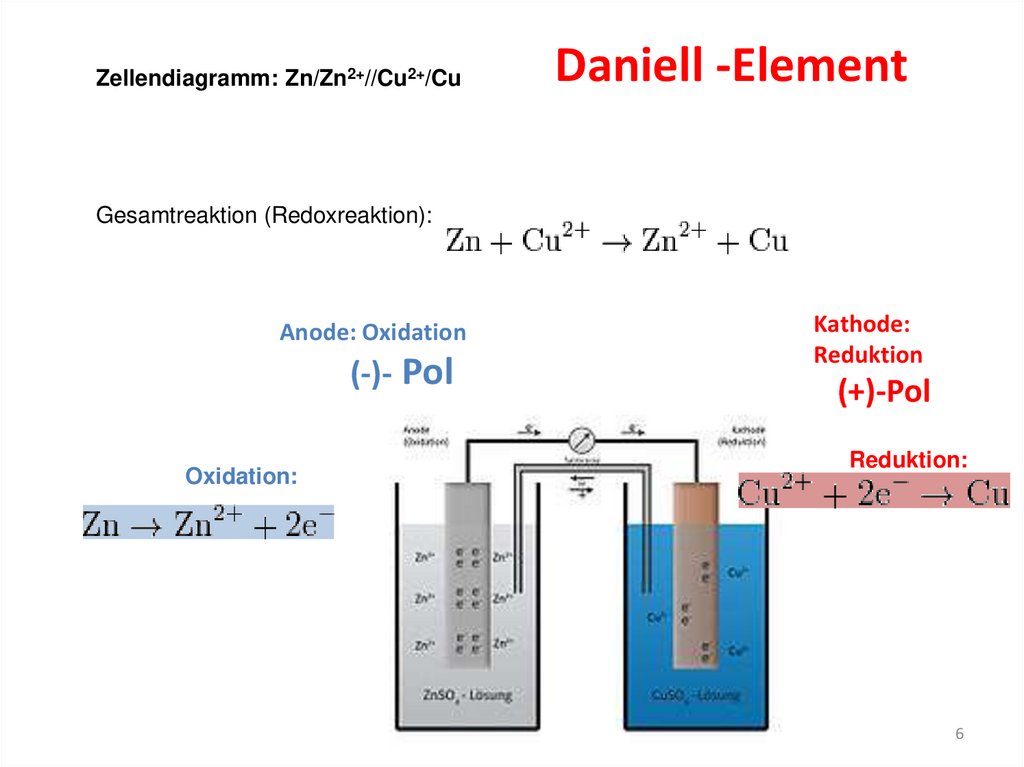
Zellendiagramm: Zn/Zn2+//Cu2+/CuDaniell -Element
Gesamtreaktion (Redoxreaktion):
Anode: Oxidation
(-)- Pol
Oxidation:
Kathode:
Reduktion
(+)-Pol
Reduktion:
6
7.
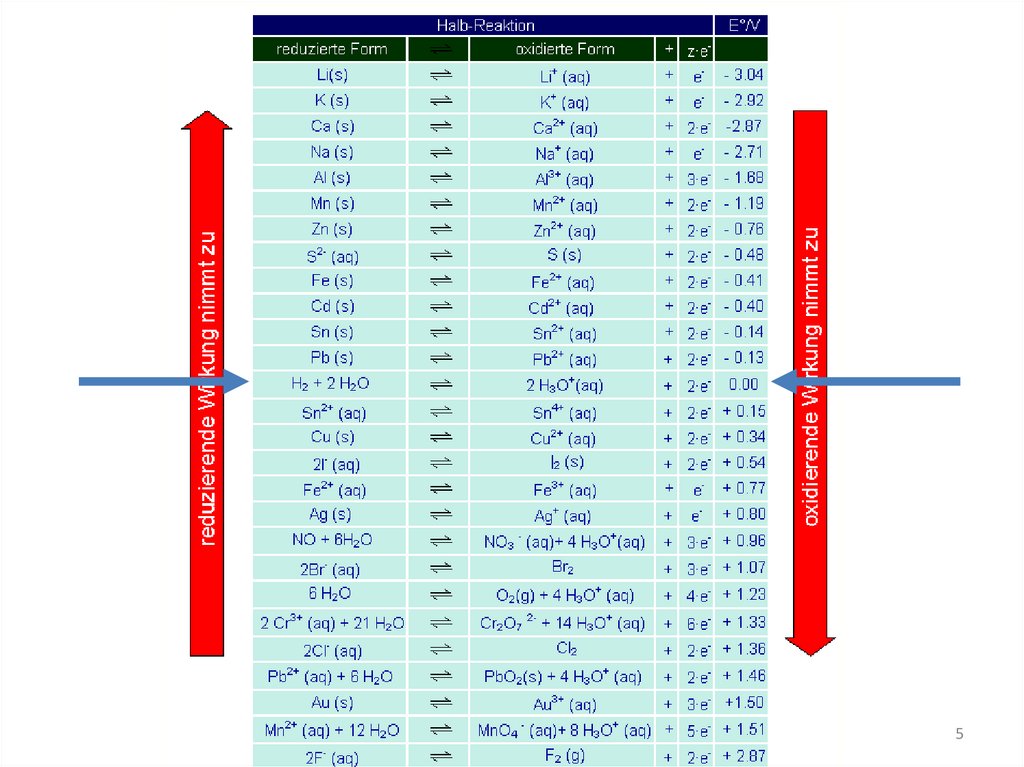
Welche Spannung wird frei?Aus den Standardpotentialen
• E° = E° (Kathode) - E°(Anode)
= E° (Pluspol) - E° (Minuspol)
Daniell-Element:
• Oxidation:
Zn → Zn2+ + 2e• Reduktion:
Cu2+ + 2e- → Cu
• Redoxreaktion: Zn + Cu2+ → Zn2+ + Cu
ΔE = E0Kathode - E0Anode
= E0Kupfer - E0Zink = 0,34 V - (-0,76 V) = 1,10 V
E = Elektromotorische Kraft EMK
7
8.
Aufgaben• Welche Metalle scheiden sich ab?
• Welche Metalle gehen in Lösung
8
9.
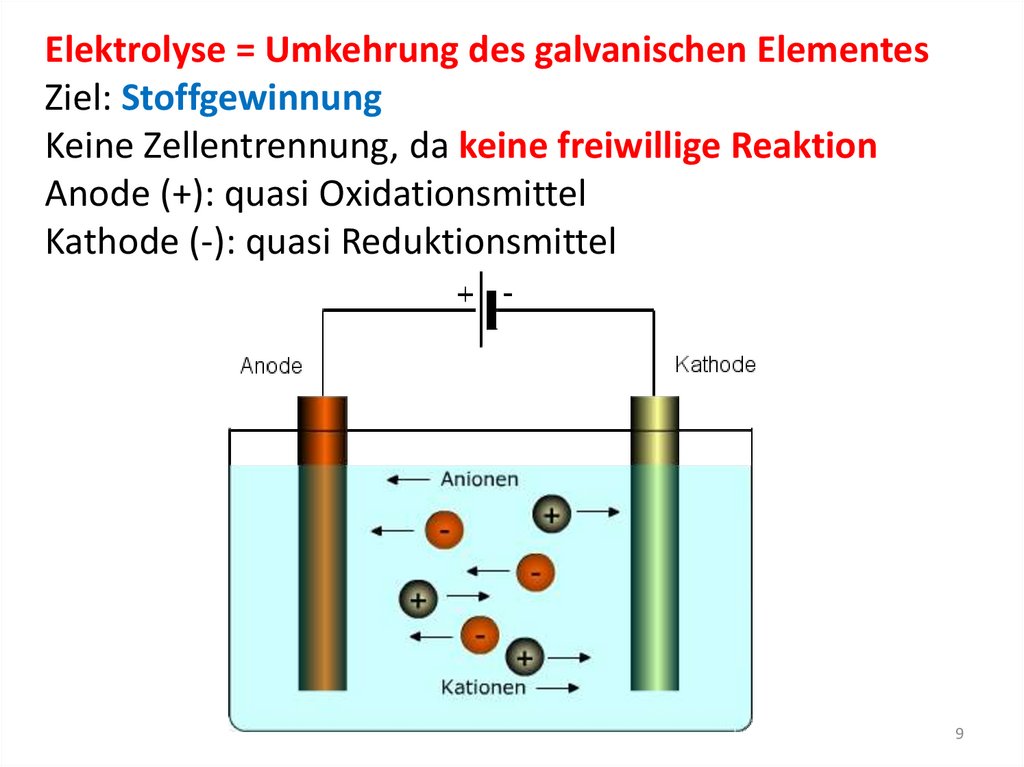
Elektrolyse = Umkehrung des galvanischen ElementesZiel: Stoffgewinnung
Keine Zellentrennung, da keine freiwillige Reaktion
Anode (+): quasi Oxidationsmittel
Kathode (-): quasi Reduktionsmittel
9
10.
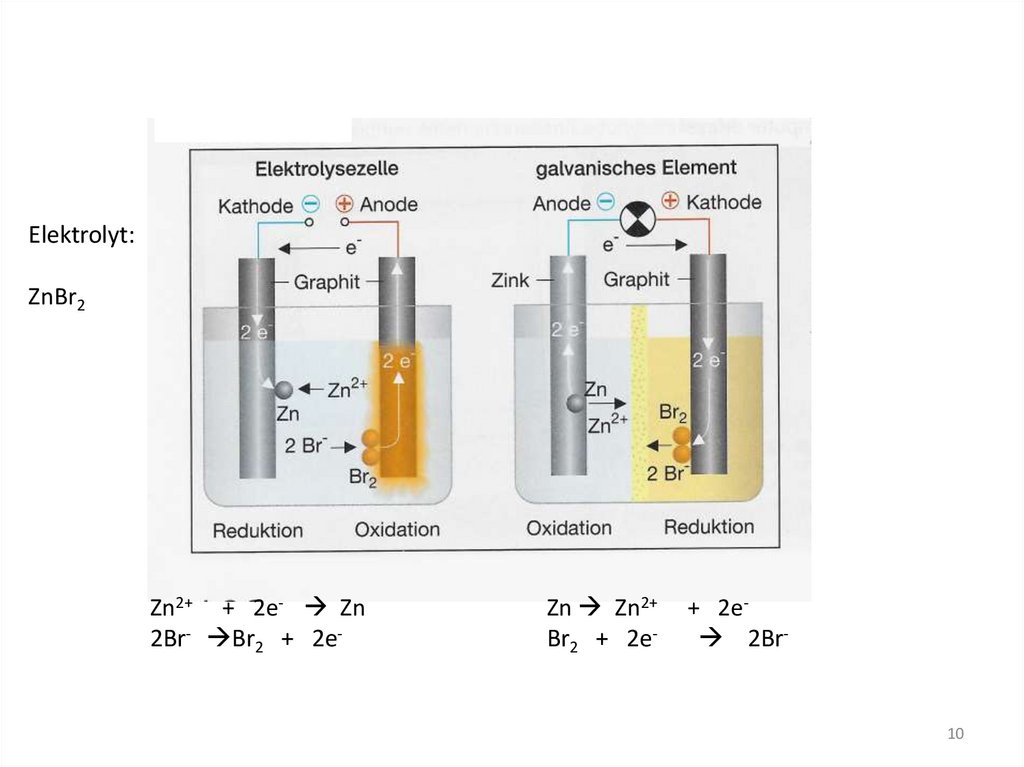
Elektrolyt:ZnBr2
Zn2+ + 2e- Zn
2Br- Br2 + 2e-
Zn Zn2+
Br2 + 2e-
+ 2e 2Br-
10
11.
ElektrolyseDurch zwei Elektroden wird ein elektrischer Gleichstrom in eine leitfähige
Flüssigkeit geleitet.
Die Spannungsquelle bewirkt einen Elektronenmangel im Pluspol = Anode
Die Spannungsquelle bewirkt einen
Elektronenüberschuss im Minuspol = Kathode
Die Lösung zwischen der Kathode und Anode enthält als Elektrolyte positiv
oder negativ geladene Ionen.
Die Kationen wandern durch das Anlegen einer Spannung zur negativ
geladenen Kathode.
An der Kathode nehmen sie ein oder mehrere Elektronen auf und werden
dadurch reduziert.
An der positiv geladenen Anode geben die Anionen Elektronen ab, werden
also oxidiert.
Die Menge der an der Anode übertragenen Elektronen ist gleich der an der
Kathode übertragenen.
11
12.
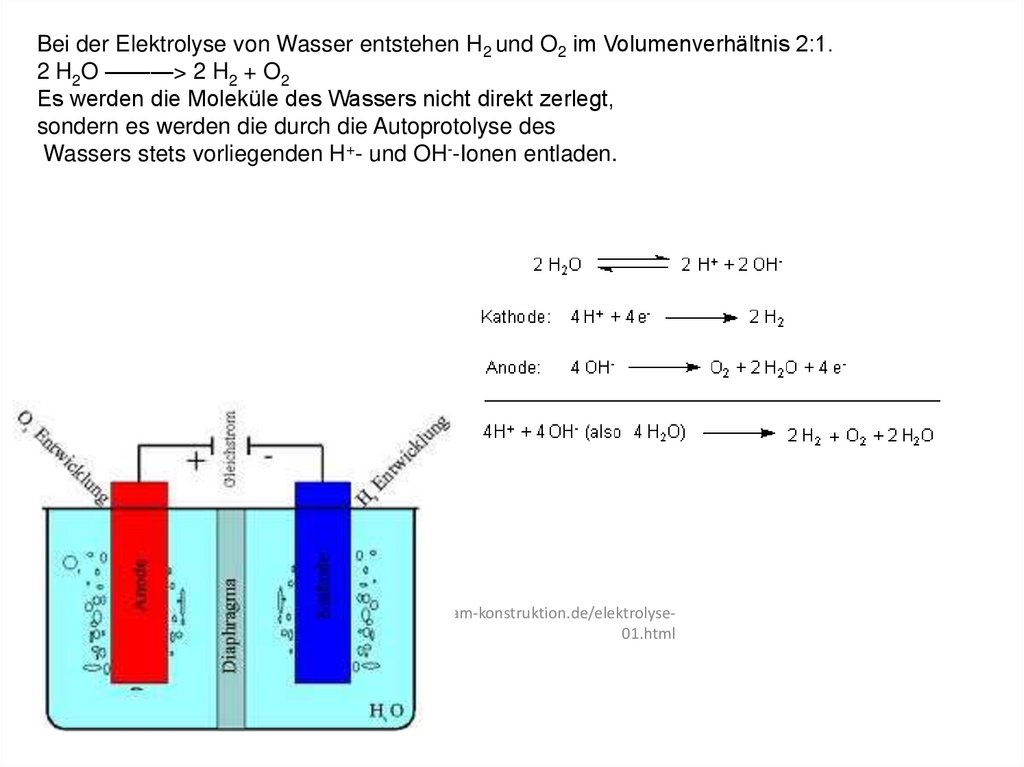
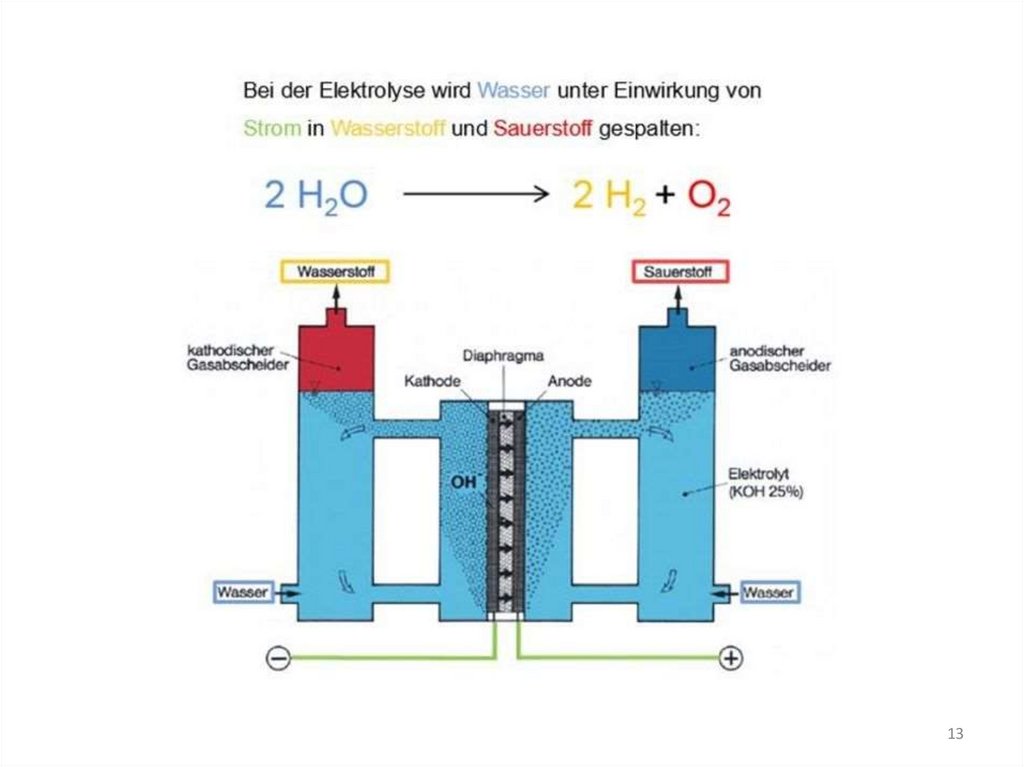
Bei der Elektrolyse von Wasser entstehen H2 und O2 im Volumenverhältnis 2:1.2 H2O ———> 2 H2 + O2
Es werden die Moleküle des Wassers nicht direkt zerlegt,
sondern es werden die durch die Autoprotolyse des
Wassers stets vorliegenden H+- und OH--Ionen entladen.
http://www.am-konstruktion.de/elektrolyse01.html
13.
1314.
1. Die Elektrolysezelle enthält Elektrolyt.2. An zwei Elektroden wird eine Spannung angelegt, wodurch ein elektrischer Strom durch
die Elektrolysezelle fließt. Dies führt zur Zersetzung der Teilchen im Elektrolyt.
3.Durch die angelegte Spannung entsteht ein Elektronenüberschuss am Minuspol (negativ
geladene Kathode). Positiv geladene Ionen (Kationen) wandern im elektrischen Feld zur
Kathode. Durch Aufnahme von Elektronen werden sie dort reduziert.
→ Es entsteht Wasserstoff.
4. Am Pluspol (positiv geladene Anode) entsteht hingegen ein Elektronenmangel. Negativ
geladene Ionen (Anionen) wandern im elektrischen Feld zur Anode. Durch Abgabe von
Elektronen werden sie dort entladen, also oxidiert.
→ Es entsteht Sauerstoff
Glossar:
Elektrolysezelle: Zelle, in der die Elektrolyse abläuft
Elektrolyt: chemische Verbindung, die im festen, flüssigen und gelösten Zustand vorkommt
und die positiv oder negativ geladene Ionen enthält z.B. Kochsalzlösung
Ion: elektrisch geladenes Atom
Elektrode: ist i.d.R. ein metallischer Leiter und dient zur Zu- oder Abführung von
elektrischem Strom in die elektrische Lösung.
Kathode: Elektrode, an der die Reduktion der Kationen (durch Aufnahme von Elektronen)
stattfindet
Anode:Elektrode, an der die Oxidation der Anionen (durch Abgabe von Elektronen) stattfin
14





 Химия
Химия


