Похожие презентации:
Расчеты по химическим уравнениям (8 класс)
1.
Урок химии в 8 классеПодготовила учитель химии и
биологии:
Раковчена Олеся Владимировна
2.
• Ознакомиться с алгоритмом решения задач• Научиться составлять краткое условие задач
• Решать задачи
3.
Закон сохранения массы веществ:Масса веществ, вступивших в
реакцию равна массе веществ,
получившихся в результате её.
4.
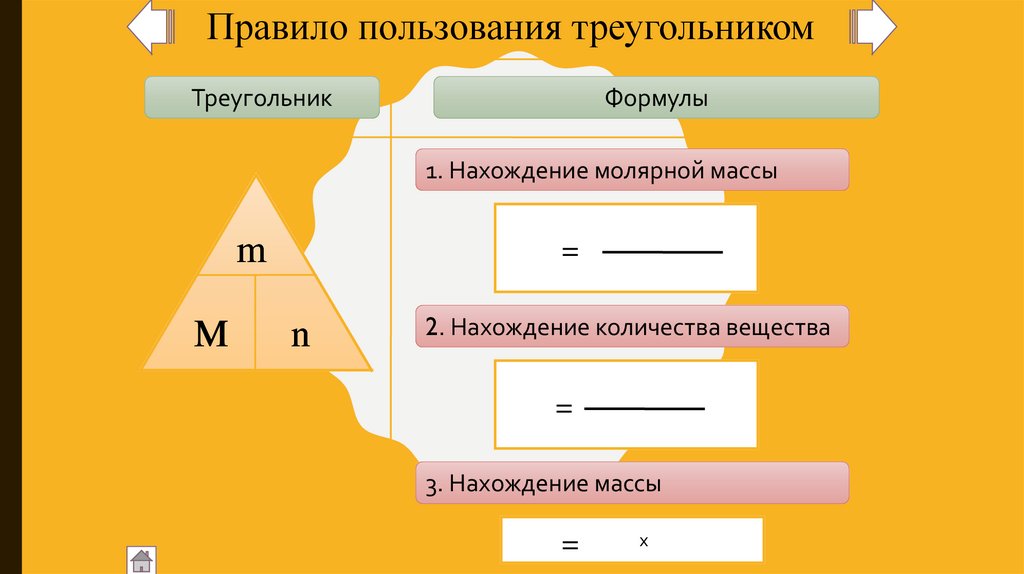
Правило пользования треугольникомТреугольник
Формулы
1. Нахождение молярной массы
m
M
=
n
2. Нахождение количества вещества
=
3. Нахождение массы
=
х
5.
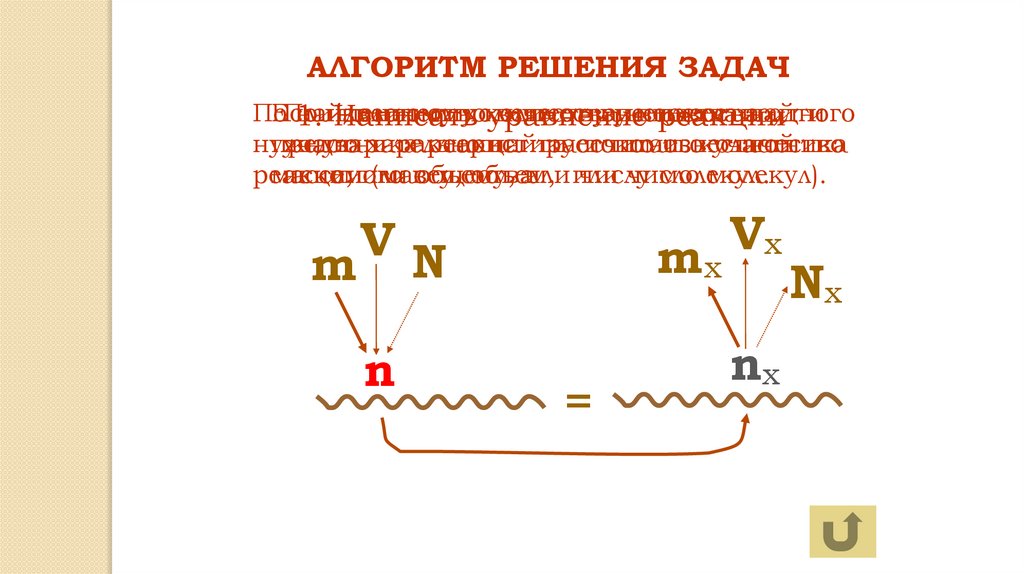
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧПо
Если
По
найденному
известному
количество
количеству
количеству
веществавещества
неизвестно,
вещества
найти
одного
1.
Написать
уравнение
реакции
нужную
предварительно
участника
характеристику
реакции
найти
рассчитать
его
искомого
по известной
количество
участника
реакции
массе,
искомого
или
(массу,
вещества
объему,
объем,
или или
числу
число
молекул.
молекул).
m
V
x
m
VN
n
?
x
=
nx
Nx
6.
Рассчитайте количество вещества алюминия,который потребуется для получения 1,5 моль
водорода при реакции с соляной кислотой.
Дано:
Решение:
x моль
n(H2) = 1,5 моль
2Al + 6HCl = 2AlCl3 + 3H2↑
n(Al) – ?
1,5 моль
2 моль
3 моль
Составляем пропорцию:
x моль
1,5 моль
=
2 моль
3 моль
x=
2 ·1,5
3
x = 1 (моль)
А
ПС
Ответ: n(Al) = 1 моль
7.
Определите количество вещества серы,необходимое для получения 2,5 моль сульфида
алюминия.
Дано:
Решение:
x моль 2,5 моль
n(Al2S3) =2,5 моль
n(S) – ?
2Al + 3S = Al2S3
3 моль 1 моль
x = n(S) = 3 n(Al2S3) =
= 3·2,5 моль = 7,5 моль
А
ПС
Ответ: n(S) = 7,5 моль
8.
Вычислите массу оксида меди (II),образующегося при разложении 14,7 г
гидроксида меди (II).
Решение:
0,15
14 ,7моль
г
Дано:
m(Cu(OH)2)=14,7 г
m(CuO) – ?
M(Cu(OH)2) =
64+(16+1)·2 =
98г/моль
M(CuO) = 64 +16 =
80г/моль
ПС
А
x моль
Cu(OH)2 = CuO + H2O
1 моль
n(Cu(OH)2) =
n(Cu(OH)2)=
1 моль
m(Cu(OH)2)
M(Cu(OH)2)
14.7 г
98 г/моль
= 0,15 моль
x = n(CuO) = n(Cu(OH)2) = 0, 15 моль
m(CuO) = n(CuO)·M(CuO) =
0,15 моль·80 г/моль = 12 г
Ответ: m(CuO) = 12 г
9.
Рассчитайте массу соли, которая образуетсяпри взаимодействии 13 г цинка с соляной
кислотой.
Дано:
m(Zn)=13 г
Решение:
0,2 моль
x моль
1 моль
1 моль
Zn + 2HCl = ZnCl2 + H2↑
m(Zn)
m(ZnCl2) – ?
M(Zn) = 65 г/моль
M(ZnCl2 =65 +35,5·2
=
136 г/моль
А
ПС
n(Zn) =
M(Zn)
n(Zn)=
13 г
65 г/моль
= 0,2 моль
x = n(ZnCl2) = n(Zn) = 0,2 моль
m(ZnCl2) = n(ZnCl2)·M(ZnCl2) =
0,2 моль·136 г/моль = 27,2 г
Ответ: m(ZnCl2) = 27,2 г
10.
САМОСТОЯТЕЛЬНАЯ РАБОТА:ВАРИАНТ 1:
Вычислите массу меди, которая
образуется при восстановлении
избытком водорода 4 г оксида меди
(II).
CuO + H2 = Cu + H2O
ВАРИАНТ 2:
В реакцию с серной кислотой
вступило 20 г гидроксида натрия.
Рассчитайте массу образовавшейся
соли.
2NaOH + H2SO4 = Na2SO4 + 2H2O
11.
ДОМАШНЕЕ ЗАДАНИЕ:Рассчитайте, какая масса кислорода
образуется при разложении 108 г
воды.
Вычислите объем (н.у.) газа, который
образуется при взаимодействии
цинка с раствором, содержащим 0,4
моль соляной кислоты
12.
«Куча мала»1.
2.
3.
4.
5.
6.
7.
4Al + 3O2 = 2Al2O3
MgCO3= MgO + CO2
2HgO= 2Hg + O2
2Na + S=Na2S
Zn + Br2 = ZnBr2
Zn + 2HCl = ZnCl2 + H2
Fe + CuSO4=FeSO4+Cu
Укажите цифрами
а) уравнения реакций
соединения:…
б)уравнения реакций
замещения:….
в) уравнения реакций
разложения:…
13.
Задача 1.Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Решение:
Дано:
m(Н20) = 9г
= 0,5 моль
n=
m(О2) = ? г
М(Н2О) = 18 г/моль
М(О2) = 32 г/моль
14.
Над формулой в уравнении реакции запишем найденноезначение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
химическим уравнением
0,5моль
Х моль
2Н2О = 2Н2 + О2
2моль
1моль
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
0,5моль
2 моль
откуда х = 0,25 моль
=
х моль
1 моль
15.
Следовательно,n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2)= n(O2)*M(O2)
m(O2) = 0,25 моль • 32 г/моль = 8 г
Запишем ответ
Ответ: m(О2) = 8 г
16.
Задачи для самостоятельного решения1. При восстановлении углем оксидов Fe2O3 и SnO2 получили по
20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)?
17.
Решение задачи 1.Дано:
Решение:
m(Fe) = 20г
n(Fe)= m/M,
n(Fe) = 20г/56г/моль=0,36моль
m(Fe2O3)=?
хмоль
0,36моль
2Fe2O3 + C = 4Fe + 3CO2
M(Fe2O3)=160г/моль
M(Fe)=56г/моль
4моль
2моль
хмоль
2моль
2моль
=
0,36моль
4моль
х=0,18моль
m(Fe2O3)= n*M,
m(Fe2O3)= 0,18*160=28,6
Ответ: 28,6г
18.
Решение задачи 2Дано:
m(Cu2O)=10г
m (CuO)=10г
m (H2O)
Решение:
1.
Cu2O + H2 = 2Cu + H2O
2. n(Cu2O) = m/ M(Cu2O)
n(Cu2O) = 10г/ 144г/моль = 0,07 моль
хмоль
0,07моль
3.
M(Cu2O) = 144г/моль
M(CuO) = 80 г/моль
Cu2O + H2 = 2Cu + H2O
1моль
4.
=
1моль
0,07моль
хмоль
1моль
1моль
х моль = 0,07моль, n(H2O)=0,07 моль
m (H2O) = n * M(H2O);
m(H2O) = 0,07моль*18г/моль=1,26г
19.
CuO + H2 = Cu + H2On(CuO) = m/ M(CuO)
n(CuO) = 10г/ 80г/моль = 0,125 моль
хмоль
0,125моль
CuO + H2 = Cu + H2O
1моль
0,125моль
1моль
=
1моль
хмоль
1моль
х моль = 0,125моль, n(H2O)=0,125 моль
m (H2O) = n * M(H2O);
m(H2O) = 0,125моль*18г/моль=2,25г
Ответ:2,25г
20.
Запишите названия исходных веществ ипродуктов реакции для следующих
уравнений химических реакций:
а) Fe + S = FeS,
Железо, сера
Исходные вещества ____________________,
Продукты реакции Сульфид
_____________________;
железа (II)
б) Cu (OH)2 = CuO + H2O,
Исходные веществаГидроксид
____________________,
меди (II)
Продукты реакцииОксид
_____________________;
меди (II), вода
в) HCl + NaOH = NaCl + H2O
Исходные веществаСоляная
____________________,
кислота, гидроксид натрия
Продукты реакции Хлорид
_____________________;
натрия, вода
21.
22.
23.
Работа в пареУравнения реакций 10 баллов. (Расставить коэффициенты)
Al(OH)3 = Al2O3 + H2O
CO2 + C = CO
N2O5 + H2O = HNO3
Zn + O2 = ZnO
Уравнения реакций 20 баллов. (Расставить коэффициенты)
Li + O2 = Li2O
P + F2 = PF5
K2O + H2O = KOH
Fe2O3 + C = Fe + CO2
Уравнения реакций 30 баллов. (Расставить коэффициенты)
NH3 = N2 + H2
HCl + Na2O = NaCl + H2O
Li + N2 = Li3N
Zn + HCl + ZnCl2 + H2
Уравнения реакций 40 баллов. (Расставить коэффициенты)
K2O + P2O5 = K3PO4
Fe + H2O = Fe2O3 + H2
Na2O + H2O = NaOH
KOH + H2SO3 = K2SO3 + H2O
Уравнения реакций 50 баллов. (Расставить коэффициенты)
FeO + HCl = FeCl2 + H2O
Al + O2 = Al2O3
AgCl = Ag + Cl2
P + Cl2 = PCl5























 Химия
Химия








