Похожие презентации:
Современные методы получения металлов
1.
Современные методыполучения металлов
Выполнила: студентка 2 курса ПО_БХ21-21 Байтуганова Р.Р.
Проверила: Ведерникова Т.Г.,
кандидат технических наук, доцент
2.
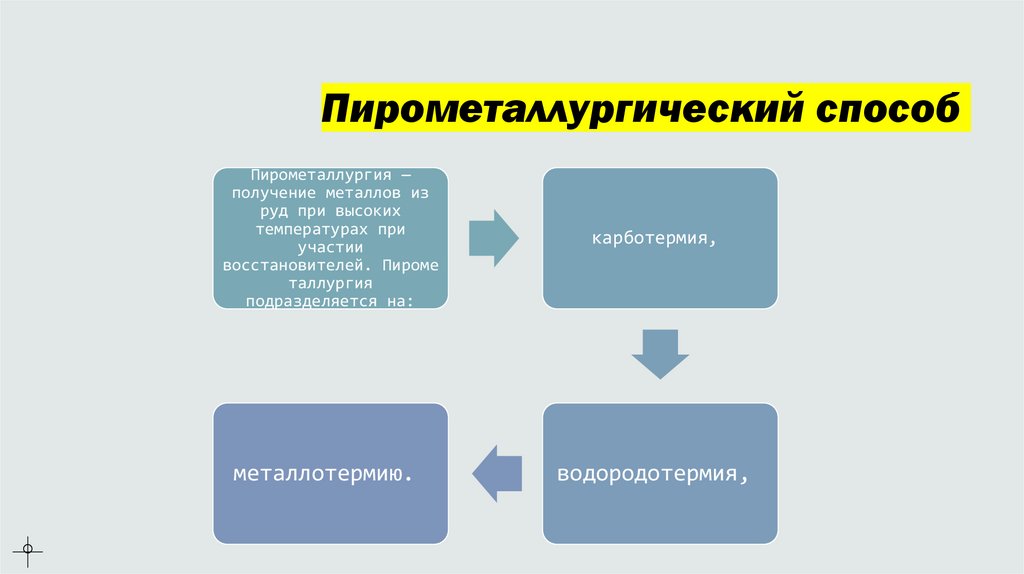
Пирометаллургический способПирометаллургия —
получение металлов из
руд при высоких
температурах при
участии
восстановителей. Пироме
таллургия
подразделяется на:
карботермия,
металлотермию.
водородотермия,
3.
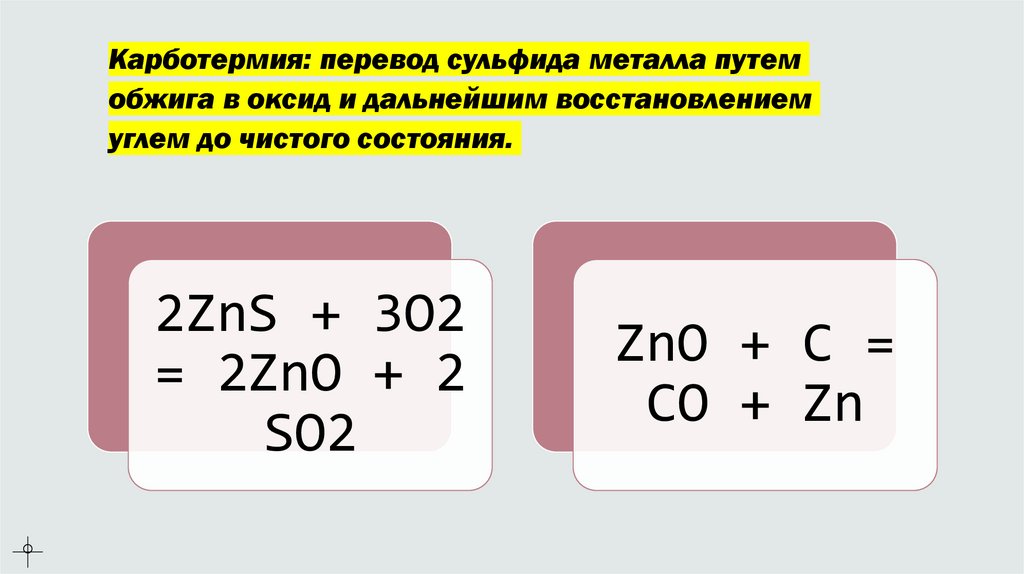
Карботермия: перевод сульфида металла путемобжига в оксид и дальнейшим восстановлением
углем до чистого состояния.
2ZnS + 3O2
= 2ZnO + 2
SO2
ZnO + C =
CO + Zn
4.
Карбонаты тоже
прокаливают с углем для
получения оксидов и
последующего
восстановления углем.
Схемы обжига сидерита и
восстановления оксида
железа:
FeCO3 = FeO + CO2↑;
FeO + C = Fe + CO↑.
5.
Водородотермия —производство
металлов
восстановлением
водородом
Достоинством этого металлургического
метода является получение очень
чистых металлов.
6.
Металлотермия• Проводят восстановление
одного металла другим,
более химически
активным. Этот способ
применяют для получения
металлов из оксидов и
галогенидов.
7.
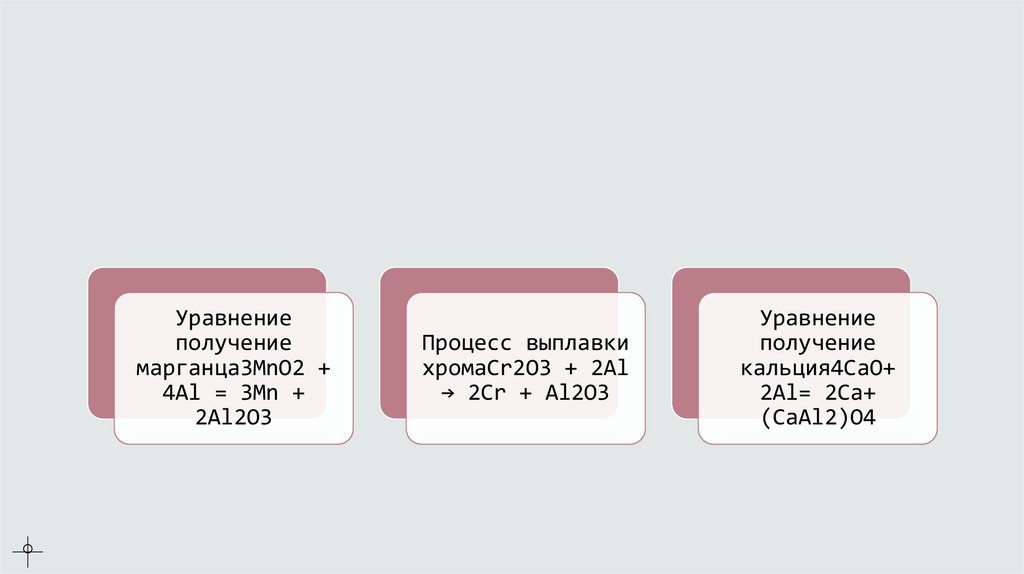
Уравнениеполучение
марганца3MnO2 +
4Al = 3Mn +
2Al2O3
Процесс выплавки
хромаCr2O3 + 2Al
→ 2Cr + Al2O3
Уравнение
получение
кальция4CaO+
2Al= 2Ca+
(CaAl2)O4
8.
Гидрометаллургический способ• Гидрометаллургия — способ получения благородных, цветных, редких металлов.
Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь
вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO4 +
Fe = Cu + FeSO4.
9.
ЭлектролизЭлектролиз расплавов оксидов, солей
и гидроксидов проводят для получения
металлов, расположенных в ряду
активности от лития до марганца.
Электролиз водных растворов служит
для производства менее активных
металлов
10.
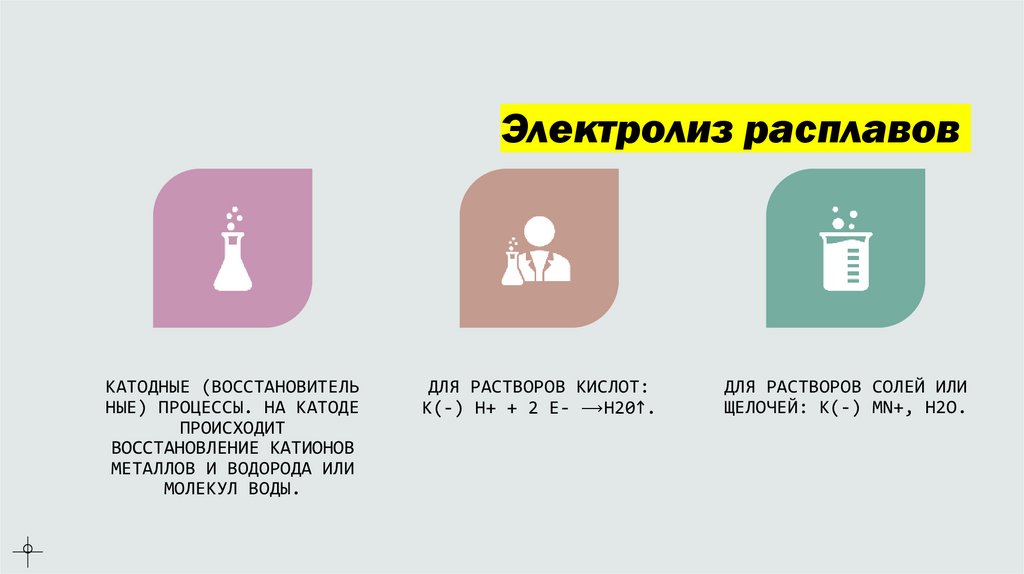
Электролиз расплавовКАТОДНЫЕ (ВОССТАНОВИТЕЛЬ
НЫЕ) ПРОЦЕССЫ. НА КАТОДЕ
ПРОИСХОДИТ
ВОССТАНОВЛЕНИЕ КАТИОНОВ
МЕТАЛЛОВ И ВОДОРОДА ИЛИ
МОЛЕКУЛ ВОДЫ.
ДЛЯ РАСТВОРОВ КИСЛОТ:
К(-) Н+ + 2 Е- ⟶H20↑.
ДЛЯ РАСТВОРОВ СОЛЕЙ ИЛИ
ЩЕЛОЧЕЙ: К(-) MN+, H2O.
11.
• Li, Cs, K, Ba, Ca, Na, Mg, Al• Катионы этих металлов не восстанавливаются, восстановлению
подвергаются молекулы воды 2 H2O +2 е- ⟶H2 + ОН-
• Mn, Zn, Cr, Fe, Co, Ni, Pb
• Катионы этих металлов восстанавливаются одновременно с молекулами
воды, поэтому на катоде одновременно выделяются и H2 и металл
• Bi, Cu, Ag, Hg, Pt, Au
• Катионы этих металлов легко и полностью восстанавливаются на катоде
12.
УРАВНЕНИЕ ЭЛЕКТРОЛИЗАРАСПЛАВА ХЛОРИДА
НАТРИЯ: 2NACL (ЭЛ. ТОК)
→ 2NA + CL2↑.
УРАВНЕНИЕ ЭЛЕКТРОЛИЗА
СУЛЬФАТА МАРГАНЦА В
РАСТВОРЕ: 2MNSO4 + 2H2O
(ЭЛ. ТОК) → 2MN +
O2↑+2H2SO4.
13.
Способтермического
разложения
Fe(CO)5 → Fe + 5CO↑
14.
Биометаллургия• Способ, основанный на
биохимических процессах с
участием микроорганизмов.
Метод получил
распространение на Западе,
так как позволяет меньше
загрязнять окружающую среду.
Биометаллургия служит для
получения меди, серебра,
никеля, свинца, урана, рения
и ряда других металлов.










 Химия
Химия








