Похожие презентации:
Электрохимические системы
1.
Электрохимическиесистемы
1
2.
ЭЛЕКТРОЛИЗЭлектролиз расплавов и растворов
2
3.
Электролизсовокупность
окислительновосстановительных процессов, протекающих при
прохождении постоянного электрического тока
через раствор или расплав электролита с
погруженными в него электродами.
3
4.
Гемфри Дэви (1778 - 1829)Первые
работы
в
области
электрохимии были посвящены
изучению
действия
электрического
тока
на
химические соединения.
Он показал, что электрический ток
вызывает
разложение
(электролиз) кислот и солей.
Дэви получил электролизом два
новых металла из расплавов их
соединений - калий и натрий. В
течение двух лет получить
также
в свободном виде еще
ранее
неизвестные
металлы:
барий,
кальций,
магний
и
стронций.
4
5.
Электролизер или электролитическая ячейка (ванна) –электрохимическая система, в которой за счет внешней
электрической
энергии
совершаются
химические
превращения
Электролиз
–
это
совокупность
окислительновосстановительных
процессов,
протекающих
при
прохождении электрического тока через электролит с
погружёнными в него электродами
Электролиз возможен только для растворов и расплавов
электролитов, когда в системе присутствуют ионы
Суммарный процесс противоположен по направлению
процессу, протекающему в гальваническом элементе
Анодом является (+) электрод, на нём протекает реакция
окисления
Катодом является (-) электрод, на нём протекает реакция
восстановления
6.
Сущность электролизаизображают с помощью
схемы , которая отражает:
• диссоциацию электролита,
• направление движения ионов,
• процессы на электродах и
выделяющиеся вещества
NaCl → Na+ + ClK (-): Na+ + 1 e- =Na0
A(+): 2Cl- - 2 e- = Cl2
2NaCl → 2Na + Cl2
6
7.
Анод – положительнозаряженный электрод,
обозначается A(+)
Катод - отрицательно
заряженный электрод,
обозначается K(-)
7
8.
Под действием электрического токаионы приобретают
направленное движение, т.е. катионы движутся к катоду, а
анионы движутся к аноду.
При электролизе за счет электрической энергии протекают
химические реакции:
• восстановление на катоде;
• окисление на аноде
8
9.
Электролиз расплавовПротекает наиболее просто
В расплавах электролитов существует по одному виду
катионов и анионов, которые разряжаются на
электродах
Катионы движутся к катоду (-) и принимают от него
электроны – восстанавливаются
Анионы движутся к аноду (+) и отдают ему электроны
– окисляются
Примеры: электролиз расплавов хлоридов металлов,
щелочей и др.
9
10.
1011.
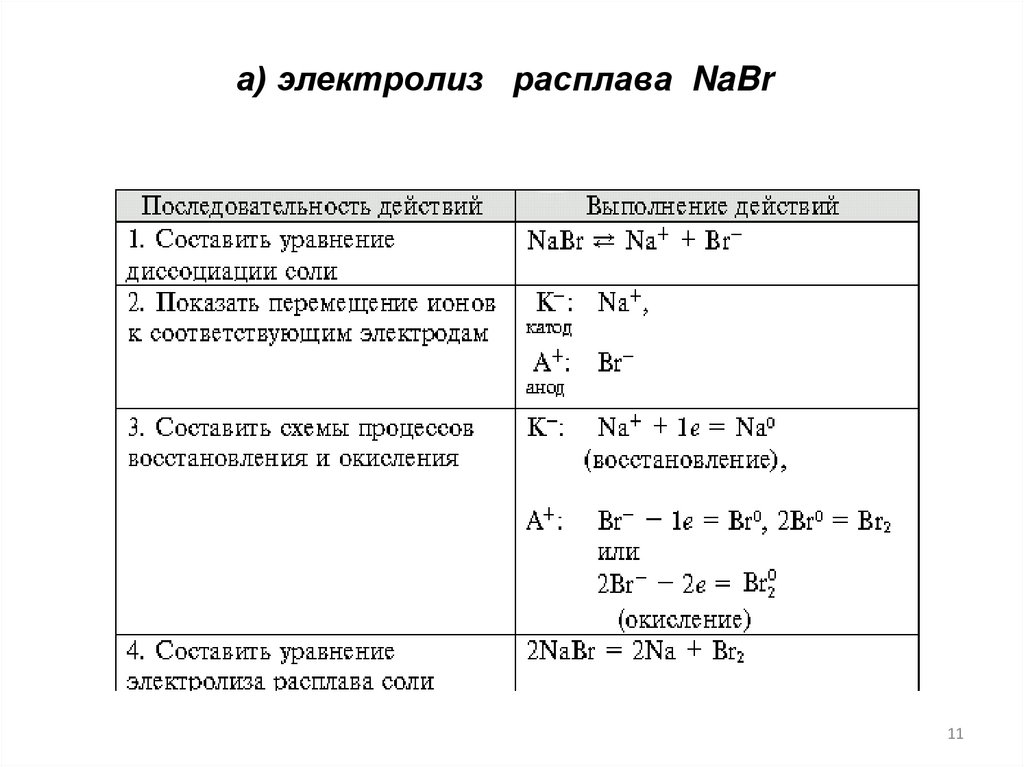
а) электролиз расплава NaBr11
12.
б) электролиз расплава NaOH12
13.
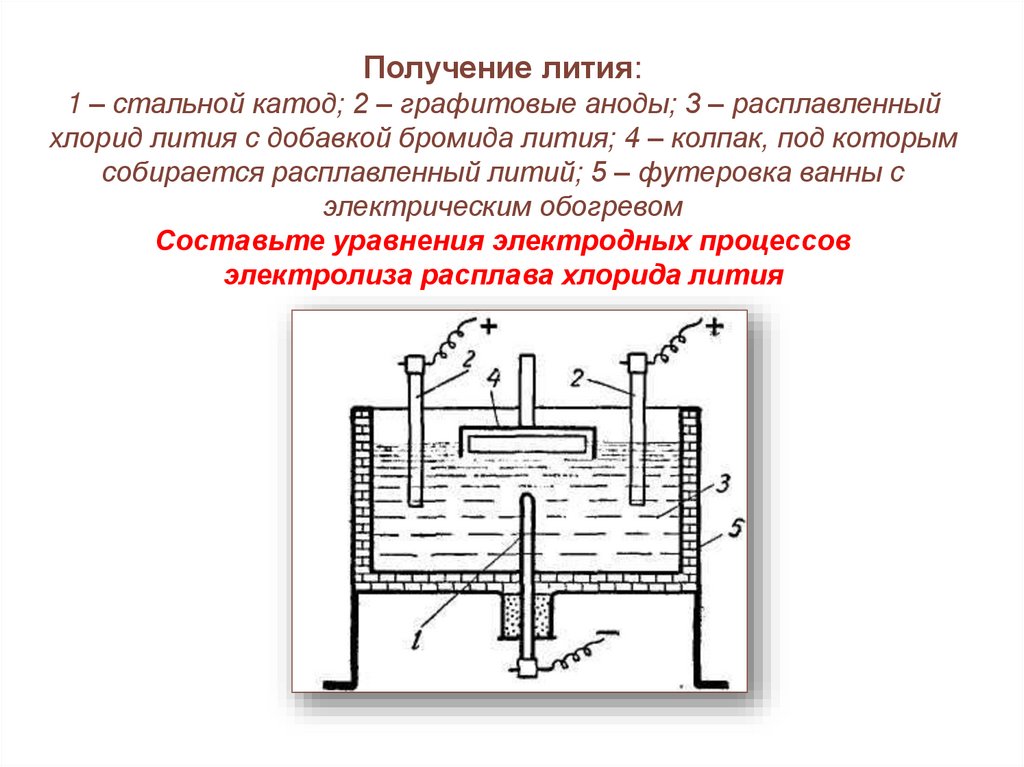
Получение лития:1 – стальной катод; 2 – графитовые аноды; 3 – расплавленный
хлорид лития с добавкой бромида лития; 4 – колпак, под которым
собирается расплавленный литий; 5 – футеровка ванны с
электрическим обогревом
Составьте уравнения электродных процессов
электролиза расплава хлорида лития
14.
Электролиз растворовПоявляется ещё одно вещество – вода
В
электродных
реакциях
наряду
с
ионами
растворённой соли участвуют молекулы воды,
катионы водорода и гидроксид-ионы
Из электродных процессов наиболее вероятен тот,
осуществление которого связано с минимальной
затратой энергии
На катоде первым восстанавливается наиболее
сильный окислитель
На аноде первым окисляется наиболее сильный
восстановитель
14
15.
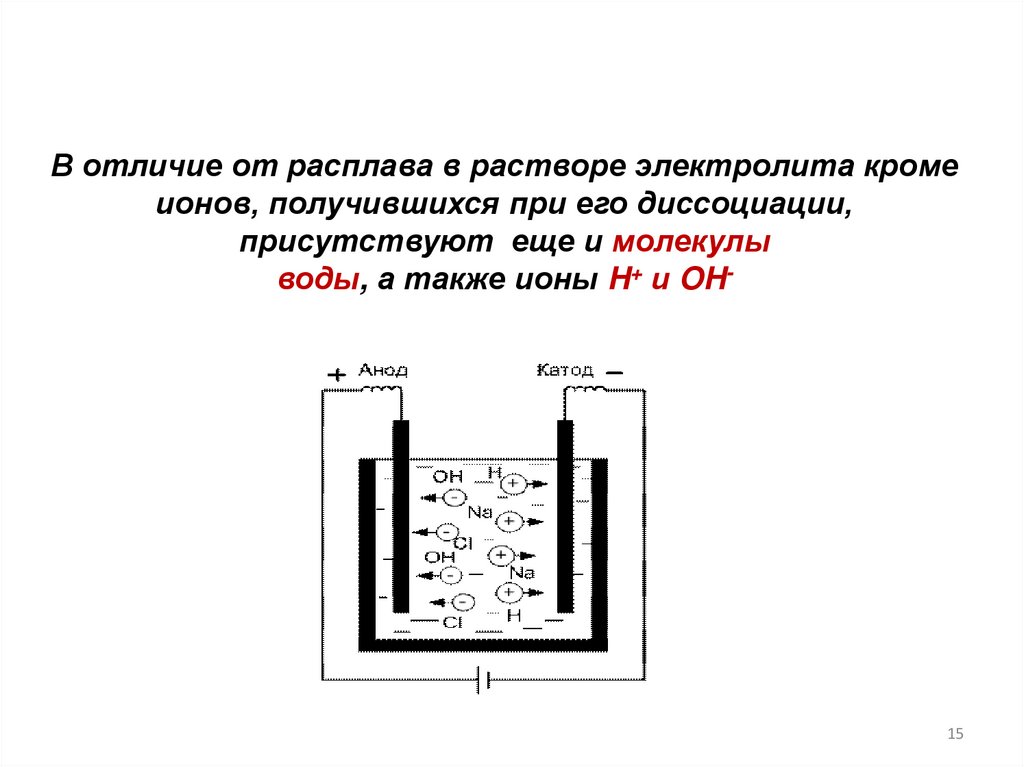
В отличие от расплава в растворе электролита кромеионов, получившихся при его диссоциации,
присутствуют еще и молекулы
воды, а также ионы H+ и OH-
15
16.
Электролиз воды16
17.
1) Если у катода накапливаются катионы металла, стоящегов ряду напряжений после H2, то восстанавливаются ионы
металла
Cu2++ 2e-=Cu0
2) Если у катода накапливаются катионы металла,
стоящего в начале
ряда напряжений (по Al), то
восстанавливаются ионы водорода из молекул воды
вместо катиона данного металла
2H2O + 2e- = H2 + 2OH17
18.
LiKBaCaNaMgAlMnZnCrFeCoNiSnPb
H2
CuAgHgAu
3)
Если
у
катода
накапливаются
катионы
металла,который расположен в ряду напряжений
после Al и до H2, то будут протекать два процесса:
восстановление иона металла и ионов водорода из
молекул воды
Zn2+ +2e-=Zn0
2H2O + 2e-=H2 + 2OH4) Если в растворе смесь катионов разных металлов,
то сначала восстанавливается менее активный
5) При электролизе раствора кислоты на катоде
восстанавливаются катионы водорода
2H+ + 2e-=H20
18
19.
Последовательность разрядки анионов на анодезависит от природы аниона:
F-, NO3-, SO42-, OH-, Cl-, S2- , Br-, IВосстановительная активность анионов
усиливается
19
20.
1)При
электролизе
растворов
солей
бескислородных кислот (кроме фторидов)
окисляются анионы кислотных остатков
2Cl- - 2e- = Cl2
При
электролизе
растворов
солей
кислородосодержащих кислот и фторидов идет
процесс окисления гидроксид-ионов из молекул
воды
2H2O – 4e- = O2 +4H+
2)
3)
При
электролизе
растворов
окисляются гидроксид-ионы
4OH- - 4e- = O2 +2H2O
щелочей
20
21.
2122.
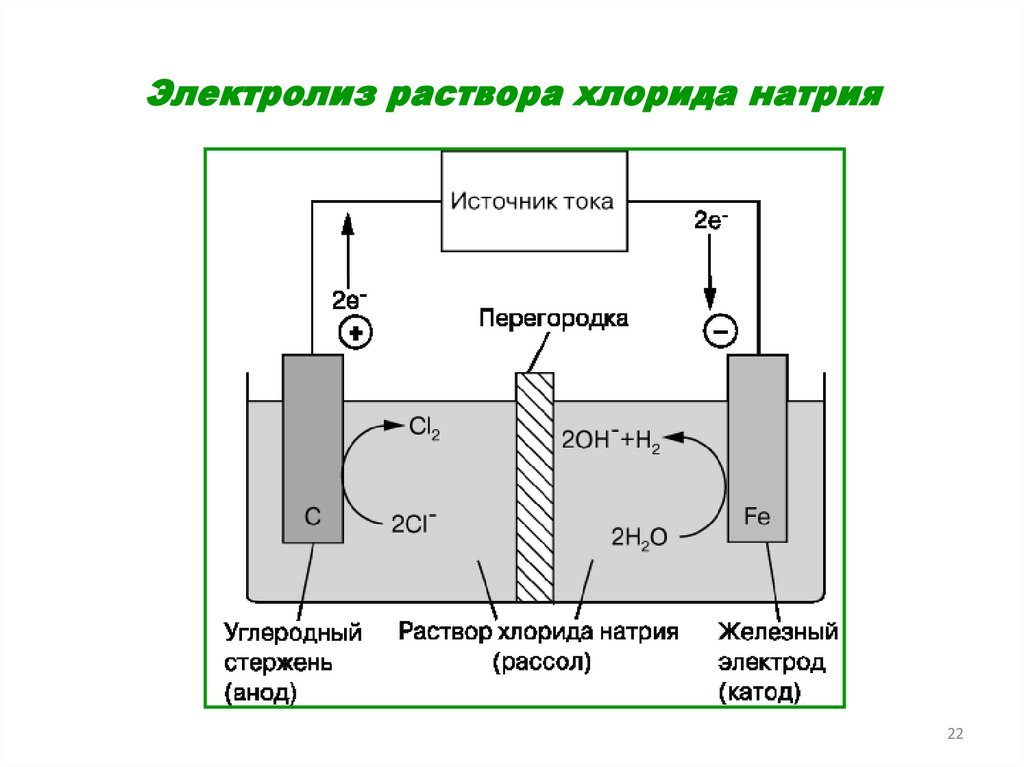
Электролиз раствора хлорида натрия22
23.
Применение электролизаЭлектролизом раствора NaCl получают гидроксид натрия,
хлор и водород
Электролизом воды получают кислород и водород высокой
чистоты
Получают многие сильные окислители: гипохлорит натрия
NaClO, хлорат натрия NaClO₃, хлорную кислоту HClO₄ и её
соли, пероксид водорода H₂O₂, перманганат калия KMnO₄,
дихромат калия K₂Cr₂O₇ и др.
В металлургии получают металлы (золото, серебро, медь,
никель, алюминий и др.)
Электролиз с растворимым анодом используют при
электролитическом рафинировании (очистке) черновых
металлов (меди, серебра, олова и др.); металл,
подвергаемый очистке, является анодом
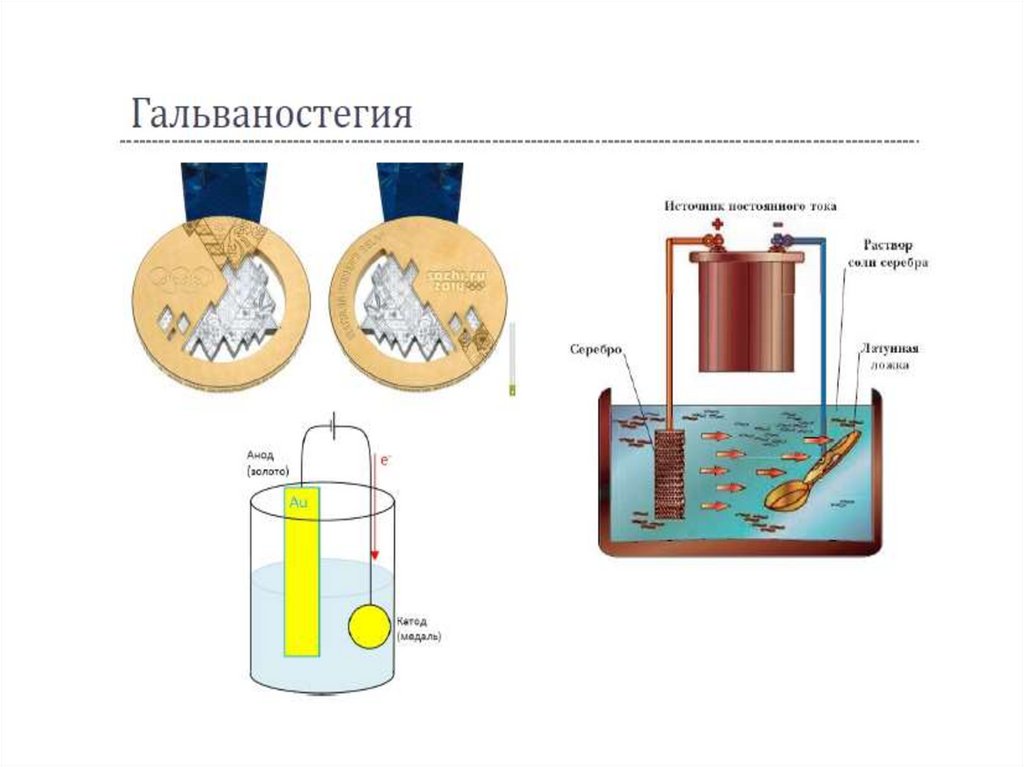
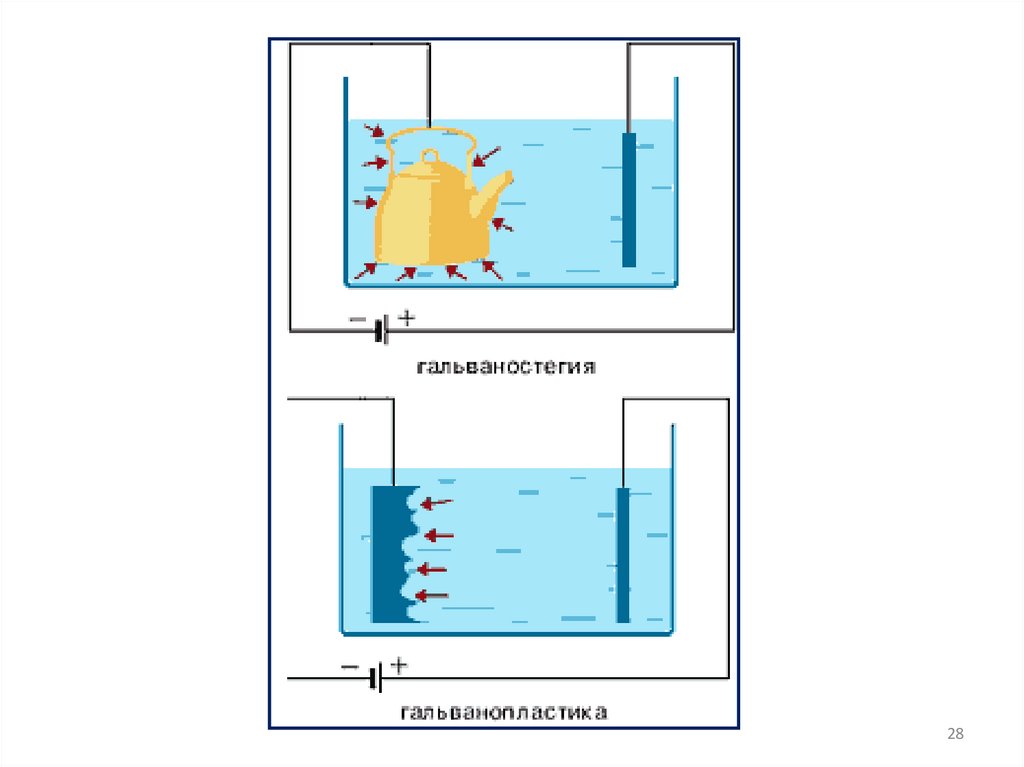
Гальванопластика – получение изделий путём осаждения
металла на модели
Гальваностегия – нанесение металлических покрытий
путём электролиза
23
24.
2425.
2526.
27.
28.
2829.
В растворе одновременно присутствуют ионы Ni2+,
Pb2+, Fe2+, Cu2+. При одинаковых условиях первыми из
раствора
при
электролизе
будут
восстанавливаться ионы …
Ni2+
Pb2+
Fe2+
Cu2+
Путем электролиза раствора нельзя получить …
хлор
кислород
натрий
медь
• При электролизе водного раствора, содержащего
нитраты ртути(II), меди(II), никеля(II) и калия в
стандартных
условиях,
последовательность
выделения веществ на катоде имеет вид…
Hg, Cu, Ni, K, H2
Cu, Hg, Ni, H2, K
Hg, Cu, Ni, H2
Hg, Cu, Ni, K
30.
• Уравнение процесса, протекающего на катоде приэлектролизе водного раствора гидроксида калия,
имеет вид …
К+ + е = К 0
2Н2О + 2е = Н2 + 2ОН2Н+ + 2е = Н2
2Н2О - 4е = 4Н+ + О2
• Металлом, который можно получить электролизом
водного раствора его соли, является…
Cu
Na
Al
K
31.
Законы ФарадеяЭлектрохимические процессы основываются на законах Фарадея.
закон Фарадея: масса веществ, выделившихся на
электродах,
прямо
пропорциональна
количеству
электричества, прошедшего через электролит:
m= k·I· t = k · Q,
где: m – масса выделившегося вещества, кг;
k – электрохимический эквивалент, кг/ Кл;
I – сила тока, А;
t – время электролиза, с;
Q – количество электричества, Кл.
Электрохимический эквивалент вычисляют по формуле:
M
k = ―,
n. F
где: k – электрохимический эквивалент, кг/Кл;
М – молярная масса, кг/кмоль;
F – число Фарадея, равное 9,648456 · 104 Кл/моль;
n – валентность (число электронов, участвующих в
процессе).
1
31
32.
2закон Фарадея: при одинаковом количестве
электричества масса вещества, выделившегося в
результате электролиза различных электролитов,
пропорциональна отношению молярной массы к
валентности:
M1 M2
m1 : m2 = k1 : k2 = ― : ―
n1 n2
где: m1 и m2 – массы выделившихся веществ, кг;
k1 и k2 – электрохимические эквиваленты, кг/Кл;
М1 и М2 – молярные массы, кг/кмоль;
n1 и n2 – валентности.
32
33.
Электрохимический эквивалент вычисляют по формуле:M
k = ▬,
n. F
где: k – электрохимический эквивалент, кг/Кл;
М – молярная масса, кг/кмоль;
F – число Фарадея, равное 9,648456 · 104 Кл/моль;
n – валентность (число электронов, участвующих в процессе).
33
34.
Для оценки процесса электролиза показателями являютсявыход по току и расход энергии.
Выход по току ( ) определяется по формуле:
m1
= ― 100%,
m0
где m1 – масса вещества, практически полученная в процессе
электролиза;
m0 – масса вещества теоретическая (по закону Фарадея).
Расход энергии выражается в Дж/кг и рассчитывается по
формуле:
U. I.t
U. Q
W = ------ = ------,
m
m
где U – напряжение электролизера, В;
Q – количество электричества, Кл;
m – масса практически полученного вещества, кг.
34




























 Химия
Химия