Похожие презентации:
Хлор (Cl)
1.
2.
Хлор (Cl)- элемент VII A группы
Степени окисления +7, +5, +3, +1, 0, −1
3.
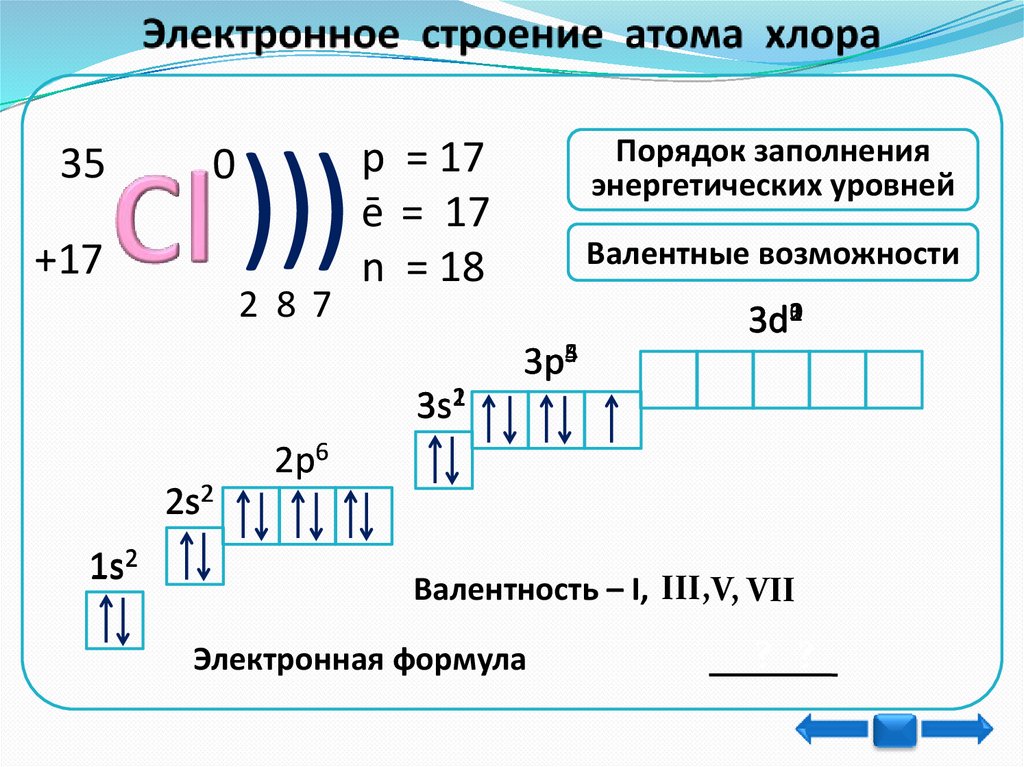
350
+17
)))
2 87
Порядок заполнения
энергетическиx уровней
p = 17
ē = 17
n = 18
Валентные возможности
3p534
3d3210
3s12
2s2
1s2
2p
2р6
Валeнтность – I, III,V, VII
Электронная формула
? ?
4.
Природные соединения хлораКаменная соль
(галит)
NaCl
5.
ГалитИсточник информации:
Каталог минералов
Описание минерала
Химическая
формула
NaCl
Химический
состав
Na – 39%
Cl – 61%
Цвет
Бесцветный,
синий, красный,
желтый
Плотность
2,3 г/cм3
Твердость
2,5
Содержание
хлора
до 61%
6.
СильвинИсточник информации:
Каталог минералов
Описание минерала
Химическая
формула
КCl
Химический
состав
К – 52%
Cl – 48%
Цвет
Бесцветный
молочно-белый
Плотность
1,98 г/cм3
Твердость
1,5 - 2
Содержание
хлора
до 48%
7.
КаинитОписание минерала
Химическая
формула
Цвет
К – 14-18%
MgO – 15-17%
Cl – 14-19%
SO3 - 28-34%
H2O - 18-21%
Серовато-белый,
желтоватый
Плотность
2,1 г/cм3
Твердость
2,5 - 3
Содержание
хлора
До 19%
Химический
состав
Источник информации:
Каталог минералов
Сокровища природы
MgSO4 · KCl · 3H2O
8.
КарналлитОписание минерала
Химическая
формула
MgCl2· KCl · 6H2O
Химический Mg - 8,7%, К - 14,1%,
Cl - 38,3%, Н2O состав
38,9%.
Красный, желтый,
белый,
Цвет
бесцветный
Источник информации:
Каталог минералов
Горные породы
Плотность
1,6 г/cм3
Твердость
1-2
Содержание
хлора
до 48%
9.
СильвинитБишофит
Кристаллическая смесь
минералов
галита и сильвина
KCl · NaCl
Магниевый полиминерал:
MgCl2, MgBr2, CaSO4, CaCl2,
CaHCO3, KCl, NaCl
Основное вещество MgCl
·6H2O
Источник информации:
Виртуальная библиотека камней
Источник информации:
Википедия – свободная энциклопедия
10.
Распространение в природеХлор – активный
элемент
Самые большие
запасы хлора
содержатся в составе
солей вод морей
и океанов.
В природе
встречаются 2
стабильных изотопа
хлора: с массовым
числом 35 и 37.
В природе он встречается только в виде
соединений в составе
минералов: галита NaCI,
сильвина KCl,
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O,
каинита KCl · MgSO4 · 3Н2О.
В организме человека и животных хлор
содержится в основном в межклеточных
жидкостях (в том числе в крови) и играет
важную роль в регуляции осмотических
процессов, а также в процессах,
связанных с работой нервных клеток.
Содержание хлора в организме человека
массой 70 кг — 95 грамм
11.
ИзотопОтносительная
масса, а.е.м.
Период
полураспада
Тип распада
Ядерный спин
35Cl
34.968852721
Стабилен
—
3/2
36Cl
35.9683069
301000 лет
β-распад в 36Ar
0
37Cl
36.96590262
Стабилен
—
3/2
38Cl
37.9680106
37,2 минуты
β-распад в 38Ar
2
39Cl
38.968009
55,6 минуты
β-распад в 39Ar
3/2
40Cl
39.97042
1,38 минуты
β-распад в 40Ar
2
41Cl
40.9707
34 c
β-распад в 41Ar
42Cl
41.9732
46,8 c
β-распад в 42Ar
43Cl
42.9742
3,3 c
β-распад в 43Ar
12.
I1
1
2
2
3
3
4
5
6
7
II
III
группы элементов
IV
V
VI
VII
VIII
3 период, VII A группа
0
35
ЭО = 2,83 (по Оллреду)
СО в соединениях: от -1 до +7
4
Неметалл
5
Земная кора – 0,017% (по массе)
Морская вода – 1,8% (по массе)
6
7
8
9
10
+17
Хлор
от латинского «chloros» зеленоватый
Входит в состав минералов:
галита, сильвина, сильвинита,
каинита, карналлита и др.
Входит в состав хлорофилла
Изотопы:
35 Cl – 75,8%, 37 Cl – 24,2%
17
17
Открыт в 1774г
К.Шееле (Швеция)
13.
История открытияВпервые хлор был получен в 1772 г. Шееле:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
• Однако Шееле предположил, что хлор
представляет собой оксид соляной кислоты.
• И только Дэви удалось электролизом
разложить поваренную соль на натрий и хлор.
14.
ПОЛУЧЕНИЕ1. В промышленности
А) Электролизом расплавов и растворов
14
15.
ЯДРаботат
ь
только
под
тягой!
Агрегатное
состояние
газ (при н.у.)
Цвет
желто-зеленый
Запах
удушливый
Тпл
-1010С
Ткип
-340С
Растворимость
в воде
в 1 объеме воды –
2,5 объема хлора
Раздражает
Воздействие
слизистую
на организм
оболочку,
разрушает легкие
16.
Физические свойстваРастворитель
Растворимость
г/100 г
Бензол
Растворим
Вода (0 °C)
1,48
Вода (80 °C)
0,22
Хлороформ
Хорошо
растворим
По электропроводности жидкий хлор занимает место среди самых
сильных изоляторов: он проводит ток почти в миллиард раз хуже,
чем дистиллированная вода. Скорость звука в хлоре примерно в
полтора раза меньше, чем в воздухе.
17.
Химические свойства18.
19.
Хлор очень сильный окислительCl2+2Na=2NaCl
20.
взаимодействие с медьюCu + Cl2 = CuCl2
21.
взаимодействие с железом2Fe +3 Cl2 = 2FeCl3
22.
взаимодействие с фосфором2P + 5Cl2 = 2PCl5
2P+3Cl2 = 2PCl3
23.
взаимодействие с водородомH2 + Cl2 = 2HCl
24.
Взаимодействие со сложными веществамиCl2 + H2O = HCl + HClO
хлорноватистая
кислота
HClO = HCl + O
24
25.
Специфичные реакции:25
26.
Взаимодействие2Na
+ Cl2 =2NaCl
с металлами
HВзаимодействие
2 + Cl2 =2HCl
с водородом
Взаимодействие
2P
+ Cl2 = 2PCl5
с неметаллами
Хлор –
сильный
ВЫВОД
окислитель
27.
Биологическая роль хлораПоддерживает нормальное осмотическое давление плазмы
крови, лимфы, спинномозговой жидкости.
Участвует в образовании соляной кислоты, обмене веществ,
построении тканей.
Необходим для дезинфекции клеток.
Способствует избавлению от лишнего веса.
Растворяет отложения на суставах.
Соляная кислота, входящая в состав желудочного сока чело
века, выполняет ряд важных функций:
— убивает большую часть бактерий, попадающих в желудок
вместе с пищей. Например, холерный вибрион погибает в 0,5%
-ной НСI. Поэтому эпидемия холеры возникает только летом,
когда из-за жары человек употребляет много воды и
кислотность желудочного сока уменьшается;
— 0,5% -ная соляная кислота в желудке создает условия для
действия ферментов на белки. Ферменты становятся
активными в кислой среде уже при 37—38 °С.
27
28.
Применения хлора• В производстве пластикатов, синтетического каучука и др.
• Для отбеливания в текстильной и бумажной промышленности
• Производство веществ, убивающих вредных для посевов
насекомых, но безопасные для растений.
Использовался как боевое отравляющее вещество
(слезоточивый газ), а так же для производства других боевых
отравляющих веществ: иприт, фосген.
Для обеззараживания воды — «хлорирования».
В пищевой промышленности зарегистрирован в
качестве пищевой добавки E925.
В химическом производстве ядов, лекарств, удобрений.
В металлургии для производства чистых металлов: титана,
олова, тантала, ниобия.
Как индикатор солнечных нейтрино в хлор-аргонных
детекторах.
29.
Оконныйпрофиль
изготовленный
из
хлорсодержащих
полимеров
Основным компонентом отбеливателей
является хлорная вода
30.
Хлор — токсичный удушливый газ, припопадании в лёгкие вызывает ожог лёгочной
ткани, удушье.
Раздражающее действие на дыхательные пути
оказывает при концентрации в воздухе около
0,006 мг/л (т.е. в два раза выше порога
восприятия запаха хлора).
Хлор был одним из первых химических
отравляющих веществ,
использованных Германией в Первую
мировую войну.
При работе с хлором следует пользоваться
защитной спецодеждой, противогазом,
перчатками. Н
а короткое время защитить органы дыхания
от попадания в них хлора можно тряпичной
повязкой, смоченной раствором сульфита
натрия Na2SO3 или тиосульфата натрия
Na2S2O3.
31.
Домашнее заданиеПараграф 27 выучить,
упр. 1 (С) стр. 134






























 Химия
Химия








