Похожие презентации:
Химические свойства оксидов. 2 часть. Параграф 34
1.
Химические свойства оксидов2 часть
параграф 34
2.
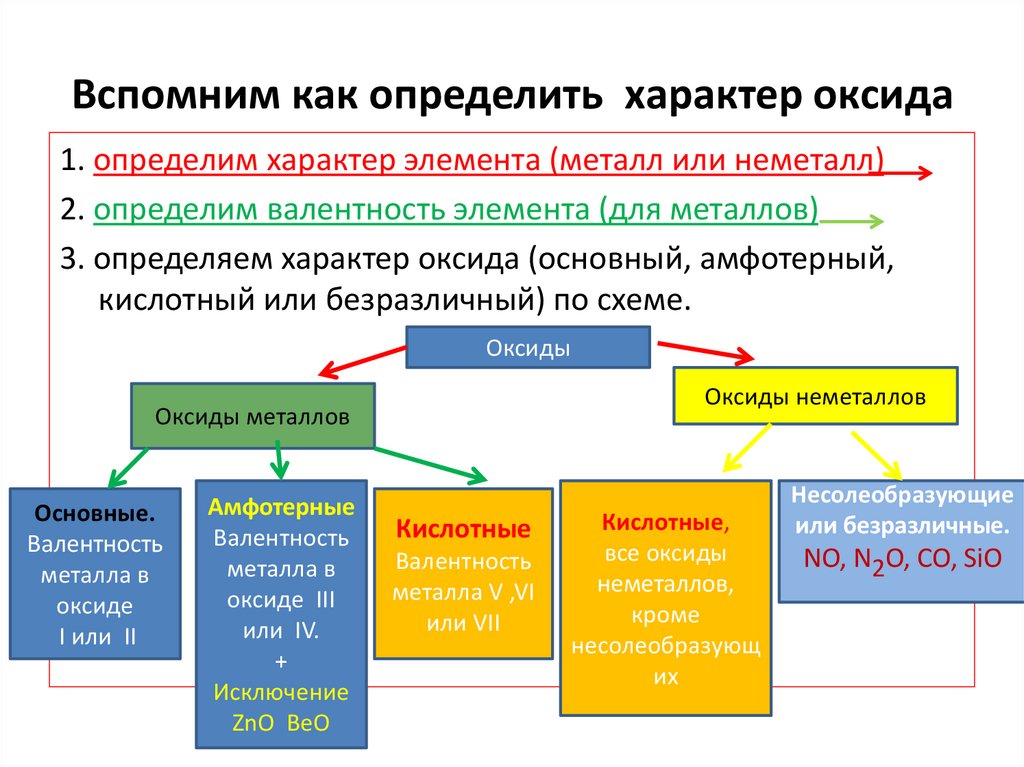
Вспомним как определить характер оксида1. определим характер элемента (металл или неметалл)
2. определим валентность элемента (для металлов)
3. определяем характер оксида (основный, амфотерный,
кислотный или безразличный) по схеме.
Оксиды
Оксиды неметаллов
Оксиды металлов
Основные.
Валентность
металла в
оксиде
I или II
Амфотерные
Валентность
металла в
оксиде III
или IV.
+
Исключение
ZnO BeO
Кислотные
Валентность
металла V ,VI
или VII
Кислотные,
все оксиды
неметаллов,
кроме
несолеобразующ
их
Несолеобразующие
или безразличные.
NO, N2O, CO, SiO
3.
Вспомните правила, которые ужезнаете
основный оксид + вода = щелочь
Na2O+H2O = 2NaOH BaO+H2O = Ba(OH)2
кислотный оксид + вода = растворимая
кислота
P2O5+3H2O =2H3PO4
SO3+H2O = H2SO4
4.
Взаимодействие оксидов друг сдругом
В реакцию могут вступать только разные оксиды:
• Основный оксид+ кислотный оксид=соль
• Основный оксид +амфотерный оксид=соль
• Амфотерный оксид+ кислотный оксид=соль
Если оксиды относятся к одному классу , то не
взаимодействуют:
• Основный оксид+основный оксид = реакция
невозможна.
5.
Взаимодействие оксидов друг сдругом (примеры)
Основный оксид+ кислотный оксид=соль
• CaO+SO3= CaSO4
MgO+SO2= MgSO3
• Na2O+CO2= Na2CO3
Основный оксид + амфотерный оксид=соль
• CaO+Al2O3= Ca(AlO2) 2
Na2O+ZnO= Na2ZnO2
Амфотерный оксид + кислотный оксид =соль
• Al2O3+3SO3= Al2(SO4)3
3ZnO+P2O5= Zn3(PO4)2
*Кто забыл как правильно составить формулу соли обращайтесь к презентациям,
которые были отправлены ранее. Все кислотные оксиды выделены в презентации
красным цветом, а амфотерные –зеленым.
Формулы солей составляем по таблице растворимости
НЕ забывайте проверять коэффициенты в уравнении.
6.
Взаимодействие оксидов скислотами и щелочами
В реакцию могут вступать только :
• Основный оксид +кислота=соль +Н2О
• Амфотерный оксид +кислота= соль +Н2О
• Амфотерный оксид+ щелочь= соль +Н2О
• Кислотный оксид +щелочь= соль+Н2О
*Про амфотерный оксид будем говорить позже
7.
Взаимодействие оксидов скислотами и щелочами
Примеры
Основный оксид +кислота=соль +Н2О
• CaO+Н2SO4= CaSO4 +Н2О
• 3MgO+2Н3PO4= Mg3(PO4)2 +3Н2О
Na2O+2НCl= 2NaCl +Н2О
Амфотерный оксид +кислота=соль +Н2О
• Al2O3+6НCl= 2AlCl3 + 3Н2О
Кислотный оксид +щелочь= соль+Н2О
• P2O5+ 6NaOH= 2Na3PO4+3Н2О
• SO3 +Ba(OH)2 = BaSO4 +Н2О
• СO2 +2NaOH = Na2CO3+Н2О
8.
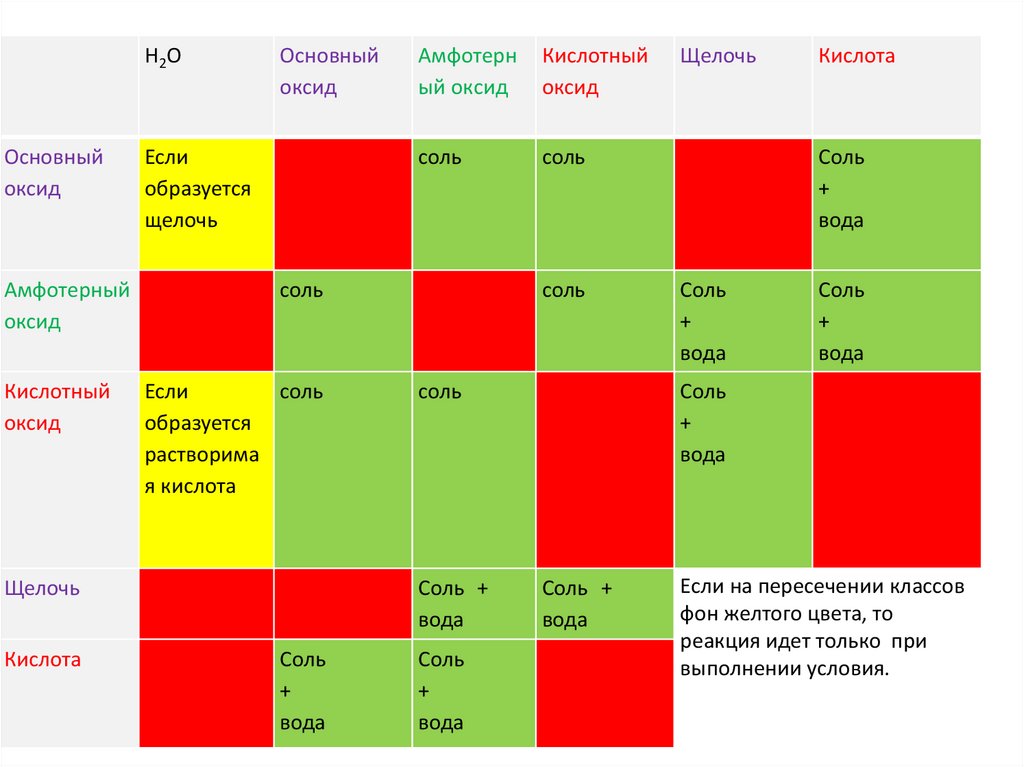
Н2ООсновный
оксид
Амфотерный
оксид
Кислотный
оксид
Основный
оксид
Если
образуется
щелочь
Кислотный
оксид
соль
соль
соль
Если
соль
образуется
растворима
я кислота
Щелочь
Кислота
Амфотерн
ый оксид
соль
соль
Соль +
вода
Соль
+
вода
Соль
+
вода
Щелочь
Кислота
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль +
вода
Если на пересечении классов
фон желтого цвета, то
реакция идет только при
выполнении условия.
9.
Домашнее задание*в учебнике есть алгоритмы
Запишите уравнения реакций между:
Оксид фосфора (V) и гидроксидом калия
Оксидом серы(IV) и гидроксидом кальция
Оксидом железа(II) и соляной кислотой
Оксидом железа (III) и серной кислотой
Оксидом натрия и оксидом углерода(IV)
Оксидом кальция и оксидом фосфора(V)
Правила взаимодействия классов веществ (9 правил) учим наизусть.
Читаем параграф 34, дополняем записи в тетради материалами
презентации, готовимся к проверочной работе.
10.
Проверка домашнего заданияОксид фосфора (V) и гидроксидом калия
Р2O5 + 6KOH= 2K3PO4 + 3H2O
Оксидом серы(IV) и гидроксидом кальция
SO2 + Ca(OH)2= CaSO3 + H2O
Оксидом железа(II) и соляной кислотой
FeO + 2HCl = FeCl2 + H2O
Оксидом железа (III) и серной кислотой
Fe2O3 + 3H2SO4 = Fe2(SO4 )3 +3 H2O
Оксидом натрия и оксидом углерода(IV)
Na2O + CO2 =Na2CO3
Оксидом кальция и оксидом фосфора(V)
Р2O5 + 3 CaO= Ca3(PO4)2
Правила выучить наизусть (9 правил в рамках)








 Химия
Химия








