Похожие презентации:
Кислоты. Часть 2 (практическая)
1.
КислотыЧасть 2 практическая
2.
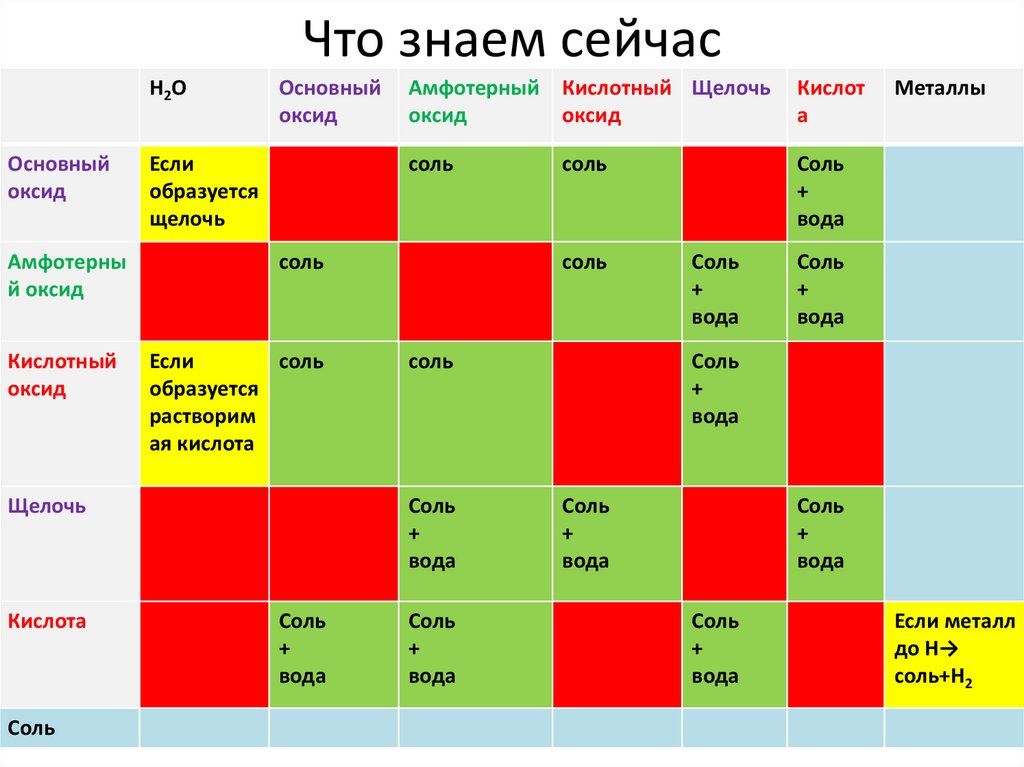
Что знаем сейчасН 2О
Основный
оксид
Основный
оксид
Если
образуется
щелочь
Амфотерны
й оксид
соль
Кислотный
оксид
Если
соль
образуется
растворим
ая кислота
Щелочь
Кислота
Соль
Амфотерный Кислотный Щелочь
оксид
оксид
Кислот
а
соль
Соль
+
вода
соль
соль
Соль
+
вода
Соль
+
вода
соль
Соль
+
вода
Соль
+
вода
Металлы
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Если металл
до Н→
соль+Н2
3.
Повторим химические свойства кислот1. Кислота +основание = соль+ вода
2. Кислота + амфотерный гидроксид =
соль+вода
3. Кислота +основный оксид = соль+ вода
4. Кислота + амфотерный оксид = соль+вода
5. Кислота + металл ( если до Н) = соль +Н2↑
4.
Проверяем домашнее заданиеСоставить уравнения реакций между соляной кислотой и веществами из перечня:
магний, оксид магния,гидроксид магния,
алюминий, оксид алюминия, гидроксид алюминия.
Назвать продукты реакции и указать класс исходных веществ.
Mg
+ 2HCl = MgCl2+ H2
Металл
кислота
2Al
+
Металл
MgO + 2HCl = MgCl2+ H2O
Al2O3 +
Mg(OH)2 +2HCl = MgCl2+ 2H2O
Al(OH)3
Основный
оксид
Основание
кислота
кислота
6HCl = 2AlCl3+ 3 H2
кислота
Амфотерный
оксид
6HCl = 2AlCl3+ 3H2O
кислота
+3HCl = AlCl3+ 3H2O
Амфотерный
гидроксид
кислота
Почему гидроксиды магния и алюминия принадлежат к
разным классам веществ?
5.
Практическая часть• Окраска индикаторов (заполните таблицу
по результатам наблюдений)
HCl
метилоранж
лакмус
фенолфталеин
Универсальный
индикатор
H2SO4
H3PO4
6.
Практическая часть• 1. Взаимодействие кислот с основаниями,
амфотерными гидроксидами и щелочами:
Уравнения реакций
H2SO4 + 2KOH = K2SO4 + 2H2O
H2SO4 + Cu(OH)2 = CuSO4+ 2H2O
Наблюдения
1.Видимых признаков нет
2.Растворение осадка
2HCl + Fe(OH)2 = FeCl2 + 2H2O
3.
3HCl + Fe(OH)3 = FeCl3 + 3H2O
4.
7.
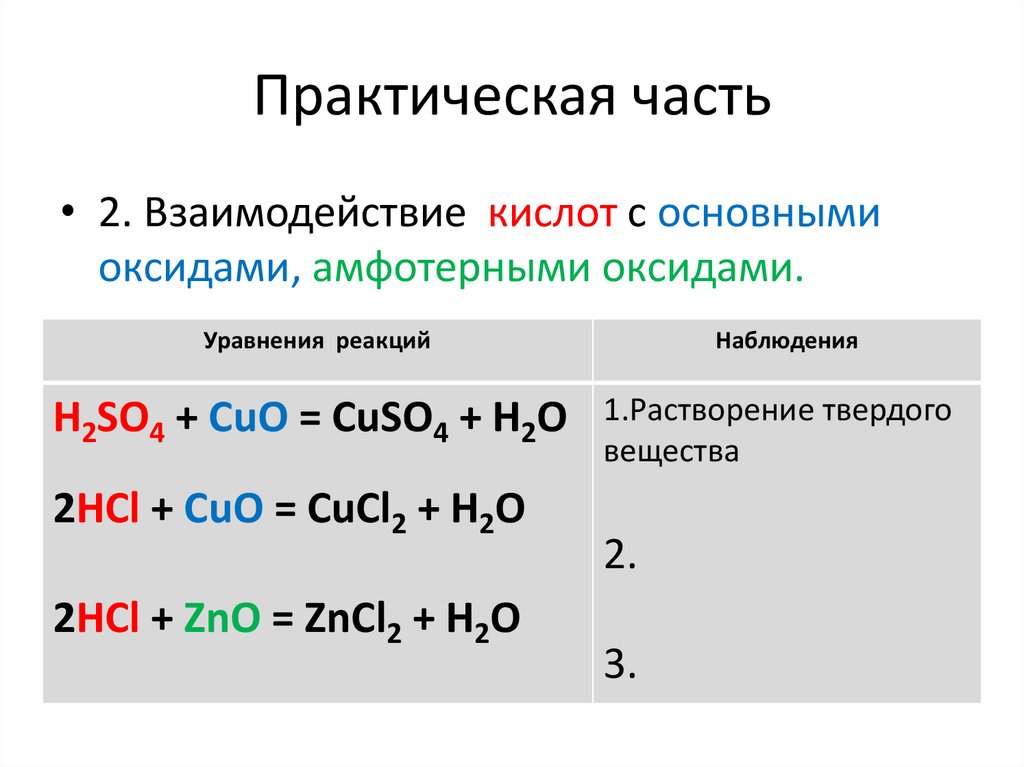
Практическая часть• 2. Взаимодействие кислот с основными
оксидами, амфотерными оксидами.
Уравнения реакций
Наблюдения
H2SO4 + CuO = CuSO4 + H2O
1.Растворение твердого
вещества
2HCl + CuO = CuCl2 + H2O
2HCl + ZnO = ZnCl2 + H2O
2.
3.
8.
Практическая часть• 3. Взаимодействие кислот с металлами.
Уравнения реакций
Наблюдения
H2SO4 + Мg = MgSO4 + H2
1.
2HCl + Zn= ZnCl2 + H2
2.
HCl + Cu = не взаимодействует, т.к. 3.
9.
Домашняя работа• Запишите уравнения возможных реакций алюминия, серебра,
оксида магния и гидроксида калия:
• с соляной кислотой
• с серной кислотой
• с фосфорной кислотой
• с бромоводородной кислотой. (см образец на слайде 4)
• Укажите классы веществ, дайте названия продуктов реакции.
• Выучите материал урока.
• Уметь записывать уравнения реакций, знать классы веществ,
понимать результат взаимодействия, комментировать
результат реакции формулировкой из правил







 Химия
Химия








