Похожие презентации:
Химические свойства элементов IV группы и их соединений
1.
Химические свойства элементовIV группы и их соединений.
2.
Учебная цель:• 11.2.1.2 составлять уравнения реакций,
характеризующих химические свойства
элементов IV группы и их соединений;
• 11.2.2.1 решать задачи по уравнениям
параллельно протекающих реакций
3.
Задание:Записать полное строение атома свинца.
Критерий оценивания: знает строение атома
Дескриптор:
- Записывает количество электронов, протонов,
нейтронов (1 балл);
- Записывает энергетические уровни и количество
электронов на каждом уровне (1 балл);
- Записывает электронно-графическую формулу
атома (1 балл);
- Записывает валентные возможности олова (1 балл).
4.
Самопроверка5.
Химические свойства:При нормальных условиях – инертно.
I. С простыми веществами:
1. С галогенами:
Sn + Cl2 =
2. С кислородом:
Sn + O2 =
3. С серой (сусальное золото):
Sn + S =
6.
II. Со сложными веществами:С водой не реагирует.
1. С кислотами при нагревании:
Sn + HCl =
2. С кислотами – окислителями:
7.
3. С щелочами в присутствииперекиси водорода:
Sn + 2KOH + 4H2O =
K2[Sn(OH)6] + 2H2
8.
Соединения:• Оксиды: SnO, SnO2
Амфотерные.
SnO2 – устойчив к t,
растворам кислот и
щелочей.
9.
Гидроксиды: Sn(OH)2, Sn(OH)4Амфотерные.
Задание: допишите уравнения
реакций
Sn(OH)2 + HCl =
Sn(OH)2 + NaOH =
Sn(OH)4+ HCl =
Sn(OH)4 + NaOH =
10.
СвинецPb
11.
Химические свойства:I. С простыми веществами:
1. С кислородом (на воздухе покрывается
желтым налетом – оксидная пленка):
Pb + O2 =
12.
II. Со сложными веществами:1. С водой не реагирует. Но в
присутствии кислорода окисляется:
2Pb + 2H2O + O2 = 2Pb(OH)2
2. С кислотами HCl, H2SO4 не
реагирует т.к. на поверхности
образуется пленка из нерастворимых
PbCl2 и PbSO4. (Пассивируется).
3. Реагирует с разбавленной азотной
кислотой:
13.
4. С растворами щелочей:14.
Соединения:• Оксиды: PbO, который при
дальнейшем t переходит в Pb3O4 –
свинцовый сурик, оранжево-красного
цвета.
Амфотерные.
15.
Гидроксид: Pb(OH)2Амфотерный.
Задание: допишите уравнения
реакций
Pb(OH)2 + HNO3 =
Pb(OH)2 + NaOH (р-р) =
Pb(OH)2+ NaOH (тв) =
16.
Соли свинца• 1. PbCl2 – осадок белого цвета. Реакция
получения:
Pb(NO3)2 + NaCl =
2. Pbl2 – осадок желтого цвета. Реакция
получения:
Pb(NO3)2 + Nal =
3. PbS – осадок черного цвета. Реакция
получения:
Pb(NO3)2 + H2S =
17.
Учебные задания:• Выучить конспект.
• Записать химические свойства
свинца и его соединений по
плану (на примере олова).












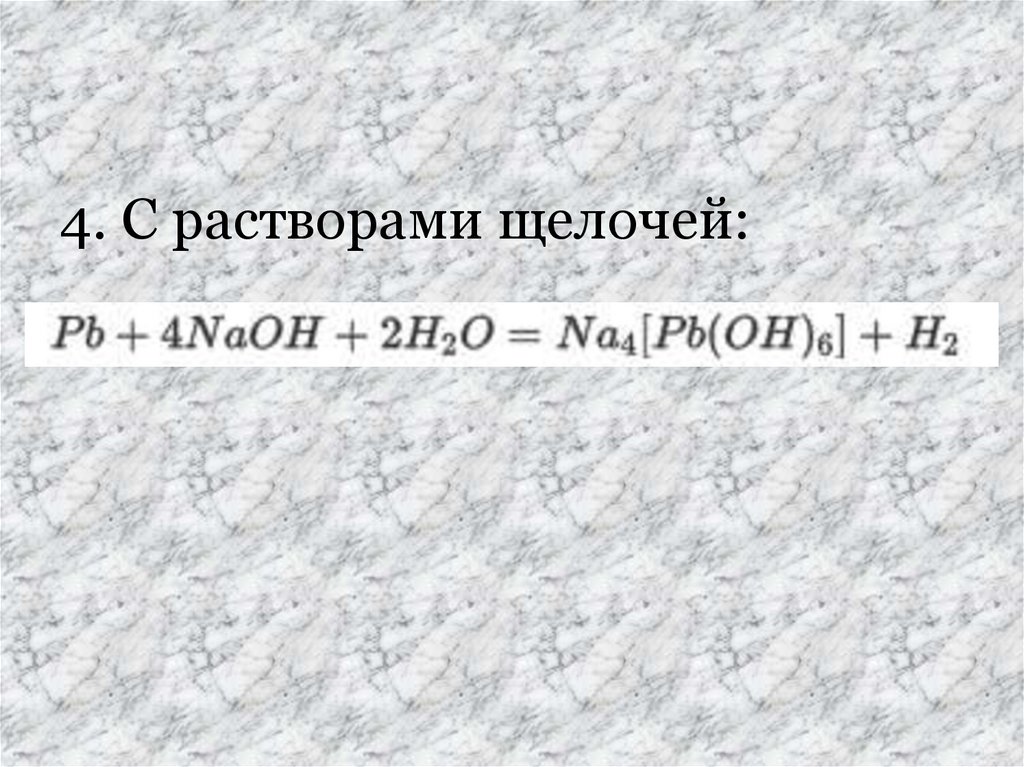




 Химия
Химия