Похожие презентации:
Углерод. Происхождение названия
1. «Углерод».
2. Цели урока
• Образовательная -- рассмотрение строения атома, аллотропииуглерода; формирование представлений о строении, свойствах и
применении алмаза и графита; ознакомление с явлением
адсорбции, характеристика физических и химических свойств
углерода.
• Развивающая – установление причинно-следственных связей
(строение – свойства – применение).
• Воспитательная – воспитание культуры общения, культуры
труда.
3. Углерод
• Химический элемент 4 группы периодическойсистемы Д.И. Менделеева, атомный номер 6,
атомная масса 12,011.
4. Происхождение названия
• В начале XIX века в русскойхимической литературе иногда
применялся термин «углетвор» (Шерер,
1807; Севергин, 1815); с 1824
года Соловьёв ввёл название «углерод».
Соединения углерода имеют в названии
часть карб(он)- от лат. carbō (род.
п. carbōnis) «уголь».
5.
+6С)2)4
+14Si )2)8)4
+32Ge )2)8)18)4
+50Sn )2)8)18)18)4
+82Pb )2)8)18)32)18)4
Общая электронная
формула внешнего слоя
nS2
n P2
↑↓
↑
↑
Р - элементы
6. Изменение свойств в группе
На внешнем слое 4 электрона, значит,являются неметаллами
С
Si
Ge
Sn
Pb
Металлические свойства
увеличиваются
7.
Углерод• Порядковый номер – 6
• Строение атома: протонов – 6, нейтронов
– 6, электронов – 6
• Энергетических уровней – 2
• Число электронов на последнем уровне –
4
• Максимальная степень окисления + 4
• Минимальная степень окисления -4
8. Нахождение в природе
• Содержание углерода в земной коре 0,1 % помассе. Свободный углерод находится в природе в
виде алмаза и графита.
В атмосфере и гидросфере находится в
виде диоксида углерода СО2, в воздухе 0,046 %
СО2 по массе, в водах рек, морей и океанов в ~60
раз больше. Углерод входит в состав растений и
животных (~18 %).
9. Углерод в организме человека
• В организм человека углерод поступает с пищей(в норме около 300 г в сутки). Общее содержание
углерода в организме человека достигает около
21 % (15 кг на 70 кг массы тела). Углерод
составляет 2/3 массы мышц и 1/3 массы костной
ткани. Выводится из организма преимущественно
с выдыхаемым воздухом (углекислый газ) и
мочой (мочевина).
10.
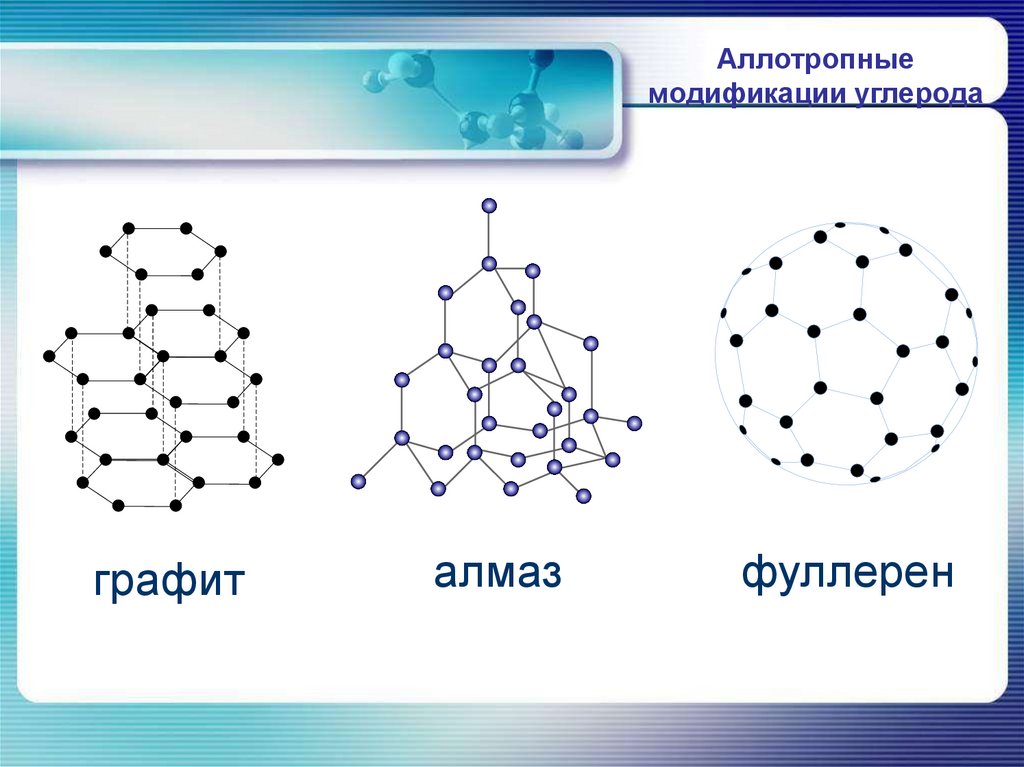
Аллотропныемодификации углерода
графит
алмаз
фуллерен
11.
ПОЧЕМУА Л М А З - очень твердый,
Г Р А Ф И Т – очень мягкий ?
Кристаллическая решетка алмаза
Кристаллическая решетка графита
12.
АЛМАЗ13.
АЛМАЗАлмаз имеет атомную
кристаллическую
решетку, в которой
каждый атом углерода
связан с четырьмя
атомами. В пространстве
эти атомы располагаются
в центре и углах
тетраэдров, соединенных
своими вершинами. Это
очень симметричная и
прочная решетка.
14.
БоровиковскийВладимир Лукич
Портрет князя А.Б. Куракина
15.
Алмаз «Шах»Звезда ордена
Св. Андрея Первозванного
Скипетр императорский
16.
Большая императорская коронаМалая императорская корона
17.
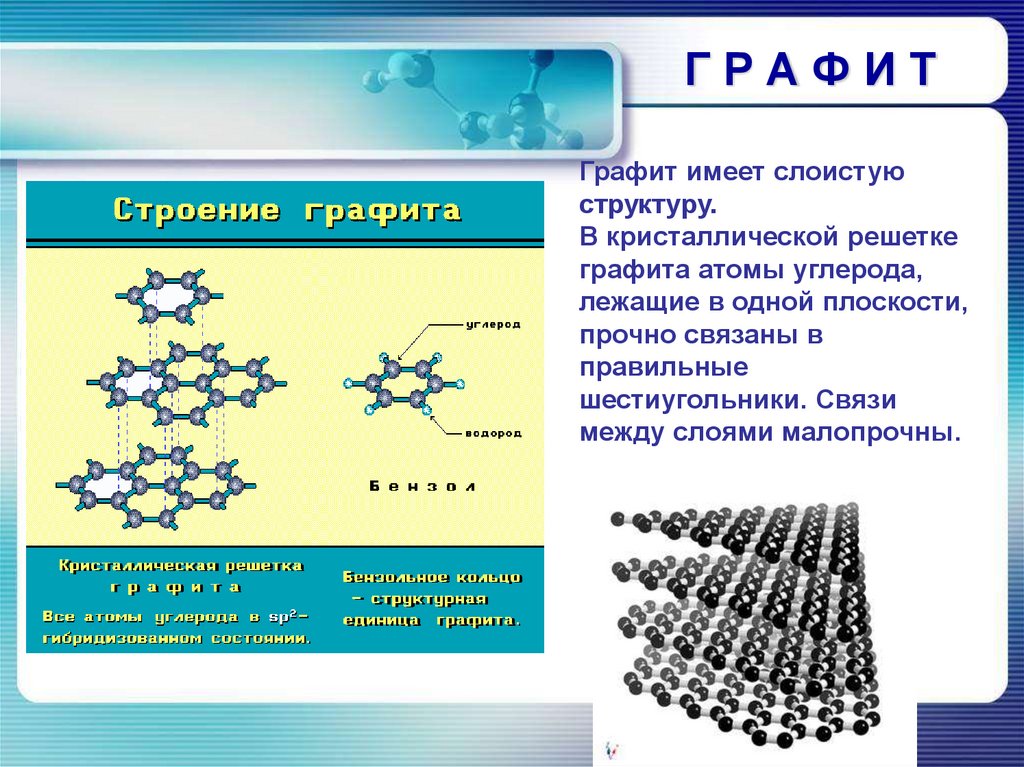
ГРАФИТГрафит имеет слоистую
структуру.
В кристаллической решетке
графита атомы углерода,
лежащие в одной плоскости,
прочно связаны в
правильные
шестиугольники. Связи
между слоями малопрочны.
18.
ГРАФИТПрименение графита:
• Электроды для электролиза
• Облицовка сопел ракетных двигателей
• Смазка для трущихся поверхностей,
работающих при очень высоких и очень низких
температурах
• Стержни для карандашей
• Замедлители нейтронов в ядерных реакторах
19.
ГРАФИТСходное с графитом строение имеют:
Сажа
типографская краска, картриджи, резина,
косметическая тушь
Древесный уголь
Кокс
твердое топливо,
адсорбент для очистки
газов и жидкостей
восстановитель при выплавке чугуна из руд
20. Адсорбция
• Поглощение газообразных или растворенныхвеществ поверхностью твердого вещества.
Выделение эти веществ- десорбция.
• Применение:
• В медицине
• Для очистки примесей
• Для очистки дыхательных путей
21.
Н.Д.Зелинский22.
Угольные фильтрыВ бытовых фильтрах, в промышленном
производстве, на очистных сооружениях –
уголь поглощает вредные вещества из воды
23.
Химическиесвойства
углерода
Окислитель
+4 ē
Восстановитель
+4
С
-4 ē
Cl2, F2, O2, HNO3 С0
Me, H2
-2ē (О2, Н2О)
С+2
С-4
24. Химические свойства
восстановительокислитель
1.С кислородом
1.С некоторыми
металлами
2Be +C=Be2C
4Al+3C=Al4C3
C+O2=CO2
2C+O2=2CO(неполное
сгорание)
2.С водой
C+H2O=CO+H2
водяной газ
t >1200 C
3.С оксидами металлов
C+2Zn=2Zn+CO2
2.С водородом
C+H2=CH4
25. Токсическое действие
• Углерод входит в состав атмосферных аэрозолей,в результате чего может изменяться
региональный климат, уменьшаться количество
солнечных дней. Углерод поступает в
окружающую среду в виде сажи в составе
выхлопных газов автотранспорта, при сжигании
угля на ТЭС, при открытых разработках угля,
подземной его газификации, получении угольных
концентратов и др.
26.
Тест1. Конфигурация внешнего
электронного уровня элементов
подгруппы углерода:
а) ns2np2
б) ns2np3
в) ns2np4
г) ns1np2
2. Наиболее характерная
валентность элементов подгруппы
углерода:
а) II
б) III
в) IV
г) V
3. Неметаллические свойства
элементов подгруппы углерода в
группе сверху вниз:
а) уменьшаются
б) уменьшаются, затем возрастают
в) возрастают
г) не изменяются
4. Углерод является:
а) восстановителем
б) восстановителем и окислителем
в) окислителем
г) не проявляет окислительно-восстановительных свойств
5. Атомную слоистую кристаллическую решетку имеет:
а) алмаз
б) фуллерен
в) графит
г) карбин
6. Наибольшей прочностью отличается кристаллическая
решетка:
а) атомная
б) ионная
в) атомная слоистая
г) молекулярная
7. Наиболее химически активна аллотропная
модификация углерода:
а) алмаз
б) фуллерен
в) графит
г) карбин
27.
ПРОВЕРЬ ПОЛУЧЕННЫЕ ЗНАНИЯОтветы к тесту
1.а; 2.в; 3.а; 4.б; 5.в;
6.а; 7.в
28.
Домашнее задание§ 29 стр. упр. 5, 6, 7.
Используя дополнительную литературу и
информацию в Интернете сделать сообщения по
темам: 1. Алмаз, 2. Графит.

























 Химия
Химия








