Похожие презентации:
Скорость протекания химических реакций
1.
2.
Химическая кинетика - раздел химии, изучающийскорости и механизмы химических реакций.
Система в химии - рассматриваемое вещество или
совокупность веществ.
Фаза - часть системы, которая отделена от других частей
поверхностью раздела.
Поверхность раздела - граница между двумя фазами.
Гомогенная (однородная) система - система, состоящая
только из одной фазы.
Гетерогенная (неоднородная) система - система,
состоящая из нескольких фаз
3.
Гомогенная реакция - реакция,протекающая в гомогенной системе
во всем объёме системы.
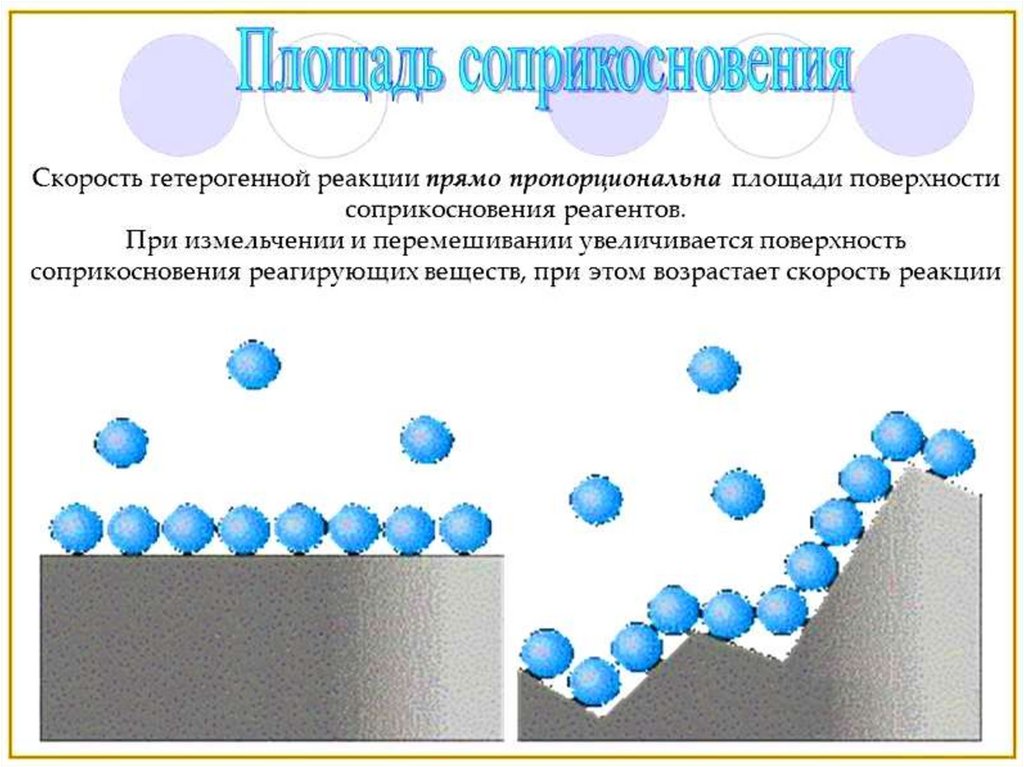
Гетерогенная реакция - реакция,
протекающая в гетерогенной
системе на поверхности раздела
фаз
4.
Скорость химической реакции –это изменение количества одного из
реагирующих веществ или одного из продуктов
реакции в единицу времени
5.
6.
7.
8.
9.
10.
11.
12.
Концентрациитвёрдых
веществ не
учитываются!
13.
14.
Константа скорости химической реакцииКонстанта скорости (k) - это скорость химической
реакции при концентрации реагирующих веществ 1
моль/л. Она зависит от природы реагирующих
веществ, температуры и присутствия катализатора, но
не зависит от изменения концентрации участвующих
в реакции веществ.
Чем больше константа скорости химической
реакции, тем больше скорость данной химической
реакции по сравнению с другими реакциями при
прочих равных условиях
15.
Влияние катализаторов и ингибиторовна скорость химической реакции:
Катализаторы - вещества, увеличивающие скорость
химической реакции, но в конце реакции остающиеся
неизменными как качественно, так и количественно. В
обратимых реакциях увеличивают скорость как прямой,
так и обратной реакции.
Ингибиторы - вещества, замедляющие скорость
химической реакции, но в конце реакции остающиеся
неизменными как качественно, так и количественно.
Катализ - изменение скорости химической реакции под
действием катализатора












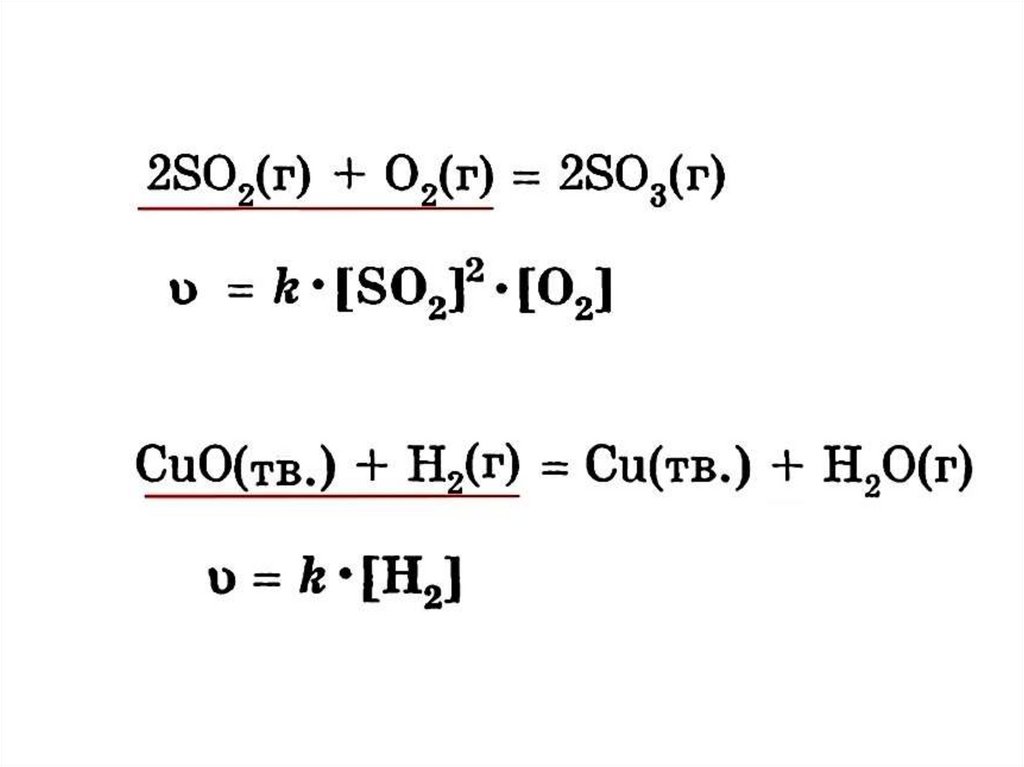




 Химия
Химия








