Похожие презентации:
Химическое равновесие. Принцип Ле Шателье
1.
Химическое равновесие.Принцип Ле Шателье
2.
Химическим равновесиемназывается
состояние
химической
системы,
при
котором
количества
исходных веществ и продуктов не
меняются со временем, но при этом
протекают
химические
реакции,
а
система является закрытой, то есть не
обменивается с окружающим миром
веществом.
3.
Химические реакции, которые протекают сосравнимыми
скоростями
в
обоих
направлениях, называются обратимыми.
Для внешнего наблюдателя в такой
системе
химические
превращения
не
происходят, но на самом деле здесь постоянно
идут прямая и обратная реакции. Рассмотрим
эту систему с точки зрения химической
кинетики.
4.
Допустим, для опыта взяли газообразныеводород и йод. В первый момент времени
еще нет HI, поэтому идет только прямая
реакция, скорость которой (vпр) выражается
кинетическим уравнением:
vпр = k1[H2][I2]
k1 – константа скорости прямой реакции.
Постепенно в смеси накапливается
продукт реакции HI. Но в этих же условиях
йодистый водород с заметной скоростью
разлагается на исходные вещества: H2 и
I2.
Скорость обратной реакции (vобр)
выражается кинетическим уравнением с
константой скорости k2:
vобр = k2[HI]2
5.
Когда йодистого водорода образуется ужедостаточно
много
(т.е.
когда
его
концентрация
достигнет
определенной
величины), скорости прямой и обратной
реакции выравниваются:
vпр = vобр
В
этом
случае
говорят,
что
наступило
химическое
равновесие.
Количество содержащихся в равновесной
системе веществ H2, I2 и HI теперь не
меняется со временем, если нет внешних
воздействий на систему.
6.
Химическоеравновесие
носит динамический характер. Например, в
приведенной
реакции
HI
постоянно
образуется и расходуется. Если добавить в
такую равновесную смесь радиоактивный
йод-131, то он быстро распределяется между
молекулами I2 и HI. Это говорит о постоянном
переходе атомов йода из исходного вещества
в продукт реакции и обратно.
7.
Можно ли изменить состояниехимического равновесия?
Иными словами – можно ли
сдвинуть равновесие в сторону
образования продуктов или в
сторону образования исходных
веществ?
8.
Принцип Ле Шателье: если насистему, находящуюся в равновесии,
оказывается внешнее воздействие, то
равновесие сместится таким образом,
чтобы это воздействие нейтрализовать.
Основные факторы, влияющие на
положение равновесия:
Давление
Температура
Концентрации реагентов и продуктов
Важно: катализатор не влияет на
положение равновесия!
9.
Анри Луи Ле Шателье (1850-1936)Французский физикохимик, Президент Французского
химического общества, член многих академий, в том
числе Петербургской АН. Был почетным членом и АН
СССР. Независимо от немецкого химика Ф. Габера в 1901
г. нашел условия синтеза аммиака.
10.
1) ДавлениеИзменение давления влияет только на
газы. При увеличении давления возрастает
концентрация газа, то есть расстояние
между молекулами уменьшается.
Для того, чтобы согласно принципу Ле
Шателье
сделать
межмолекулярное
расстояние прежним при увеличении
давления равновесие смещается туда, где
меньше моль газов, при уменьшении –
туда, где больше.
11.
12.
2) Температура.Процессы, происходящие с выделением
тепла, называют экзотермическими, с поглощением –
эндотермическими.
При изменении температуры равновесии
сместится так, чтобы это изменение нивелировать:
при нагревании система «захочет» остыть, при
охлаждении – нагреться. То есть в эндотермическом
процессе при нагревании равновесие сместится в
сторону продуктов, при охлаждении – реагентов, а
в экзотермическом – наоборот.
13.
3) КонцентрацияПосле добавления какого-либо участника
реакции согласно принципу Ле Шателье его
концентрация должна уменьшится, то есть он
начинает расходоваться быстрее и равновесие
смещается в сторону «от него». При понижении
концентрации
вещества
оно
начинает
накапливаться (чтобы концентрация возросла и
стала прежней) – равновесие смещается «к нему».
14.
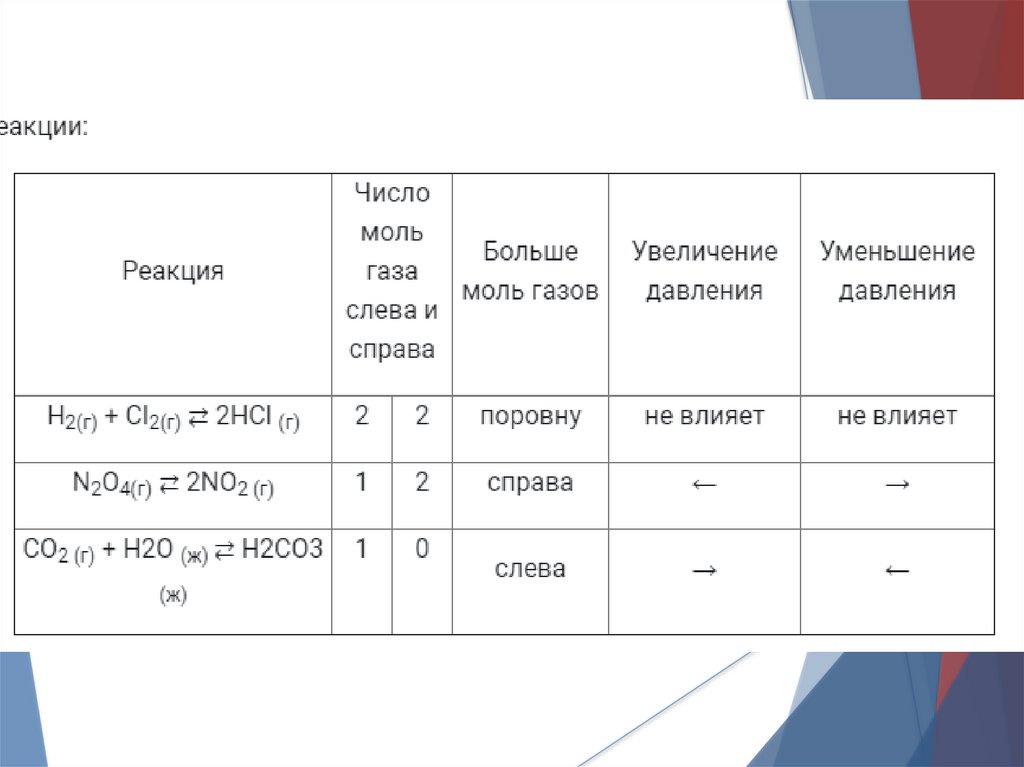
Задачи1. В каких реакциях изменение давления
окажет влияние на смещение равновесия?
15.
https://dzen.ru/media/id/5d2de3c4bc228f00aec36bc0/ege-po-himii2022-algoritm-vypolneniia-23zadachi-617a4e662f27ea04c8bf9126 Ссылка на
16.
Домашнее задание1. В реактор постоянного объёма поместили некоторое
количество оксида серы(IV) и кислорода. В результате протекания
обратимой реакции 2SO(г) + O2 (г)= 2SO3 (г) в реакционной системе
установилось химическое равновесие. При этом исходная
концентрация кислорода составила 1,4 моль/л, а равновесная
концентрация оксида серы(IV) и оксида серы(VI) — 1,4 моль/л и
0,4 моль/л соответственно.
Определите исходную
концентрацию O2.
концентрацию
и
SO2
равновесную
2. В реактор постоянного объёма поместили некоторое количество
азота и водорода. В результате протекания обратимой реакции N2 (г)
+ 3H2 (г) = 2NH3 (г) в реакционной системе установилось
химическое равновесие. При этом исходная концентрация азота
составила 1,5 моль/л, а равновесная концентрация водорода и
аммиака — 0,2 моль/л и 0,9 моль/л соответственно.
Определите равновесную
концентрацию H2.
концентрацию
N2
и
исходную















 Химия
Химия








