Похожие презентации:
Соединения Углерода
1.
2.
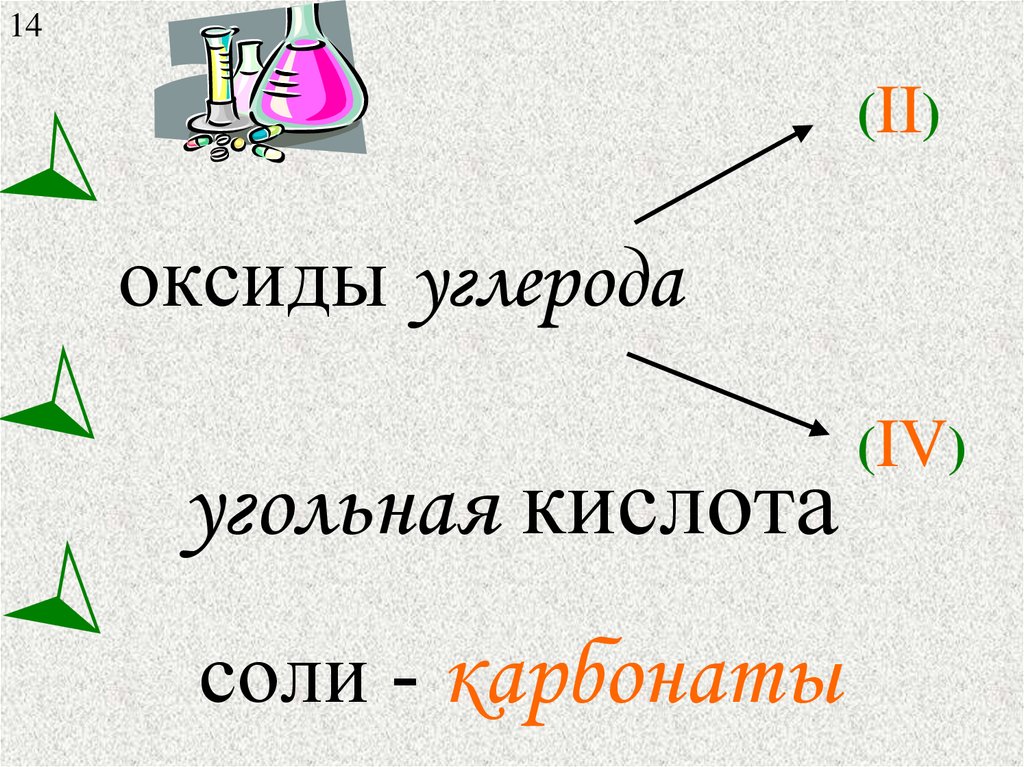
14(II)
оксиды углерода
угольная кислота
соли - карбонаты
(IV)
3.
15оксид углерода (II)
окись углерода
CO
угарный газ
ядовит
↑
ц
з
н
4.
16 Симптомы угорания:слабость
головокружение
удушье
потеря сознания
смерть
Первая медицинская помощь при отравлении СО:
Свежий воздух
Вызвать врача
Нюхать нашатырный спирт
Теплое питье
К ногам и рукам
теплые грелки
5.
17ПОЛУЧЕНИЕ
1. В газогенераторах
C + O2 = CO2 ↑ + Q
CO2 + C = 2CO↑ - Q
2. В лаборатории
HCOOH = H2O + CO
6.
187.
19С кислородом ОВР
CO + O2=CO2 + Q
Горит синим пламенем
8.
20С оксидами металлов
2e
+2
+2
tо
о
+4
C O+Cu O = Cu + C O2
9.
21С хлором на свету
+2
СО
C O + Cl2 = COCl2
фосген
несолеобразующий
10.
22оксид углерода IV
диоксид углерода
CO2
↑
ц
з
Р
M(CO2)
угольный ангидрид
в1
V
H
O
1V
CO
2
2
углекислый газ
ДЫХАНИЕ
ГОРЕНИЕ
Т0= 150с
Тв.- хладагент- «
»
сухой лёд
11.
23Получение
Обжиг известняка
CaCO3 = Ca O + CO2↑
В лаборатории – действием
сильных кислот на карбонаты
CaCO3+ 2HCl = CaCl2 + CO2↑ + H2O
Кислотный оксид
12.
2413.
25Общие с кислотными оксидами
1. С водой
CO2 +H2O ↔ H2 CO3
2. Со щелочами
CO2 + 2NaOH → Na2 CO3 + H2O
3. С основными оксидами
CO2 + CaO → Ca CO3
14.
26СПЕЦИФИЧЕСКИЕ
1. При пропускании через известковую
воду наблюдается
CO2 + Ca(OH)2 → Ca CO3 ↓ + H2O
Для обнаружения оксида углерода ( IV)
2. При повышенной температуре обладает
окислительными свойствами
CO2 + 2Mg → 2MgO + C
15.
27Качественная реакция
CO2 + Ca( OH)2 = Ca CO3↓ + H2O
Помутнение
известковой воды
16.
ЕИ
Н
28
М
И
Р
П
Е
Н
Е Тушение пожаров
Производство минеральных вод
«Сухой лёд»
Производство соды, которую
используют для получения
♦ стекла,
♦ моющих средств,
♦ лекарств.






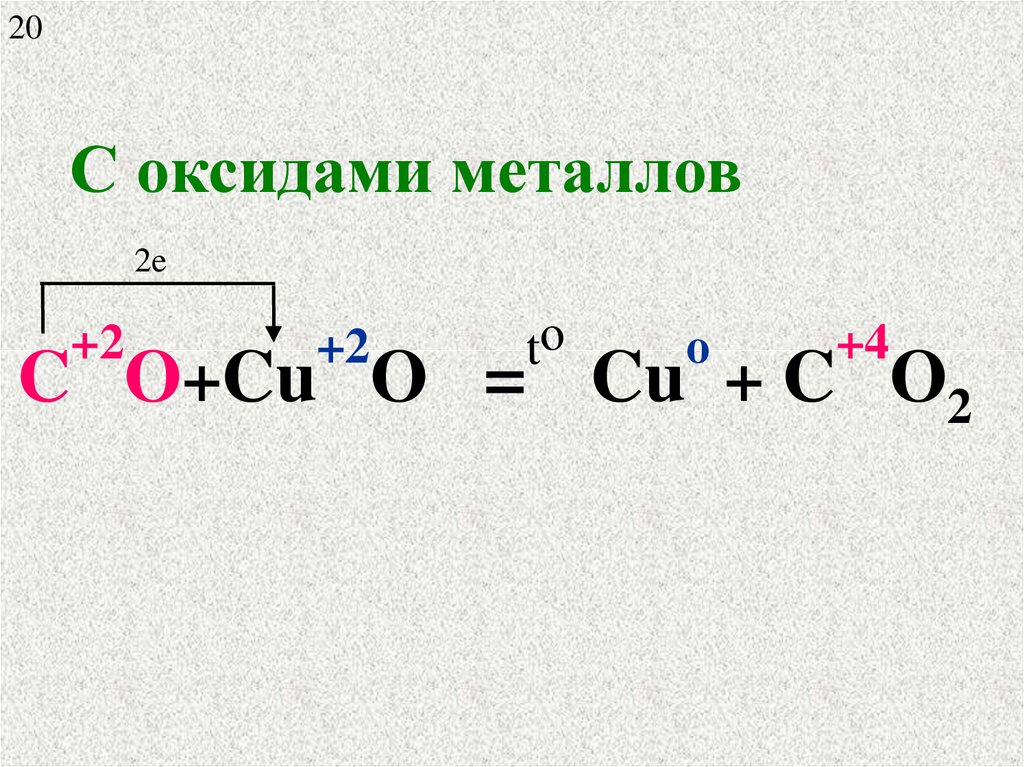








 Химия
Химия








