Похожие презентации:
Вода и минеральные вещества организма. Лекция №2
1.
Лекция № 2Вода и минеральные вещества
организма
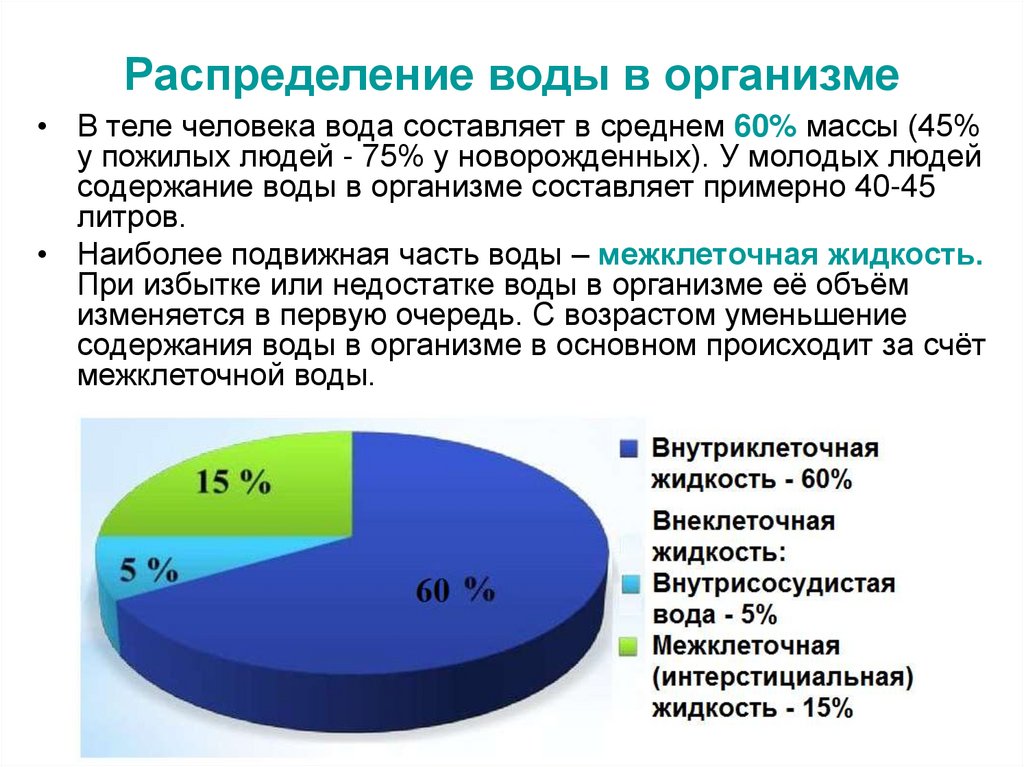
2. Распределение воды в организме
• В теле человека вода составляет в среднем 60% массы (45%у пожилых людей - 75% у новорожденных). У молодых людей
содержание воды в организме составляет примерно 40-45
литров.
• Наиболее подвижная часть воды – межклеточная жидкость.
При избытке или недостатке воды в организме её объём
изменяется в первую очередь. С возрастом уменьшение
содержания воды в организме в основном происходит за счёт
межклеточной воды.
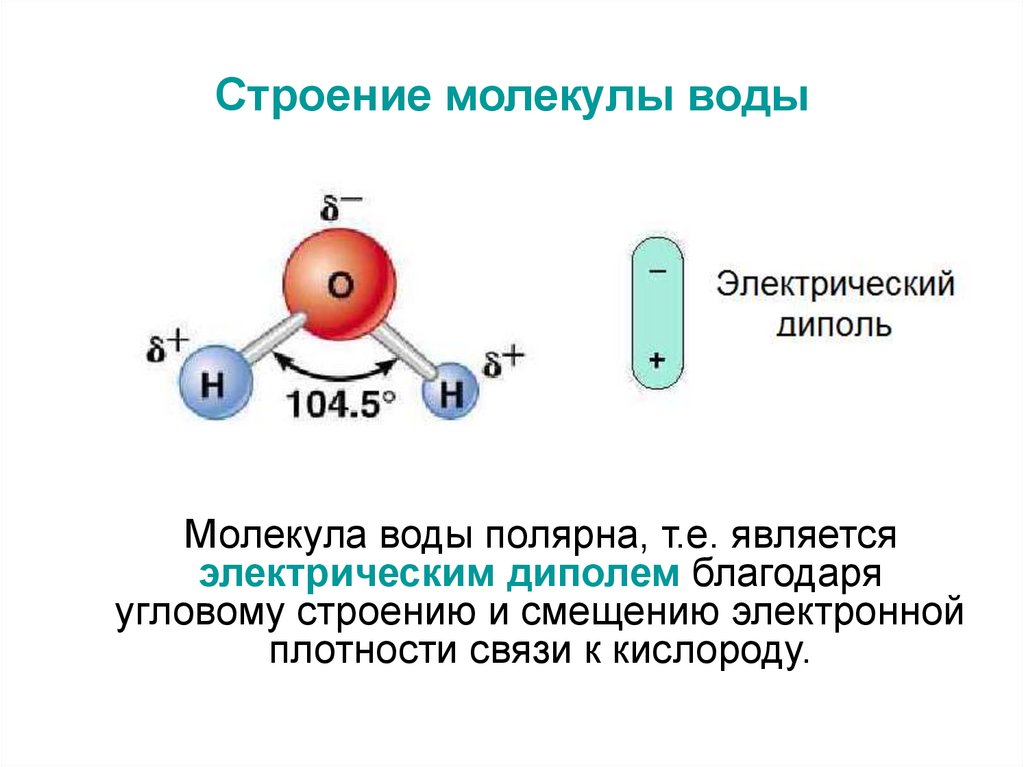
3. Строение молекулы воды
Молекула воды полярна, т.е. являетсяэлектрическим диполем благодаря
угловому строению и смещению электронной
плотности связи к кислороду.
4.
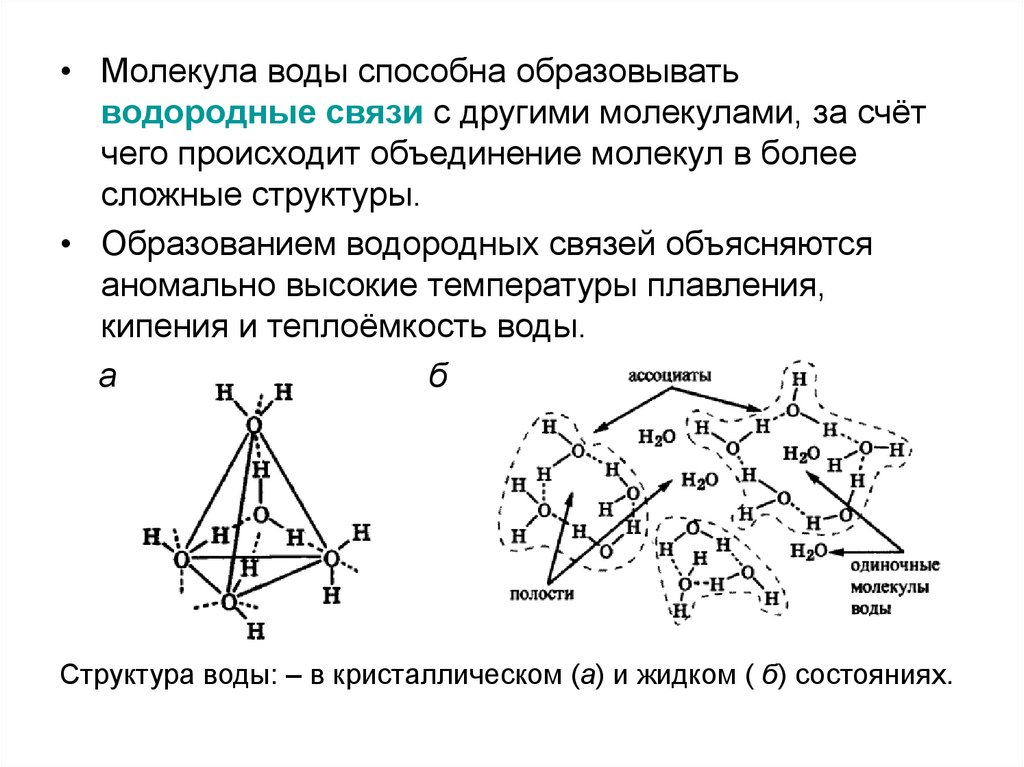
• Молекула воды способна образовыватьводородные связи с другими молекулами, за счёт
чего происходит объединение молекул в более
сложные структуры.
• Образованием водородных связей объясняются
аномально высокие температуры плавления,
кипения и теплоёмкость воды.
а
б
Структура воды: – в кристаллическом (а) и жидком ( б) состояниях.
5. Вода как растворитель
• Вода является универсальным растворителемблагодаря высокой полярности молекул и
способности образовывать водородные связи.
• При растворении веществ
происходит их гидратация –
притяжение молекул воды к
частицам растворяемого
вещества.
• Вокруг молекул или ионов
растворённого вещества
образуется оболочка из
молекул воды – гидратная
оболочка.
6. Состояние воды в организме (в зависимости от степени связанности)
• Свободная вода составляет основу биологическихжидкостей (крови, лимфы, слюны, мочи и др.). Участвует
в обмене веществ с внешней средой, в доставке
клеткам питательных веществ и кислорода, удалении
продуктов обмена.
• Гидратационная (связанная) вода входит в состав
гидратных оболочек различных молекул. Участвует в
формировании пространственных структур
биополимеров. Бóльшая часть воды в организме
находится в связанном состоянии.
• Иммобилизованная вода находится в замкнутых
структурах различных молекул и органелл, в порах
биологических мембран.
7.
По способности связываться с водоймолекулы или отдельные части молекул
делятся на следующие виды:
• Гидрофильные («любящие воду») – это
частицы, притягивающие воду: ионы и
полярные группы в молекулах (например,
гидроксильная –ОН, амино –NH2,
карбоксильная –СООН и др.)
• Гидрофобные («боящиеся воды») - это
частицы, отталкивающие воду:
углеводородные радикалы органических
соединений (жиры, воски, холестерин)
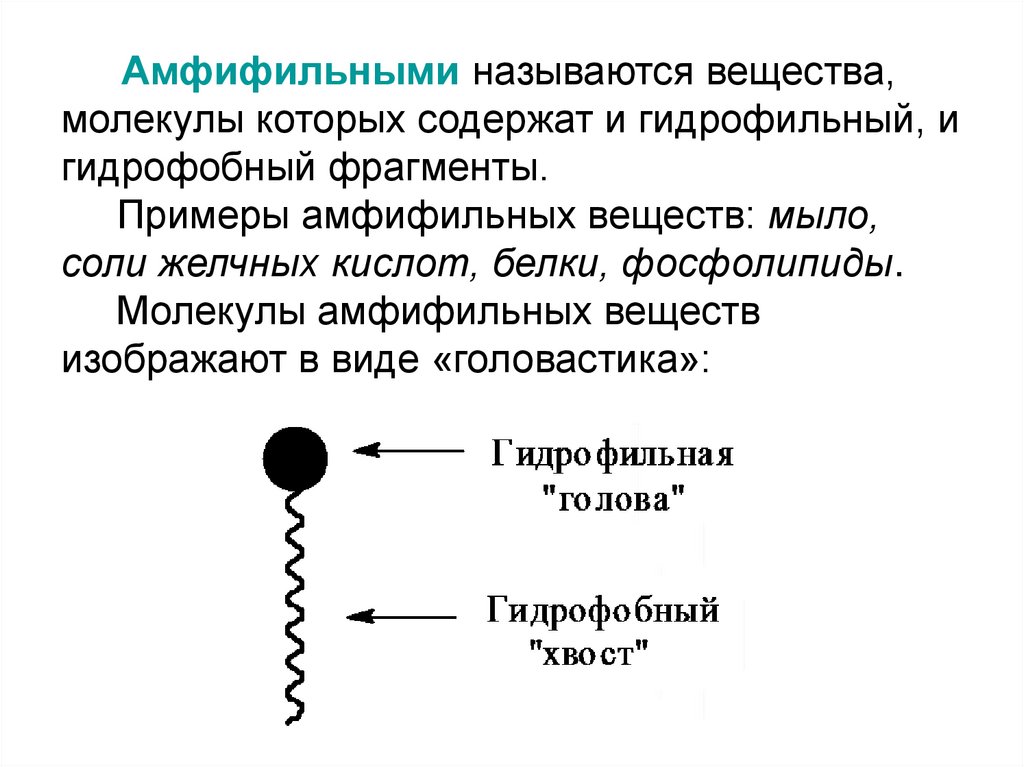
8. Амфифильными называются вещества, молекулы которых содержат и гидрофильный, и гидрофобный фрагменты. Примеры амфифильных
веществ: мыло,соли желчных кислот, белки, фосфолипиды.
Молекулы амфифильных веществ
изображают в виде «головастика»:
9.
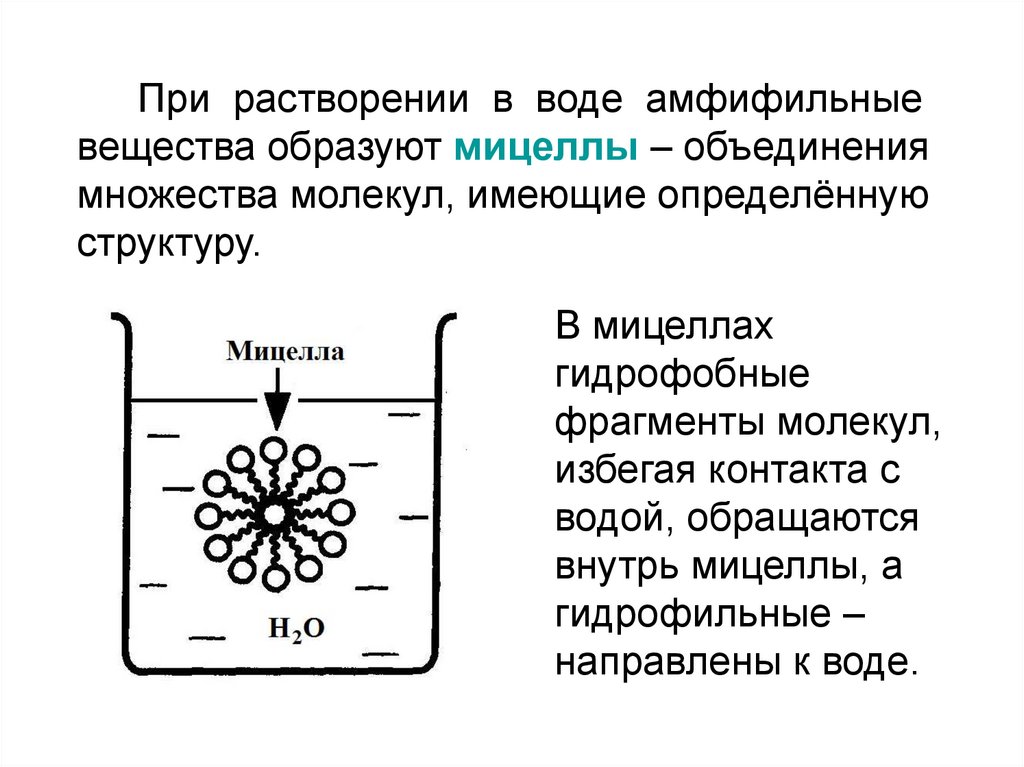
При растворении в воде амфифильныевещества образуют мицеллы – объединения
множества молекул, имеющие определённую
структуру.
В мицеллах
гидрофобные
фрагменты молекул,
избегая контакта с
водой, обращаются
внутрь мицеллы, а
гидрофильные –
направлены к воде.
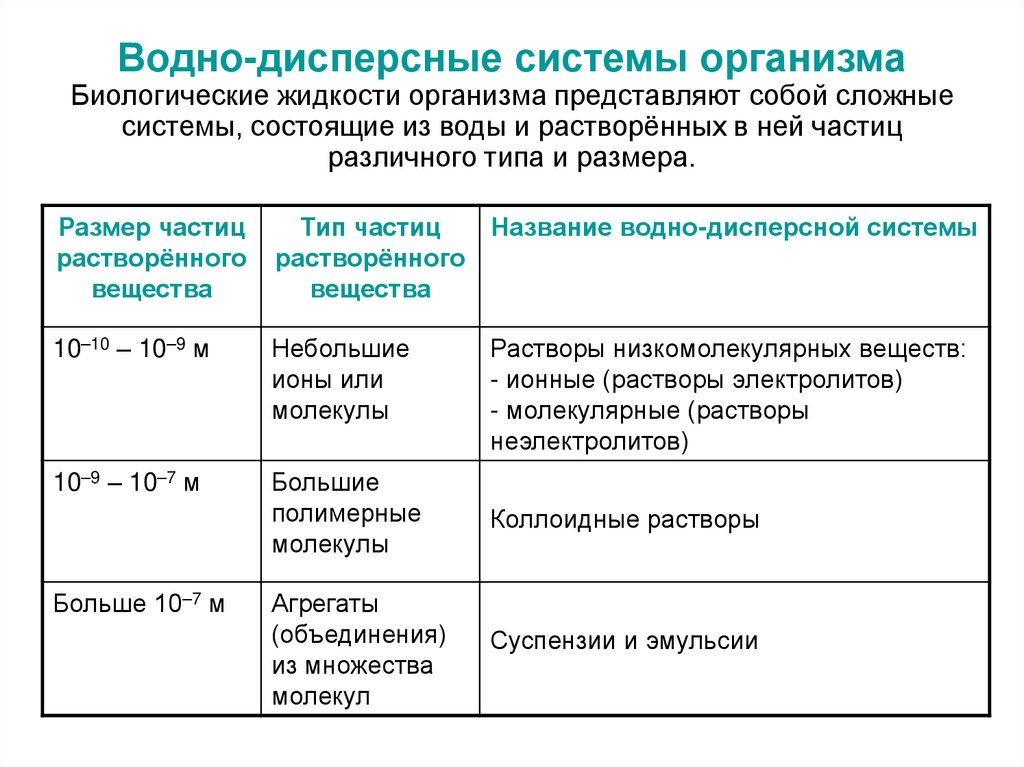
10. Водно-дисперсные системы организма Биологические жидкости организма представляют собой сложные системы, состоящие из воды и
растворённых в ней частицразличного типа и размера.
Размер частиц
растворённого
вещества
Тип частиц
Название водно-дисперсной системы
растворённого
вещества
10–10 – 10–9 м
Небольшие
ионы или
молекулы
10–9 – 10–7 м
Большие
полимерные
молекулы
Коллоидные растворы
Агрегаты
(объединения)
из множества
молекул
Суспензии и эмульсии
Больше 10–7 м
Растворы низкомолекулярных веществ:
- ионные (растворы электролитов)
- молекулярные (растворы
неэлектролитов)
11. Растворы электролитов
• Электролиты – вещества, которые прирастворении распадаются на ионы (ионы –
частицы, имеющие заряд). К электролитам
относятся кислоты, основания, соли.
• Электролитическая диссоциация - это
распад электролитов на ионы при их
растворении или расплавлении.
• Растворы электролитов хорошо проводят
электрический ток. Под действием
электрического тока положительно
заряженные ионы (катионы) движутся к
катоду, отрицательно заряженные (анионы) –
к аноду.
12.
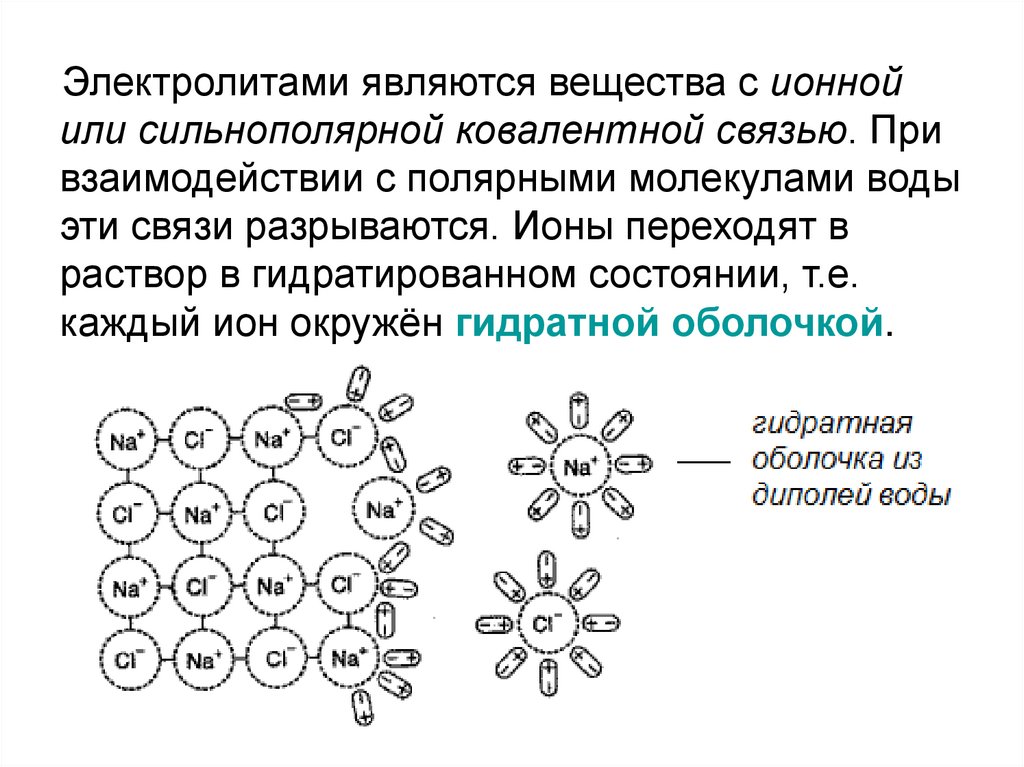
Электролитами являются вещества с ионнойили сильнополярной ковалентной связью. При
взаимодействии с полярными молекулами воды
эти связи разрываются. Ионы переходят в
раствор в гидратированном состоянии, т.е.
каждый ион окружён гидратной оболочкой.
13. Основные классы электролитов: кислоты, основания, соли
• Кислоты диссоциируют в воде собразованием иона водорода H+:
HCl → H+ + Cl–
• Основания диссоциируют в воде с
образованием гидроксид-ионов ОН–:
NaOH → Na+ + ОН–
Основания щелочных металлов (LiOH, NaOH,
KOH) называются щелочами. Свойства
оснований проявляют также аммиак и амины:
NH3 + H2O → NH4+ + ОН–
R–NH2 + H2O → R–NH3+ + ОН–
14.
• Амфотерные электролиты проявляютсвойства и кислот, и оснований.
Примерами амфотерных электролитов
являются вода, аминокислоты:
H2O ↔ Н+ + OH–
NH2–СН(R)–СООН ↔ NH3+–СН(R)–СОО–
• Соли диссоциируют в воде на катионы
металлов или аммония и анионы
кислотного остатка:
NаCl → Na+ + Cl–
NH4Cl → NH4+ + Cl–
15. Растворы неэлектролитов
• Неэлектролиты – вещества, которые прирастворении распадаются на молекулы. Их
растворы слабо проводят электрический ток.
• К неэлектролитам относятся полярные
органические вещества, например, спирты,
альдегиды, кетоны, сахара.
• Растворение неэлектролитов происходит за
счёт образования водородных связей
между молекулами воды и полярными
группами растворяемого вещества:
16. Коллоидные растворы
Коллоидные (клееподобные ) растворы
образуют в воде крупные полимерные
молекулы, например, белки, гиалуроновая
кислота, нуклеиновые кислоты.
Коллоидные растворы имеют высокую
вязкость и при определённых условиях
могут переходить в гелеобразное состояние.
Гель – это система, в которой частицы
растворённого вещества не движутся и
образуют пространственную сетку,
заполненную водой.
17. Суспензии и эмульсии
• Суспензии и эмульсии представляют собойгетерогенные (неоднородные) системы, в
которых крупные частицы, образованные путём
объединения множества молекул, находятся во
взвешенном состоянии в воде.
• В суспензиях частицы растворённого вещества
твёрдые. Например, кровь представляет собой
суспензию клеток в плазме.
• В эмульсиях частицы растворённого вещества
представляют собой капли жидкости, не
смешивающейся с водой (такие жидкости
называют «масло»). Примерами эмульсий
являются молоко, сливки, сметана.
18.
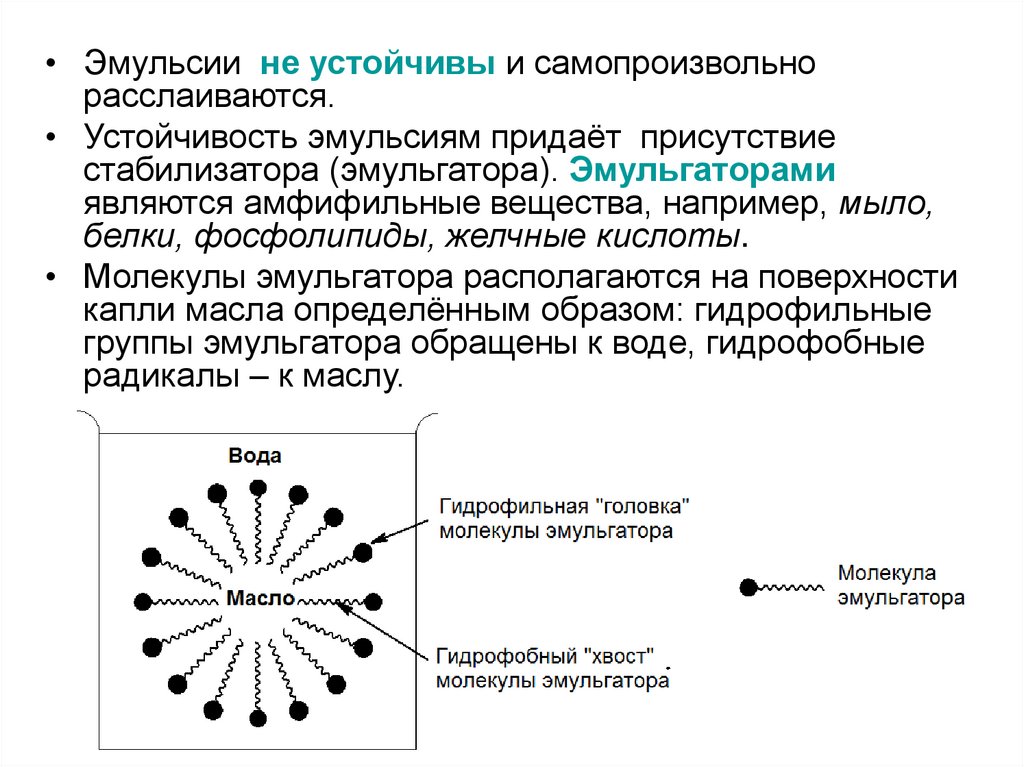
• Эмульсии не устойчивы и самопроизвольнорасслаиваются.
• Устойчивость эмульсиям придаёт присутствие
стабилизатора (эмульгатора). Эмульгаторами
являются амфифильные вещества, например, мыло,
белки, фосфолипиды, желчные кислоты.
• Молекулы эмульгатора располагаются на поверхности
капли масла определённым образом: гидрофильные
группы эмульгатора обращены к воде, гидрофобные
радикалы – к маслу.
19. Биологическая роль воды
1. Вода – универсальный растворитель.Благодаря высокой полярности и
способности образовывать водородные
связи вода участвует в растворении многих
веществ, что способствует высокой скорости
протекания химических реакций.
2. Транспортная функция воды обеспечение доставки к клеткам
питательных веществ и кислорода, а также
выделения во внешнюю среду продуктов
обмена веществ.
20.
3. Участие воды в регуляции тепловогобаланса организма - благодаря высокой
теплоёмкости и большой теплоте испарения
вода обеспечивает регуляцию теплового
баланса организма.
4. Участие в биохимических реакциях - вода
принимает участие во многих биохимических
реакциях в организме, в частности, в
процессах гидролиза – разрыва связей в
биомолекулах.
5. Структурно-механическая функция воды вода и растворённые в ней вещества
способствуют сохранению внутриклеточного
давления и формы клеток (тургор).
21. Водный баланс организма
• Водный баланс организма – это равновесиемежду потреблением и выделением воды.
• Потребность в воде зависит:
от возраста
от температуры окружающей среды
от характера деятельности
от состава потребляемой пищи.
• Суточная потребность в воде взрослого
человека составляет 20 – 40 г на кг массы
тела (2,5-2,8 л при средней массе 70 кг). У
грудного ребёнка потребность в воде в 3 – 4
раза больше.
22. Поступление и выведение воды
23. Нарушения водного баланса
• При нарушениях водного баланса в первуюочередь изменяется объём межклеточной
жидкости.
• Гипергидратация – избыточное поступление воды
при неадекватно малом её выделении. При этом
увеличивается нагрузка на сердце и почки.
• Дегидратация (обезвоживание) – потеря воды
организмом. При дегидратации снижается общий
объём крови, повышается её вязкость. При этом
ухудшается кровообращение мозга, мышц и других
тканей, снижается их функциональная активность.
Потеря 1% воды вызывает чувство жажды. При
потере 20% воды в клетках происходят
необратимые изменения, которые приводят к
гибели организма.
24.
• Дегидратация возможна при физических нагрузкахна выносливость, т.к. увеличивается скорость
метаболических процессов и усиливается
потоотделение. Например, при марафонском беге,
особенно в условиях повышенной температуры,
спортсмен теряет 2-3 л воды в час.
• Для предупреждения дегидратации рекомендуется
выпивать 400 – 500 мл воды за 40 – 60 минут до
начала тренировки или соревнования. Во время
тренировки запасы воды пополняются за счёт частого
приёма небольших порций (40 – 50 мл) воды или
углеводно-минеральных растворов.
• Количество воды, необходимой для восстановления
водного баланса после тренировки или
соревнования, спортсмен может определить путём
взвешивания: потеря 0,5 кг массы тела
соответствует потере 378 мл воды.
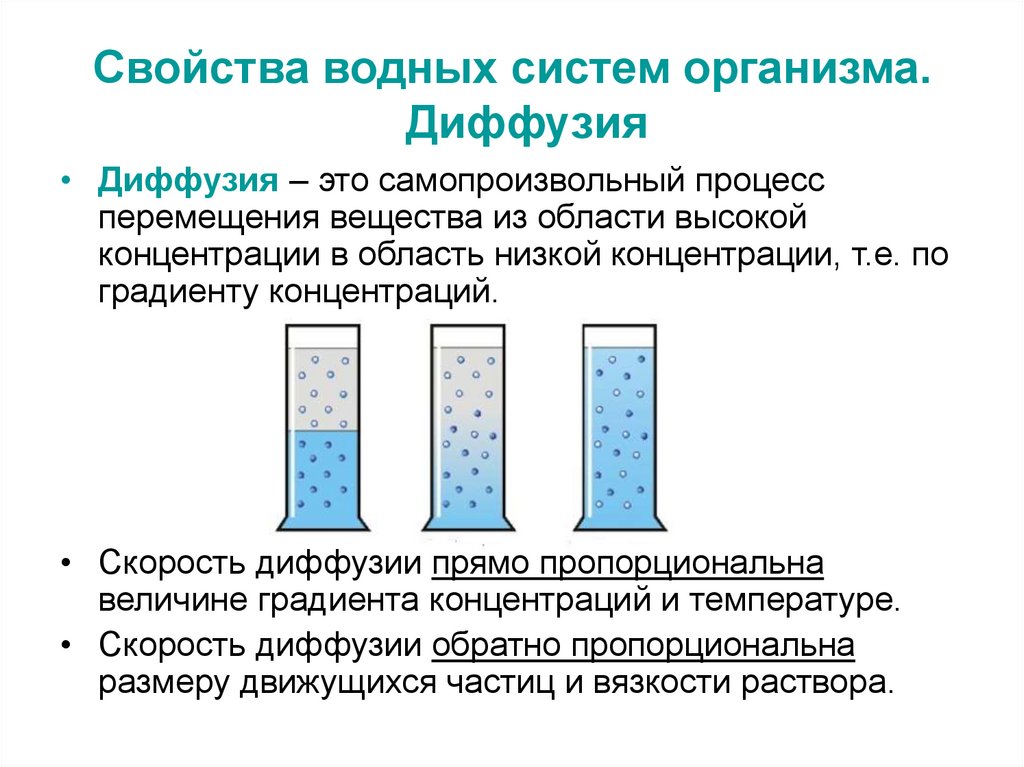
25. Свойства водных систем организма. Диффузия
• Диффузия – это самопроизвольный процессперемещения вещества из области высокой
концентрации в область низкой концентрации, т.е. по
градиенту концентраций.
• Скорость диффузии прямо пропорциональна
величине градиента концентраций и температуре.
• Скорость диффузии обратно пропорциональна
размеру движущихся частиц и вязкости раствора.
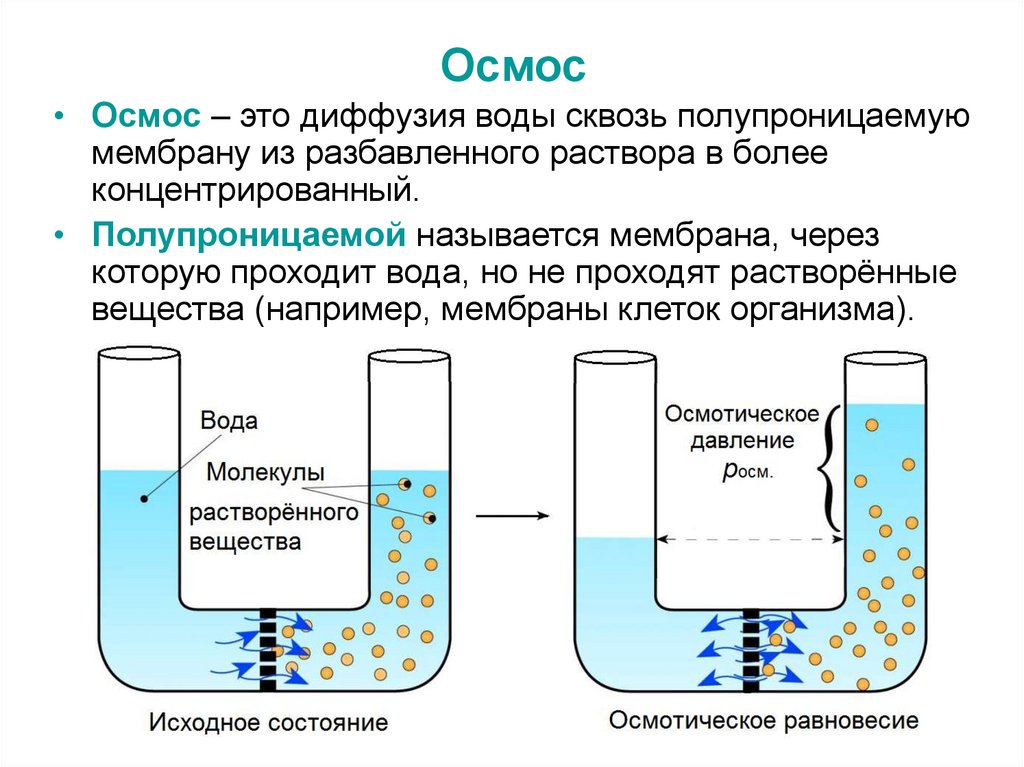
26. Осмос
• Осмос – это диффузия воды сквозь полупроницаемуюмембрану из разбавленного раствора в более
концентрированный.
• Полупроницаемой называется мембрана, через
которую проходит вода, но не проходят растворённые
вещества (например, мембраны клеток организма).
27.
• Осмотическое давление (росм.) – это давлениераствора, возникающее в результате осмоса.
• Когда давление достигает определённой
величины, осмос прекращается и в системе
наступает осмотическое равновесие – это
состояние, при котором молекулы воды будут
двигаться через мембрану в противоположных
направлениях с одинаковой скоростью.
• Осмотическое давление прямо пропорционально
концентрации раствора и температуре, т.е. чем
выше концентрация раствора и его
температура, тем выше давление.
• Осмотическое давление клеток обеспечивает их
упругое состояние, называемое тургором.
28.
• Изотоническими называются растворы содинаковым осмотическим давлением (от
греч. изос – равный и тонос – давление). При
контакте таких растворов через мембрану
происходит равновесный обмен водой.
• У растворов с разным осмотическим
давлением гипертоническим раствором
называется тот, у которого осмотическое
давление больше, а гипотоническим –
раствор с меньшим давлением. Вода через
мембрану поступает из гипотонического
раствора в гипертонический.
29. Состояние клетки в изотонической среде
Если клетка (например, эритроцит) находится визотоническом растворе плазмы крови, то
молекулы воды перемещаются через мембрану в
обоих направлениях с одинаковой скоростью. При
этом клетка сохраняет свою форму и функции.
30. Состояние клетки в гипотонической среде
Если концентрация солей в плазме уменьшается,то клетка оказывается в гипотоническом
растворе. Вода будет поступать внутрь клетки и
произойдёт набухание клетки. При значительной
разнице в осмотических давлениях осмос приводит
к разрыву клеточной мембраны и разрушению
(лизису) клеток.
31. Состояние клетки в гипертонической среде
При повышении концентрации солей в плазмеклетка оказывается в гипертоническом растворе.
Вода из клетки будет поступать наружу и
происходит сжатие оболочки клетки (плазмолиз).
При долго длящемся плазмолизе функции клетки
нарушаются. Плазмолиз является одной из причин
гибели организма при обезвоживании.
32. Регуляция водного баланса организма
• В основе регуляции водного обмена в организмележит поддержание постоянства осмотического
давления.
• Осмотическое давление жидкостей у человека
составляет 740 – 780 кПа и зависит от общей
концентрации:
− минеральных ионов,
− низкомолекулярных органических веществ,
− белков (вклад белков в общее осмотическое
давление составляет около 5%).
• Наибольший вклад в осмотическое давление крови
вносит хлорид натрия NaCl, что связано с его
высоким содержанием во внеклеточных жидкостях.
Поэтому основной механизм регуляции
осмотического давления связан с изменением
выделения либо воды, либо NaCl.
33.
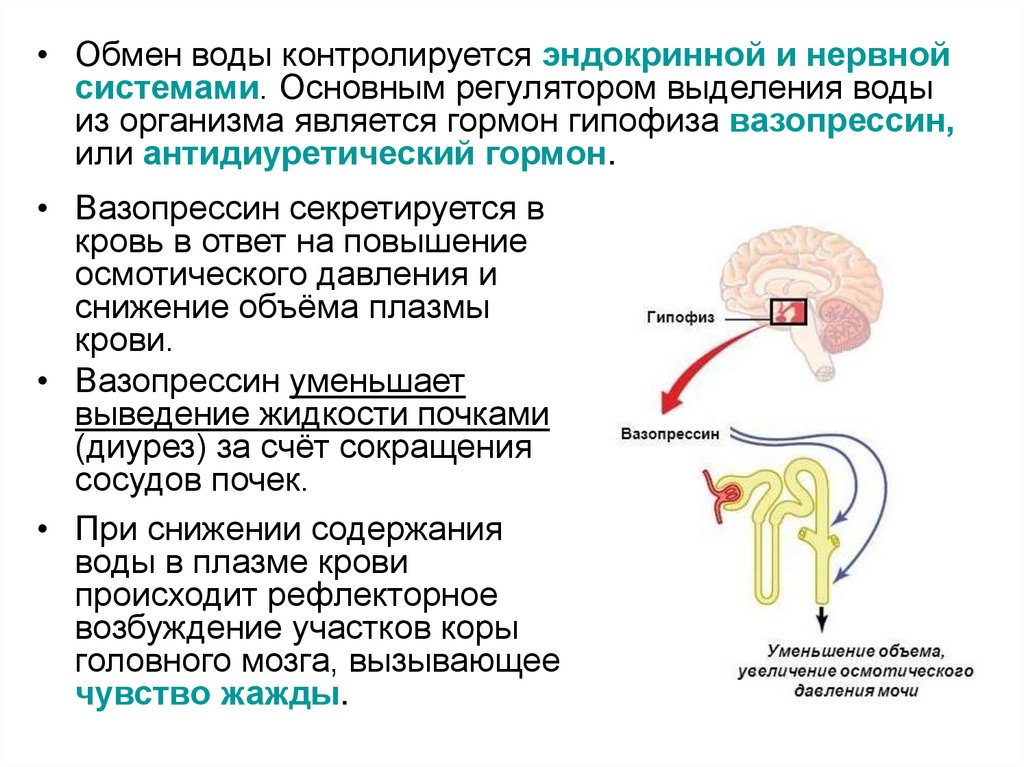
• Обмен воды контролируется эндокринной и нервнойсистемами. Основным регулятором выделения воды
из организма является гормон гипофиза вазопрессин,
или антидиуретический гормон.
• Вазопрессин секретируется в
кровь в ответ на повышение
осмотического давления и
снижение объёма плазмы
крови.
• Вазопрессин уменьшает
выведение жидкости почками
(диурез) за счёт сокращения
сосудов почек.
• При снижении содержания
воды в плазме крови
происходит рефлекторное
возбуждение участков коры
головного мозга, вызывающее
чувство жажды.
34.
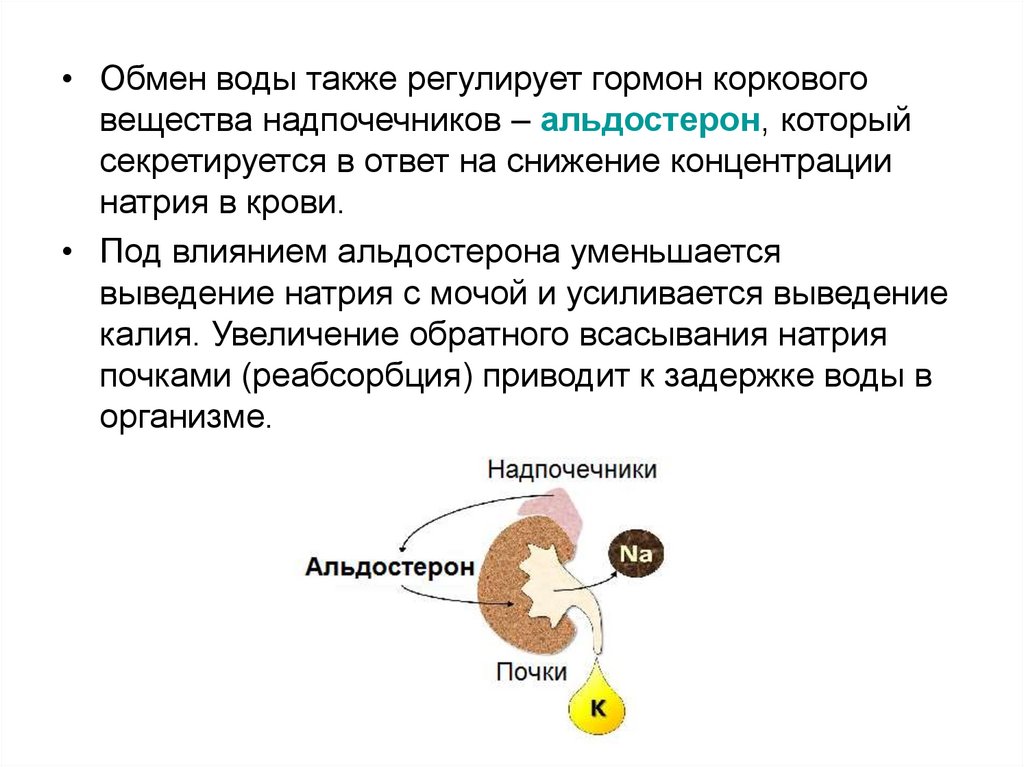
• Обмен воды также регулирует гормон корковоговещества надпочечников – альдостерон, который
секретируется в ответ на снижение концентрации
натрия в крови.
• Под влиянием альдостерона уменьшается
выведение натрия с мочой и усиливается выведение
калия. Увеличение обратного всасывания натрия
почками (реабсорбция) приводит к задержке воды в
организме.
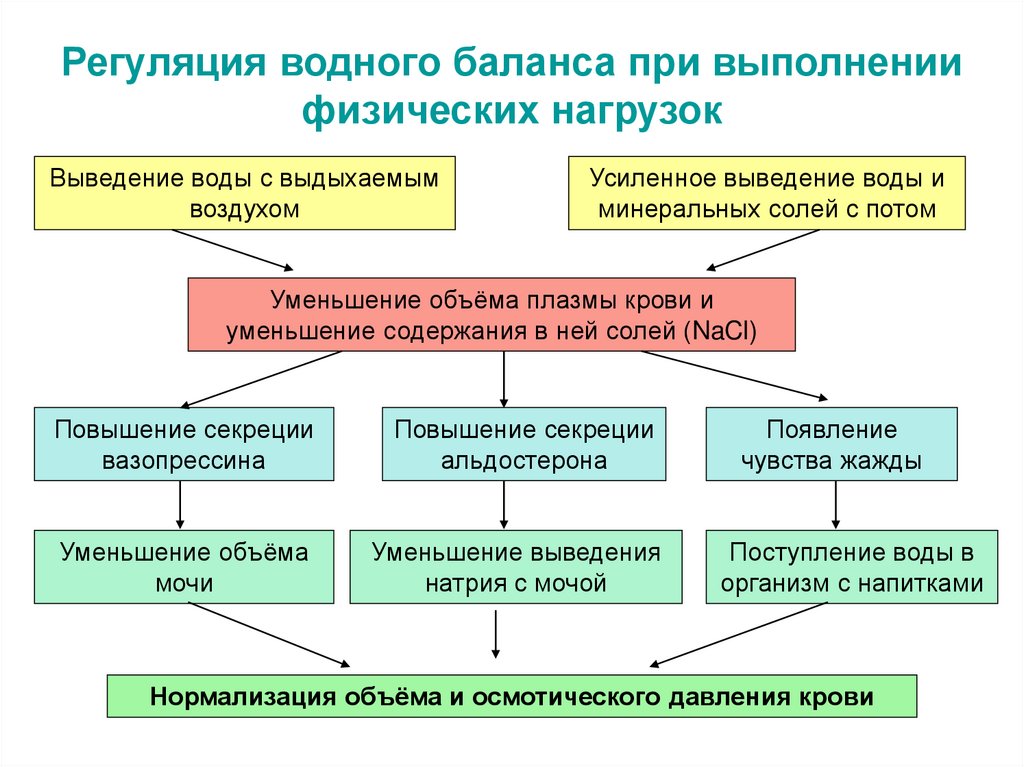
35. Регуляция водного баланса при выполнении физических нагрузок
Выведение воды с выдыхаемымвоздухом
Усиленное выведение воды и
минеральных солей с потом
Уменьшение объёма плазмы крови и
уменьшение содержания в ней солей (NaCl)
Повышение секреции
вазопрессина
Повышение секреции
альдостерона
Уменьшение объёма
мочи
Уменьшение выведения
натрия с мочой
Появление
чувства жажды
Поступление воды в
организм с напитками
Нормализация объёма и осмотического давления крови
36. Активная реакция среды
• Активная реакция среды определяетсясоотношением концентраций ионов водорода
Н+ и гидроксид-ионов ОН– в растворе.
• Реакция среды может быть:
− кислой, если концентрация ионов Н+ больше,
чем ионов ОН–
− оснóвной (щелочной), если концентрация
ионов ОН– больше, чем ионов Н+
− нейтральной, если концентрации ионов Н+ и
ОН– равны.
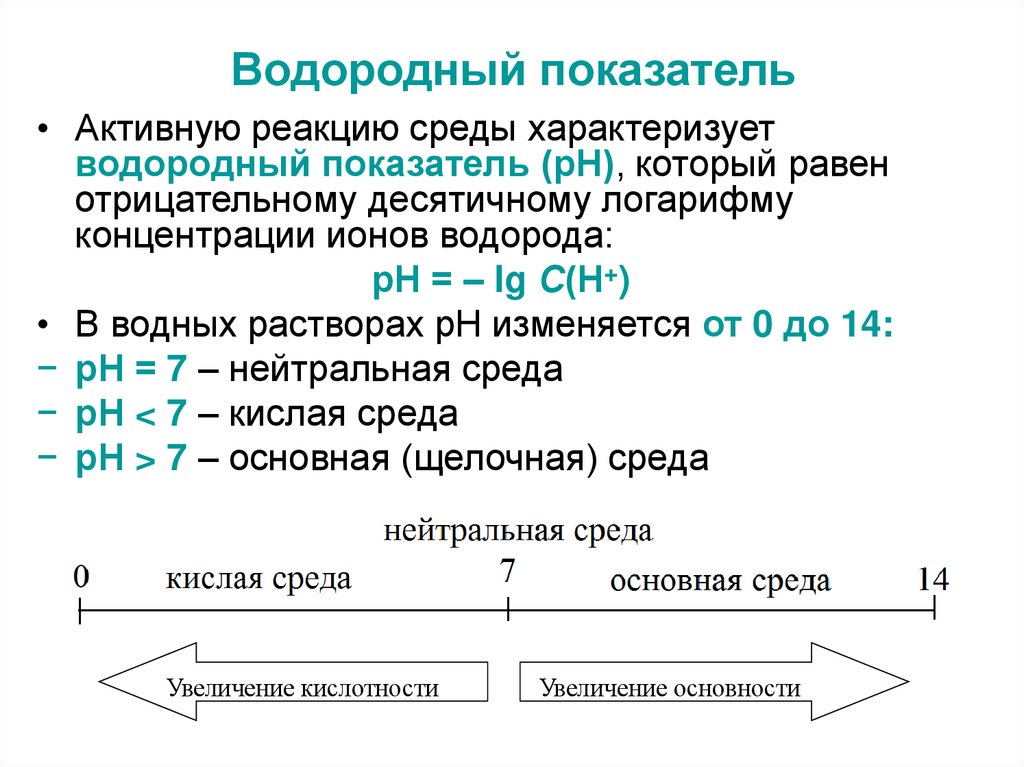
37. Водородный показатель
• Активную реакцию среды характеризуетводородный показатель (рН), который равен
отрицательному десятичному логарифму
концентрации ионов водорода:
рН = – lg С(Н+)
• В водных растворах рН изменяется от 0 до 14:
− рН = 7 – нейтральная среда
− рН < 7 – кислая среда
− рН > 7 – основная (щелочная) среда
Увеличение кислотности
Увеличение основности
38. Кислотно-оснóвное равновесие
• Кислотно-оснóвное равновесие – постоянствозначения рН биологических сред организма.
• Сохранение постоянства активной реакции жидких
сред имеет для жизнедеятельности человеческого
организма огромное значение, т.к. рН среды влияет
на следующие процессы:
состояние белков, особенно ферментов, и их
биологическую активность;
сократительную способность мышц (понижение рН
снижает силу мышечного сокращения);
транспорт ионов и возбудимость клеточных мембран;
скорость распада АТФ;
возбудимость болевых рецепторов.
39. Интервалы значений рН в некоторых биологических жидкостях
• в крови реакция нейтральнаярН = 7,36 – 7,44
• в слюне реакция слабокислая
рН = 6,3 – 6,9
• в желудочном соке реакция сильнокислая
рН = 1,5 – 2,5
• в панкреатическом соке реакция
слабощелочная
рН = 7,8 – 8,0
• в моче: рН = 4,8 – 8,0
40. Системы организма, поддерживающие кислотно-основное равновесие
• Дыхательная система (лёгкие) – выведениеуглекислого газа – основного кислого компонента
организма. Ускорение или замедление
вентиляции позволяет регулировать скорость
выведения СО2.
• Выделительная система (почки) – выведение
нелетучих кислот (серной, фосфорной,
молочной, кетоновых тел и др.) или оснований.
• Буферные системы.
Чтобы ликвидировать сдвиг рН крови, лёгким
требуется 1– 3 минуты, почкам – 10 – 20 часов,
буферные системы действуют мгновенно.
41. Буферные системы
• Буферные системы – это растворы,способные поддерживать постоянство рН при
изменении концентрации кислот или
оснований.
• Действие буферных растворов ограничено их
буферной ёмкостью.
• Буферная ёмкость измеряется количеством
кислоты или основания, которое нужно
добавить к 1 л буферного раствора, чтобы
изменить величину рН на единицу.
• Чем выше концентрация буферного раствора,
тем больше буферная ёмкость.
42. Буферные системы организма
• Главными буферными системами организмачеловека являются бикарбонатная,
фосфатная, гемоглобиновая, белковая.
• В крови бикарбонатный буфер составляет 53
% общей буферной ёмкости, гемоглобиновый
– 35 %, белковый – 7 %, фосфатный – 5 %.
• В клетках органов и тканей максимальной
буферной ёмкостью обладает белковая
система, несколько меньшей – фосфатная и
бикарбонатная. В почках наибольшее
значение имеет фосфатная система.
43. Механизм буферного действия (на примере бикарбонатной системы)
Бикарбонатная система состоит из угольной кислоты ибикарбоната натрия (H2CO3 + NaHCO3)
• При поступлении в кровь кислых продуктов ионы
водорода Н+ соединяются с бикарбонатами с образованием
угольной кислоты, которая разлагается на воду и CO2:
H+ + HCO3– → H2CO3 → H2O + CO2↑
Избыток CO2 удаляется через лёгкие за счёт
гипервентиляции, в результате чего восстанавливается
соотношение H2CO3 и NaHCO3.
• При поступлении в кровь оснований гидроксид-ионы
ОН– взаимодействуют с угольной кислотой и образуются
бикарбонаты и вода:
ОН– + H2CO3 → H2O + HCO3–
Часть CO2 задерживается в организме за счёт
гиповентиляции , в результате чего восстанавливается
соотношение H2CO3 и NaHCO3.
44. Нарушения кислотно-основного равновесия организма
• Исчерпание буферных резервов приобразовании больших количеств кислот или
щелочей приводит к нарушениям кислотнооснóвного равновесия:
ацидоз – сдвиг рН крови в кислую сторону
алкалоз – сдвиг рН крови в щелочную
сторону.
• Пределы отклонений рН крови от нормы,
совместимые с жизнью, составляют 6,8 – 7,9.
45. Причины нарушений кислотно-основного равновесия
Причины нарушений кислотноосновного равновесия• Дыхательный (респираторный) ацидоз
связан с замедлением выделения углекислого
газа с выдыхаемым воздухом при некоторых
заболеваниях органов дыхания.
• Метаболический ацидоз связан с повышенным
образованием нелетучих кислот при
интенсивных физических нагрузках, нарушении
кровообращения, голодании, сахарном диабете
и др.
Ацидоз, вызванный образованием большого
количества молочной кислоты при интенсивных
физических нагрузках, является одним из
основных факторов утомления.
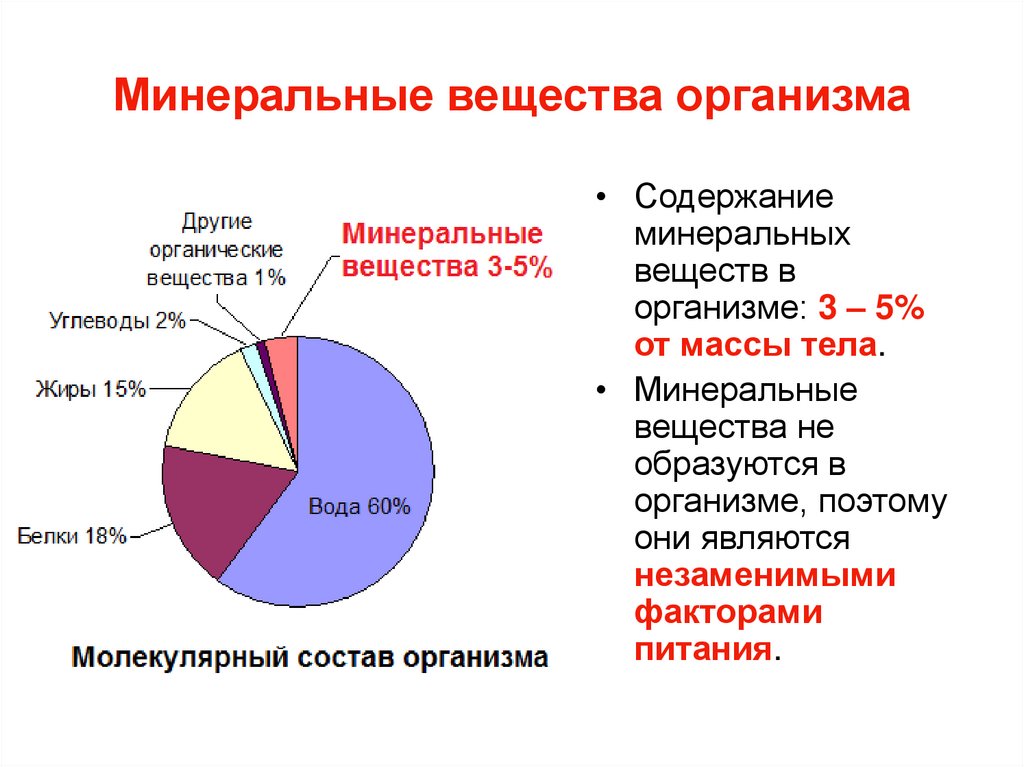
46. Минеральные вещества организма
• Содержаниеминеральных
веществ в
организме: 3 – 5%
от массы тела.
• Минеральные
вещества не
образуются в
организме, поэтому
они являются
незаменимыми
факторами
питания.
47. Классификация минеральных веществ
• Макроэлементы – содержание в организме больше10–3 %: кальций Ca, фосфор P, сера S, калий K, хлор
Cl, натрий Na, магний Mg. Главная функция
макроэлементов состоит в построении тканей, особенно
костной ткани, и в поддержании осмотического, водноэлектролитного и кислотно-основного равновесия. Сера и
фосфор также входят в состав биоорганических молекул.
• Микроэлементы – содержание меньше 10–3 %:
железо Fe, цинк Zn, марганец Mn, молибден Mo,
кобальт Co, медь Cu, фтор F, бром Br, йод I.
Микроэлементы входят в состав ферментов, гормонов,
витаминов и других биологически активных соединений, в
основном, в качестве активаторов обмена веществ.
• Ультрамикроэлементы – содержание 10–4 – 10–6 %:
селен Se, никель Ni, хром Cr, ванадий V, бор B,
алюминий Al, литий Li и др.
48. Формы существования минеральных веществ в организме
• В виде растворимых солей, полностью или частичнодиссоциированных (в виде ионов). Основные катионы
являются Na+, К+, Ca2+, Mg2+. Основные анионы:
фосфаты РО43–, хлориды Cl–, сульфаты SО42–,
гидрокарбонаты НСО3–.
• В виде нерастворимых соединений, например,
фосфатов кальция Са5(РО4)3ОН и Са3(РО4)2 костной
ткани, фторидов кальция Са5(РО4)3F зубной эмали.
• В составе органических соединений, например,
фосфорная и серная кислоты образуют эфиры с
органическими веществами, в том числе с углеводами и
белками, микроэлементы входят в состав ферментов,
гормонов, витаминов (железо – в ферментах
цитохромах, йод – в гормонах йодтиронинах, кобальт –
в витамине В12).
49. Распределение минеральных веществ в организме
Минеральные вещества неравномерно
распределяются между органами и тканями.
В составе костной и хрящевой ткани сосредоточено
99% всего кальция организма, 87% Р, 50% Mg.
Калий в основном находится внутри клеток (75% всех
катионов), натрий – во внеклеточной среде (90% всех
катионов).
Большинство микроэлементов в максимальных
концентрациях содержится в ткани печени.
Наибольшее содержание йода наблюдается в
щитовидной железе, фтора – в эмали зубов, цинка –
в поджелудочной железе, молибдена – в почках, а
марганца и брома – в гипофизе.
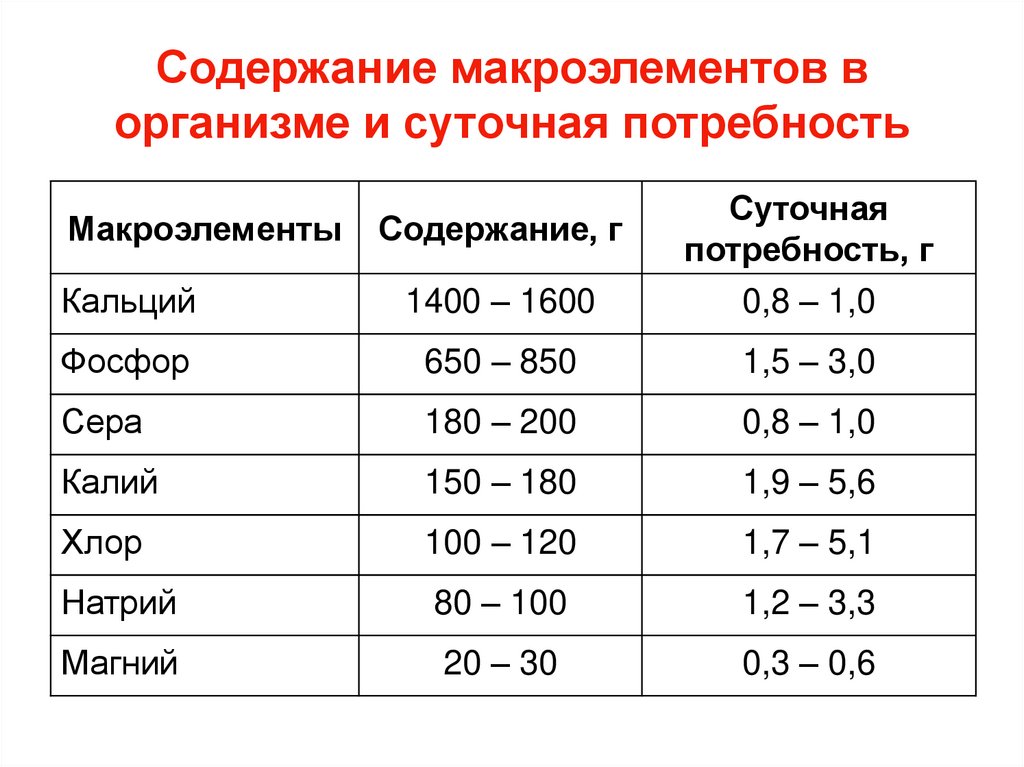
50. Содержание макроэлементов в организме и суточная потребность
Кальций1400 – 1600
Суточная
потребность, г
0,8 – 1,0
Фосфор
650 – 850
1,5 – 3,0
Сера
180 – 200
0,8 – 1,0
Калий
150 – 180
1,9 – 5,6
Хлор
100 – 120
1,7 – 5,1
Натрий
80 – 100
1,2 – 3,3
Магний
20 – 30
0,3 – 0,6
Макроэлементы
Содержание, г
51. Натрий, калий и хлор. Пищевые источники
• Натрий. Обычно взрослый человек употребляетоколо 2,5 г натрия с различными продуктами и 1 –
3 г при подсаливании пищи. Минимальная
суточная потребность в натрии составляет около 1
г, однако при сильном потоотделении потребность
возрастает до 4 – 5 г и более.
• Калий. Пищевые источники калия: абрикосы,
персики, апельсины, виноград, свёкла, морковь,
соя, горох, морская капуста.
• Хлор. Основное количество хлора поступает в
организм с поваренной солью NaCl. Содержание
хлора в пищевых продуктах незначительно.
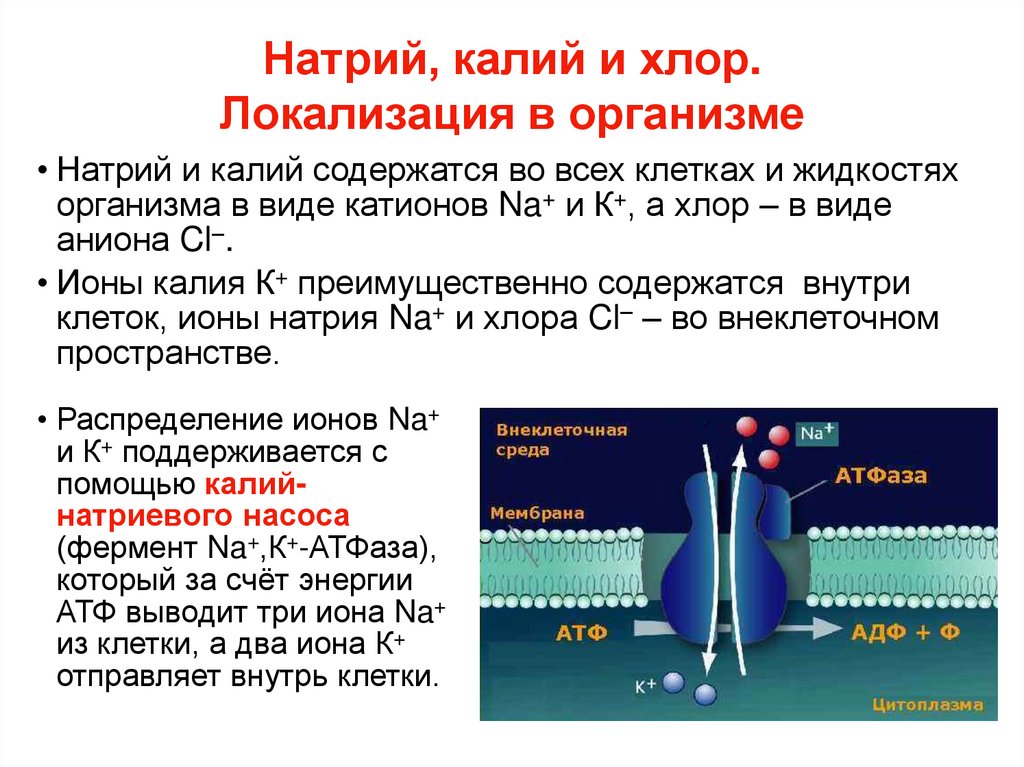
52. Натрий, калий и хлор. Локализация в организме
• Натрий и калий содержатся во всех клетках и жидкостяхорганизма в виде катионов Na+ и К+, а хлор – в виде
аниона Cl–.
• Ионы калия К+ преимущественно содержатся внутри
клеток, ионы натрия Na+ и хлора Cl– – во внеклеточном
пространстве.
• Распределение ионов Na+
и К+ поддерживается с
помощью калийнатриевого насоса
(фермент Na+,К+-АТФаза),
который за счёт энергии
АТФ выводит три иона Na+
из клетки, а два иона К+
отправляет внутрь клетки.
53. Натрий, калий и хлор. Биологическая роль
• Основная роль натрия, калия и хлора – поддержаниеосмотического давления, удержание воды тканями.
• Ионы натрия и калия участвуют в создании
электрохимического потенциала на мембране клетки,
что необходимо для возникновения и проведения
нервных импульсов. Ионы калия являются
важнейшим регулятором функции миокарда.
• Ионы натрия и калия входят в состав буферных систем
и участвуют в регуляции кислотно-щелочного
равновесия в организме.
• Ионы Na+, К+ и Cl– являются активаторами некоторых
ферментов, например, Na+ и Cl– активируют амилазу
слюны, Na+ и К+ – ферменты гликолиза.
• Ионы Cl– используются для образования соляной
кислоты желудочного сока.
54. Регуляция обмена натрия и калия
• В регуляции обмена натрия и калия участвует гормоннадпочечников альдостерон, он препятствует
выведению натрия с мочой и усиливает выведение
калия. Альдостерон секретируется в ответ на
снижение концентрации натрия в крови.
• Из-за значительного увеличения потоотделения при
длительных физических нагрузках на выносливость
снижается содержание натрия, калия и хлора в
крови. Это приводит к нарушению деятельности ЦНС,
сердечно-сосудистой системы, сократительного
аппарата мышц, что сопровождается снижением
работоспособности.
• Если потери жидкости составляют более 8% массы
тела в сутки, то рекомендуется принимать
специальные препараты и напитки, содержащие
минеральные вещества.
55. Кальций, магний и фосфор. Пищевые источники
• Кальций. Наилучшим источником кальция длячеловека являются молоко и молочные продукты.
Кальций также содержится в яичных желтках,
овощах, фруктах.
• Магний. Почти половина потребности в магнии
удовлетворяется хлебом, крупяными изделиями,
бобовыми. Небольшое количество магния
содержится в зелёных листовых культурах. В молоке
и твороге относительно мало магния, однако, в
отличие от растительных продуктов, магний в них
находится в легкоусвояемой форме.
• Фосфор. Много фосфора содержится в фасоли,
горохе, овсяной, перловой, ячневой крупах. Основное
же его количество человек обычно потребляет с
молоком и хлебом.
56. Кальций, магний и фосфор. Локализация в организме
• Кальций, магний, фосфор в основном находятся всоставе костной ткани в виде нерастворимых
фосфорнокислых солей кальция и магния. В костной и
хрящевой ткани сосредоточено 99% всего кальция
организма, 87% фосфора и 50% магния. Остальное
количество кальция, магния и фосфора в организме
распределяется следующим образом:
Кальций находится в плазме крови и межклеточных
жидкостях в виде иона Са2+.
Магний сосредоточен внутри клеток в виде ионов Mg2+.
Фосфор входит в состав различных органических
соединений (нуклеиновых кислот, нуклеотидов,
фосфопротеинов, фосфолипидов, креатинфосфата),
также фосфаты РО43– являются одним из
внутриклеточных анионов.
57. Биологическая роль кальция
• Кальций входит в состав костной ткани.• Концентрация ионов кальция (Ca2+) во внеклеточной
жидкости определяет порог возбудимости ЦНС.
Чем меньше кальция во внеклеточной жидкости, тем
ниже порог возбудимости, поэтому уменьшение
содержания кальция в организме проявляется
судорогами.
• Ионы Ca2+ в клетках мышц регулируют процессы
сокращения и расслабления.
• Ионы Ca2+ участвуют в передаче гормонального
сигнала в клетку и являются активаторами
некоторых ферментов, например, амилазы.
• Ионы Ca2+ плазмы участвуют в процессе
свёртывания крови.
• Ионы Ca2+ регулируют проницаемость мембран
клеток.
58. Биологическая роль фосфора
• Фосфор входит в состав костной ткани в виденерастворимых фосфатов, придающих прочность
костям и зубам. Кроме того, фосфат кальция
Са3(РО4)2 костной ткани является резервом ионов
кальция и фосфатов в организме.
• Фосфор играет важную роль в энергетическом
обмене, так как входит в состав АТФ, АДФ,
креатинфосфата и других макроэргических
соединений.
• Фосфаты участвуют в построении и обмене
многих соединений организма (нуклеиновых
кислот, фосфопротеинов, фосфолипидов).
• Растворимые фосфаты образуют фосфатную
буферную систему и участвуют поддержании
кислотно-основного равновесия в организме.
59. Регуляция обмена кальция и фосфора
Регуляторы содержания кальция и фосфора в крови:витамин D
кальцитонин – гормон щитовидной железы
паратгормон – гормон паращитовидных желёз.
• Витамин D усиливает всасывание кальция и
фосфора в кишечнике и препятствует выведению
кальция через почки.
• При понижении концентрации ионов кальция в крови
(например, при дефиците витамина D) паратгормон
активирует растворение минеральных соединений в
костях, что повышает содержание кальция в крови и
выведение его с мочой.
• При увеличении уровня кальция в плазме крови
кальцитонин активирует отложение кальция и
фосфора в костной ткани.
60. Биологическая роль магния
• Магний входит в состав костной ткани.• Ионы магния являются одним из основных активаторов
ферментов: они активируют ферменты
окислительного фосфорилирования; фермент
креатинкиназу, участвующую в энергообеспечении
мышечной деятельности; ферменты репликации ДНК,
образования рибосом и синтеза белка.
• Магний влияет на энергетический обмен: ионы магния
(Mg2+) во внутриклеточной жидкости образуют
комплексы с ионами АТФ, способствуя их гидролизу,
сопровождающемуся выделением энергии.
• Ионы Mg2+ участвуют в поддержании осмотического
давления внутри клеток.
• Ионы Mg2+ способствуют выведению холестерина из
организма, усилению перистальтики кишечника и
секреции желчи.
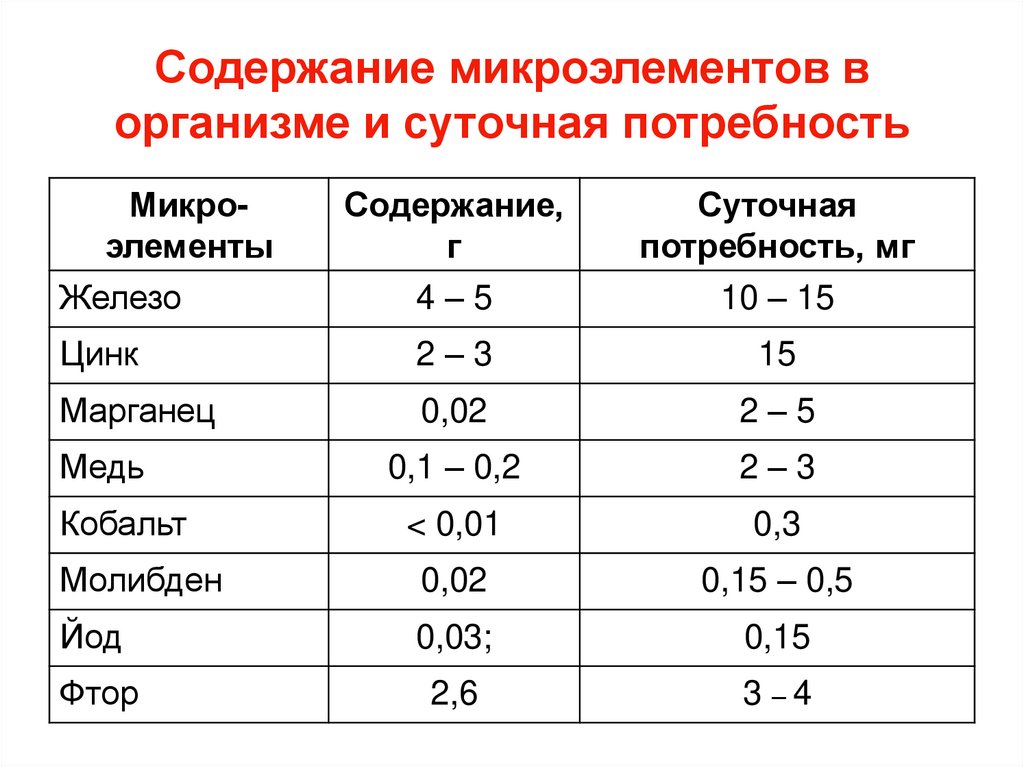
61. Содержание микроэлементов в организме и суточная потребность
МикроэлементыЖелезо
Содержание,
г
4–5
Суточная
потребность, мг
10 – 15
Цинк
2–3
15
Марганец
0,02
2–5
Медь
0,1 – 0,2
2–3
Кобальт
< 0,01
0,3
Молибден
0,02
0,15 – 0,5
Йод
0,03;
0,15
Фтор
2,6
3 –4
62. Железо. Пищевые источники
Железо содержится в печени, говядине, зелёныховощах, моркови, изюме, гречневой крупе.
Наиболее ценным является железо,
поступающее с животной пищей. Если из мясных
продуктов усваивается около 30% железа, то из
зерновых – всего 5 – 10%. Зерновые продукты,
богатые фосфатами и фитином, образуют с
железом трудно растворимые соли и снижают его
усвояемость организмом. Повышают усвояемость
железа лимонная, аскорбиновая кислоты,
серосодержащие аминокислоты.
63. Железо. Локализация в организме
• Железо находится в организме в виде ионов Fе2+ иFе3+ в основном в составе биоорганических молекул.
• 80% железа в организме находится в составе
гемоглобина в эритроцитах; 5-10% - в составе
миоглобина мышечных клеток.
• В тканях (преимущественно в печени) железо
депонируется с помощью белка ферритина. Из
тканей железо, связываясь с белком
трансферрином, переносится кровью в костный
мозг, где образуется гемоглобин.
• При физиологическом распаде эритроцитов в печени
и селезёнке 9/10 железа остаётся в организме и идёт
на построение новых эритроцитов.
• Около 1 мг железа теряется организмом за сутки, в
основном, с желчью.
64. Биологическая роль железа
• Основная функция железа в организме – участие втранспорте кислорода в составе гемоглобина и
депонировании кислорода в мышцах в составе
миоглобина. Гемоглобин также переносит из тканей в
лёгкие 10 – 15% образующегося СО2. Дефицит
железа приводит к нарушению образования
гемоглобина, развитию железодефицитной анемии и
снижению работоспособности.
• Ионы железа принимают активное участие в
окислительных процессах в организме, входят в
состав около 50 видов окислительных
ферментов (оксидазы, гидроксилазы, цитохромы
дыхательной цепи митохондрий).
• Ионы железа необходимы для функциональной
активности нейтрофилов, которые являются
компонентом иммунной системы.














































 Биология
Биология