Похожие презентации:
Оксосоединения
1.
Краевое государственноебюджетное
профессиональное
образовательное учреждение
«Бийский медицинский
колледж»
Оксосоединения
Подготовила:
преподаватель химии
Горбунова Ю.Ю.
2.
План:Номенклатура альдегидов и
кетонов.
Строение карбонильной группы.
Химические свойства: реакции
нуклеофильного присоединения,
окисления, восстановления,
замещения.
3.
Строение карбонильнойгруппы
Атом углерода в карбонильной группе
находится
в
состоянии
sp2гибридизации.
Углы R-C-H, R-C-O и H-C-O составляют
приблизительно 120° (где R — алкил).
4.
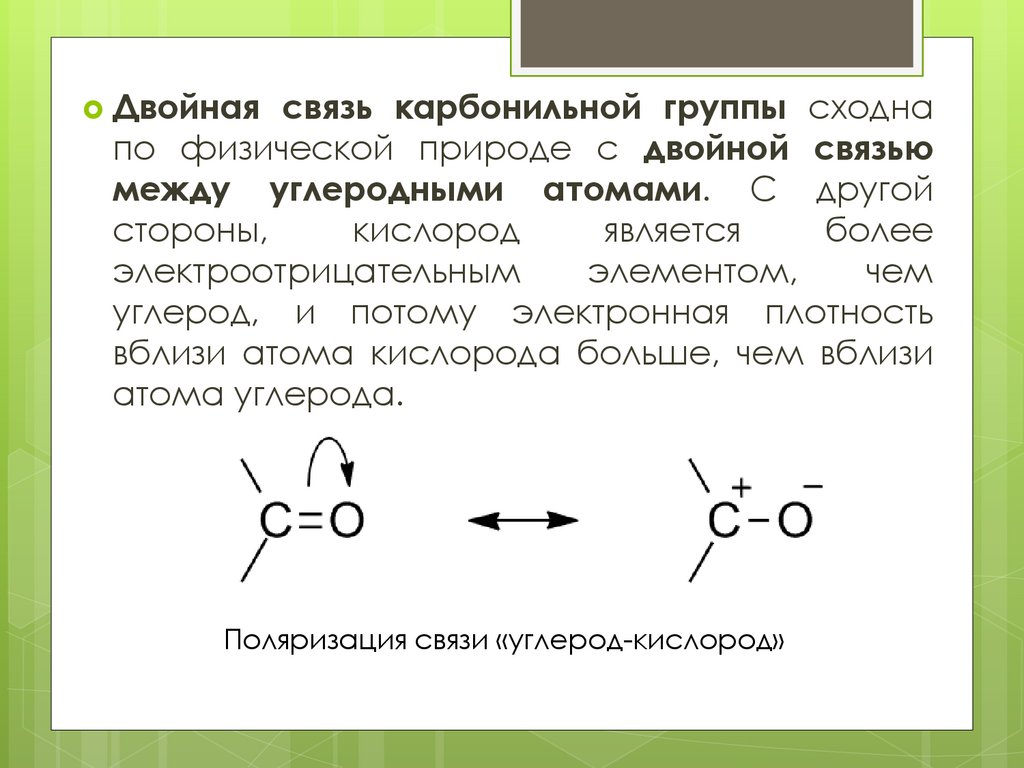
Двойнаясвязь карбонильной группы сходна
по физической природе с двойной связью
между углеродными атомами. С другой
стороны,
кислород
является
более
электроотрицательным
элементом,
чем
углерод, и потому электронная плотность
вблизи атома кислорода больше, чем вблизи
атома углерода.
Поляризация связи «углерод-кислород»
5.
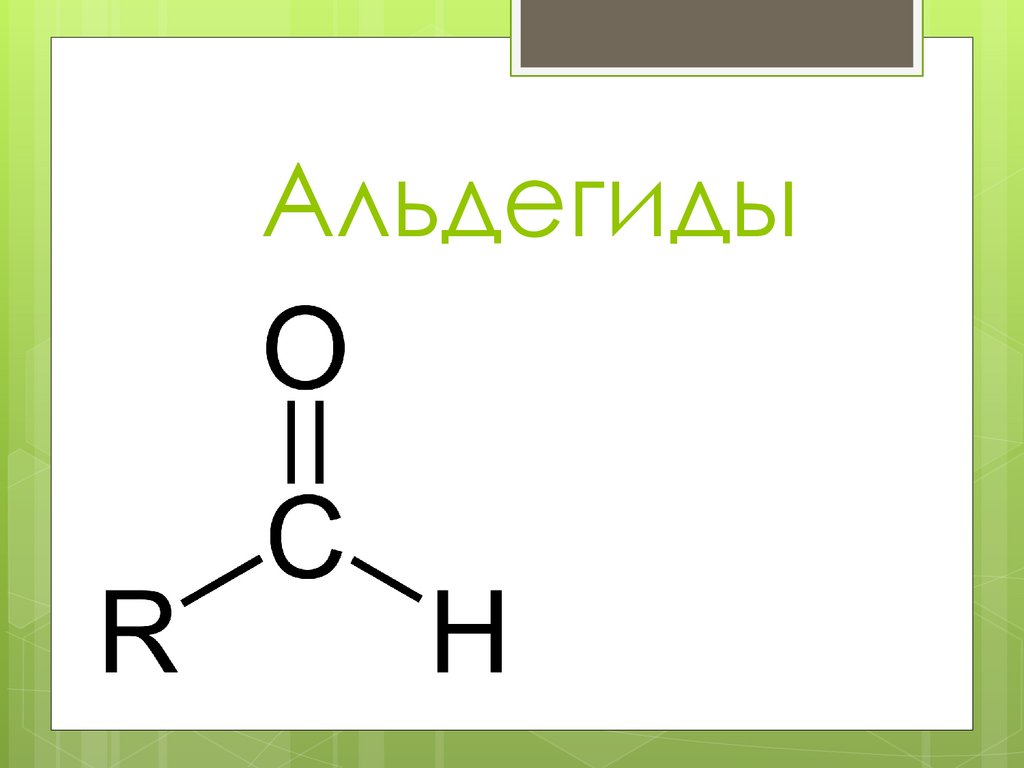
Альдегиды6.
ЭтимологияСлово альдегид было придумано
Юстусом фон Либихом как
сокращение латинского alcohol
dehydrogenatus — дегидрированный
спирт (в некоторых источниках —
alcohol dehydrogenatum). Название
радикала формил, а также другие
однокоренные слова
(формальдегид, формиаты),
произошли от лат. formica —
муравей.
7.
Тривиальные названияТривиальные названия обычно
происходят от названия
соответствующих карбоновых кислот,
а также от названия источника, из
которого был выделен тот или иной
альдегид.
8.
Формальдегид называютмуравьиным альдегидом,
этаналь — уксусным, пентаналь —
валериановым альдегидом,
цитронеллаль получил своё
название, поскольку был выделен из
масла цитрусовых.
9.
Систематическаяноменклатура
По номенклатуре ИЮПАК названия
простых альдегидов образуются от
названий соответствующих алканов
с добавлением суффикса -аль, а
диальдегидов — суффикса -диаль
(в данном случае атом углерода
альдегидной группы уже входит в
состав родоначального алкана).
10.
При этом в названии номер приальдегидной группе, как правило, не
ставят, поскольку она всегда
занимает крайнее положение. Если
карбонильная группа не входит в
родоначальную структуру
(например, если родоначальной
структурой является циклический
углеводород или гетероцикл), то к
названию добавляется суффикс –
карбальдегид.
11.
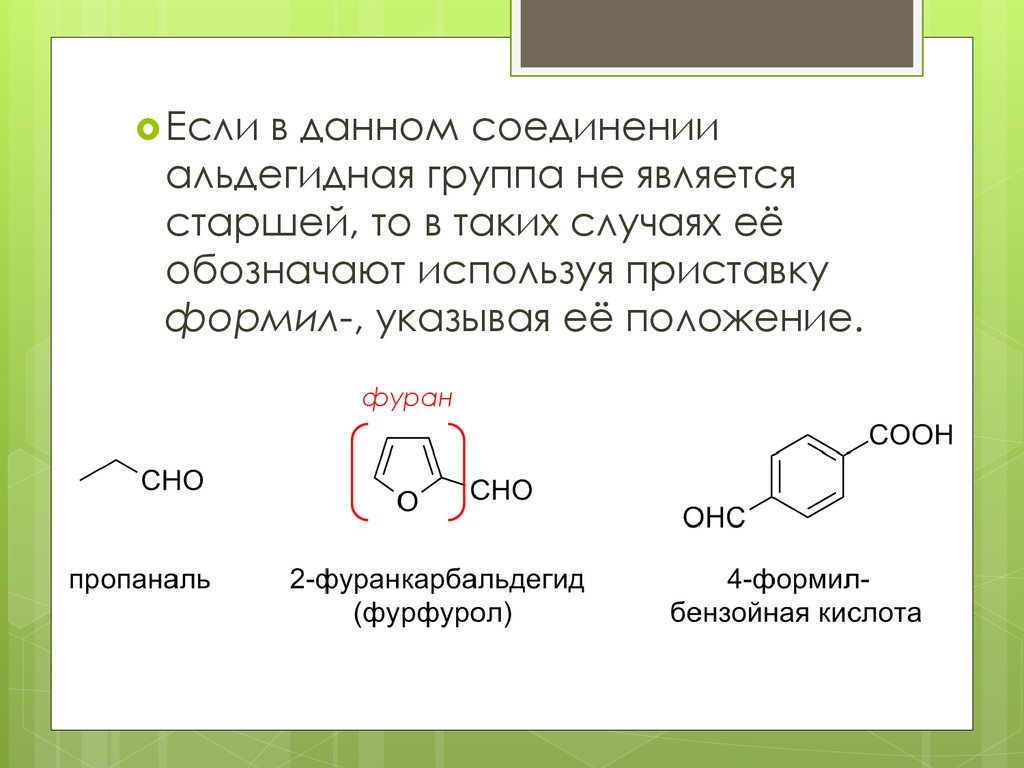
Если в данном соединенииальдегидная группа не является
старшей, то в таких случаях её
обозначают используя приставку
формил-, указывая её положение.
фуран
12.
Классификацияальдегидов
В зависимости от насыщенности
углеводородного заместителя:
предельные (насыщенные) альдегиды
(ацетальдегид);
непредельные (ненасыщенные) альдегиды
(акролеин);
ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
альдегиды с одной карбонильной группой
(формальдегид);
диальдегиды (глиоксаль);
многоатомные альдегиды.
13.
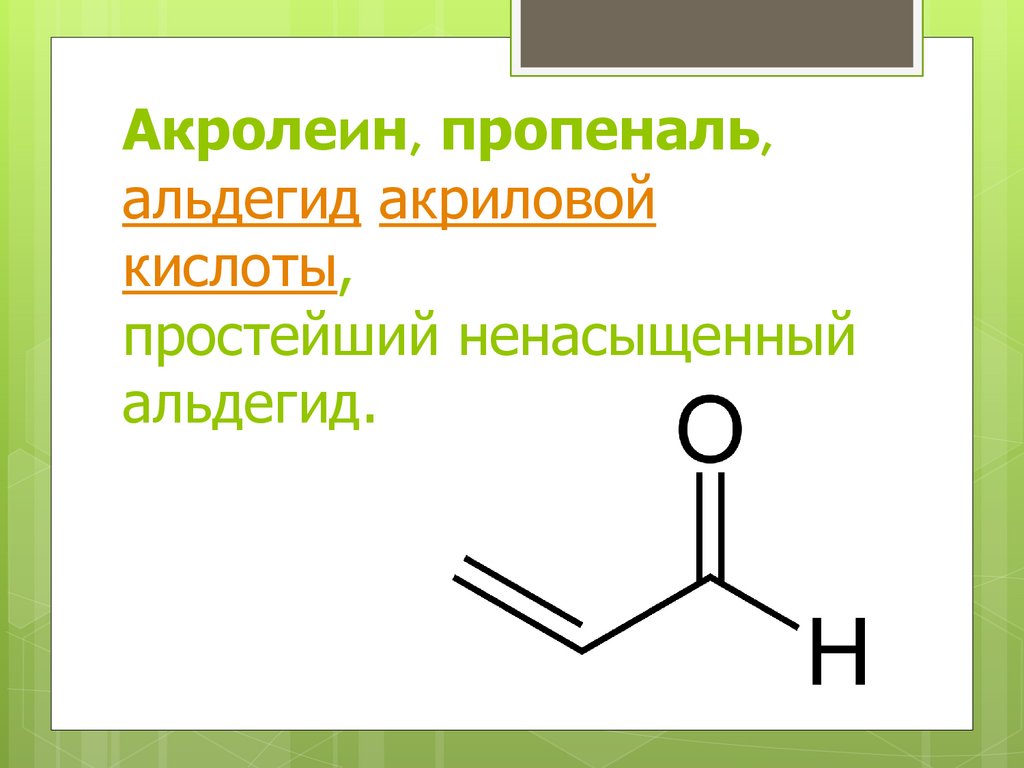
Акролеин, пропеналь,альдегид акриловой
кислоты,
простейший ненасыщенный
альдегид.
14.
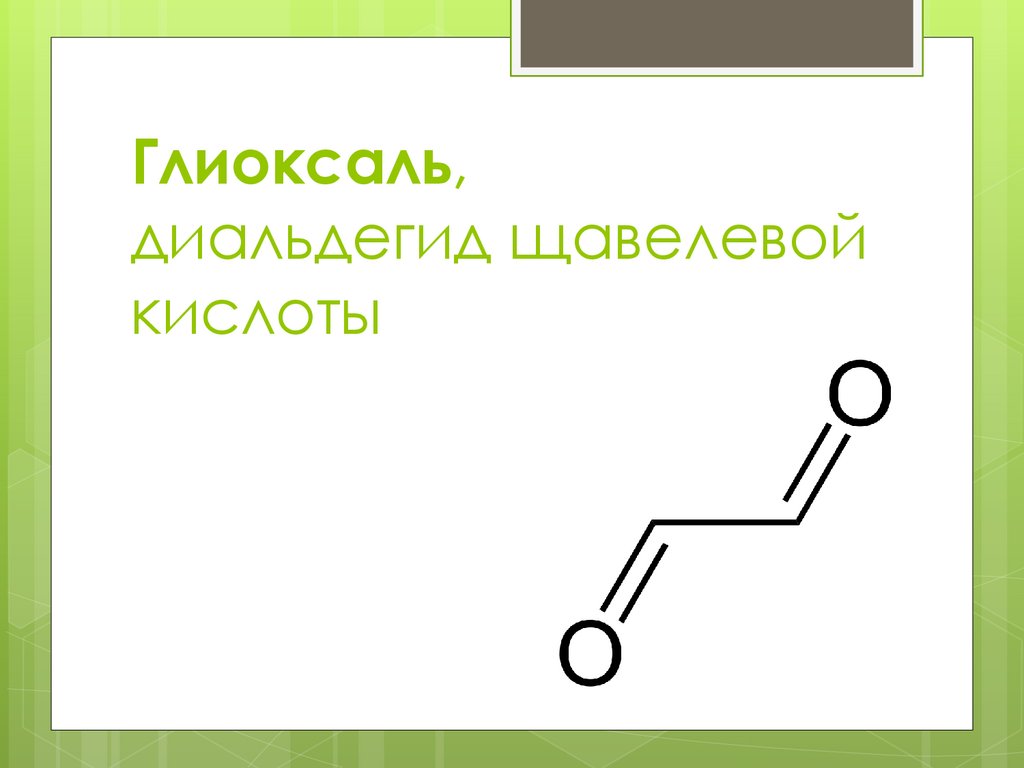
Глиоксаль,диальдегид щавелевой
кислоты
15.
Нахождение в природеАльдегидная группа содержится во многих
природных веществах, таких, как углеводы
(альдозы), некоторые витамины (ретиналь,
пиридоксаль).
Алифатический альдегид СН3(СН2)7С(Н)=О
(тривиальное название — пеларгоновый
альдегид) содержится в эфирных маслах
цитрусовых растений, обладает запахом
апельсина, его используют как пищевой
ароматизатор.
Цитраль содержится в лемонграссовом и
кориандровом маслах (до 80 %),
цитронеллаль — в эвкалиптовом.
Бензальдегид — в масле горького миндаля.
Куминовый альдегид содержится в масле тмина.
16.
Нахождение в природе17.
Физические свойстваФормальдегид представляет собой
газообразное при комнатной
температуре вещество. Альдегиды до
С12 — жидкости, а альдегиды
нормального строения с более длинным
неразветвлённым углеродным скелетом
являются твёрдыми веществами.
Температуры кипения альдегидов с
неразветвлённым строением углеродной
цепи выше, чем у их изомеров.
Например, валериановый альдегид кипит
при 100,4 °C, а изовалериановый — при
92,5 °C.
18.
Формальдегид и ацетальдегидпрактически неограниченно
смешиваются с водой.
С ростом длины углеродного скелета,
растворимость альдегидов в воде
сильно уменьшается.
19.
Химические свойстваРеакции нуклеофильного присоединения
Альдегиды
содержат
поляризованную
карбонильную группу и склонны присоединять
нуклеофильные
реагенты
(нуклеофильные
реагенты
(нуклеофилы)
—
частицы,
образующие новую ковалентную связь за счет
своей электронной пары. ), как нейтральные
(аммиак, амины, воду, спирты, тиолы и др.), так
и анионные (цианид-ион CN-, алкоголяты,
гидрид-ион H-, карбанионы и др.).
В данных реакциях альдегиды являются более
реакционноспособными по сравнению с
кетонами.
Это
связано
с
большей
термодинамической устойчивостью кетонов, а
также
меньшими
пространственными
затруднениями в случае присоединения к
альдегидам.
20.
РеакцияГриньяра — металлорганическая
химическая
реакция,
в
которой
алкилмагнийгалогениды (также называемые
реактивами
Гриньяра)
действуют
как
нуклеофилы, атакуя электрофильный атом
углерода
с
образованием
углерод
—
углеродной связи. Реакция Гриньяра — важный
метод как создания углерод-углеродных связей,
так и связей углерод-гетероатом (P, Sn, B, Si и
др.)
Реактивы Гриньяра — магнийорганические
соединения, содержащие ковалентную связь CMg.
Чаще
всего
их
получают
из
органилгалогенидов вида R-X, где X = Cl, Br, I и
магния в безводной среде.
21.
Реакции восстановленияАльдегиды
можно восстанавливать до
первичных
спиртов.
Наиболее
распространённые
методы
восстановления
включают
реакции
с
комплексными гидридами: боргидридом
натрия NaBH4, боргидридом лития LiBH4 и
алюмогидридом лития LiAlH4.
22.
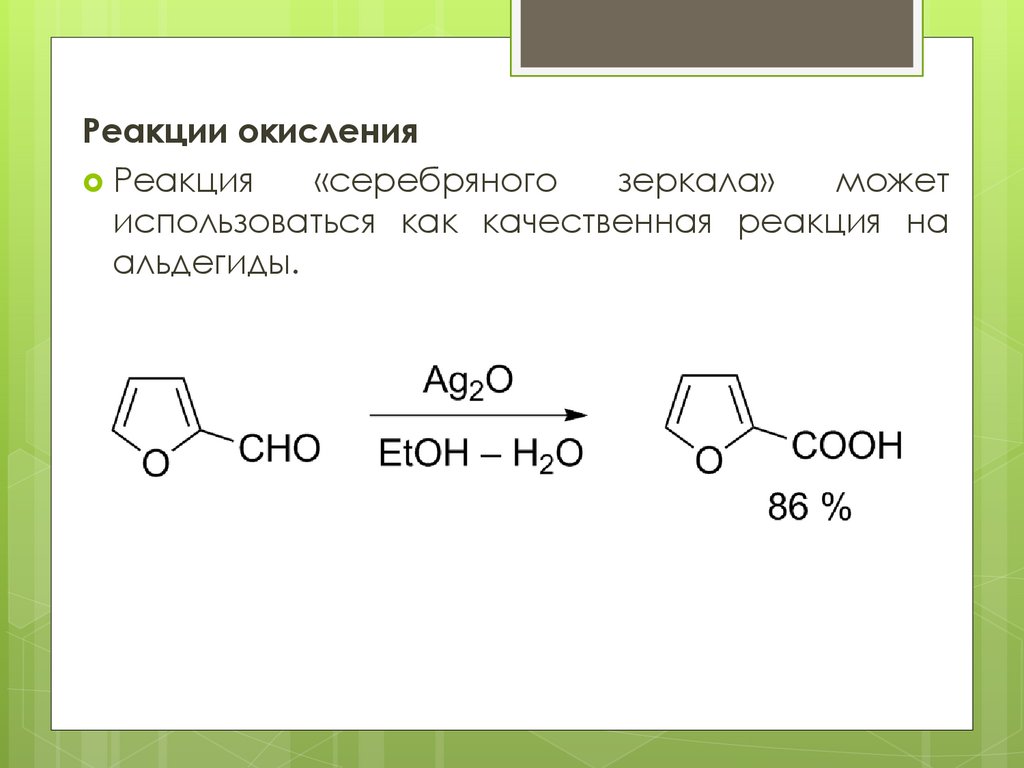
Реакции окисленияРеакция
«серебряного
зеркала»
может
использоваться как качественная реакция на
альдегиды.
23.
Качественный анализкарбонильных групп
Реакция серебряного зеркала — это
реакция восстановления серебра из
аммиачного раствора оксида серебра
(реактив Толленса).
Если реакция проводится в сосуде с
чистыми и гладкими стенками, то серебро
осаждается на них в виде тонкой плёнки,
образуя зеркальную поверхность. При
наличии малейших загрязнений серебро
выделяется в виде серого рыхлого осадка.
24.
Реакция «серебряного зеркала» глюкозыприменяется при изготовлении зеркал и
ёлочных украшений.
25.
Биологическое действиеАльдегиды ТОКСИЧНЫ!
26.
Способны накапливаться в организме.Кроме общетоксического, обладают
раздражающим и нейротоксическим
действием. Эффект зависит от молекулярной
массы: чем она больше, тем слабее
раздражающее, но сильнее наркотическое
действие, причём ненасыщенные альдегиды
токсичнее насыщенных. Некоторые обладают
канцерогенными свойствами.
Альдегиды раздражают слизистые оболочки
глаз и верхних дыхательных путей, вредно
влияют на нервную систему. С увеличением
числа атомов углерода в молекуле
раздражающее действие ослабевает.
Ненасыщенные альдегиды обладают более
сильным раздражающим действием, чем
насыщенные.
27.
Ацетальдегид СН3СНО вызываетвозбуждение, сменяющееся
наркозом. Он является
промежуточным продуктом
метаболизма этилового спирта в
организме.
28.
Введение галогена в молекулу альдегидаповышает его наркотическое (снотворное)
действие. Так, наркотические свойства
хлораля более выражены, чем у
ацетальдегида. Альдегидная группа
усиливает токсичность вещества, но она
может быть значительно снижена путём
образования гидратной формы альдегида.
Гидратные формы мало токсичны, в такой
форме хлораль применяется в медицине
под названием хлоралгидрата,
проявляющего снотворное действие.
29.
Лекарственные препараты,содержащие в молекуле
альдегидную группу, и их основное
действие на организм
Название
Действие на организм
Формальдегид (формалин)
Антисептическое
Хлоральгидрат
Снотворное,
противосудорожное
Цитраль
Снижает артериальное
давление
Циминаль
Противомикробное
30.
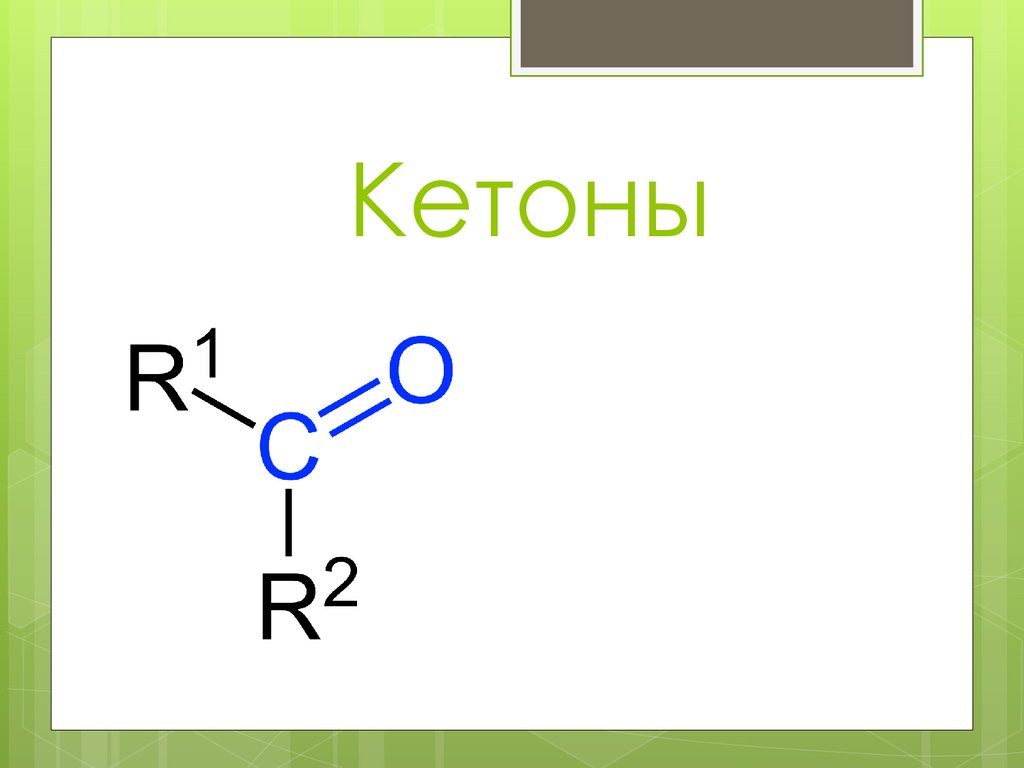
Кетоны31.
Ацетон(пропано́н, димети́лкето́н, пропано́н-2)
C3H6O или CH3—C(O)—CH3) Класс:
насыщенные кетоны.
32.
Кетонурия, ацетонурия – состояние, когда кетоновые телапоявляются в моче. На практике этим кетоном является ацетон ,
который благодаря своему характерному запаху легко
ощущается в моче в случае его высокой концентрации, что
дополнительно сопровождается повышением концентрации
кетонов в крови (так называемая кетонемия), которая вызывает
образование метаболического ацидоза , а сам ацетон может
ощущаться в выдыхаемом воздухе.
Клинически избыточное производство кетонов происходит в двух
ситуациях:
Невозможность переваривать сахар из-за дефицита инсулина,
который возникает при неконтролируемом диабете в случае
чрезмерного β-окисления жиров, что может привести к голоду.
Другими редкими причинами кетонурии являются почечная
гликозурия, гликогеноз, диета с низким содержанием
углеводов (низкоуглеводная или Кетогенная диета) или высоким
содержанием белка. Это состояние может также временно
появиться в случае рвоты или лихорадки.
Лечение кетонурии является симптоматическим, то есть
существующие нарушения должны быть компенсированы нарушения уровня глюкозы, кислотно-щелочного и водноэлектролитного баланса или адекватного баланса калорий.
33.
Литературные источники:Кнунянц, И. Л. и др. т.1 А-Дарзана // Химическая
энциклопедия. — М.: Советская энциклопедия, 1988. —
623 с. — 100 000 экз.
Коноплева, Е. Клиническая фармакология в 2 ч. Часть 1.
Учебник и практикум для СПО. — Litres, 2019. — С. 75. —
347 с. — ISBN 9785041747503.
https://books.google.ru/books?id=7SubDwAAQBAJ&pg=PA71#v
=onepage&q&f=false
Реутов, О. А. и др. Органическая химия. В 4 частях. — М.:
Бином. Лаборатория знаний, 2004.
Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G.
D. Aldehydes, Araliphatic // Ullmann's Encyclopedia of Industrial
Chemistry. — Wiley, 2013. —
doi:10.1002/14356007.m01_m03.pub2.
Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G.
D. Aldehydes, Aliphatic // Ullmann's Encyclopedia of Industrial
Chemistry. — Wiley, 2013. — doi:10.1002/14356007.a01_321.pub3.


























 Химия
Химия