Похожие презентации:
Сполуки нітрогену з оксигеном
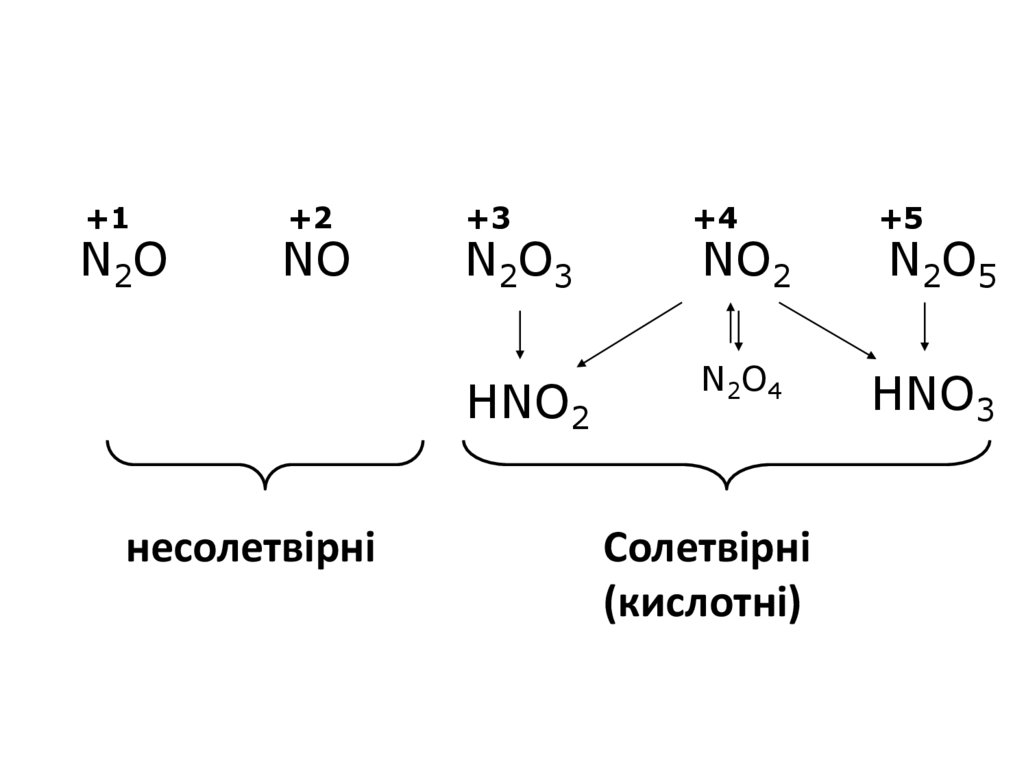
1. Сполуки нітрогену з оксигеном
2. N2O NO N2O3 NO2 N2O5
+1N2O
+2
NO
+3
N2O3
HNO2
несолетвірні
+4
+5
N2O4
HNO3
NO2
Солетвірні
(кислотні)
N2O5
3. N2O Добування NH4NO3 → N2O + H2O Молекула лінійна => sp - гібридизація
N 2OДобування
+5
-3
+1
t
NH4NO3 →
N2O + H2O
4е
Молекула лінійна
=>
sp - гібридизація
NNO
-
N+
↑ ↑ ↑
NNO
↑↓
N N O
113пм
+
N =N =O
↓↑ ↑ ↑
↑
-3 +5 -2
-
N
118пм
+
-
N ≡ N –O
μ = 0,05·10-29 Кл·м
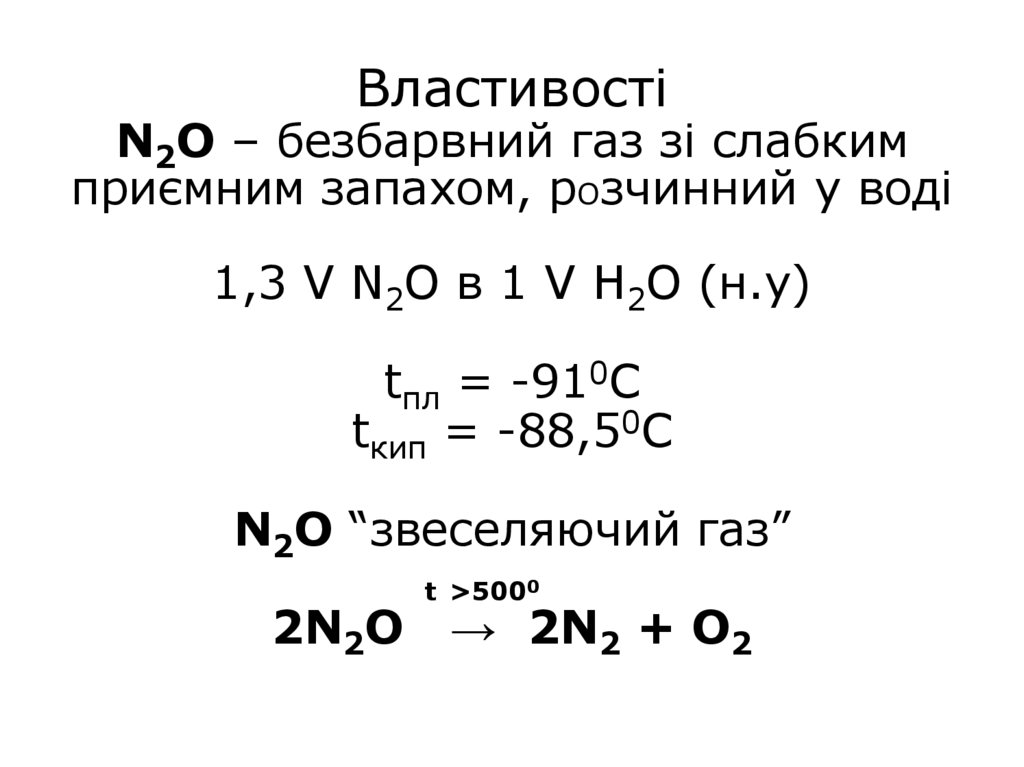
4. Властивості N2O – безбарвний газ зі слабким приємним запахом, розчинний у воді 1,3 V N2O в 1 V H2O (н.у) tпл = -910С tкип =
-88,50СN2O “звеселяючий газ”
2N2O
t >5000
→ 2N2 + O2
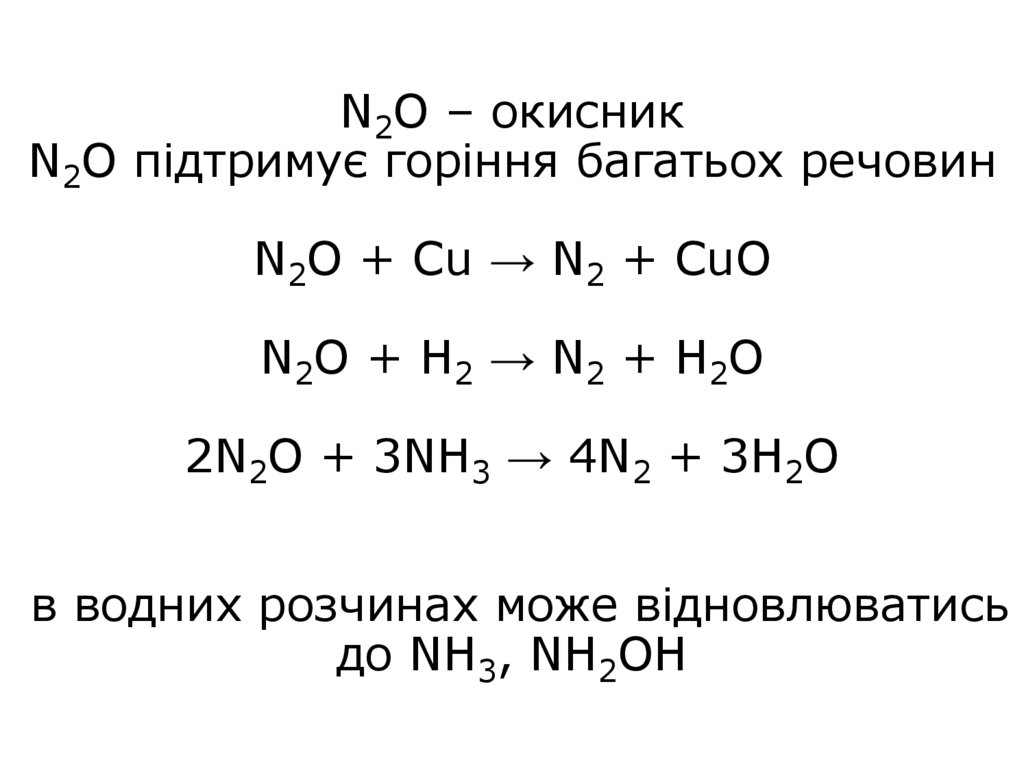
5. N2O – окисник N2O підтримує горіння багатьох речовин N2O + Cu → N2 + CuO N2O + H2 → N2 + H2O 2N2O + 3NH3 → 4N2 + 3H2O в водних
розчинах може відновлюватисьдо NH3, NH2OH
6. NO – газ без кольору і без запаху tпл = -1640С tкип = -1510С Молекула малополярна (μ = 2·10-31 Кл·м) Тому погано розчиняється у
воді0,07 V NO в 1 V H2O (00C)
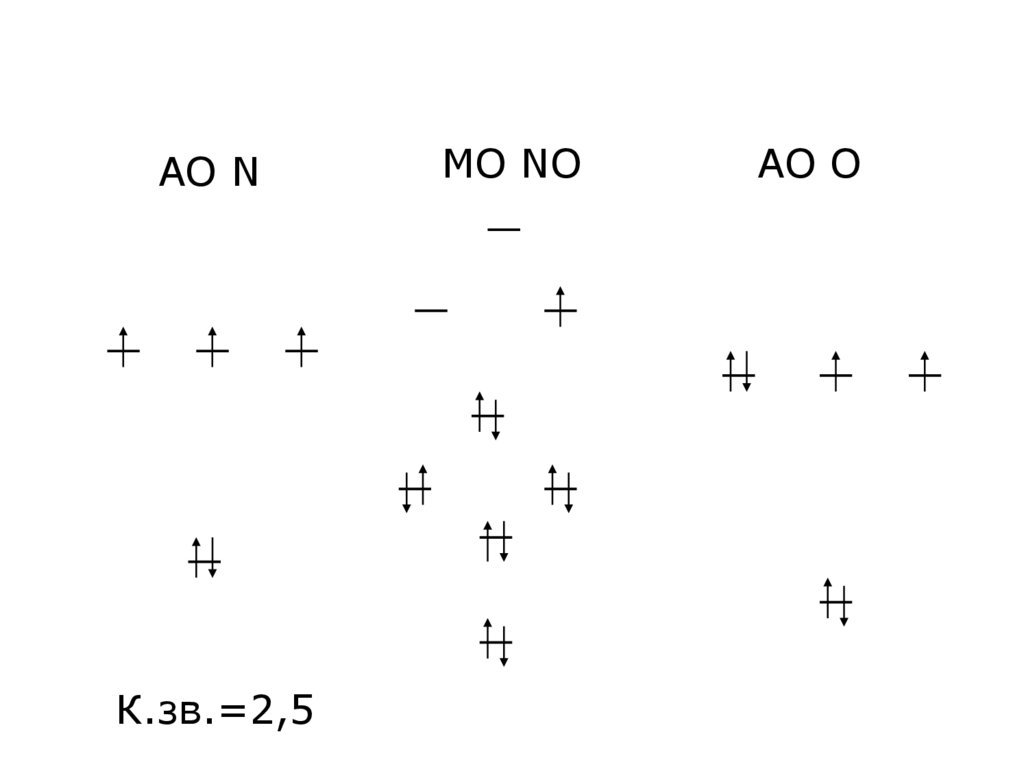
7.
АО NК.зв.=2,5
МО NO
AO O
8. Димеризація може відбуватися за низьких температур ON· + · NO ⇆ ONNO в твердому стані 100% N2O2 Добування В промисловості: 4NH3
Димеризація може відбуватися занизьких температур
ON· + · NO ⇆ ONNO (N2O2)
в твердому стані 100% N2O2
Добування
В промисловості:
4NH3 + 5O2
Kat
→
4NO + 6H2O
9. В невеликих кількостях NO утворюється в атмосфері під час грозових розрядів N2 + O2 ⇆ 2NO ∆ H= 90,3 кДж/моль ∆S = 8,7 Дж/моль·K
в лабороторії:Cu + 8HNO3(розв) → 3Cu(NO3)2 + 2NO +
4H2O
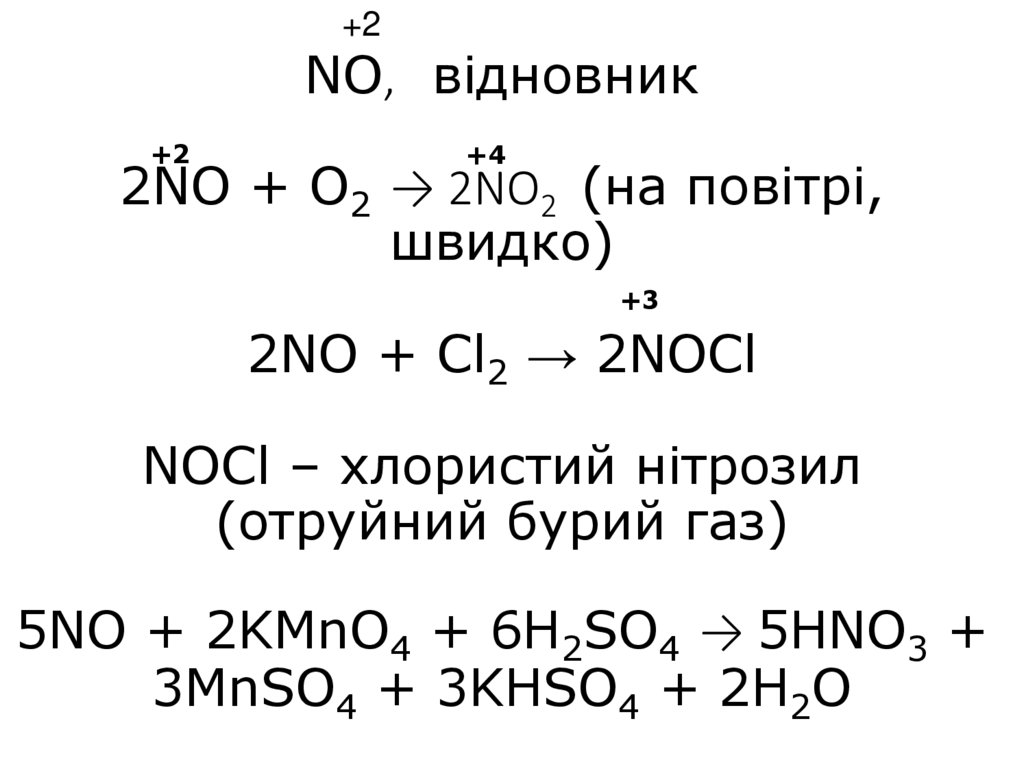
10. NO, відновник 2NO + O2 → 2NO2 (на повітрі, швидко) 2NO + Cl2 → 2NOCl NOCl – хлористий нітрозил (отруйний бурий газ) 5NO +
+2NO, відновник
+2
+4
2NO + O2 → 2NO2 (на повітрі,
швидко)
+3
2NO + Cl2 → 2NOCl
NOCl – хлористий нітрозил
(отруйний бурий газ)
5NO + 2KMnO4 + 6H2SO4 → 5HNO3 +
3MnSO4 + 3KHSO4 + 2H2O
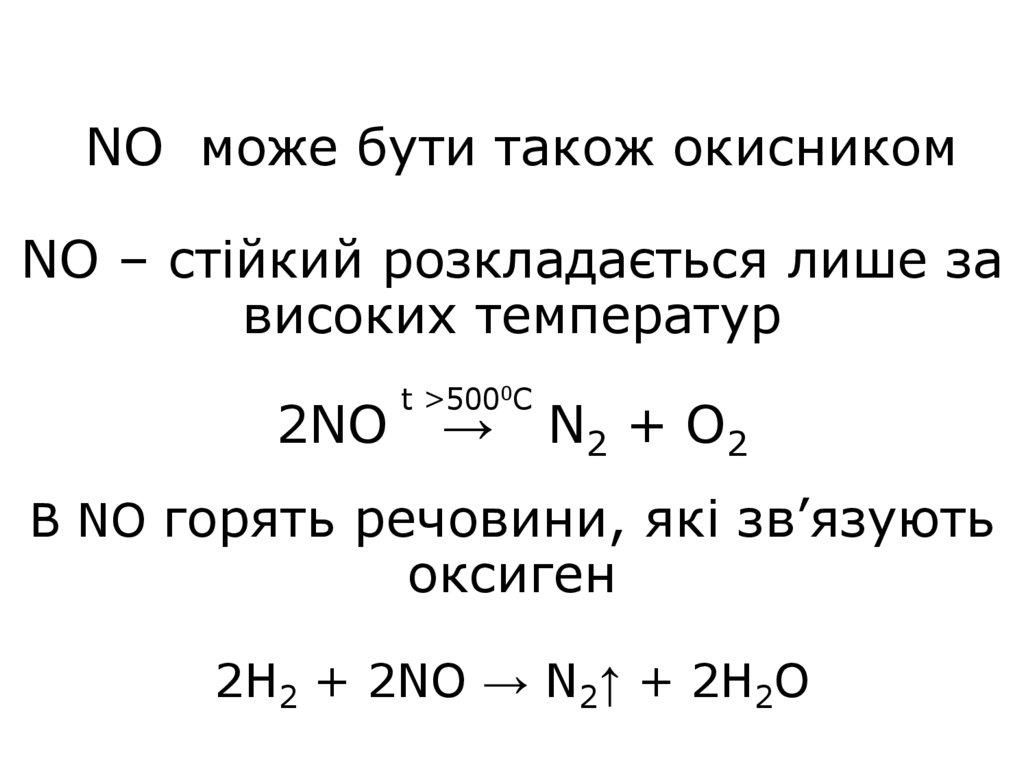
11. NO може бути також окисником NO – стійкий розкладається лише за високих температур 2NO → N2 + O2 В NO горять речовини, які
NO може бути також окисникомNO – стійкий розкладається лише за
високих температур
2NO
t >5000C
→
N2 + O2
В NO горять речовини, які зв’язують
оксиген
2H2 + 2NO → N2↑ + 2H2O
12. 4P + 10NO → 5N2 + 2P2O5 2Cu + 2NO → N2↑ + CuO 5CrCl2 + NO + 4H2 → NH3↑ + 5Cr(OH)Cl2
t4P + 10NO → 5N2 + 2P2O5
t
2Cu + 2NO →
N2↑ + CuO
5CrCl2 + NO + 4H2 → NH3↑ + 5Cr(OH)Cl2
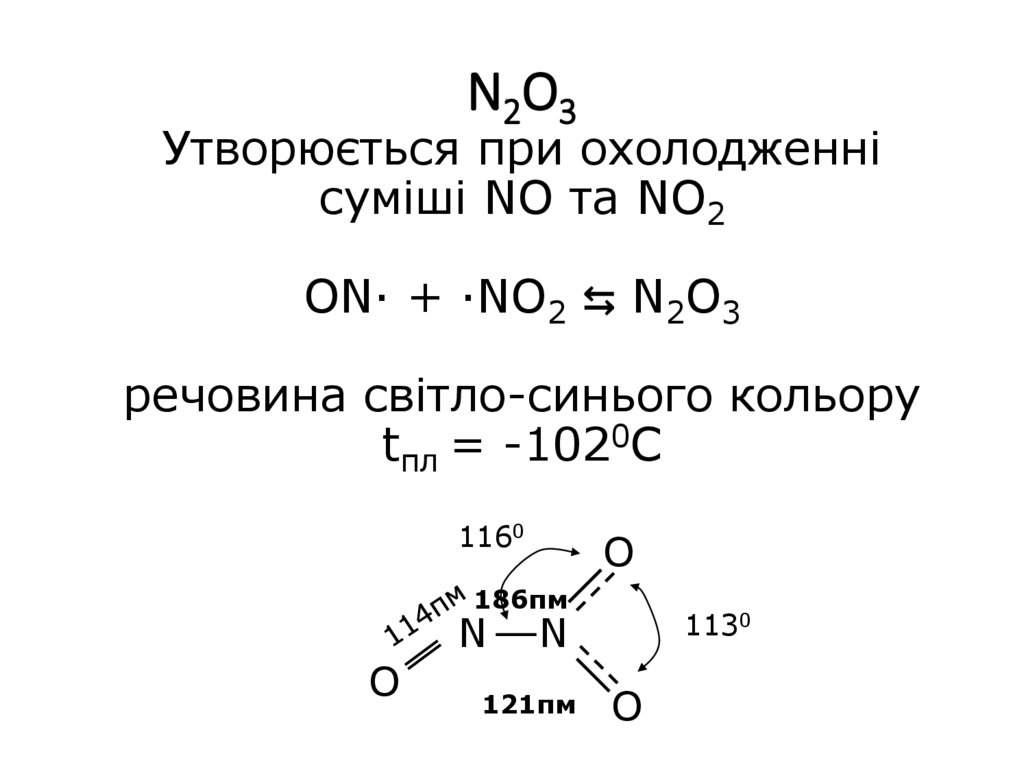
13. N2O3 Утворюється при охолодженні суміші NO та NO2 ON· + ·NO2 ⇆ N2O3 речовина світло-синього кольору tпл = -1020С
1160O
186пм
N
O
1130
N
121пм
O
14. N2O3 + H2O ⇆ 2HNO2 HNO2 – нітритна (азотиста) кислота Солі нітритної кислоти (нітрити) в промисловості добувають NO + NO2 +
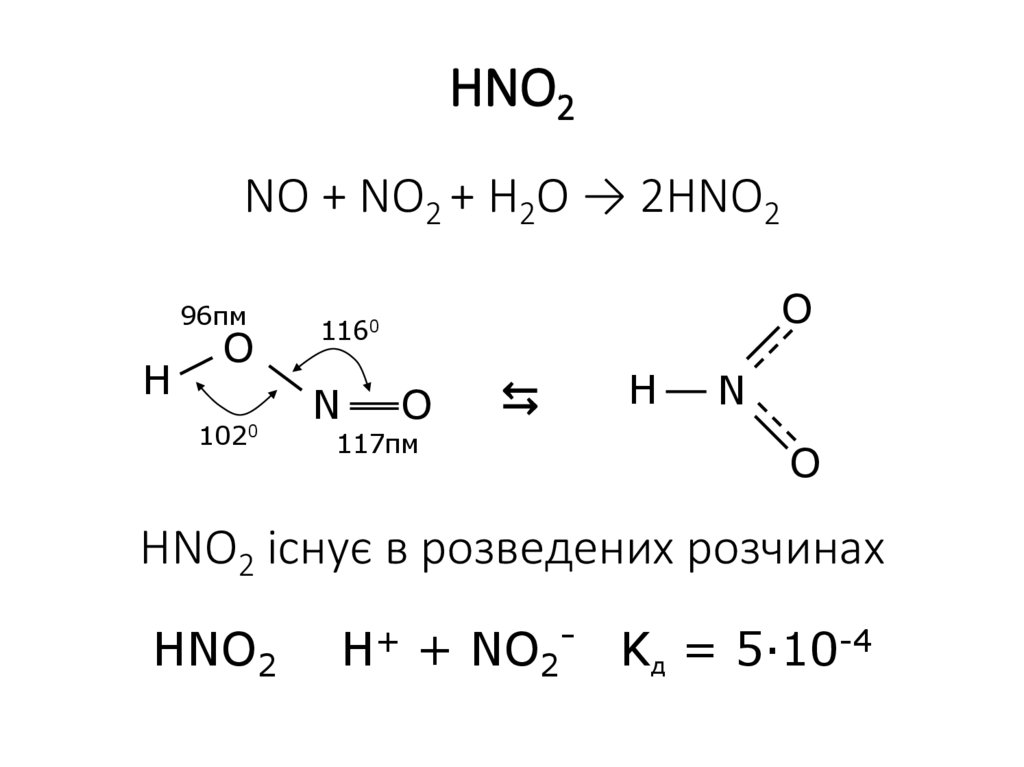
2NaOH → 2NaNO2 + H2O15. HNO2 NO + NO2 + H2O → 2HNO2 ⇆ HNO2 існує в розведених розчинах HNO2 ⇆ H+ + NO2- Kд = 5·10-4
HNO2NO + NO2 + H2O → 2HNO2
96пм
H
O
1020
O
1160
N
O
117пм
⇆
H
N
O
HNO2 існує в розведених розчинах
HNO2 ⇆ H+ + NO2- Kд = 5·10-4
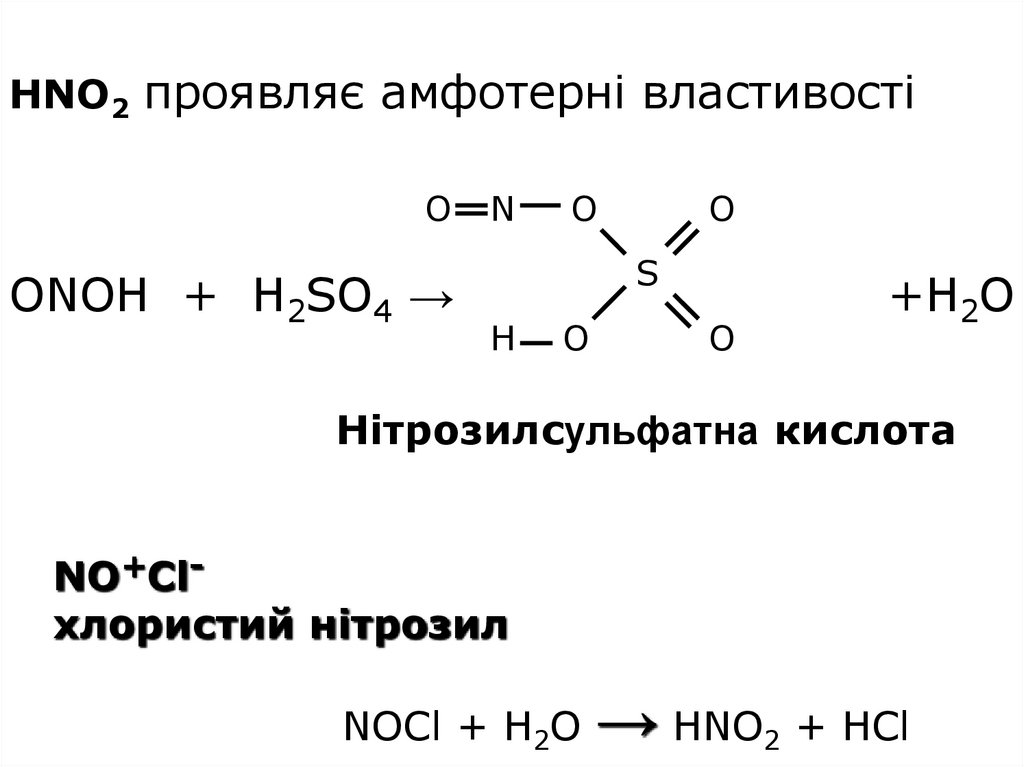
16. HNO2 проявляє амфотерні властивості ONOH + H2SO4 → +H2O
HNO2 проявляє амфотерні властивостіO
ONOH + H2SO4 →
N
O
O
S
H
O
O
+H2O
Нітрозилсульфатна кислота
NO+Clхлористий нітрозил
NOCl + H2O → HNO2 + HCl
17.
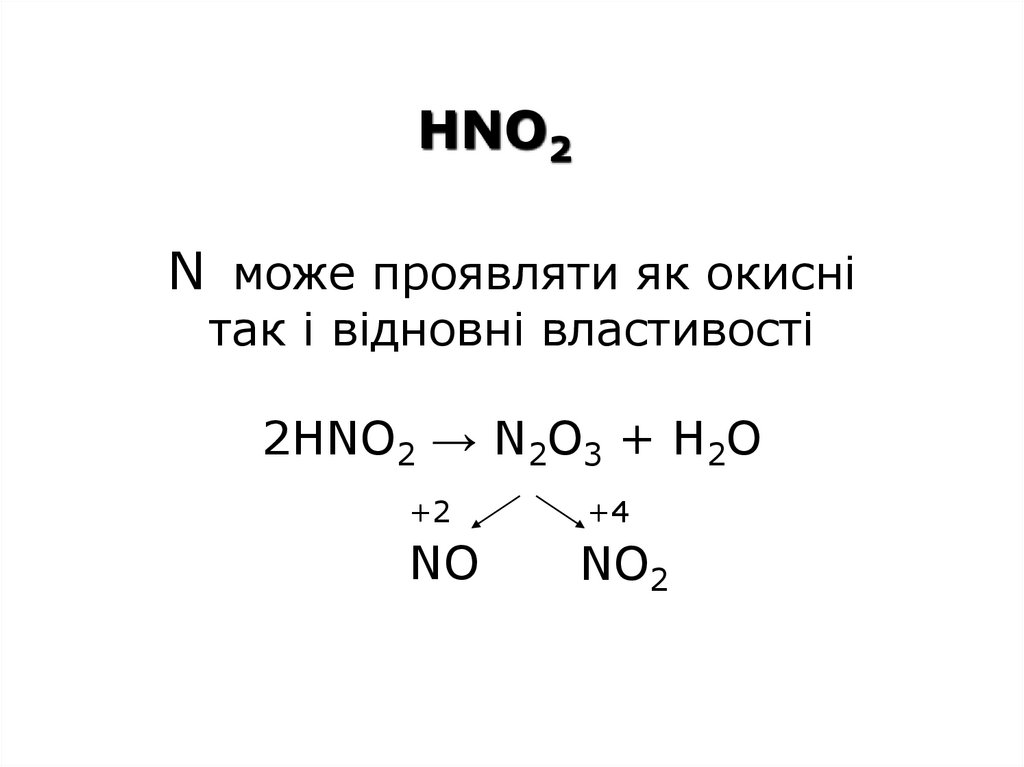
HNO2+3
N може проявляти як окисні
так і відновні властивості
+3
2HNO2 → N2O3 + H2O
+2
+4
NO
NO2
18. Окисні властивості більш характерні ніж відновні HNO2 + H+ + 1e ⇆ NO + H2O E0 = 1,00 B H2S + 2HNO2→ S + NO + 2H2O 2KJ + 2NaNO2
Окисні властивості більш характерні ніжвідновні
HNO2 + H+ + 1e ⇆ NO + H2O
E0 = 1,00 B
H2S + 2HNO2→ S + NO + 2H2O
0
-1
+2
+3
2KJ + 2NaNO2 + 2H2SO4 → J2 + 2NO +
↓1e·2
↑1e
K2SO4 + Na2SO4 + 2H2O
+7
+3
+2
2KMnO4 + 5NaNO2 +3H2SO4 → 2MnSO4 +
+5
↑5e
5NaNO3 + K2SO4 + 3H2O
↓2e
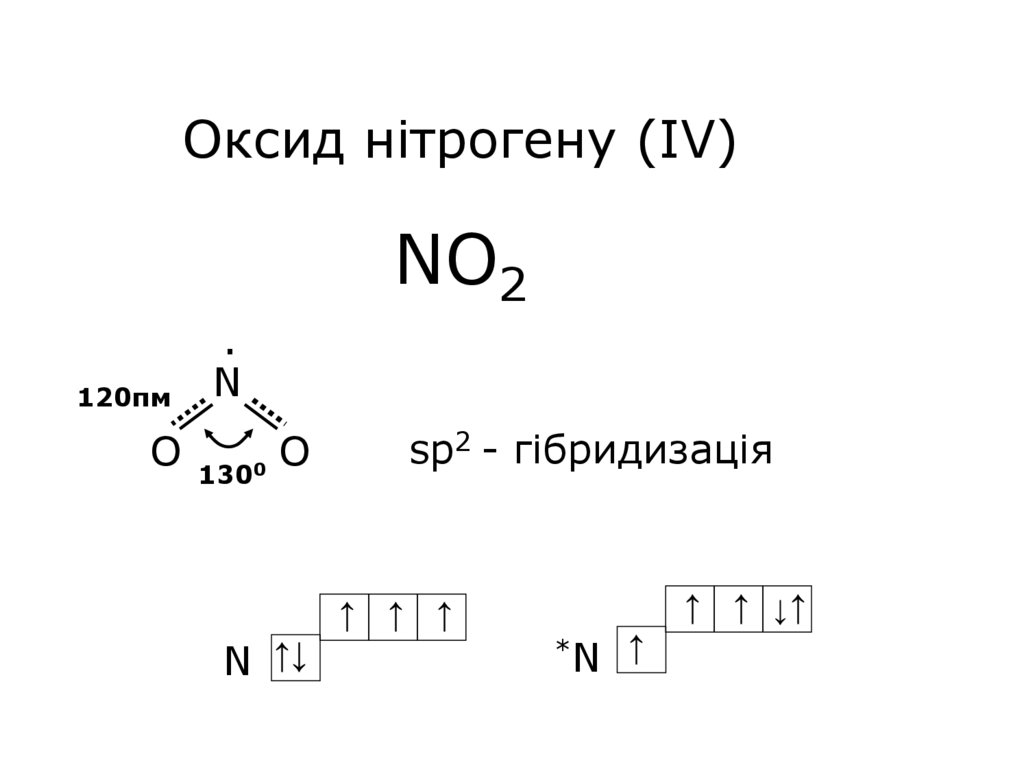
19. Оксид нітрогену (IV) NO2
120пм·
N
O 1300 O
sp2 - гібридизація
↑ ↑ ↑
N ↑↓
↑ ↑ ↓↑
*N
↑
20.
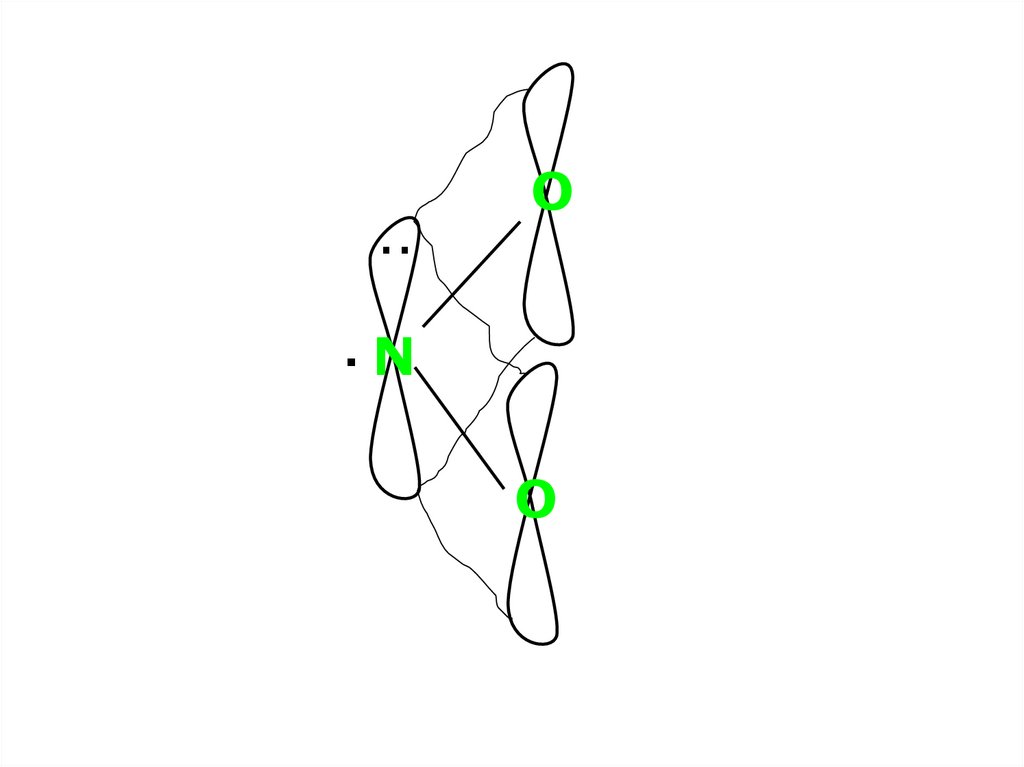
..O
·N
O
21.
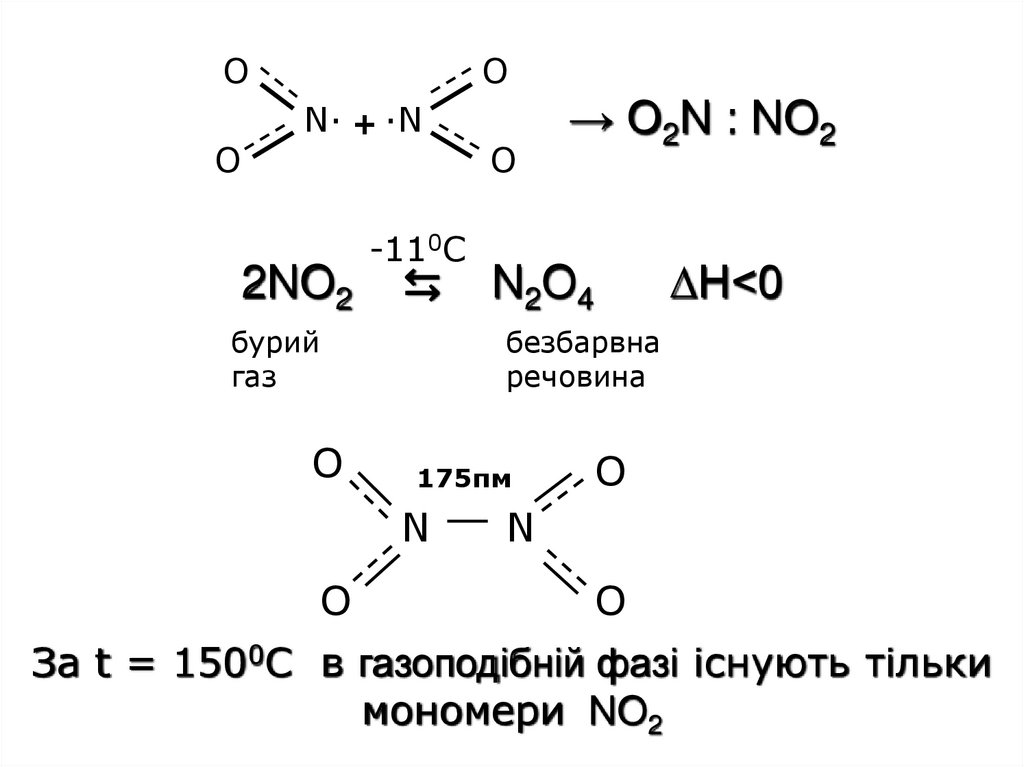
OO
O
N· + ·N
2NO2
-110С
⇆
бурий
газ
O
→ O2N : NO2
∆H<0
N 2O 4
безбарвна
речовина
O
175пм
N
O
O
N
O
За t = 1500C в газоподібній фазі існують тільки
мономери NO2
22. 2NO2 + H2O → HNO2 + HNO3 Оксиду NO2 – відповідають дві кислоти 2NO2 + 2KOH → KNO2 + KNO3 +H2O NO2 + Ca(OH)2 → У разі розчинення
+4+3
+5
2NO2 + H2O → HNO2 + HNO3
Оксиду NO2 – відповідають дві кислоти
2NO2 + 2KOH → KNO2 + KNO3 +H2O
NO2 + Ca(OH)2 →
У разі розчинення в гарячій воді
2NO2 + H2O → HNO3 + HNO2
H 2O
t
N2O3
NO
NO2
3NO2 + H2O → 2HNO3 + NO↑
23. Якщо NO2 розчиняється у воді в присутності кисню, то утворюється тільки нітратна (азотна) кислота 4NO2 + 2H2O + O2 → 4HNO3 2NO2
>5000C→
2NO↑ + O2↑
Тому за високих температур NO2 сильний
окисник
t
8P + 10NO2 → 4P2O5 + 5N2
t
2C + 2NO2 →
2CO2 + N2
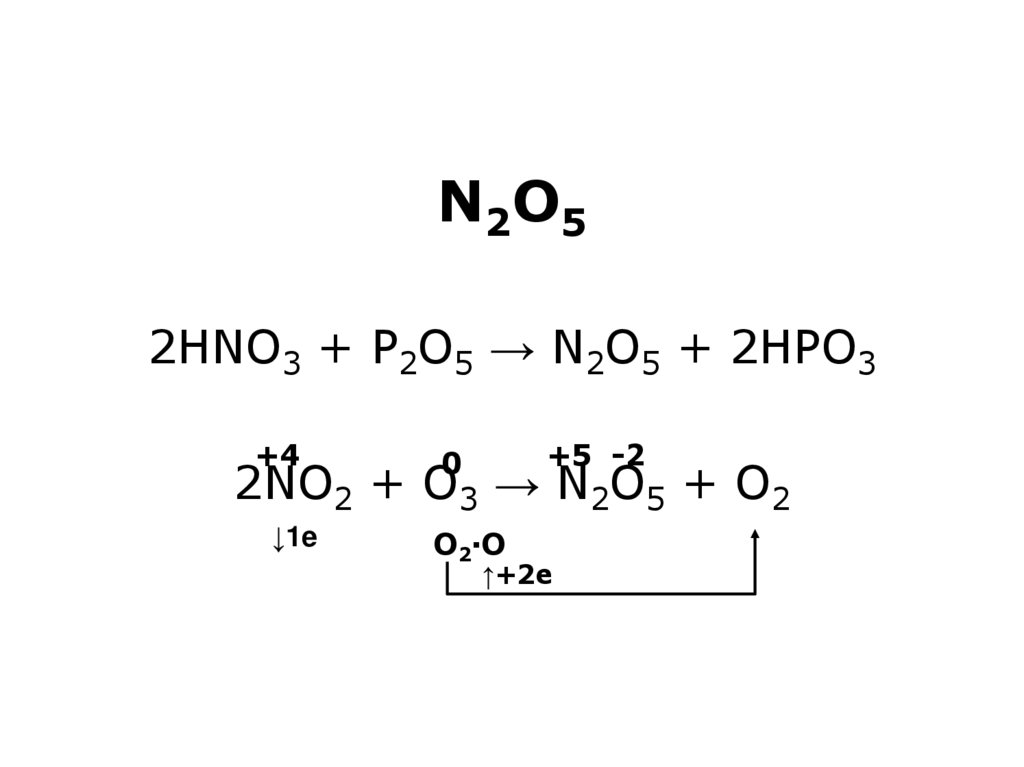
24. N2O5 2HNO3 + P2O5 → N2O5 + 2HPO3 2NO2 + O3 → N2O5 + O2
N2O52HNO3 + P2O5 → N2O5 + 2HPO3
+4
0
+5 -2
↓1e
O2·O
2NO2 + O3 → N2O5 + O2
↑+2e
25. tсубл = 320С в твердому стані N2O5 - іонна сполука NO2+NO3- нітрат нітронію В газоподібному стані має молекулярну будову
NO
121пм
146пм
O
O
950
N
1340
O
O
26. N2O5 + H2O → 2HNO3 в промисловості для добування HNO3 не використовується N2O5 + 2NaOH → 2NaNO3 + H2O
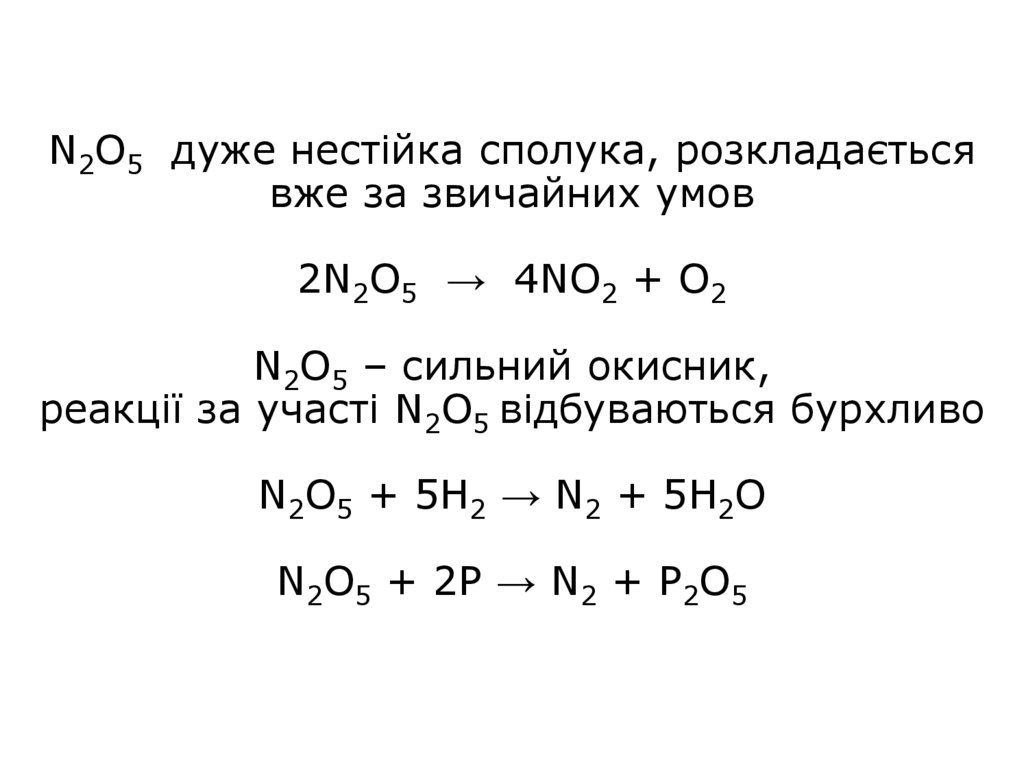
27. N2O5 дуже нестійка сполука, розкладається вже за звичайних умов 2N2O5 → 4NO2 + O2 N2O5 – сильний окисник, реакції за участі
N2O5 відбуваються бурхливоN2O5 + 5H2 → N2 + 5H2O
N2O5 + 2P → N2 + P2O5
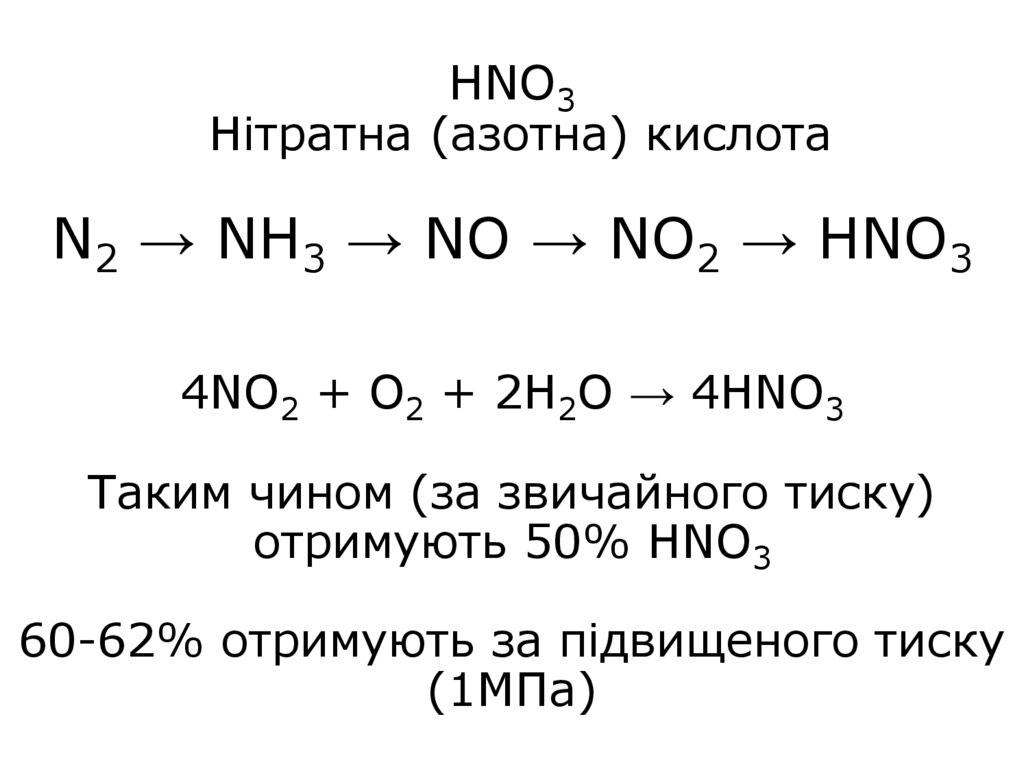
28. HNO3 Нітратна (азотна) кислота N2 → NH3 → NO → NO2 → HNO3 4NO2 + O2 + 2H2O → 4HNO3 Таким чином (за звичайного тиску) отримують
50% HNO360-62% отримують за підвищеного тиску
(1МПа)
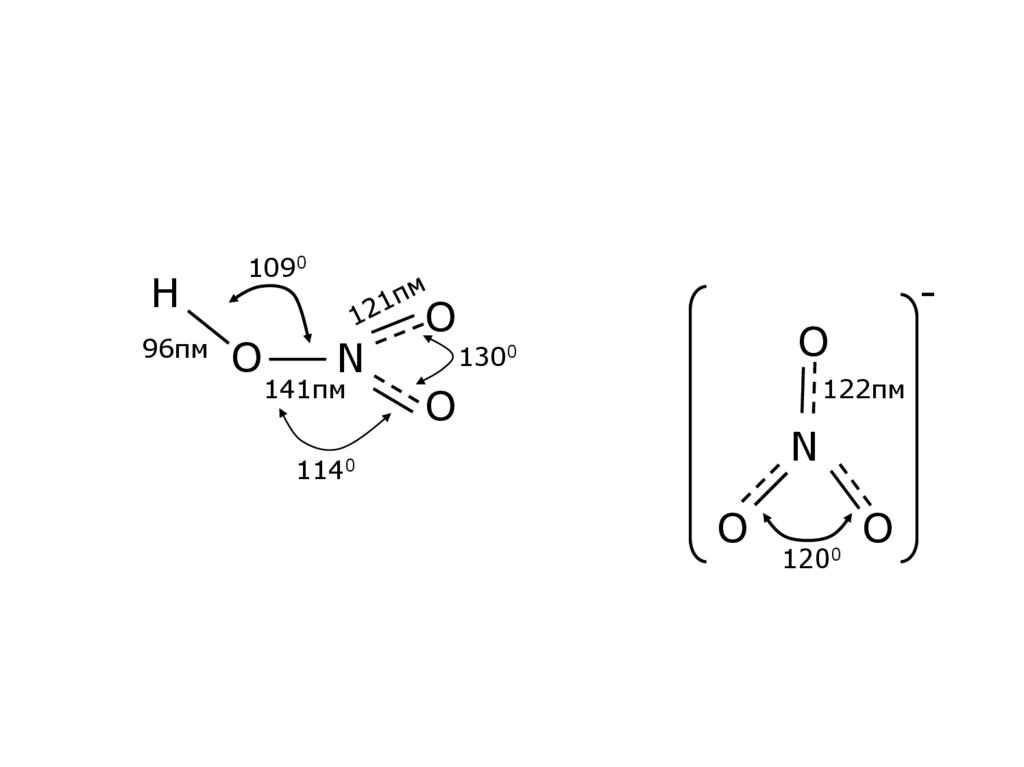
29. Будова молекули
HO
+
N
O
H
O
O-
+
O-
N
O
↓↑ ↑ ↑
↑ ↑ ↑
O- ↑↓
N+ ↑
H
O
+
O
-1/2
N
O
-1/2
30.
H96пм
1090
O
N
141пм
-
O
O
1300
122пм
O
N
1140
O
1200
O
31. Властивості HNO3 Сильна кислота HNO3 → H+ + NO3- Cильний окисник 3J2 + 10HNO3 → HJO3 + 10NO + 2H2O 3P + 5HNO3 + H2O → 3H3PO4 +
Властивості HNO3Сильна кислота
HNO3 → H+ + NO3Cильний окисник
0
+5
↓5e·2
↑3e
+5
+2
3J2 + 10HNO3 → HJO3 + 10NO + 2H2O
3P + 5HNO3 + H2O → 3H3PO4 + 5NO
32.
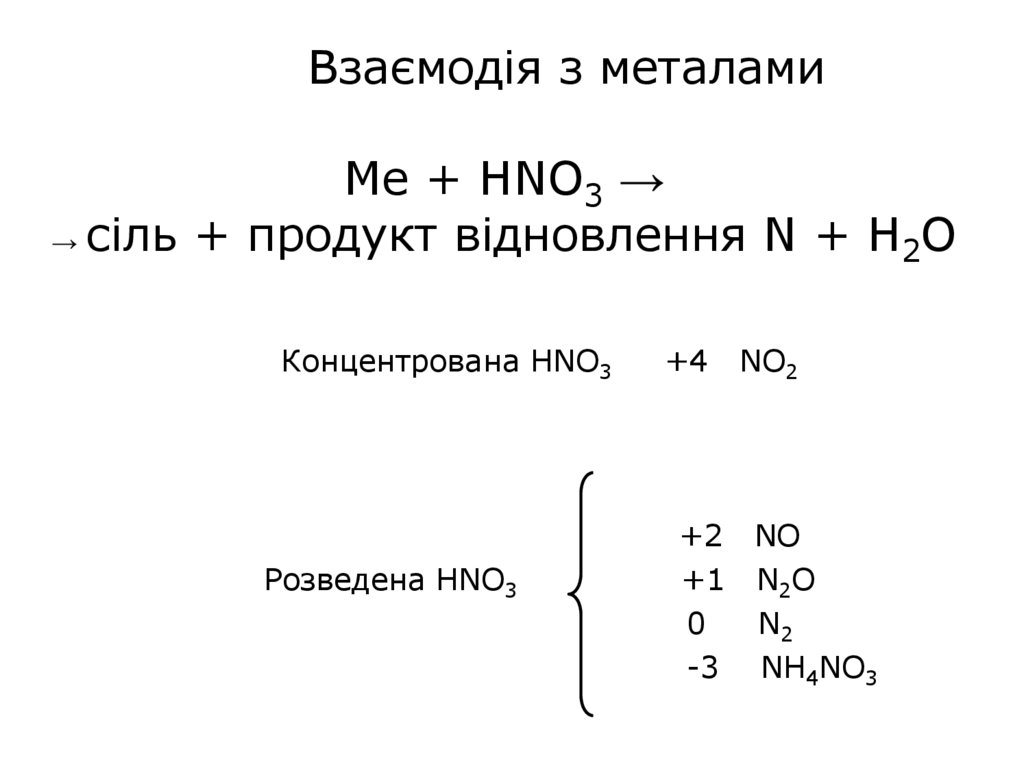
Взаємодія з металамиMe + HNO3 →
→ сіль + продукт відновлення N + H2O
Концентрована HNO3
Розведена HNO3
+4
NO2
+2 NO
+1 N2O
0
N2
-3 NH4NO3
33. NO3- + 1e + 2H+ ⇆ NO2 + H2O E0 = 0,80 B NO3- + 3e + 4H+ ⇆ NO + 2H2O E0 = 0,96B 2NO3- + 8e + 10H+ ⇆ N2O + 5H2O E0 = 1,12B 2NO3-
+ 10e + 12H+ ⇆ N2 + 6H2O E0 = 1,25BNO3- + 8e + 10H+ ⇆ NH4+ + 3H2O E0 = 0,87B
34. Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O Cu + HNO3(розв) → Cu(NO3)2 + NO + H2O Zn + HNO3(розв) → Zn(NO3)2 + N2 + H2O 8Al +
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2OCu + HNO3(розв) → Cu(NO3)2 + NO + H2O
Zn + HNO3(розв) → Zn(NO3)2 + N2 + H2O
0
+5
+3
-3
↓3e
↑8e
8Al + 30HNO3(розв) → 8Al(NO3)3 + 3NH4NO3
+9H2O
35. Концентрована HNO3 на холоді пасивує деякі метали: Al, Fe, Co, Ni, Cr та їх сплави HNO3 не діє на Au, Os, Ir, Pt, Nb, Ta, W
Царська горілка:суміш концентрованої HNO3 і HCl (1:3)
3HCl + HNO3 → NOCl + Cl2 + 2H2O
2NOCl → 2NO + Cl2
36. Au + HNO3 + 3HCl → AuCl3 + NO + H2O 3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O
37. Солі нітратної кислоти Добування: взаємодія HNO3 з металами, оксидами, гідроксидами, карбонатами Всі нітрати добре розчиняються
у водіТермічний розклад солей HNO3
t 2KNO2 + O2
2KNO3 →
2Cu(NO3)2 →
2CuO + 4NO2 + O2
t
38.
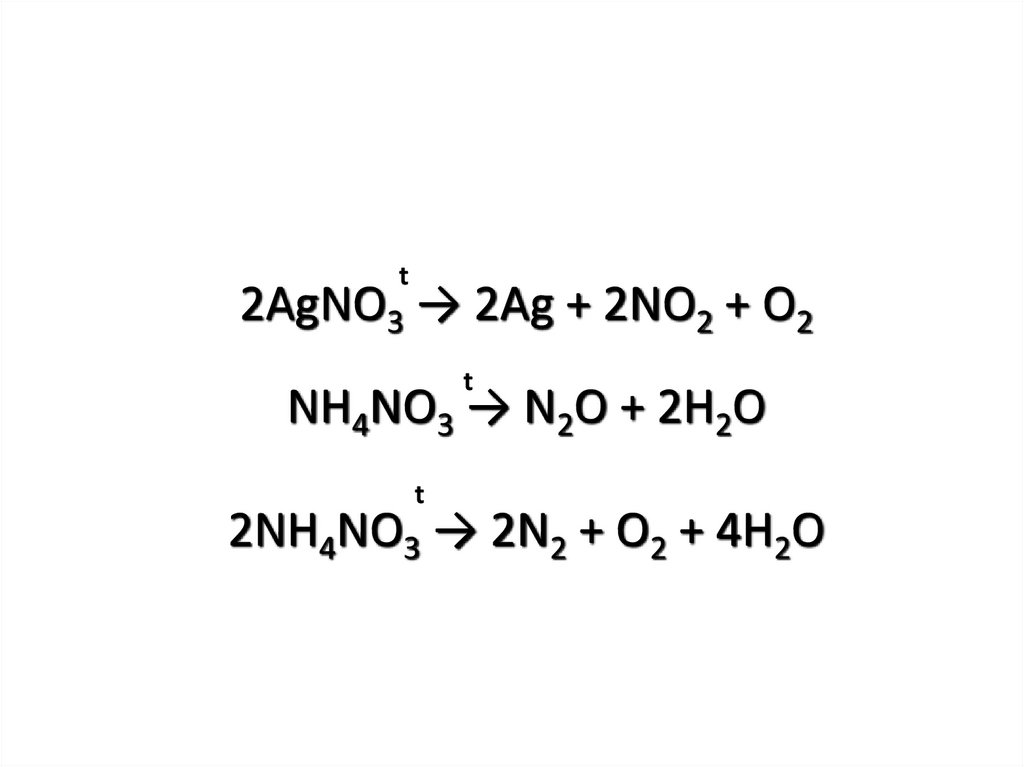
t2AgNO3 → 2Ag + 2NO2 + O2
t
NH4NO3 → N2O + 2H2O
t
2NH4NO3 → 2N2 + O2 + 4H2O





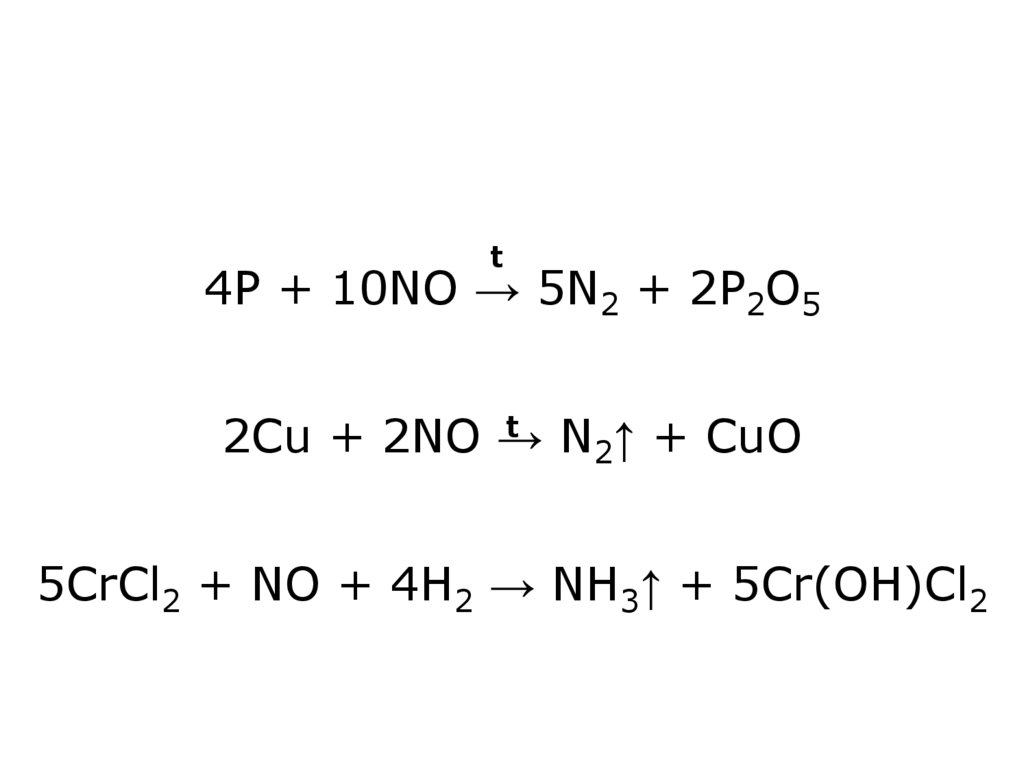









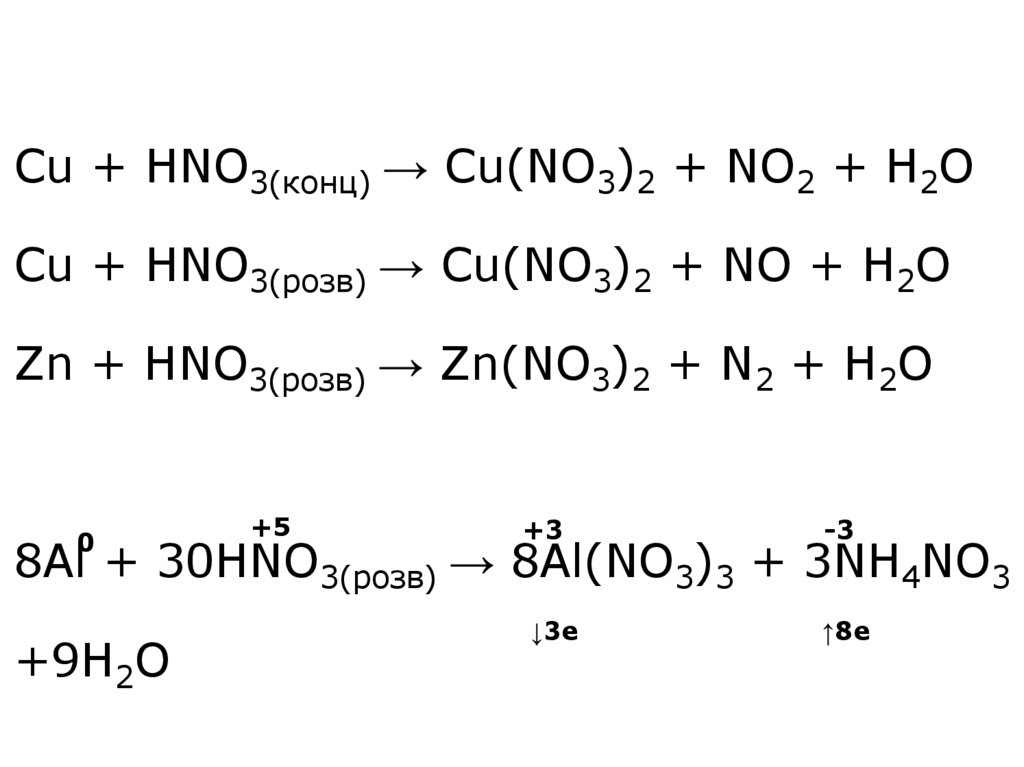

![Au + HNO3 + 3HCl → AuCl3 + NO + H2O 3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O Au + HNO3 + 3HCl → AuCl3 + NO + H2O 3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O](https://cf4.ppt-online.org/files4/slide/s/shDGOP3Ucw02WHBF5nXJyxN1YzeIbCEpd6gak7/slide-35.jpg)

 Химия
Химия








