Похожие презентации:
Химия атмосферы, озон в атмосфере
1. Химия атмосферы, озон в атмосфере
Калякин Сергей Николаевич1
2. Химия окружающей среды
Геохимия
Химия почв
Гидрохимия
Химия атмосферы
Химия природных
соединений
Атмосфера – газовая оболочка Земли,
связанная с ней силой тяжести и
принимающая участие в ее суточном и
годовом вращении.
2
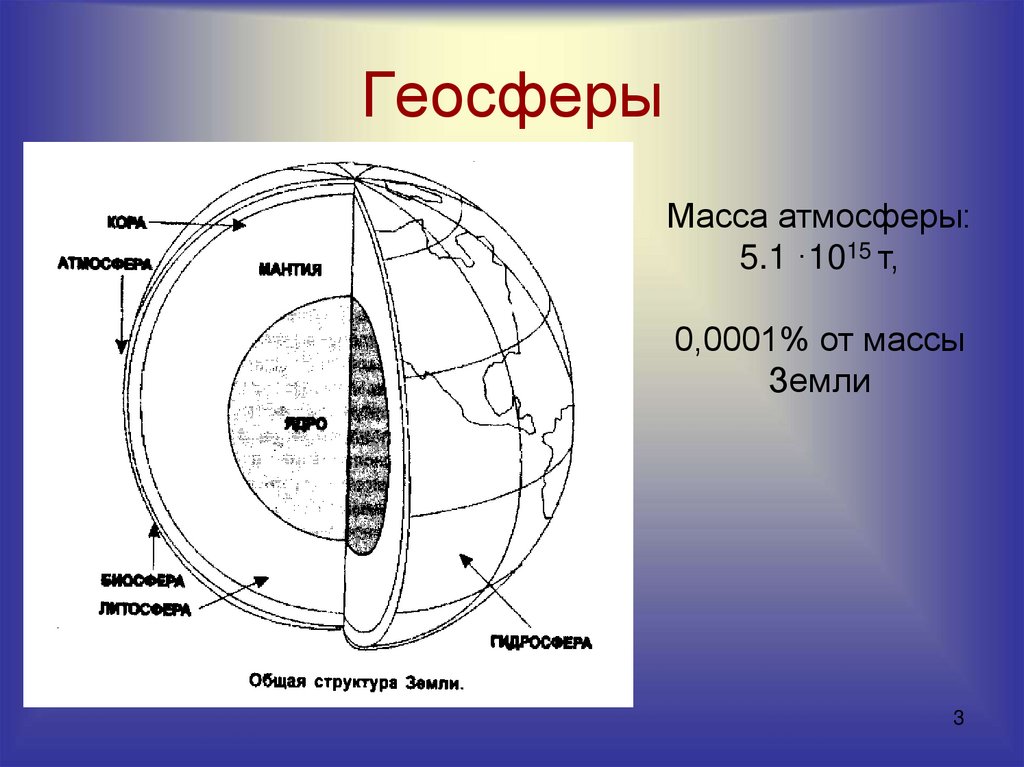
3. Геосферы
Масса атмосферы:5.1 ·1015 т,
0,0001% от массы
Земли
3
4. Строение атмосферы
Основные зоны атмосферы ЗемлиЗона
Тропосфера
Нижняя и верхняя
границы, км над
уровнем моря
0 – (8…18)
Стратосфера (8…18) –
(50…55)
Мезосфера (50…55) –
(80…85)
Термосфера (80…85) – 1000
<100 нм
Стратопауза
Температу
рный
градиент,
К/км
Температура на
границах, ˚С
нижней верхней
–6,45
15
–56
+1,38
–56
–2
–2,56
–2
–90
+3,13 (до
300 км)
–92
1200
Барометрическая
формула
<330 нм
PH = PO exp (-H / 7,99)
Скорость молекул
>330 нм
T= mV2 / 3kB
4
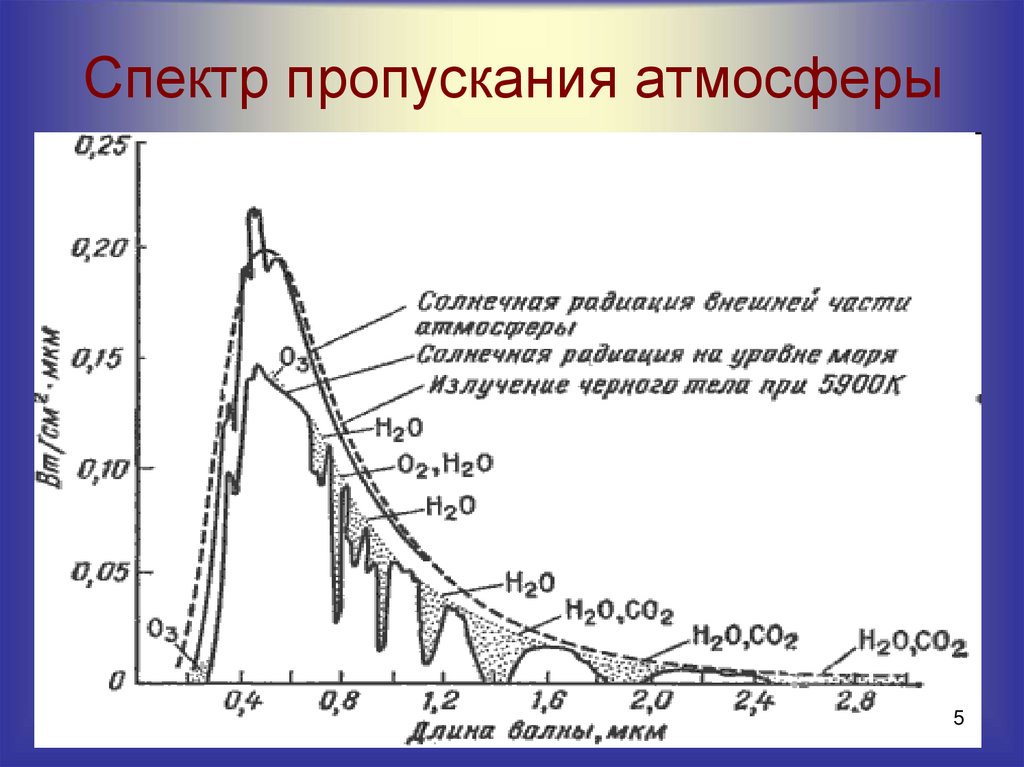
5. Спектр пропускания атмосферы
1-мах = 420 нм
2-
мах = 460 нм
5
6. Состав атмосферы вблизи земной поверхности
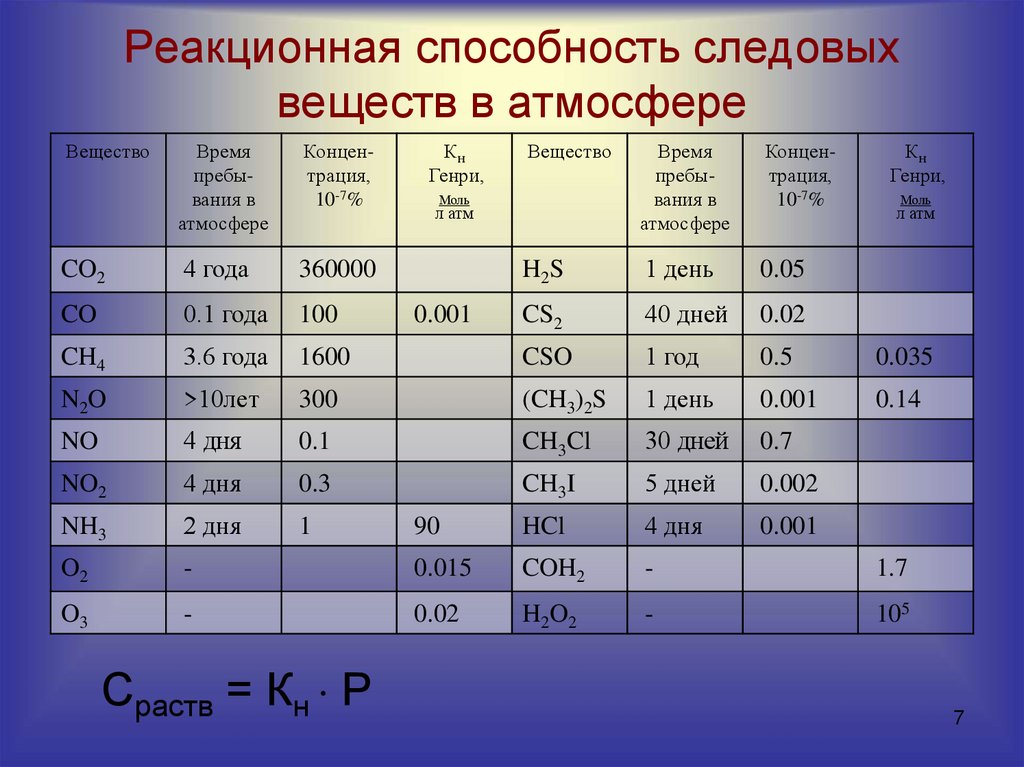
67. Реакционная способность следовых веществ в атмосфере
ВеществоВремя
пребывания в
атмосфере
Концентрация,
10-7%
CO2
4 года
360000
CO
0.1 года
100
CH4
3.6 года
N2O
Время
пребывания в
атмосфере
Концентрация,
10-7%
H2S
1 день
0.05
CS2
40 дней
0.02
1600
CSO
1 год
0.5
0.035
>10лет
300
(CH3)2S
1 день
0.001
0.14
NO
4 дня
0.1
CH3Cl
30 дней
0.7
NO2
4 дня
0.3
CH3I
5 дней
0.002
NH3
2 дня
1
90
HCl
4 дня
0.001
O2
-
0.015
COH2
-
1.7
O3
-
0.02
H2O2
-
105
Сраств = Кн Р
Кн
Генри,
Вещество
Моль
л атм
0.001
Кн
Генри,
Моль
л атм
7
8. Фотохимические реакции в атмосфере
• ФотодиссоциацияEν > 495 кДж/моль, λ < 190 нм
• Ионизация
8
9. Реакции ионов в атмосфере
• Диссоциативнаярекомбинация
*
*
• Перенос заряда
• Реакция обмена
9
10. Генерация озона в стратосфере
1011. Пороговые длины волн поглощаемого излучения, при которых происходит фотодиссоциация молекулярного кислорода
O2 + hv O(3P) + O(3P)< 242 nm
O2 + hv O(3P) + O(1D)
< 175 nm
O2 + hv O(3P) + O(1S)
< 133 nm
11
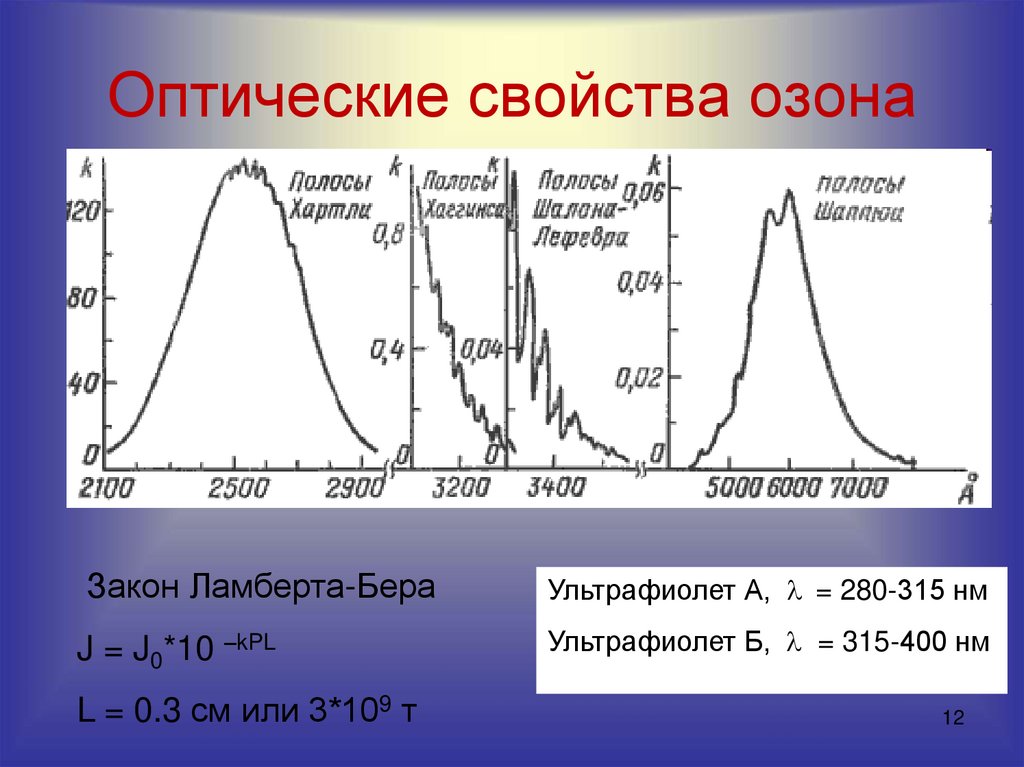
12. Оптические свойства озона
Закон Ламберта-БераУльтрафиолет А, = 280-315 нм
J = J0*10 –kPL
Ультрафиолет Б, = 315-400 нм
L = 0.3 см или 3*109 т
12
13. Озоновые дыры в атмосфере
АнтарктидаСеверное полушарие
13
14. Содержание озона и соединений хлора в стратосфере
1415. Высотный самолет Геофизика М55 использованный для измерения озона в стратосфере
1516. Процессы разложения озона в стратосфере
• ФотодиссоциацияO3 + hν → O2 + O*
O3 + O → 2O2
• Каталитические цепные процессы с участием радикалов
– Водородный цикл
OH + O3 → HO2 + O2
HO2 + O → OH + O2
– Азотный цикл
NO + O3 → NO2 + O2
NO2 + O → ON + O2
– Хлорный цикл
Cl + O3 → ClO + O2
ClO + O → Cl + O2
16
17. Воздействие хлорфторуглеродов (ХФУ) на атмосферу Земли
Монреальскийпротокол
по
веществам
разрушающим озоновый слой, вступил в силу 1989г
Фреоны – галогенированые углеводороды,
предложенные для промышленного применения
фирмой «Дюпон»
• трихлорфторметан (tкип 23,8 °C) — Фреон R-11
• дифтордихлорметан (tкип −29,8 °C) — Фреон R-12
• трифторхлорметан (tкип −81,5 °C) — Фреон R-13
• тетрафторметан (tкип −128 °C) — Фреон R-14
• тетрафторэтан (tкип −26,3 °C) — Фреон R-134A
• хлордифторметан (tкип −40,8 °C) — Фреон R-22
17
18. Техническое обозначение фреонов
обозначение состоит из буквенного R и цифрового:• первая цифра справа — это число атомов фтора в соединении;
• вторая цифра справа — это число атомов водорода в
соединении плюс единица;
• третья цифра справа — это число атомов углерода в
соединении минус единица (для соединений метанового ряда
нуль опускается);
• число атомов хлора в соединении находят вычитанием
суммарного числа атомов фтора и водорода из общего числа
атомов, которые могут соединяться с атомами углерода;
• для циклических производных в начале определяющего номера
ставится буква C;
• в случае, когда на месте хлора находится бром, в конце
определяющего номера ставится буква B и цифра,
показывающая число атомов брома в молекуле.
18
19. Безопасность фреонов
ГруппаКласс соединений
Хлорфторуглероды
(CLFC)
Фреоны (хладоны)
R-11, R-12, R-13, R-111, R-112, R-113,
R-113а, R-114, R-115
A
R-12B1, R-12B2, R-113B2, R-13B2,
Бромфторуглероды
B
Хлорфторуглеводор
оды (HCLFC)
Фторуглеводороды
(HFC)
C
Фторуглероды
(перфторуглеводоро
ды) (CF)
Воздействие на
озоновый слой
Вызывают
истощение
озонового слоя
R-13B1, R-21B1, R-22B1, R-114B2
R-21, R-22, R-31, R-121, R-122, R-123, R124,R-131, R-132, R-133, R-141, R-142в,
R-151, R-221,R-222, R-223, R-224, R-225,
R-231, R-232, R-233
Вызывают слабое
истощение
озонового слоя
R-23, R-32, R-41, R-125, R-134, R-143,
R-152, R-161,R-227, R-236, R-245, R-254
R-14, R-116, R-218, R-C318
Озонобезопасные
фреоны
(хладоны)
19
20. Озон в тропосфере
• ПДК среднесуточная – 30 мкг/м3,• ПДК разовая – 160 мкг/м3.
• Угнетение растений 80 мкг/м3
• Раздражение слизистых оболочек носа,
горла, глаз наблюдается при 100 мкг/м3, при
более высоких концентрациях – раздражение
дыхательных путей, кашель, тяжесть в груди,
головные боли, сильная усталость и др.
• В чистом воздухе в летние месяцы на
средних широтах концентрация озона не
превышает 40…80 мкг/м3, над городами
концентрация озона техногенного
происхождения 400 мкг/м3 и более.
20
21. Химические реакции в тропосфере с участием свободных радикалов, активные формы кислорода
2122. Образование тропосферного озона при участии оксидов азота
NO2 + hν = NO + O,O + O2 + M = O3 + M*.
Разрушение:
O3 + NO = NO2 + O2.
СО,Cl-, SO3 катализирует конверсию NO
22
23. Фотохимический смог
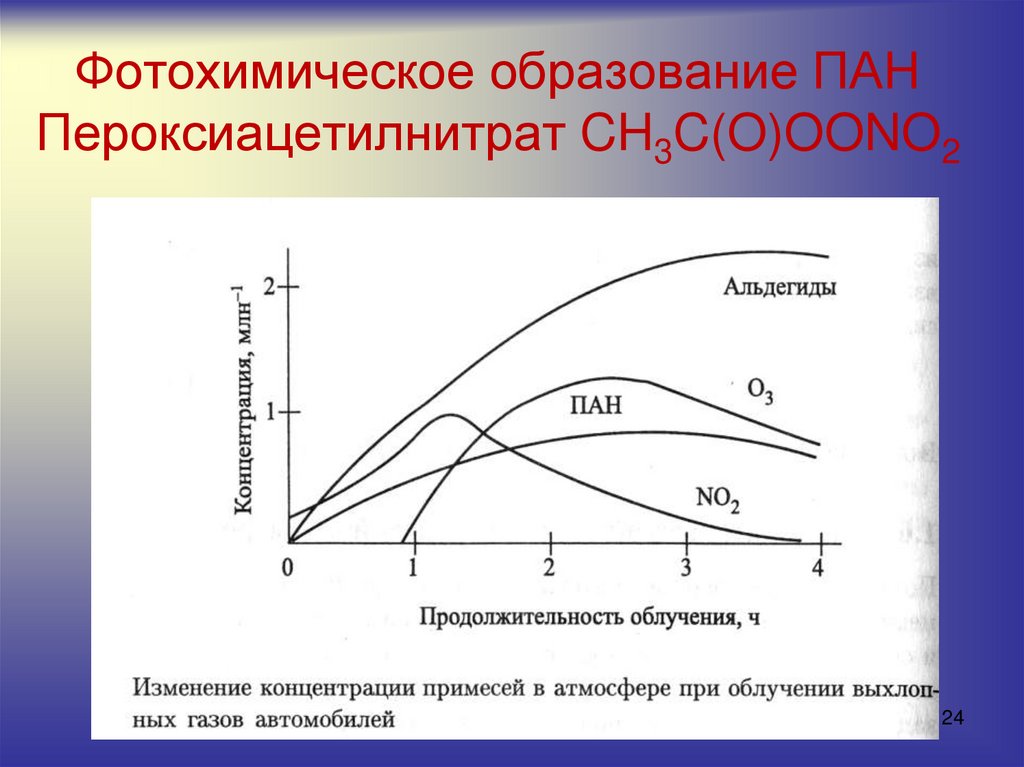
2324. Фотохимическое образование ПАН Пероксиацетилнитрат CH3C(O)OONO2
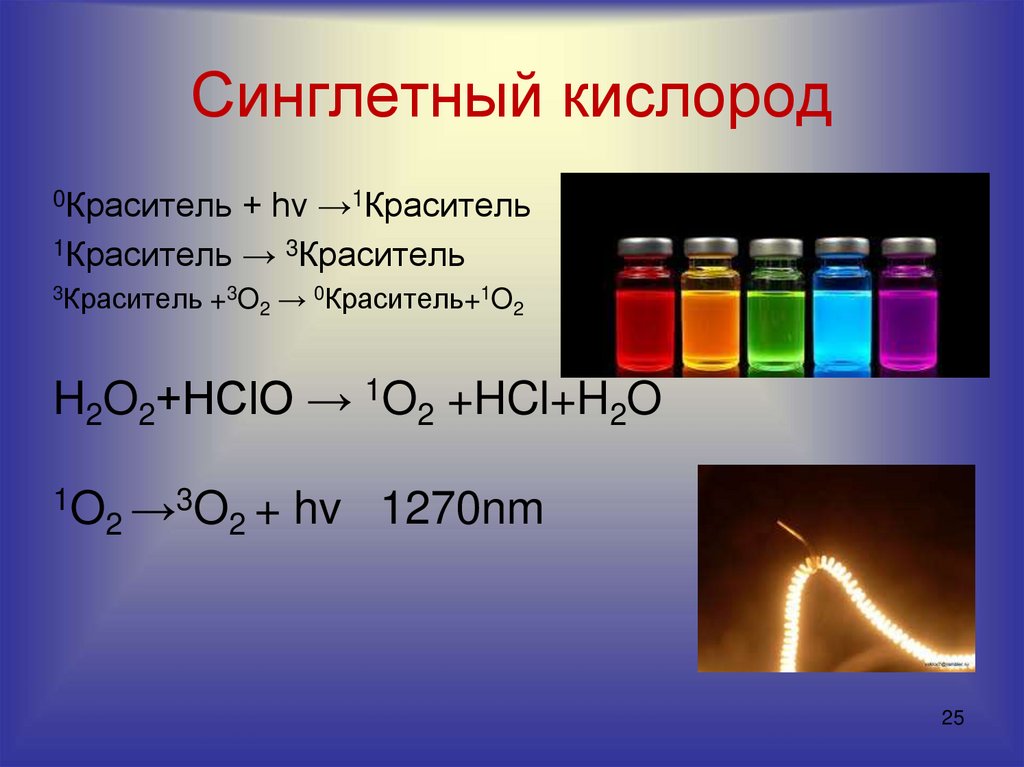
2425. Синглетный кислород
0Краситель + hv →1Краситель1Краситель → 3Краситель
3Краситель +3O
2→
0Краситель+1O
2
H2O2+HClO → 1O2 +HCl+H2O
1O
3O + hv 1270nm
→
2
2
25





















 Химия
Химия Экология
Экология








