Похожие презентации:
Типы кристаллических структур
1.
ТИПЫКРИСТАЛЛИЧЕСКИХ
СТРУКТУР
2.
Свойства веществ зависят не только от составаатомов, ионов, молекул, но и от их расположения.
В соответствии с этим твердые вещества могут быть
в двух состояниях: кристаллическом и аморфном.
Кристаллы – это твердые вещества, с упорядоченным
расположением структурных единиц (атомов, ионов,
молекул).
Структурные единицы – молекулы.
3.
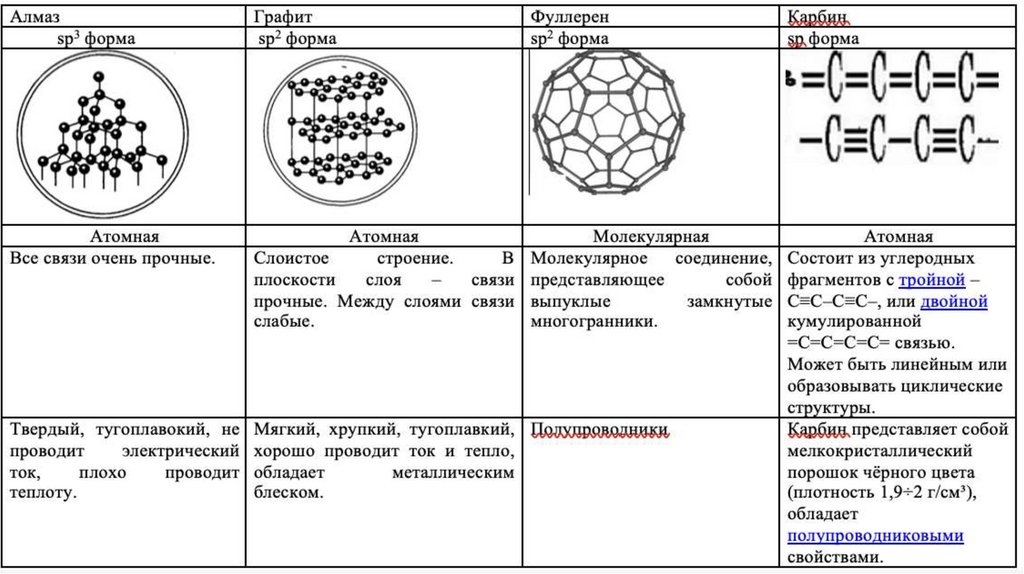
К веществам немолекулярного строения, укоторых структурные единицы атомы или ионы
относятся : металлы (Na, Cu, Fe), неметаллы (B,
Si, Cалмаз, Сграфит, PКрасный), соединения металлов с
неметаллами (NaCl, NaH, Na2SO4, CuCl2, Fe2O3) и
неметаллов с неметаллами (SiC, SiO2).
В аморфном состоянии порядок у структурных
единиц отсутствует. Примеры: стекло, смола,
парафин, полиэтилен, сажа.
4.
5.
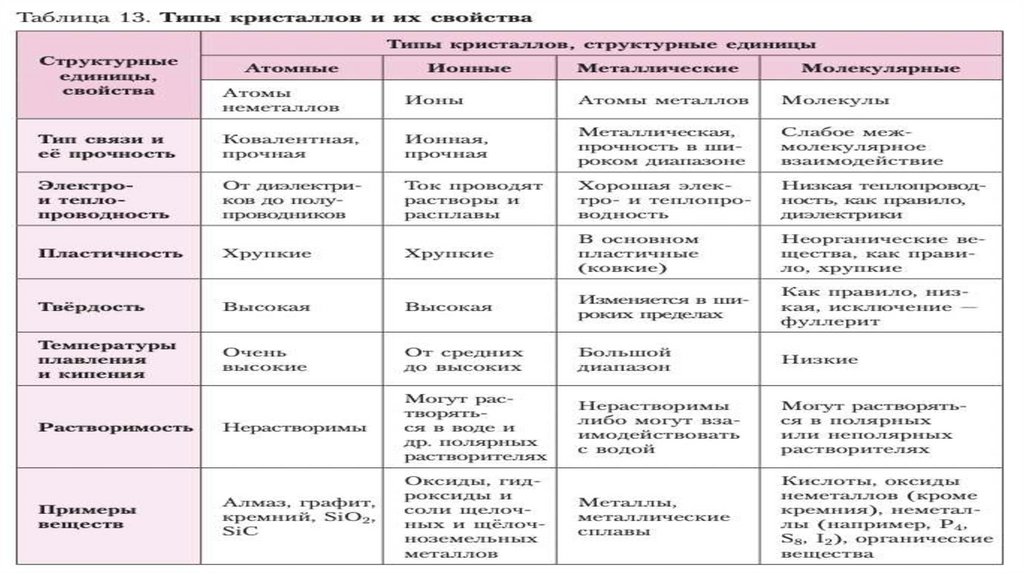
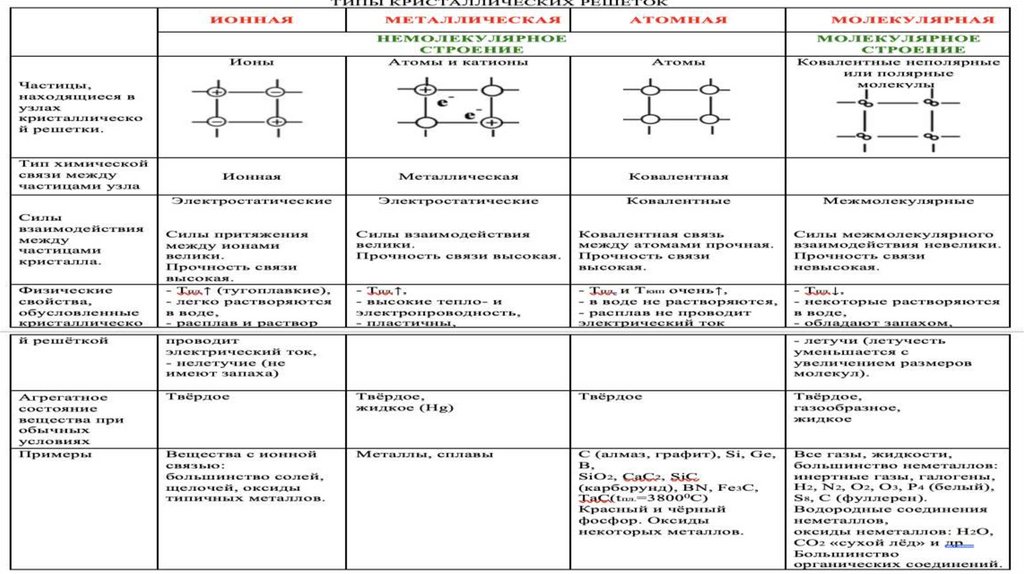
Ионная:Физические свойства: твердые, хрупкие, тугоплавкие,
многие растворимы в воде, расплавы проводят эл.ток,
нелетучие, при н.у.-твердые.
Частицы в узлах решетки: ионы.
Тип связи: ионная связь.
Примеры: NaCl, KOH, Ba(NO3)2, соли, в т.ч.
органические, основания, оксиды и бинарные соединения,
содержащие Ме.
6.
7.
Атомная:Физические свойства: очень твердые, очень
тугоплавкие, прочные, нелетучие, нерастворимы в
воде.
Частицы в узлах решетки: атомы.
Тип связи: ковалентная связь.
Примеры: Cалмаз, Cграфит, B, Si, SiC, SiO2, Al2O3, H2,
O2.
8.
Металлическая:Физические свойства: ковкие, обладают
блеском, пластичностью, тепло- и
электропроводностью.
Частицы в узлах решетки: атомы и ионы.
Тип связи: металлическая.
Примеры: металлы и сплавы.
9.
Молекулярная:Физические свойства: непрочные, летучие, легкоплавкие,
способны к возгонке, имеют небольшую твердость, при
н.у.-газы и жидкости.
Частицы в узлах решетки: молекулы.
Тип связи: межмолекулярные силы притяжения.
Примеры: вещества, образующие маленькие молекулы
(CO2, O2, N2, Cl2, H2O), благородные газы (VIIIА),
органические вещества (C6H6, CH4 и др.), S8, P4 (белый),
I2.
10.
Свойства решетки зависят от строения кристаллов и прочностисвязей.
На странице 91-92 есть примеры того, как построены эти
решетки.
Атомные, ионные и металлические кристаллы различаются
устойчивостью к механической деформации, из-за которой могут
перемещаться отдельные слои кристаллической структуры.
В атомной может происходить деформация из-за разрыва
химических связей; в ионной – из-за отталкивания одноименно
заряженных ионов; в металлической – кристаллы не
разрушаются, а деформируются (т.е. просто перемещаются).
11.
12.
13.
Домашнее задание:параграф 16 №5, №7.










 Химия
Химия








