Похожие презентации:
Инструментальные методы исследования органических веществ
1.
Федоров Сергей ВладимировичИнструментальные методы
исследования органических
веществ
2.
Спектроскопические методы3.
Инструментальныеметоды анализа
Спектроскопия – наука о спектрах электромагнитного
излучения, т.е. изучение спектров различных видов излучения.
Методы спектроскопии используют для исследования
энергетической
структуры атомов, молекул и
макроскопических тел, образованных из них.
К преимуществам спектроскопии относится возможность
диагностики in situ, то есть непосредственно в «среде
обитания» объекта, бесконтактно, дистанционно, без какойлибо специальной подготовки объекта.
4.
Инструментальныеметоды анализа
Задачи спектроскопии:
Прямая задача спектроскопии – предсказание вида спектра
вещества исходя из знаний о его строении, составе и прочего.
Обратная задача спектроскопии – определение характеристик
(строение, химические свойства и т.п.) органического вещества
по его спектрам.
5.
Инструментальныеметоды анализа
Разным веществам соответствуют разные спектры, что
позволяет использовать спектроскопические методы для
определения состава и строения вещества.
В основе спектральных методов лежит взаимодействие
падающего излучения, потока частиц или поля с веществом
и измерение результата этого взаимодействия.
Каждое вещество поглощает электромагнитное излучение,
колебания и длина волны которого имеют строго
определенные значения.
6.
Инструментальныеметоды анализа
Электромагнитное излучение – распространяющееся в
пространстве
возмущение
(изменение
состояния)
электромагнитного поля.
Электромагнитное поле – это силовое поле, образованное
вокруг электрического тока, эквивалентное электрическому
полю и магнитному полю, расположенным под прямыми углами
друг к другу.
Принято относить к излучению ту часть переменных
электромагнитных полей, которая способна распространяться
наиболее далеко от своих источников – движущихся зарядов,
затухая наиболее медленно с расстоянием.
7.
Электромагнитное излучение1020
1016
7,5х1014
4,3х1014
1011 109
(см-1) 1010
106
2,5х104
1,3х104
10 0,1
10-3
10
380
780
106 108
Е (эВ) 106
102
3,3
1,6
10-3 10-5
(с-1)
(нм)
8.
Электромагнитное излучениеЭлектромагнитная волна – это процесс
электромагнитного поля в пространстве.
С увеличением частоты
излучения, возрастает его
энергия
время
Е = hn
распространения
амплитуда
n
ча
ст
от
а
l
длина волны
h – постоянная Планка, с – скорость света
с = ln
С увеличением частоты
излучения, длина волны
уменьшается
С увеличением длины
волны излучения, его
энергия падает
9.
Электромагнитное излучениеХарактеристики электромагнитной волны
Длина волны (l):
Å(ангстрем)
мкм (микрометр)
нм (нанометр)
-
1Å = 10-10м
1мкм = 10-6 м = 104Å
1нм = 10-9м = 10Å
Частота (n):
Гц (герц)
см-1 (волновое число; равно величине, обратной длине волны,
измеренной в сантиметрах, т.е., числу волн, укладывающихся в 1 см)
Энергия (Е):
эВ (электроновольт)
кал (калория)
Дж (Джоуль)
-
1 эВ = 1,602·10−19 Дж
1 кал = 4,1868 Дж
1 Дж ≈ 0,239 кал.
10.
Электромагнитное излучениеСопоставимость характеристик электромагнитного излучения
С увеличением частоты
излучения, длина
волны уменьшается
Тип
излучения
Длина
волны (м)
радиоволновое
инфракрасное
микроволновое
103
ультрафиолетовое
видимое
10-2
10-5
0,5х10-6
гамма-излучение
рентгеновское
10-8
10-10
10-12
кончик иглы простейшие
молекул
а
атом
ядро атома
1012
1016
Размер длины
волны
здание
человек
бабочк
а
Частота
(Гц)
104
108
1015
1018
1020
11.
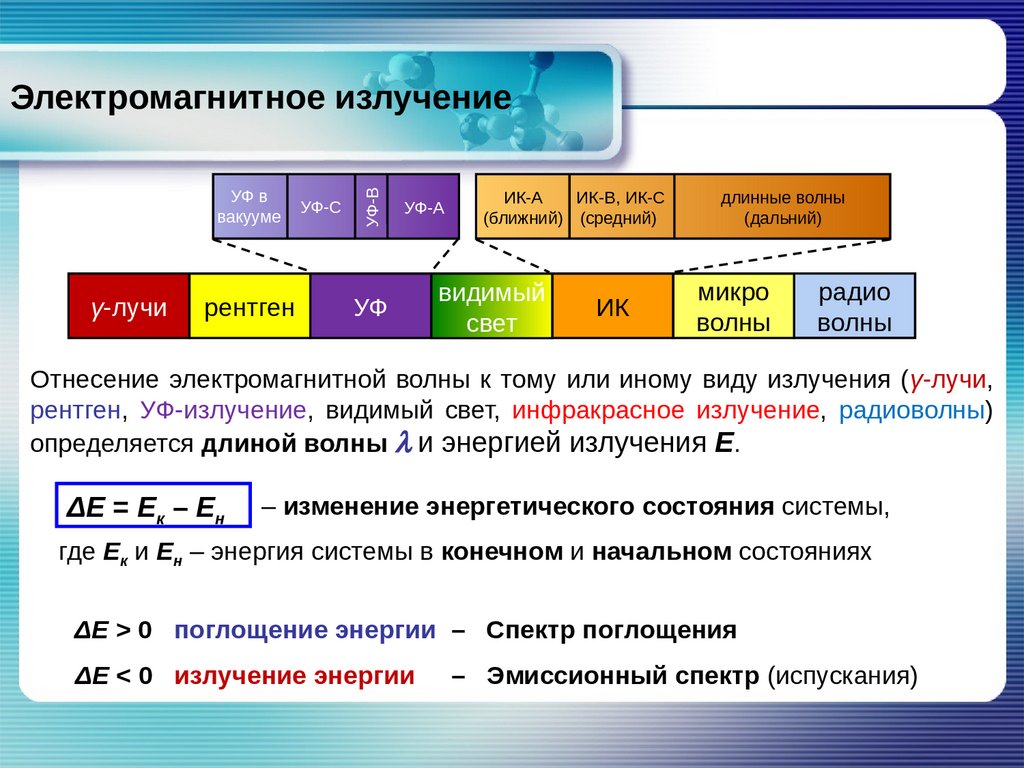
Электромагнитное излучениеγ-лучи
Ближний УФ
УФ-С
УФ-А
380–200 нм
рентген
УФ
УФ-В
УФ в
вакууме
видимый
свет
ИК
микро
волны
Области применения УФ-излучения:
• медицина;
• пищевая промышленность;
• промышленность;
• наука.
радио
волны
12.
УФ ввакууме
γ-лучи
УФ-С
рентген
УФ-В
Электромагнитное излучение
УФ
УФ-А
ИК-А
ИК-В, ИК-С
(ближний) (средний)
видимый
свет
ИК
длинные волны
(дальний)
микро
волны
Области применения ИК-излучения:
военная промышленность;
астрономия;
медицина;
пищевая промышленность;
промышленность;
электроника;
наука.
радио
волны
13.
Электромагнитное излучениеОсновной цвет
Красный
Оранжевый
Желтый
Зеленый
Голубой
Синий
Фиолетовый
l, нм
650-760
600-650
560-600
490-560
450-490
420-450
400
14.
УФ ввакууме
γ-лучи
рентген
УФ-С
УФ-В
Электромагнитное излучение
УФ-А
УФ
ИК-А
ИК-В, ИК-С
(ближний) (средний)
видимый
свет
ИК
длинные волны
(дальний)
микро
волны
радио
волны
Отнесение электромагнитной волны к тому или иному виду излучения (γ-лучи,
рентген, УФ-излучение, видимый свет, инфракрасное излучение, радиоволны)
определяется длиной волны l и энергией излучения Е.
ΔЕ = Ек – Ен
– изменение энергетического состояния системы,
где Ек и Ен – энергия системы в конечном и начальном состояниях
ΔЕ > 0 поглощение энергии – Спектр поглощения
ΔЕ < 0 излучение энергии
– Эмиссионный спектр (испускания)
15.
Электромагнитный спектр/ Спектр поглощения водорода
/ Спектр испускания водорода
16.
СпектроскопияПроцессы, происходящие с органическим веществом при
поглощении или излучении энергии
радио
волны
10 см;
> 10-6 эВ
Изменение энергетического состояния спинов ядер и
электронов (спектроскопия ЯМР и ЭПР)
микро
волны
10-1 – 10 см;
~ 10-3 эВ
Колебание атомов в кристаллической решетке;
изменение вращательного энергетического состояния
ИК
10-4 - 10-2см;
~ 10-1 эВ
Колебание атомов в молекуле (ИК-спектроскопия)
видимый свет
Изменение энергетического состояния
электронов (электронная спектроскопия)
УФ
10-6- 10-4см;
~ 10 эВ
рентген
10-8- 10-6 см;
~ 105 эВ
γ-лучи
10-11- 10-8 см; Изменения
в энергетическом
7
~ 10 эв
(спектроскопия γ-резонанса)
внешних
Изменения в энергетическом состоянии внутренних
электронов атомов (рентгеноспектроскопия)
состоянии
ядер
17.
Электромагнитный спектрСпектр (от лат. spectrum «видение») – термин ввел Исаак
Ньютон в 1671-72 годах.
Электромагнитный спектр – совокупность всех диапазонов
частот
электромагнитного
излучения
(распределение
интенсивности электромагнитного излучения по частотам или
по длинам волн).
18.
Виды спектров• Линейчатый
• Непрерывный
• Полосатый
19.
Виды спектровСпектры
испускания
Спектры
поглощения
20.
Виды спектров21.
Виды спектровУФ
ИК
ЯМР
Масс
22.
Инструментальныеметоды анализа
Фотон (от др.-греч. photos, «свет») – элементарная частица, квант
электромагнитного излучения и переносчик электромагнитного
взаимодействия.
Электрический заряд фотона равен нулю.
Фотон не имеет массы и способен существовать в вакууме только
двигаясь со скоростью света, и обладает энергией Е = hn.
В зависимости от частоты излучения (длины волны) в веществе
фотон распространяется с разной скоростью.
Фотоны могут быть поглощены атомами, молекулами или ядрами
атомов, спровоцировав таким образом переходы между их
энергетическими состояниями.
23.
Инструментальныеметоды анализа
Перед эмиссией
Возбужденный
уровень
hu
После эмиссии
Е2
DЕ
ЭМИ
Основной
уровень
Эмиссия
Энергетический уровень – собственные
значения энергии квантовых систем,
hu
состоящих из микрочастиц (электронов,
протонов, фотонов и других элементарных
частиц)
и
подчиняющихся
законам
квантовой механики.
hu
Е
Атом в
возбужденном
состоянии
Е1
Атом в основном
состоянии
Е2 – Е1 = DЕ = hu
Атом в основном
состоянии
24.
Инструментальныеметоды анализа
Спектроскопические методы:
УФ-спектроскопия
ИК-спектроскопия
Оптические
ЯМР-спектроскопия
Масс-спектрометрия
Оптическая спектроскопия – спектроскопия в оптическом
(видимом) диапазоне длин волн с примыкающими к нему
ультрафиолетовым и инфракрасным диапазонами.
25.
Пропускание, (%)Оптическая плотность
Инструментальные
методы анализа
Длина волны, нм
Частота, см-1
В
оптических
спектроскопических
методах
измеряют
зависимость интенсивности излучения I, прошедшее через
вещество или рассеянное веществом, от длины волны l (УФ)
или частоты (ИК), т.е. определяют функцию I(l) или I(
).
26.
Оптическая спектроскопия – УФ(часть 1)
27.
УФ спектроскопияИстория
В 1801 году
немецкий
физик Иоганн
Вильгельм Риттер начал поиски излучения с
противоположного конца видимого спектра, с
длинами волн короче, чем у излучения
фиолетового цвета.
Ученые, пришли к соглашению, что свет состоит
из
трех
отдельных
компонентов:
окислительного
или
теплового
(инфракрасного) компонента, осветительного
компонента
(видимого
света),
и
восстановительного
(ультрафиолетового)
компонента.
28.
УФ спектроскопияИсточники УФ-излучения
Основной
естественный
источник
УФ-излучения
Земле – Солнце.
Искусственные источники УФ-излучения:
Лампа
• Эритемные лампы
• Ртутно-кварцевые лампы
• Люминесцентные лампы
• Эксилампы
Светодиод
Лазер
на
29.
УФ спектроскопияИстория
В начале 1940-х годов вышла серия статей
Роберта Бёрнса Вудворда, описывающая
применение УФ-спектроскопии в объяснении
структуры природных продуктов.
Вудворд собрал большое количество
эмпирических данных и разработал ряд
правил, позднее названных «правилами
Вудворда», которые могли применяться
для выяснения структур как природных
веществ, так и синтезированных молекул.
30.
УФ спектроскопияγ-лучи
рентген
видимый
свет
(электронная)
УФ
радио
микро
волны
волны
спектроскопия
– раздел
ИК
УФ-В
Ультрафиолетовая
оптической спектроскопии, который включает получение,
УФ в
исследование ивакууме
применение
спектров испускания, поглощения
УФ-С
УФ-А
и отражения в ультрафиолетовой области.
В УФ-области поглощают все органические вещества.
Если вещество окрашено, то в его спектре наблюдаются
полосы поглощения в видимой области.
Необходимые для исследования
невелики – около 0,1 мг.
количества
вещества
31.
УФ спектроскопияЗакон Бугера-Ламберта-Бера
L
lg(I0/I) = e L c – закон Бугера-Ламберта-Бера
I0
I21
где e – молярный коэффициент поглощения,
L – толщина (путь), c – концентрация
сс2
T=I/I0 – коэффициент пропускания
А= –lg(T) = –lg(I/I0) – оптическая плотность
I1 > I2 > I3
А = e L c - закон светопропускания
I0
I3
с2
Выполнимость закона Бугера-ЛамбертаБера необходимо всегда проверять перед
началом
экспериментальной
работы
построением калибровочного графика.
32.
УФ спектроскопияЗакон Бугера-Ламберта-Бера
Закон Бугера-Ламберта-Бера строго справедлив
разбавленных растворов и в определенных условиях:
только
для
• постоянство состава и неизменность поглощающих частиц в
растворе
• исследуемые молекулы должны быть диспергированы до
молекулярного уровня, они не должны рассеивать свет и
взаимодействовать друг с другом
• монохроматичность и параллельность проходящего через раствор
лучистого потока небольшой интенсивности
• постоянство температуры
33.
УФ спектроскопияЭлектронная спектроскопия изучает электронные переходы между
валентными молекулярными орбиталями.
Поглощение фотонов УФ диапазона атомами или молекулами,
приводит к переходам между их энергетическими состояниями.
Разность энергий ΔЕ между этими состояниями квантована, поэтому
молекулы поглощают фотоны только строго определенной энергии.
Молекулы в возбужденном состоянии, могут терять избыток энергии:
• Разрыв связи
• Испускание
• Флуоресценция
• Фосфоресценция
• Безизлучательные переходы
34.
УФ спектроскопияОрбиталь – область наиболее вероятного
местонахождения
электрона
в
атоме
(атомная
орбиталь)
или
в
молекуле
(молекулярная орбиталь).
В зависимости от строения,
молекула органического
соединения может содержать
три типа молекулярных
орбиталей:
,,
*,,
,
**,иn.
n.
*,
Электронный переход – переход электрона
с одной молекулярной орбитали на другую.
*
-
hn
+
+
Атом А
Атом В
Молекула АВ
-
35.
УФ спектроскопияТипы молекулярных орбиталей
Связывающие орбитали. Образуются в результате перекрывания
атомных орбиталей двух соседних атомов. На связывающих
- и
орбиталях, соответственно, находятся
-электроны одинарных (C–C, C–
H, C–O, C–N, C–S, C–Hal и др.) и
-электроны кратных связей (С=С,
С=N, C=O, C≡C, C≡N и др.).
Несвязывающие орбитали. Молекулы, содержащие гетероатомы с
неподелёнными электронными парами (O:, N:, S:, Hal: и др.), имеют nорбитали несвязывающих неподелённых пар электронов, существенно
не участвующих в образовании химической связи.
Разрыхляющие орбитали. Связывающим орбиталям соответствуют
разрыхляющие орбитали
* и
*. Электроны на них «разрыхляют»
химическую связь (т.е. способствуют разъединению молекулы).
36.
Типы перекрывания s, p и spn-гибридных АОУФ спектроскопия и образующиеся при этом связывающие и
разрыхляющие МО
+
s
+
+
+
s
+
+
s
s
–
+
s
–
+
p
H2
–
–
+
–
+
+
+
p
p
+
–
+
–
+
–
+
–
p
p
p*
–
+
–
+ –
+
–
+
–
–
+
spn
–
spn
+
–
C–C
+ –
spn
–
+
s
+
–
Br2
s*
spn
+
–
s
+
+
spn
>C=C<
>C≡C<
+
–
p
+
–
p
+
+
–
p
spn
–
–
+
p
s*
–
+
+
+
s*
+
+
+
–
–
s
s
+
C–H
s
–
+
–
s*
, – связывающие,
*,
* – разрыхляющие орбитали; (+) и (−) – знаки волновой функции, • – атомные ядра
37.
УФ спектроскопияЭлектронные переходы
Е
* - МО
* - МО
*
*
n
→
*,
→
*, n→
*, n→
*
Возбужденное
состояние
*
n
*
n - МО
Е
- МО
- МО
Основное
состояние
В результате
поглощения
ультрафиолетового
и видимого излучения
происходит переход
валентного электрона с
занимаемого им уровня
на уровень с более
высокой энергией.
Е=1.8-6.2 эВ
=100-800 нм
38.
УФ спектроскопияЭлектронные переходы – правила отбора
1. По симметрии: разрешены переходы между орбиталями такой симметрии,
которые могут перекрываться в пространстве; если орбитали ортогональны,
то переходы между ними запрещены (например, n→p* в соединениях с
группами C=O, C=S, C=N, NO).
2. По спину: запрещены переходы с изменением спина электрона, т.е. между
состояниями различной мультиплетности (с поворотом электрона).
3. По числу возбужденных электронов: запрещены переходы, при которых
происходит возбуждение более чем одного электрона.
39.
УФ спектроскопияУФ-спектроскопия является одним из распространенных физикохимических методов исследования органических и неорганических
соединений.
Спектрофотометрический анализ может быть проведен для
органических веществ, обладающих определенными особенностями
строения
(ароматические
соединения,
соединения
с
сопряженными кратными связями, соединения ряда металлов и
др.).
Величина поглощенного излучения прямо пропорциональна числу
молекул растворенного вещества и поэтому возрастает с увеличением
концентрации.
Электронные спектры (спектры в ультрафиолетовой и видимой
областях) представляют собой зависимость поглощения излучения от
длины волны излучения.
40.
Оптическая плотностьУФ спектроскопия
l1
lмакс
полоса
поглощения
l2
Длина волны, нм
Область поглощения называется
полосой.
Совокупность
всех
полос
поглощения данной молекулы –
спектр поглощения.
«Рабочая»
область
спектра
составляет интервал 190-730 нм.
В качестве меры поглощения используется оптическая плотность.
Величина поглощения – длина волны света.
Спектр характеризуется: положением максимума полосы поглощения
– lмакс; интенсивностью поглощения; формой линии поглощения.
41.
УФ спектроскопия184
Полоса поглощения – область спектра, в которой имеется
детектируемый сигнал с одним или несколькими максимумами.
204
Тонкая колебательная структура – сложный контур
полосы
бензол
поглощения, возникающий за счет перехода на разные уровни одного и
того же электронного состояния.
Хромофор – структурная группа в органическом соединении, которая
255
обуславливает избирательное поглощение света в электронном
спектре. Обычно это группы C=C, C≡C, C=O, N=N, N=O, NO2,
ароматические системы и т.д.
Ауксохром – насыщенная группа в органическом соединении,
присоединение которой к хромофору изменяет положение и
интенсивность полосы поглощения последнего в спектре. Типичные
группы: –Alk, –SH, –NH2, –OH, –Hal
42.
УФ спектроскопияОсновные хромофорные группы
Тип перехода
max
нитрилы
n→π*
160
алкины
π→π*
170
алкены
π→π*
175
спирты, простые эфир
n→σ*
180
π→π*
180
n→π*
280
π→π*
190
n→π*
290
амины
n→σ*
190
кислоты, сложные эфиры
n→π*
205
амиды, тиоспирты
n→π*
210
нитросоединения
n→π*
271
азосоединения
n→π*
340
Хромофор
кетоны
альдегиды
43.
УФ спектроскопияКоэффициент поглощения
Изобестическая точка – длина волны l, при которой два
соединения, способные превращаться друг в друга, имеют
одинаковую поглощательную способность.
соединение 1
соединение 2
Оптическая плотность при этой длине
волны не зависит от соотношения
lизобест
концентраций.
Длинна волны, нм
44.
УФ спектроскопияВлияния замены ауксохрома на поглощение хромофора
СНН3
С2Н
СН
NН
O
Н23
5Сl
204
214
235
204
214
235
С=О
292
290
294
295
310
l, нм
45.
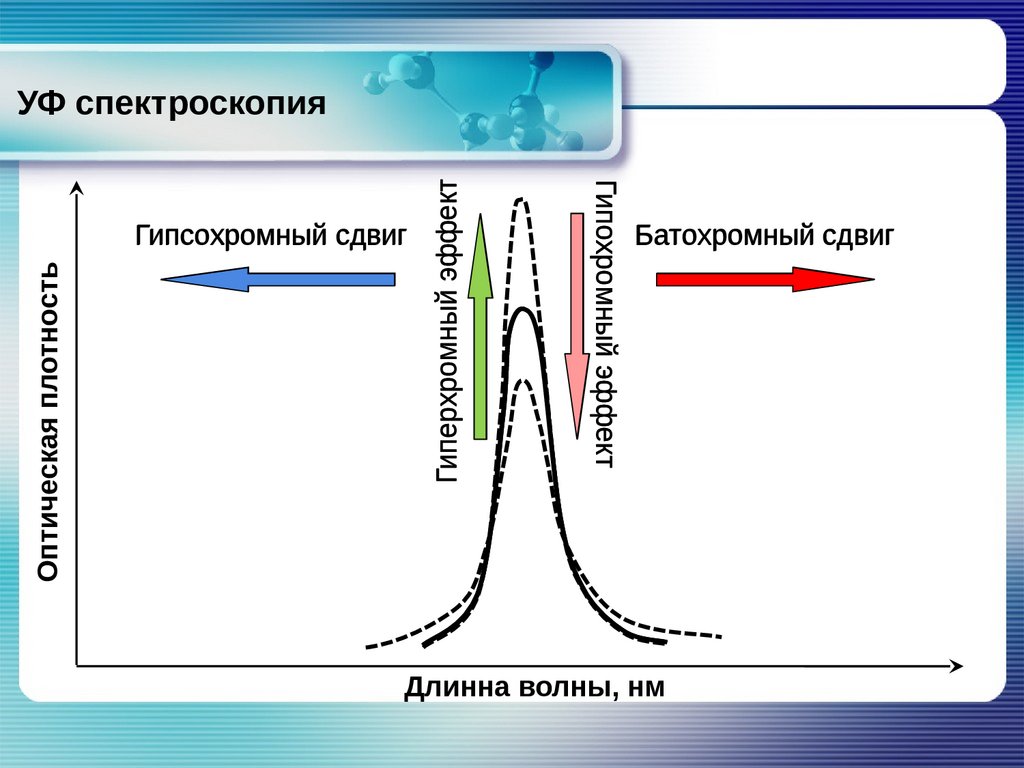
УФ спектроскопияВзаимосвязь электронных спектров и структуры
органических молекул
Гипсохромный сдвиг – смещение полосы поглощения в
коротковолновую область спектра;
Батохромный сдвиг – смещение полосы поглощения в
область длинных волн;
Гиперхромный эффект – увеличение интенсивности полосы
поглощения;
Гипохромный эффект – уменьшение интенсивности полосы
поглощения.
46.
Оптическая плотностьГипохромный эффект
Гипсохромный сдвиг
Гиперхромный эффект
УФ спектроскопия
Батохромный сдвиг
Длинна волны, нм
47.
УФ спектроскопиявода эфир
диэтиловый
метанол
этанол
гексан
Гипсохромный сдвиг полосы
n
p*
при
увеличении
полярности растворителя
305
312
315
326
l, нм
327
Батохромный сдвиг полосы
p
p*
при
увеличении
полярности растворителя
230
237
238
244
l, нм
48.
УФ спектроскопияПрименение УФ-спектроскопии
1. Идентификация
органических
соединений,
хромофорные группировки - доказательство
исследуемом веществе группировок-хромофоров.
содержащих
наличия в
2. Исследование
деталей
строения,
используя
величины
коэффициента молярной экстинкции и длины волны в максимуме
полосы поглощения. Относительное расположение хромофорных
групп у кратных связей влияет на спектры поглощения, что
позволяет различить цис- и транс-изомеры.
3. Количественный анализ, включая контроль за ходом реакций и
определение примесей в образце органического вещества,
исследования процессов комплексообразования.
49.
УФ спектроскопияВ настоящее время для структурного анализа органических соединений
электронная спектроскопия имеет ограниченное применение.
УФ-спектроскопия − широко применяется, как количественный анализ.
Количественное определение вещества проводится на основании спектра, в
котором измеряется интенсивность поглощения света этим веществом при
выбранной длине волны.
При проведении такого количественного анализа длина волны должна
соответствовать следующим требованиям:
• выбранная полоса должна быть по возможности свободна от наложения
полос поглощения других компонентов анализируемой системы.
• выбранная
полоса
должна
обладать
достаточно
высоким
коэффициентом поглощения для индивидуального соединения.
Такие полосы поглощения называются аналитическими.
50.
Инструментальныеметоды анализа
Вопросы к лекции:
1. Что такое спектроскопия, виды электромагнитного излучения?
2. Характеристики электромагнитной волны, единицы их измерения?
3. Виды спектров, их классификация?
4. Понятия фотона и энергетических состояний?
5. Что такое УФ-спектроскопия?
6. Закон светопоглощения?
7. Что такое молекулярные орбитали; типы молекулярных орбиталей?
8. Виды электронных переходов?
9. Основные характеристики УФ-спектра?
10. Основные понятия УФ-спектроскопии?
11. Применение УФ-спектроскопии?
51.
Федоров Сергей ВладимировичИнструментальные методы
исследования органических
веществ

















































 Физика
Физика








