Похожие презентации:
Technické využití elektrolýzy aneb O článcích, galvanostegii, korozi a jiném
1. Snímka 1
TECHNICKÉ VYUŽITÍELEKTROLÝZY
aneb
O článcích, galvanostegii, korozi a jiném
PaedDr. Jozef Beňuška
jbenuska@nextra.sk
2. Snímka 2
Chemické změny probíhající na elektrodách je možnév praxi využít různým způsobem:
1. galvanické články,
2. elektrometalurgie,
3. galvanostegie,
4. elektrolytický kondenzátor,
5. zábrana před vlhnutím zdiva,
6. koroze, atd.
3. Snímka 3
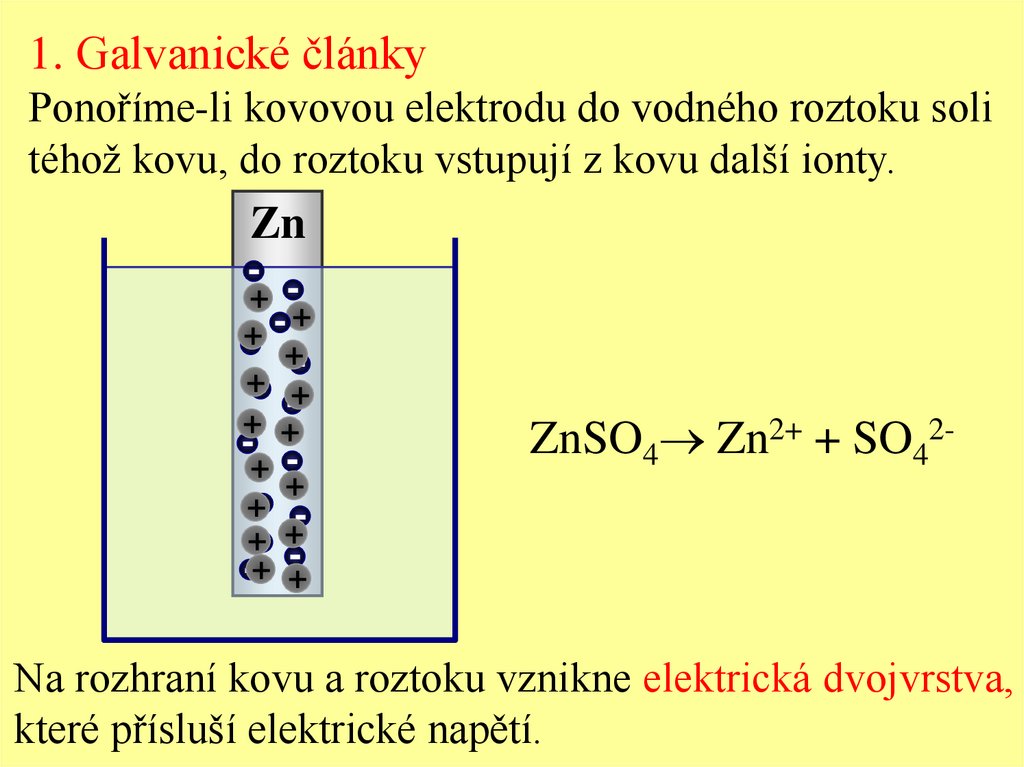
1. Galvanické článkyPonoříme-li kovovou elektrodu do vodného roztoku soli
téhož kovu, do roztoku vstupují z kovu další ionty.
Zn
- +
-+
+
- ++- +
-+ ++
+
+- +- +-+ +
ZnSO4 Zn2+ + SO42-
Na rozhraní kovu a roztoku vznikne elektrická dvojvrstva,
které přísluší elektrické napětí.
4. Snímka 4
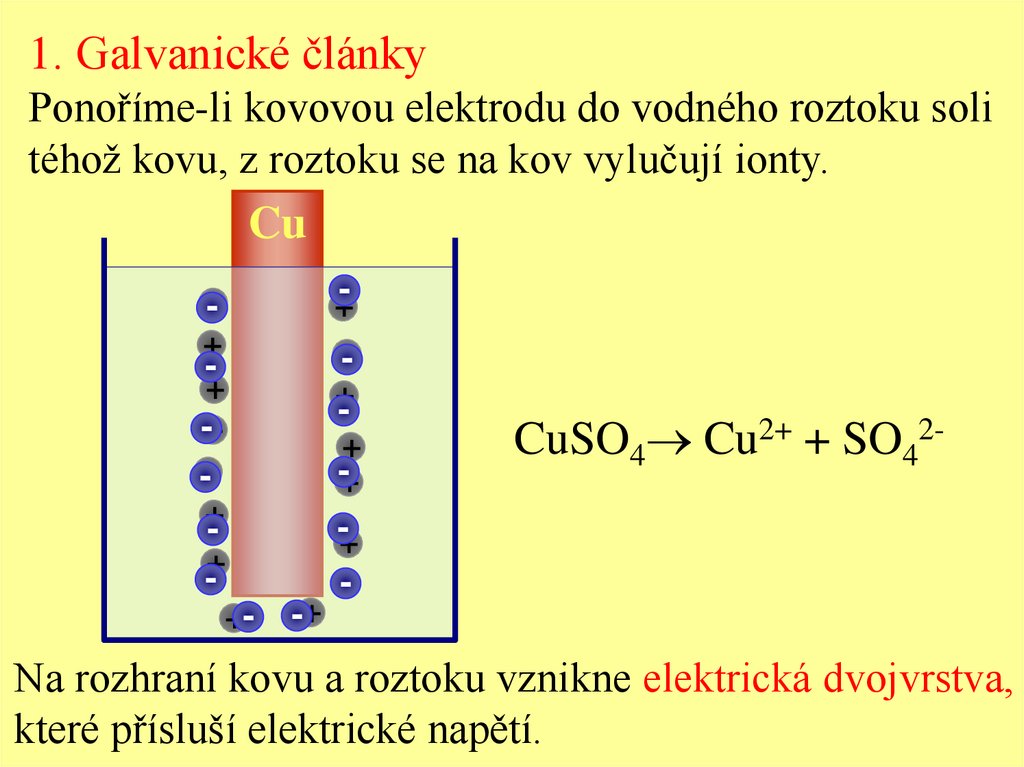
1. Galvanické článkyPonoříme-li kovovou elektrodu do vodného roztoku soli
téhož kovu, z roztoku se na kov vylučují ionty.
Cu
++
+
-
+
+
+
-+
-+
+
-+
+-
+
-+
-+
CuSO4 Cu2+ + SO42-
-+
-
Na rozhraní kovu a roztoku vznikne elektrická dvojvrstva,
které přísluší elektrické napětí.
5. Snímka 5
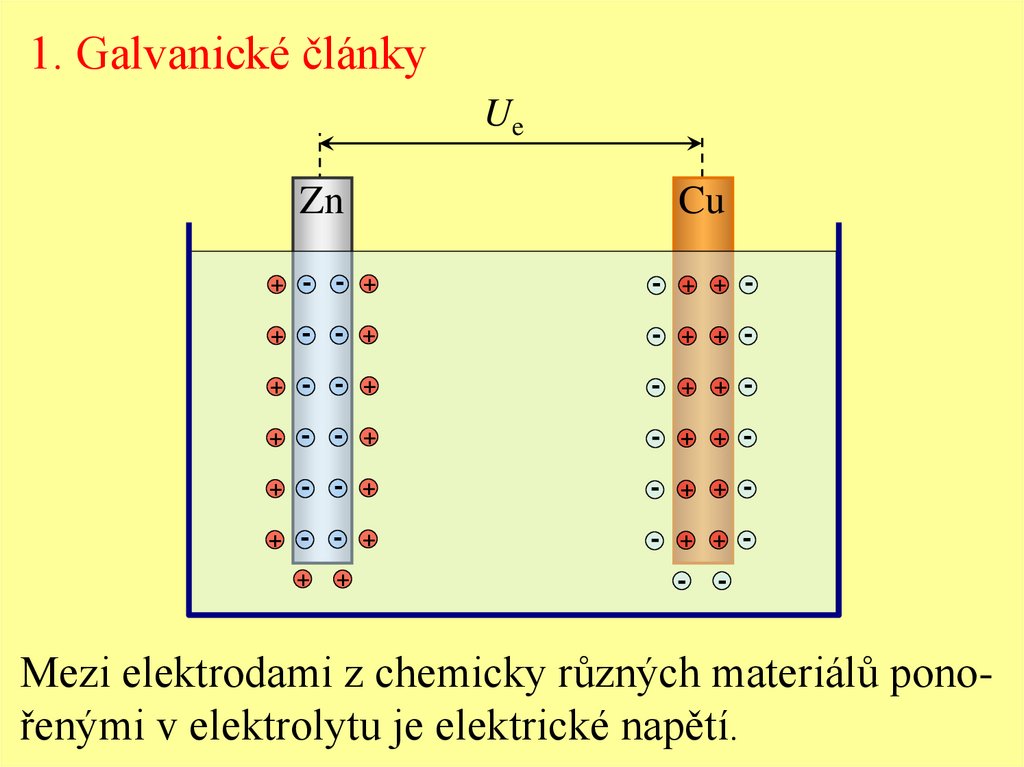
1. Galvanické článkyUe
Zn
Cu
+
- - +
-
+ +
-
+
- - +
-
+ +
-
+
- - +
-
+ +
-
+
- - +
-
+ +
-
+
- - +
-
+ +
-
+
- - +
-
+ +
-
+
+
-
-
Mezi elektrodami z chemicky různých materiálů ponořenými v elektrolytu je elektrické napětí.
6. Snímka 6
1. Galvanické článkyGalvanický článek
- je zdroj stejnosměrného napětí, který se skládá
z elektrolytu a dvou chemicky různých elektrod.
7. Snímka 7
Stahy svalstva při dotekudvěma různými kovy
Luigi Galvani (1737-1798), italský lékař a přírodovědec
8. Snímka 8
1. Galvanické články - Daniellův článekUe ÷ 1,1V
Zn
-
vodný roztok
ZnSO4
Cu
+
vodný roztok
CuSO4
9. Snímka 9
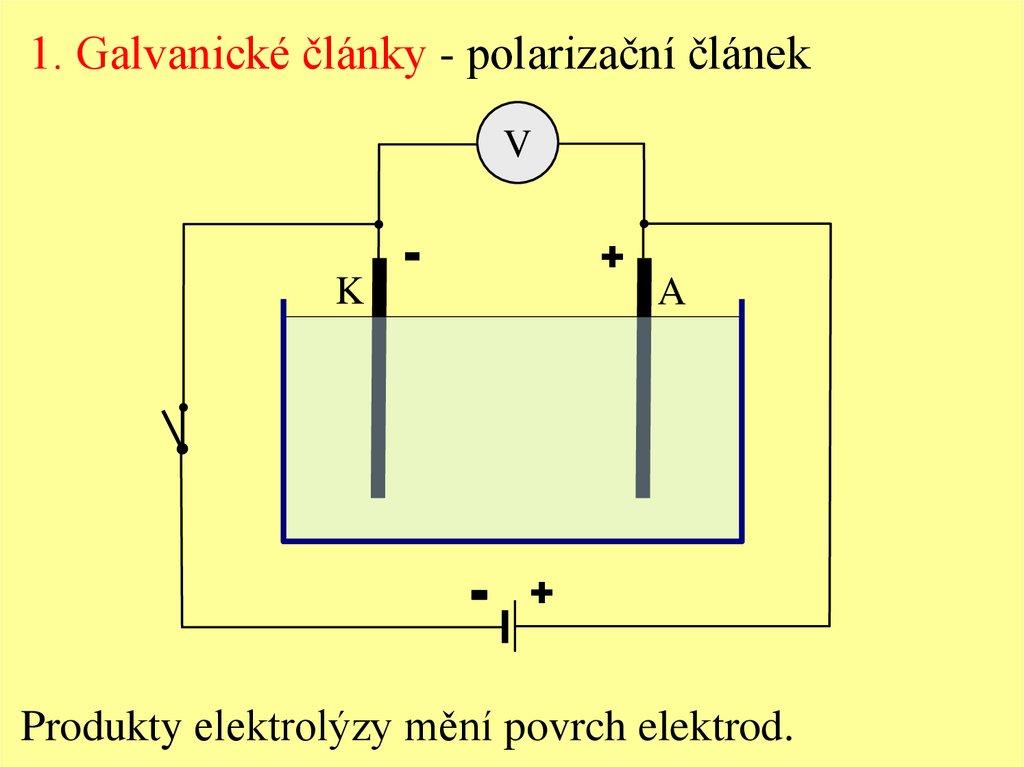
1. Galvanické články - polarizační článekV
K
-
+
-
A
+
Produkty elektrolýzy mění povrch elektrod.
10. Snímka 10
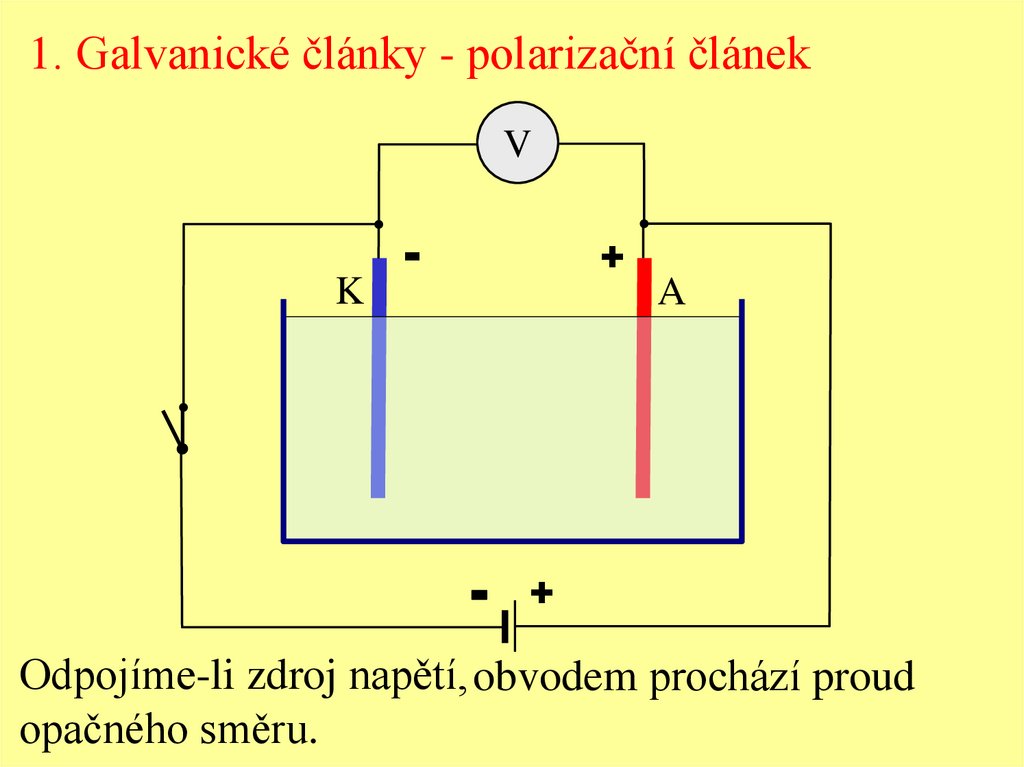
1. Galvanické články - polarizační článekV
K
-
+
-
A
+
Odpojíme-li zdroj napětí, obvodem prochází proud
opačného směru.
11. Snímka 11
1. Galvanické články - polarizační článekElektrody se při elektrolýze polarizují.
Elektromotorické napětí vzniklé polarizací elektrod,
tzv. polarizační napětí, má opačnou polaritu než napětí
zdroje původně zapojeného na elektrody.
Horní hranice polarizačního napětí je rozkladné napětí.
12. Snímka 12
1. Galvanické články - polarizační článekVoltův článek (Ue= 1V):
- Zn (H SO +H O) Cu+
2
4
2
Elektrolýzou vzniká polarizační článek s
elektromotorickým napětím opačné polarity.
+Zn (H SO +H O) H 2
4
2
2
13. Snímka 13
Sestrojil první zdroj dlouhotrvajícího elektrického prouduAllesandro Volta (1745-1827), italský fyzik
14. Snímka 14
1. Galvanické články - suchý článekLeclancheův článek (Ue= 1,5 V):
Složení:
- uhlíková tyčka s mosaznou čepičkou,
- salmiak (NH4Cl) zahuštěný škrobovým mazem,
- zinková nádoba tvaru válečku.
15. Snímka 15
1. Galvanické články - suchý článekPlochá baterie
- tři suché články spojeny za sebou.
16. Snímka 16
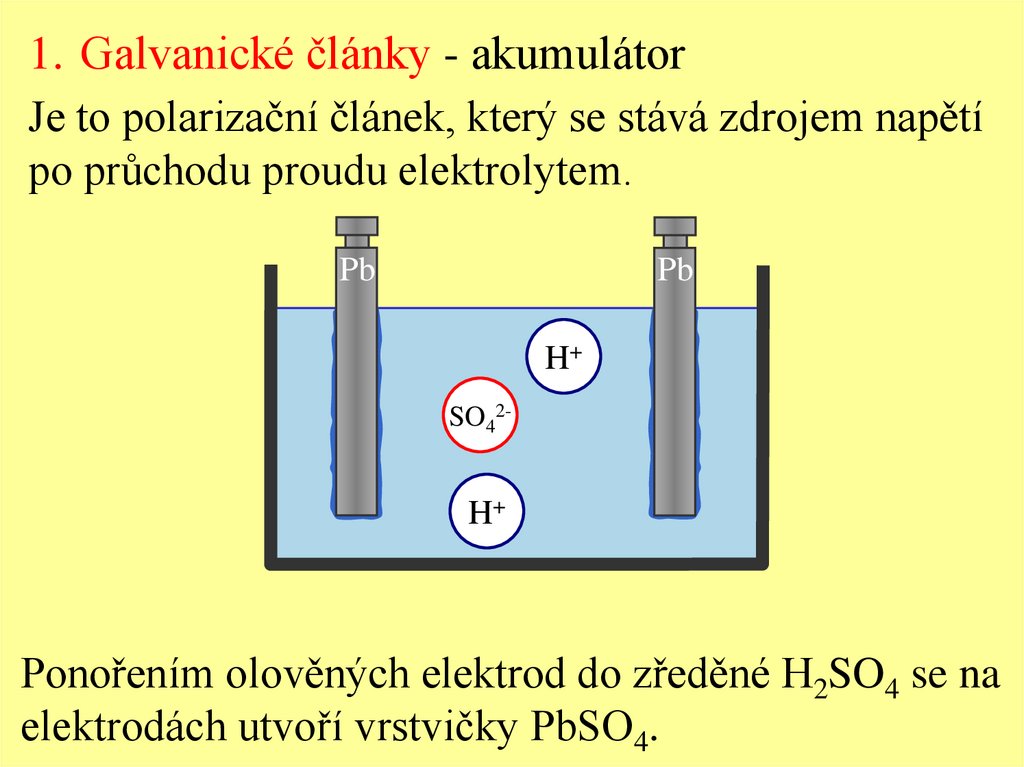
1. Galvanické články - akumulátorJe to polarizační článek, který se stává zdrojem napětí
po průchodu proudu elektrolytem.
Pb
Pb
H+
SO42-
H+
Ponořením olověných elektrod do zředěné H2SO4 se na
elektrodách utvoří vrstvičky PbSO4.
17. Snímka 17
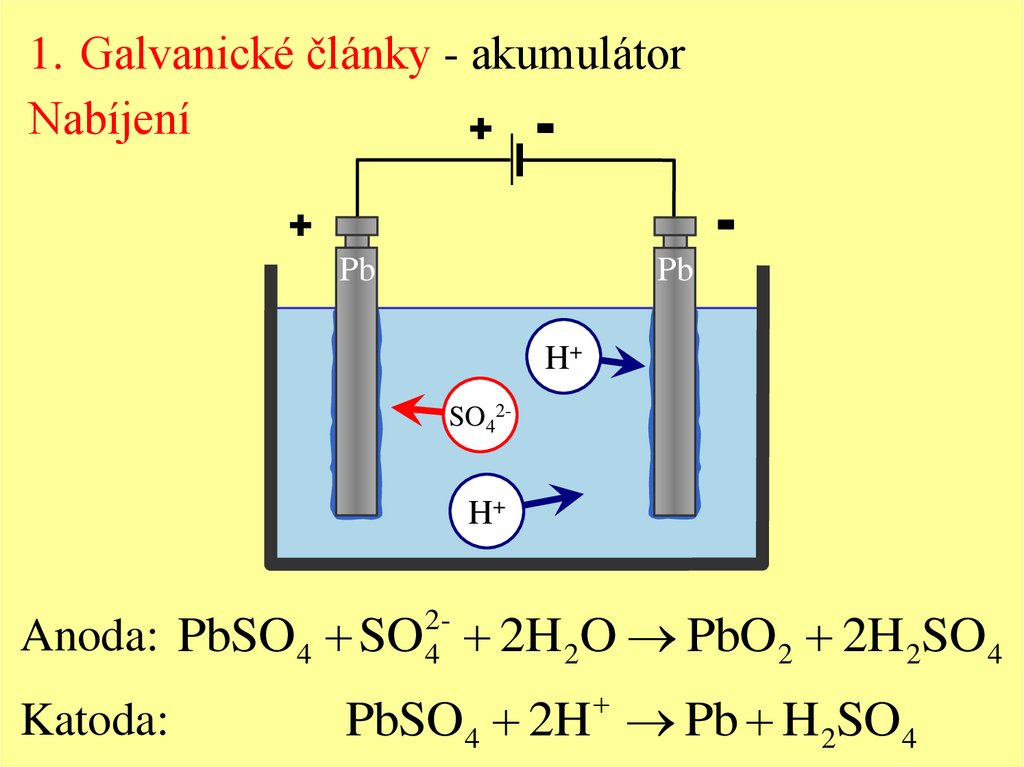
1. Galvanické články - akumulátorNabíjení
+ -
-
+
Pb
Pb
H+
SO42-
H+
Anoda: PbSO 4 SO 2H 2O PbO 2 2H 2SO4
24
Katoda:
PbSO4 2H Pb H 2SO4
18. Snímka 18
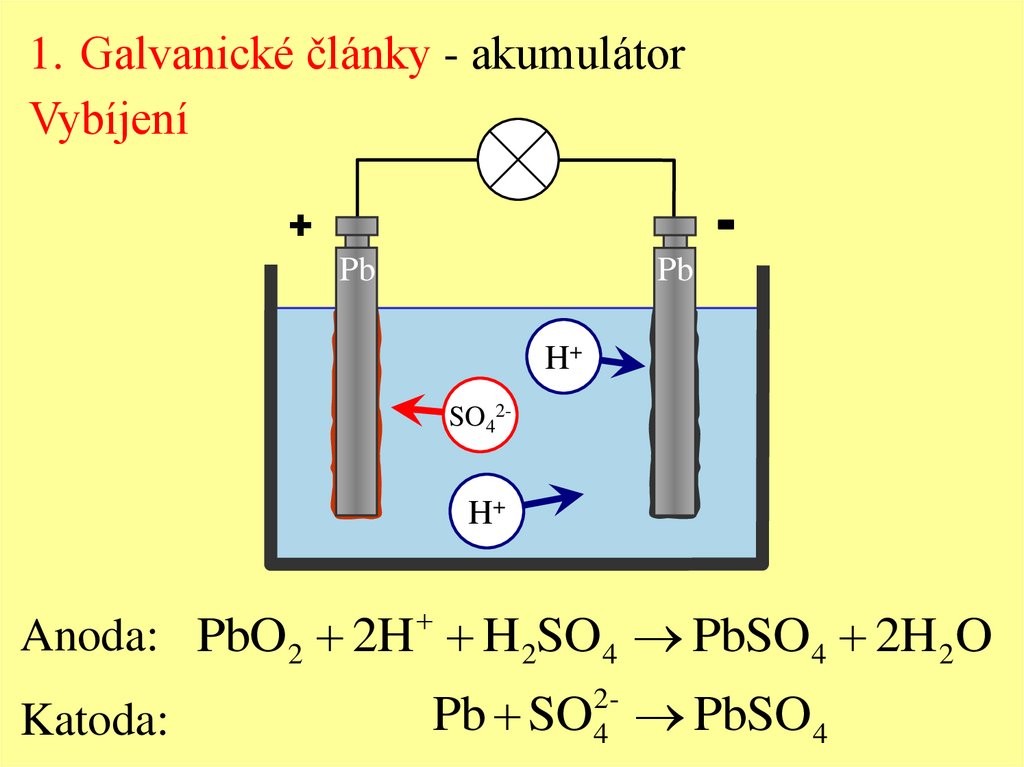
1. Galvanické články - akumulátorVybíjení
-
+
Pb
Pb
H+
SO42-
H+
Anoda: PbO2 2H H 2SO4 PbSO4 2H 2O
Katoda:
Pb SO PbSO4
24
19. Snímka 19
1. Galvanické články - akumulátorová baterieAkumulátorová baterie - jsou akumulátory spojeny
za sebou.
55 A.h
Kapacita akumulátoru - celkový náboj Q (A.h), který
akumulátor může vydat při vybíjení .
20. Snímka 20
2. ElektrometalurgieJe odbor zabývající se získáváním kovů z roztoků
+
+
-
-
-
-
-
-
-
-
-
-
-
-
+
+
+
Vana z uhlíku naplněna směsí bauxitu a kryolitu. Průchodem proudu se směs taví a na dně se usazuje čistý hliník.
21. Snímka 21
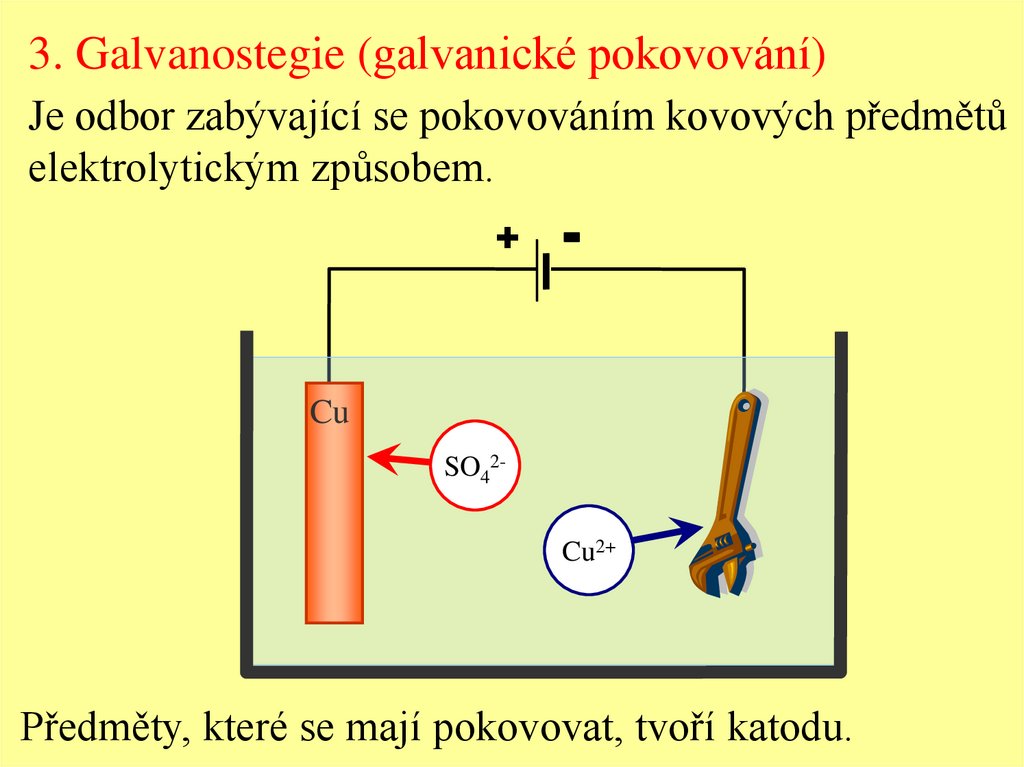
3. Galvanostegie (galvanické pokovování)Je odbor zabývající se pokovováním kovových předmětů
elektrolytickým způsobem.
+
-
Cu
SO42Cu2+
Předměty, které se mají pokovovat, tvoří katodu.
22. Snímka 22
3. Galvanostegie (galvanické pokovování)23. Snímka 23
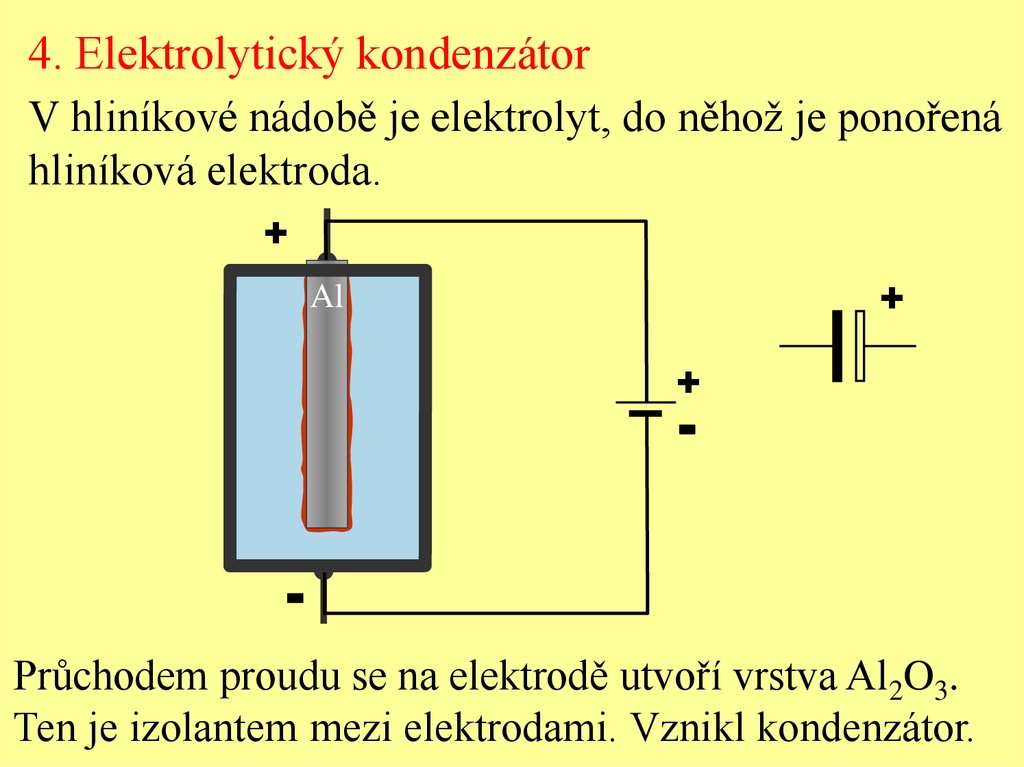
4. Elektrolytický kondenzátorV hliníkové nádobě je elektrolyt, do něhož je ponořená
hliníková elektroda.
+
+
Al
+
-
Průchodem proudu se na elektrodě utvoří vrstva Al2O3.
Ten je izolantem mezi elektrodami. Vznikl kondenzátor.
24. Snímka 24
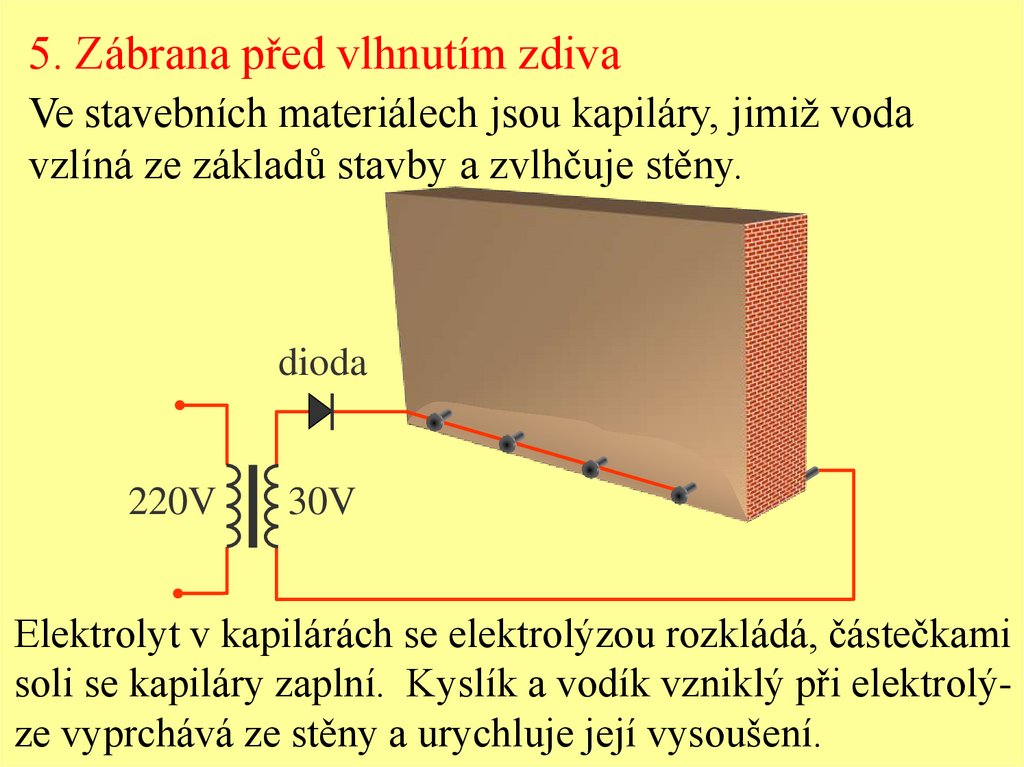
5. Zábrana před vlhnutím zdivaVe stavebních materiálech jsou kapiláry, jimiž voda
vzlíná ze základů stavby a zvlhčuje stěny.
dioda
220V
30V
Elektrolyt v kapilárách se elektrolýzou rozkládá, částečkami
soli se kapiláry zaplní. Kyslík a vodík vzniklý při elektrolýze vyprchává ze stěny a urychluje její vysoušení.
25. Snímka 25
6. KorozePorušení povrchu kovu chemickým nebo elektrochemickým působením.
Nejčastějším typem koroze je oxidace kovů účinkem
vzdušného kyslíku a vlhkostí vzduchu.
Kov, který tvoří anodu se naleptává.














 Физика
Физика Химия
Химия








