Похожие презентации:
Материальные и тепловые эффекты горения топлива (лекция 3)
1.
МИНИСТЕРСТВО НАУКИ И ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИРГУ им. А. Н. Косыгина
Кафедра ЭТПЭБ
Лекция 3.
Материальные и тепловые эффекты
горения топлива
Акатьев В.А.
лауреат премии Правительства РФ
в области науки и техники
1
2.
Учебные вопросы1. Стехиометрия горения
2. Теплофизика горения
3. Объемы воздуха и продуктов сгорания
2
3.
1. Стехиометрия горенияСтехиометрия – часть химии, изучающая законы количественных
соотношений между реагирующими веществами.
В большинстве случаев в основе горения лежат реакции
соединения горючих веществ с кислородом воздуха и только в
отдельных случаях, когда горят взрывчатые вещества,
пиротехнические изделия и другие материалы с положительным
кислородным балансом, горение происходит за счет кислорода,
содержащегося в молекуле горючего вещества или кислорода
окислителя.
3
4.
Горение в атмосфере воздухаВещество
Объемный процент
Массовый процент
Кислород
21
23
Азот
79
77
Уравнение реакции горения вещества в воздухе составляют с учетом того,
что на каждый киломоль кислорода приходится по 3,76 киломолей азота.
Например, реакции горения спирта, метана и водорода запишутся в виде
следующих уравнений:
C2 H 5OH 3O2 3 3,76 N 2 2CO2 3H 2O 3 3,76 N 2
CH 4 2O2 2 3,76 N 2 CO2 2 H 2O 2 3,76 N 2
2 H 2 O2 3,76 N 2 2 H 2O 3,76 N 2
4
5.
0Vв
Стехиометрия горения топлива
.
Азот в уравнениях химических реакций горения учитывается потому, что
он поглощает часть теплоты, выделяемой в результате реакций горения, и
входит в состав продуктов сгорания – дымовых газов.
По уравнениям химических реакций горения рассчитывается количество
воздуха, необходимого для полного сгорания единицы массы или единицы
объема горючего вещества, а также состав и количество продуктов сгорания.
Минимальное количество воздуха, необходимое для полного сгорания
единицы массы (кг) или объема (м3) горючего вещества, называется
Так, для индивидуального вещества:
теоретически необходимым и обозначается
4,76 O
V
Z
O
B
О – количество киломолей кислорода;
Z – количество киломолей горючего газа;
4,76 – количество кмолей воздуха в расчете на кмоль кислорода
5
6.
Теоретически необходимый объем воздухаТеоретически необходимый объем воздуха на горение веществ,
представляющих смесь химических соединений (древесина, торф,
нефть, газы и др.), определяется по следующим формулам:
– для сгорания 1 кг жидких и твердых веществ:
V =0,269(С/З+Н+S/8–О/8),
С, Н, S, О – процентное содержание соответствующего элемента в
веществе по массе
0
в
6
7.
Расчет теоретически необх. объема воздуха для горения водородаРешение. Составляем уравнение реакции горения водорода в воздухе:
2Н2+О2+3,76N2=2Н2О+3,76N2.
Согласно уравнению на горение двух молей водорода необходимо 4,76 молей
воздуха, следовательно:
, м3 воздуха/м3 водорода
7
8.
Теоретически необходимый объем воздухаФормула для смеси газов, состоящей из метана, водорода,
оксида углерода, сероводорода и кислорода может быть
представлена с учетом значений коэффициентов Кi:
Vво = (2СН4+0,5Н2+0,5Н2S–О2) / 21, м3 воздуха/м3 смеси
газов,
где СН4, Н2, СО, Н2S, О2 – процентное содержание
соответствующего газа в смеси газов;
Ki=2; 0,5; 0,5; 1 – коэффициенты при формулах газов –
количество молей кислорода на 1 моль соответствующего
газа.
8
9.
Теоретически необходимый объем воздухана горение веществ, представляющих смесь химических соединений
(древесина, торф, нефть, газ и др.), определяется по следующим формулам:
– для сгорания 1 кг жидких и твердых веществ:
0
Vв =0,269(С/З+Н+S/8–О/8), м3 воздуха/кг горючего,
где С, Н, S, О – процентное содержание соответствующего элемента в
веществе по массе;
К iГi
0
– для сгорании 1 м3 смеси газов: Vв
м3 воздуха/м3 смеси газов
21
где Кi – количество молей кислорода, расходуемых на 1 моль i–го газа;
Гi – процентное содержание i–го газа в смеси газов, % об.
9
10.
для сгорании смеси газов:КГ
V
0
в
i
21
i
Кi – количество киломолей кислорода, расходуемых на 1
киломоль i–го газа;
Гi – процентное содержание i–го газа в смеси газов, % об.
Формула для смеси газов, состоящей из метана, водорода, оксида
углерода, сероводорода и кислорода может быть представлена с учетом
значений коэффициентов Кi:
КГ
= (2СН4+0,5Н2+0,5Н2S–О2) / 21,
V
0
в
i
i
21
СН4, Н2, СО, Н2S, О2 – процентное содержание соответствующего газа в смеси
газов; 2; 0,5; 0,5. Коэффициенты при формулах газов – количество кмолей
кислорода на 1 кмоль соответствующего газа.
10
11.
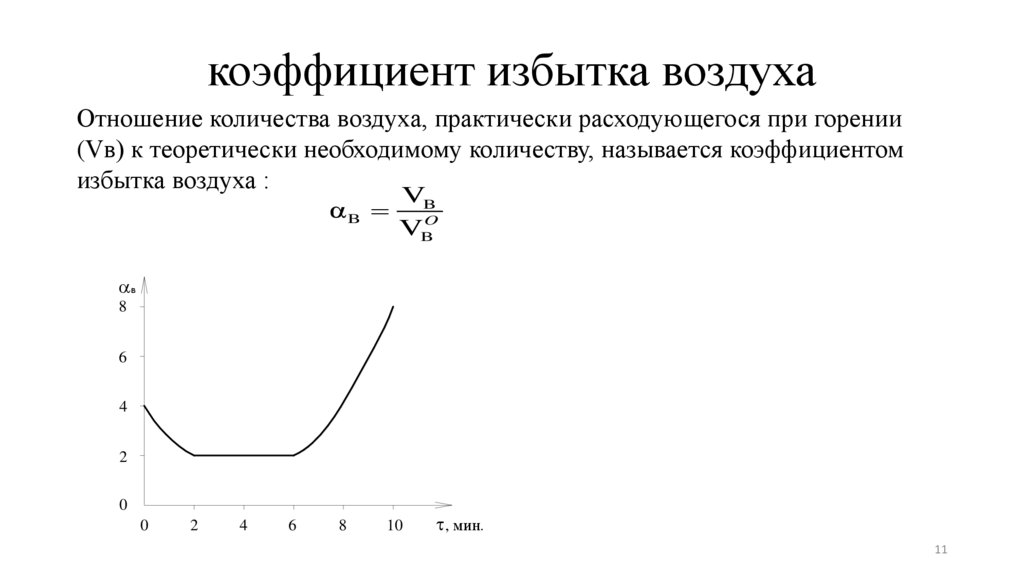
коэффициент избытка воздухаОтношение количества воздуха, практически расходующегося при горении
(Vв) к теоретически необходимому количеству, называется коэффициентом
избытка воздуха :
VB
αB O
VB
в
8
6
4
2
0
0
2
4
6
8
10
, мин.
11
12.
Теплота сгорания топливаПод удельной теплотой сгорания понимают количество теплоты, выделяющейся при сгорании единицы массы
или единицы объема вещества.
Различают высшую и низшую удельную теплоту сгорания. Высшая удельная теплота сгорания (Qв) представляет
собой количество теплоты, выделяющейся при полном сгорании единицы массы (объема) вещества с образованием
воды в жидкой фазе. Низшая удельная теплота сгорания (Qн) – количество теплоты, выделяющейся при сгорании
единицы массы (объема) вещества с образованием воды в парообразном состоянии.
При расчетах количества теплоты, выделяющейся при пожарах, исходят из низшей теплоты сгорания. Высшая и
низшая удельные теплоты сгорания связаны соотношением:
Qн=Qв – 25,1(9Н+W), кДж/кг,
где 25,1(9Н+W) – теплота, затраченная на испарение влаги W вещества и воды, образующейся при сгорании
водорода H горючего вещества, кДж/кг.
12
13.
Оценка теплоты сгорания (по формулам Д. И. Менделеева)Qв=339,4С+1257Н – 108,9 (О – S), кДж/кг;
Qн=339,4С+1257Н – 108,9 (О – S) – 25,1 (9Н+W), кДж/кг,
где C, H, W, S – содержание углерода, водорода, влаги и серы в рабочей массе горючего вещества, %;
О – суммарное содержание кислорода и азота в рабочей массе горючего вещества, %.
Пример. Определить низшую удельную теплоту сгорания Qн мазута, имеющего состав:
С – 82,5 %, Н – 10,65 %, S – 3,1 %, (О – N) – 0,5 %, А (зола) – 25 %, W – 3 %.
Решение. Используя формулу Д. И. Менделеева, получим:
Qн=339,4 82,5 + 257 10,65 – 108,9(0,5 – 3,1) – 25,1(9 10,65 + 3)=38622,7 кДж/кг.
Низшая удельная теплота сгорания 1 м3 сухих газов может быть определена по формуле:
Qн=126,5СО+107,7Н2+358,2СН4+590,8С2Н4+636,9С2Н6+913,4С3Н8+1185,8С4Н10+
+1462,3С5Н12+234,6Н2S, кДж/м3,
где СО, Н2 и т. д. – содержание отдельных компонентов газа в процентах по объему.
13
14.
Условное топливоТеплота сгорания условного топлива принята равной 29,31 МДж/кг
14
15.
Тепловой баланс реакции горенияТепловой баланс внутреннего пожара на любой стадии развития может быть приведен
к единице площади пожара:
Q w M QФ Q1 Q2 Q3 Q4 Q5 Q6
H
P
Q – низшая удельная теплота сгорания вещества, кДж/кг; QФ – энтальпия горючих
H
P
веществ и воздуха, поступающих на горение в единицу времени на 1 м2 площади пожара,
кДж/(м2 с); wм – массовая скорость выгорания горючего вещества с 1 м2 горящей
поверхности в единицу времени, кг/(м2 с); Q1– энтальпия продуктов сгорания, уходящих из
зоны горения с 1 м2 площади в единицу времени, кДж/(м2 с); Q2 – энтальпия избытка
воздуха, поступающего на горение, кДж/(м2 с); Q3 – количество теплоты, излучаемой
пламенем, кДж/(м2 с); Q4 – количество теплоты, затрачиваемой на нагрев реагирующих
веществ, кДж/(м2 с); Q5 – количество теплоты, затрачиваемой на нагрев строительных
конструкций, кДж/(м2 с); Q6 – потери теплоты вследствие неполноты химического
сгорания, кДж/(м2 с).
15
16.
Тепловой баланс открытого пожараТепловой баланс открытого пожара отличается от внутреннего тем, что в правой
части уравнения отсутствует величина Q5. На открытом пожаре наибольшее значение
имеет теплота, уносимая с продуктами сгорания и излучаемая зоной горения.
Последнее обстоятельство способствует распространению пожара и затрудняет
действия пожарных.
Количество теплоты, излучаемой пламенем факела в единицу времени с единицы
поверхности, может быть определено по формуле Стефана–Больцмана:
Q 3 ε о σ Т
4
пл
ε o – степень черноты пламени;
– постоянная Стефана-Больцмана,
= 5,67 10-11 кВт/( м2К4);
Тпл – температура пламени, К.
16
17.
Площадь пожара и площадь поверхности пламениЕсли форму пламени принять конической, то отношение поверхности
пламени Fпл к площади пожара Fп для случая горения нефтепродуктов в
резервуарах (при H = 4R) составит :
A
F π R R (4R)
π R
F
2
2
ПЛ
Fпл
H
2
R
П
0
Fп
FПЛ‘
17
FП
17
18.
Для случая горения бензинаПрименяя соотношение (6.12) к бензину, для которого =0,05,
Q рн =43785 кДж/кг
wм=0,0533 кг/(м2 с), Тпл=1400 К, получим долю
теплоты, излучаемую пламенем по отношению к
удельной теплоте пожара:
11
17 σ Т
17 5,7 10 1400
Q3 FПЛ
H
0, 41
Q П FП Q P w M (1 η) 43785 0,0533 0,95
4
ПЛ
4
Таким образом, на внутренних пожарах доля теплоты, теряемой
излучением, меньше половины теплоты, выделяющейся в результате горения.
18
19.
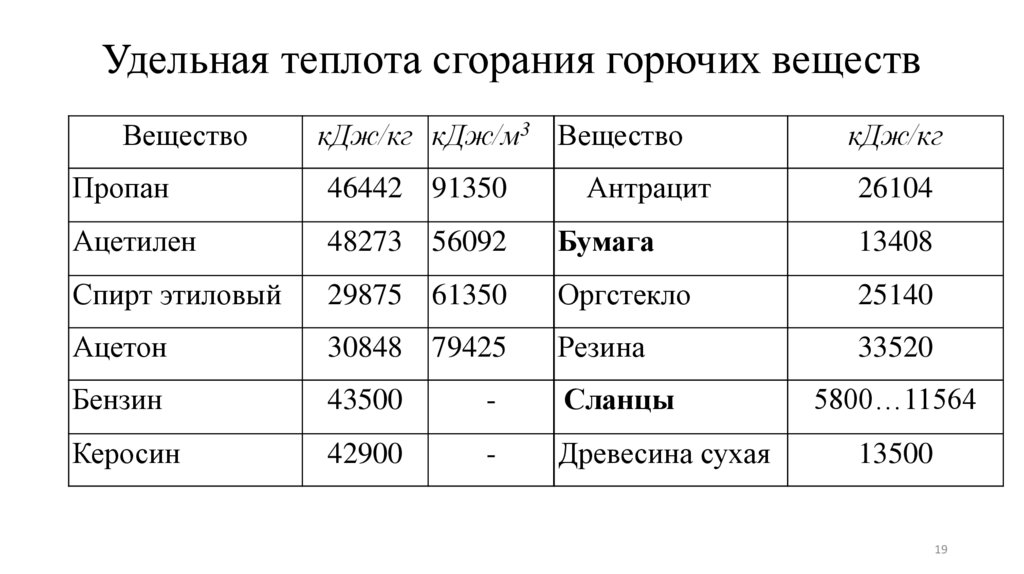
Удельная теплота сгорания горючих веществВещество
кДж/кг кДж/м3 Вещество
Антрацит
кДж/кг
Пропан
46442 91350
Ацетилен
48273 56092
Бумага
13408
Спирт этиловый
29875 61350
Оргстекло
25140
Ацетон
30848 79425
Резина
33520
Бензин
43500
-
Сланцы
5800…11564
Керосин
42900
-
Древесина сухая
26104
13500
19
20.
Температура горения• Различают калориметрическую, теоретическую и действительную температуры
горения.
• Действительной
температурой
горения
называется
температура,
реально
устанавливающаяся в условиях пожара.
• Под калориметрической температурой понимается температура, которую приобретают
продукты полного сгорания, когда вся теплота расходуется на их нагревание.
• При вычислении теоретической температуры пренебрегают потерями теплоты в
окружающую среду, но учитывают расход теплоты на диссоциацию продуктов реакции (при
температурах выше 1970 К).
Калориметрическую температуру горения вычисляют для следующих постоянных
условий:
воздух и горючее вещество находятся при нормальных условиях (273 К);
коэффициент избытка воздуха равен единице;
вещество полностью сгорает (недожог отсутствует);
потери теплоты отсутствуют (процесс адиабатный).
20
21.
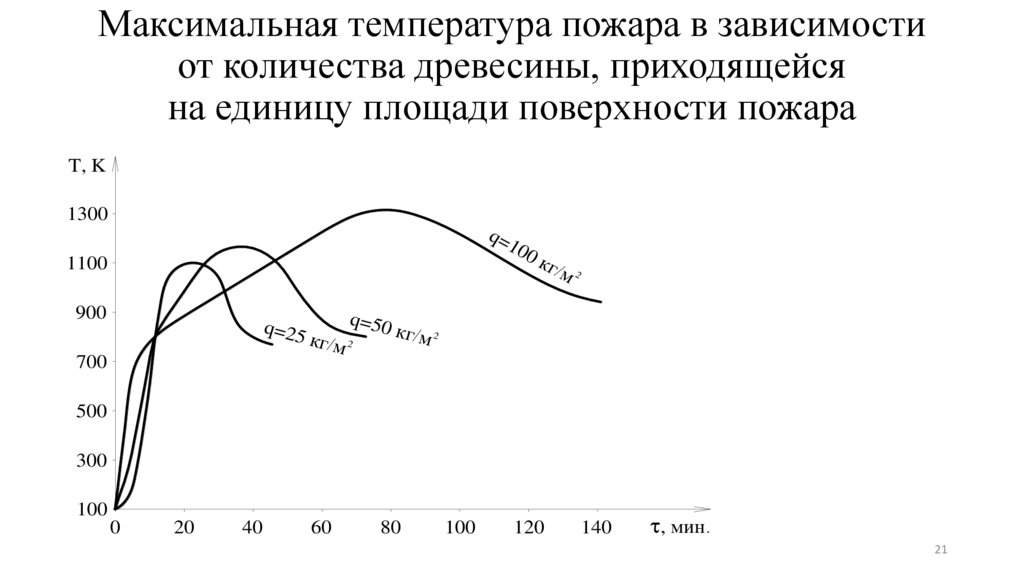
Максимальная температура пожара в зависимостиот количества древесины, приходящейся
на единицу площади поверхности пожара
T, K
1300
q=
100
1100
900
q=25
700
кг/
м2
q=50
кг/
м2
кг/м 2
500
300
100
0
20
40
60
80
100
120
140
, мин.
21
22.
Объемы продуктов сгоранияТеоретический объем продуктов сгорания твердых и жидких горючих веществ определяется по
формуле:
M
M
M
M
(
СО
Н
О
N
SO 2 ) 22,4
O
2
2
2
VПС
M
мСО , мН О, мN , мSО – число кмолей соответствующего вещества в уравнении реакции горения
2
2
2
2
одного кмоля горючего вещества; М – молярная масса горючего вещества, кг/кмоль.
Если горение протекает при избытке воздуха Vв, то этот избыток воздуха равен: Vв = ( в – 1)VВ0 ,
Полное количество азота в продуктах сгорания составит:
VN2 VNO2 0,79(αB 1) VBO
Количество избыточного кислорода:
Полное количество продуктов сгорания:
VO2 0,21(αB 1) VВ0
0
VПС VПС
VB0
22
23.
ДымообразованиеЗная массовую скорость выгорания топлива wм, можно
определить интенсивность дымообразования: Vпс wм,
где wм – массовая скорость выгорания, кг/(м2 с).
Таким образом, в лекции рассмотрены теоретические
основы для расчета удельной теплоты сгорания горючих
веществ, калориметрической температуры горения,
теоретически необходимых расходов воздуха на горение,
объемов продуктов сгорания, истекающих из зоны горения.
23




















 Химия
Химия








