Похожие презентации:
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
1. Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність.
2.
Положення Алюмінію в періодичнійсистемі, будова його атома
Алюміній — хімічний елемент ІІІА групи 3 періоду;
на зовнішньому енергетичному рівні – 3 валентні електрони,
металічний р-елемент
Відновник: Al0– 3 ē → Al3+
2
2
6
2
1
1s 2s 2p 3s 3p
3.
Сріблясто-білий метал,легкий і пластичний,
ρ = 2,7 г/см3, tпл = 660 °С;
легко витягується в
дріт, прокочується в
листи й фольгу;
за електропровідністю
поступається лише
сріблу й міді;
входить до складу легких
сплавів.
Алюміній
4.
Природні сполуки Алюмінію•Каолініт Al2O3 2SiO2 2H2O,
входить до складу глини.
•Корунд Al2 O3, кристали: червоні
(рубіни), сині (сапфіри).
•Польовий шпат K 2O Al2O3 6SiO2 .
5.
•БокситAl2O3 nH 2O.
•Нефелін
Na 2O Al2O3 2SiO2 .
•Кріоліт
Na 3 AlF6 .
6. Хімічні властивості Алюмінію
Алюмінотермі́я — спосібвідновлення металів з їх
оксидів за допомогою
алюмінію
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
Добування - електроліз розплавленої суміші алюміній оксиду
Al2O3 з криолітом Na3AlF6. Глинозем плавиться за температури
2050°С, а суміш із 10% глинозему і 90% криоліту -за 960°С.
Сумарне рівняння процесу:
2Al2O3 → 4Al +3O2↑
7. Хімічні властивості Алюмінію
Активний метал:реагує з неметалами;
виявляє амфотерні
властивості –
розчиняється в
кислотах та лугах
Конц. НNО3 та
Н2SО4 на холоду
пасивують алюміній, проте при
нагріванні реакція
відбувається
8. Хімічні властивості Алюмінію
Взаємодія з водой2Al + 6H2O = 2Al(OH)3 + 3H2↑
Взаємодія з йодом
H2O
2Al + 3І2 = 2AlІ3
9.
Алюміній оксид Al2 O3Біла тугоплавка речовина, нерозчинна у воді, tпл = 2 050 °C.
За хімічними властивостями він належить до амфотерних
оксидів: з кислотами реагує як основний оксид, у реакціях з
лугами виявляє властивості кислотних оксидів:
Аl2О3 + 6НСl = 2АlСl 3 + 3Н2О;
Аl2О3(свіжоотр.) + 2NaOН + 3Н2О = 2Na[Al(OH)4]
Натрій тетрагідроксоалюмінат
При сплавлянні алюміній оксиду з лугом утворюються алюмінати відповідного
металічного елемента і вода:
Аl2О3 + 2NaOH = 2NaAlО2 + Н2О
Натрій метаалюмінат
Аl2О3 + 6NaOH = 2Na3AlО3 + 3Н2О
Натрій ортоалюмінат
10.
Алюміній гідроксид Al(OН)3Біла, тверда, нерозчинна у воді речовина
За хімічними властивостями належить до
амфотерних гідроксидів -з кислотами реагує як основа,
у реакціях з лугами виявляє властивості кислот:
В розчинах:
Аl(ОН)3↓+ 3НСl = АlСl3 + 3Н2О;
Аl(ОН)3↓ + NaOН = Na[Al(OH)4]
Натрій тетрагідроксоалюмінат
або
Аl(ОН)3 + 3NaOН = Na3[Al(OH)6]
Натрій гексагідроксоалюмінат
При сплавлянні алюміній гідроксиду з лугом
утворюються відповідні алюмінати та вода:
Аl(ОН)3 + NaOH = NaAlО2 + 2Н2О
Натрій метаалюмінат
Аl(ОН)3 + 3NaOH = Na3AlО3 + 3Н2О
Натрій ортоалюмінат
При нагріванні розкладається :
Добувають дією надлишку розчинної солі на луг:
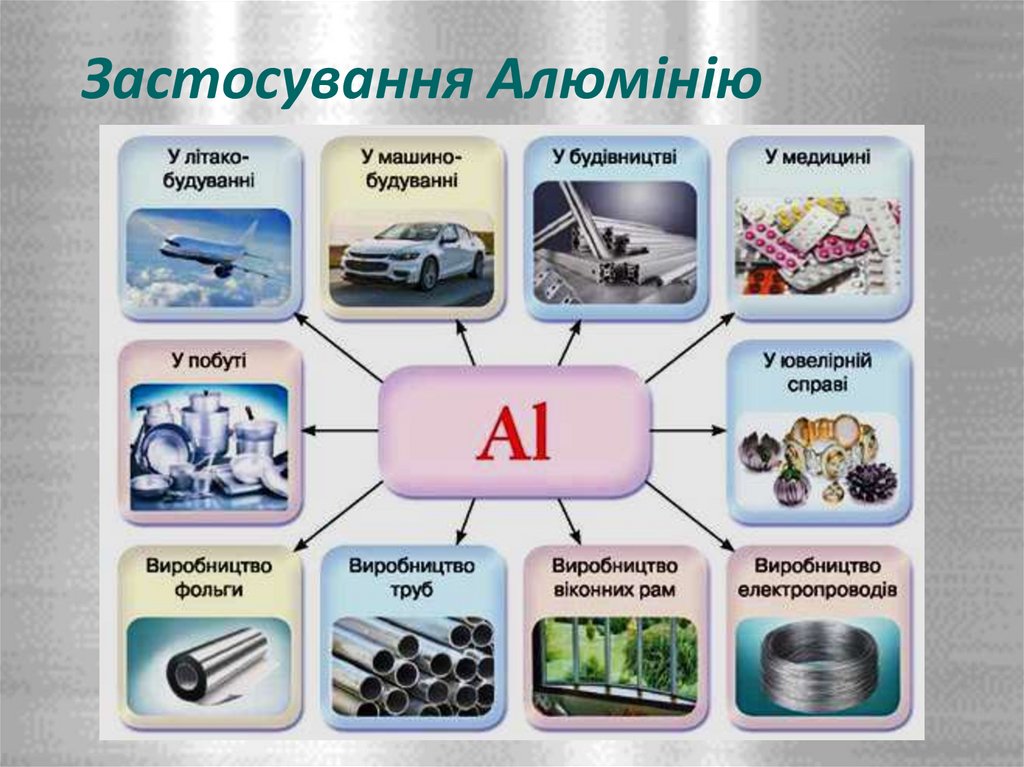
11. Застосування Алюмінію
12. Застосування Алюмінію
• У металургії для одержання інших менш активних металів методомалюмотермії.
• Алюміній є цінним конструкційним матеріалом.
• Авіаційна промисловість - дюралюмінієм обшивають корпуси літаків
• Пилоподібний алюміній та деякі його сполуки використовують як тверде
ракетне пальне.
• З алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні
гаджети
• Через свою високу відбивну здатність та легкість напилення алюміній є
ідеальним матеріалом для виготовлення дзеркал.
• Суміш алюмінію з ферум(ІІІ) оксидом — терміт — використовують для
зварювання залізничних рейок та труб.
13.
1) Обчисліть об'єм розчину сульфатної кислоти з масовоючасткою розчиненої речовини 18% (густина 1,127 г/мл),
необхідного для розчинення 39 г алюміній гідроксиду.
2) Визначте масу алюмінію, необхідного для відновлення
мангану з 25 кг мінералу піролюзіту, який містить 84% МnО2.
3) Здійсніть перетворення:
1. Al Al 2 O3 AlCl3 Al(OH)3
2. Al Al 2 (SO 4 )3 Al(OH)3 Al(NO3 )3
3. Al AlCl3 Al(OH)3 NaAlO 2
4. Al AlBr3 Al(OH)3 AlCl3












 Химия
Химия








