Похожие презентации:
Азот
1.
АЗОТ2.
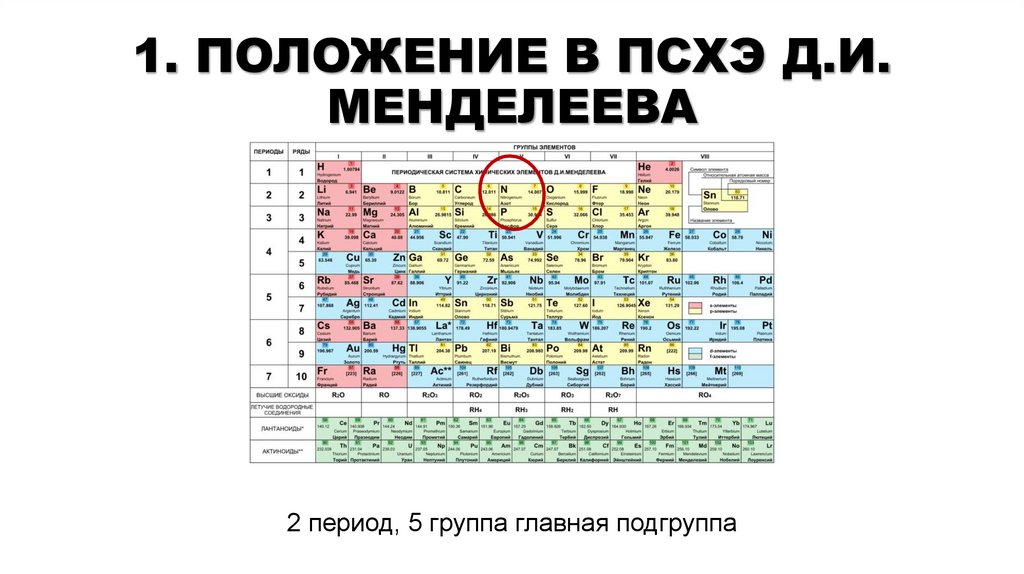
1. ПОЛОЖЕНИЕ В ПСХЭ Д.И.МЕНДЕЛЕЕВА
2 период, 5 группа главная подгруппа
3.
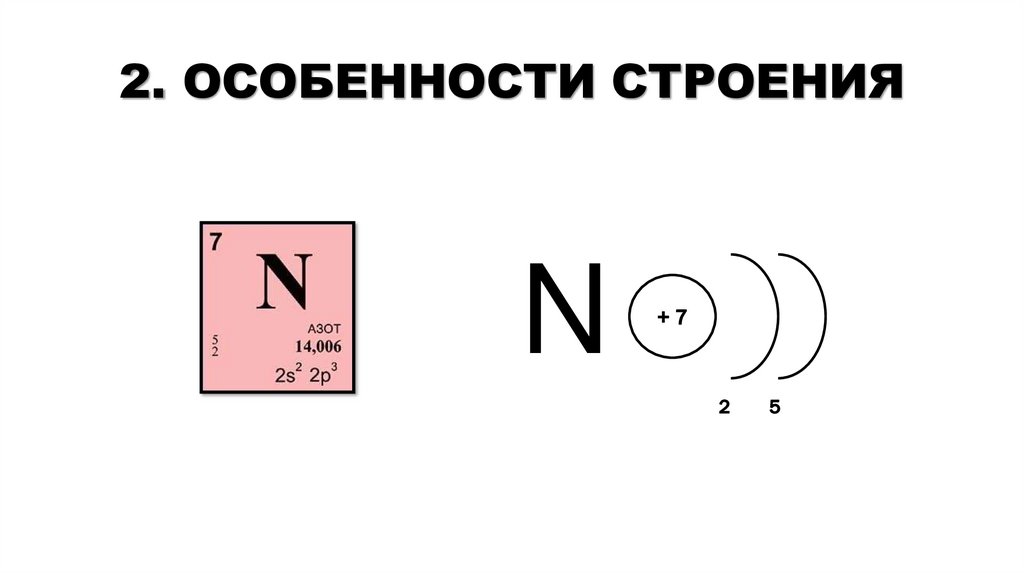
2. ОСОБЕННОСТИ СТРОЕНИЯN
4.
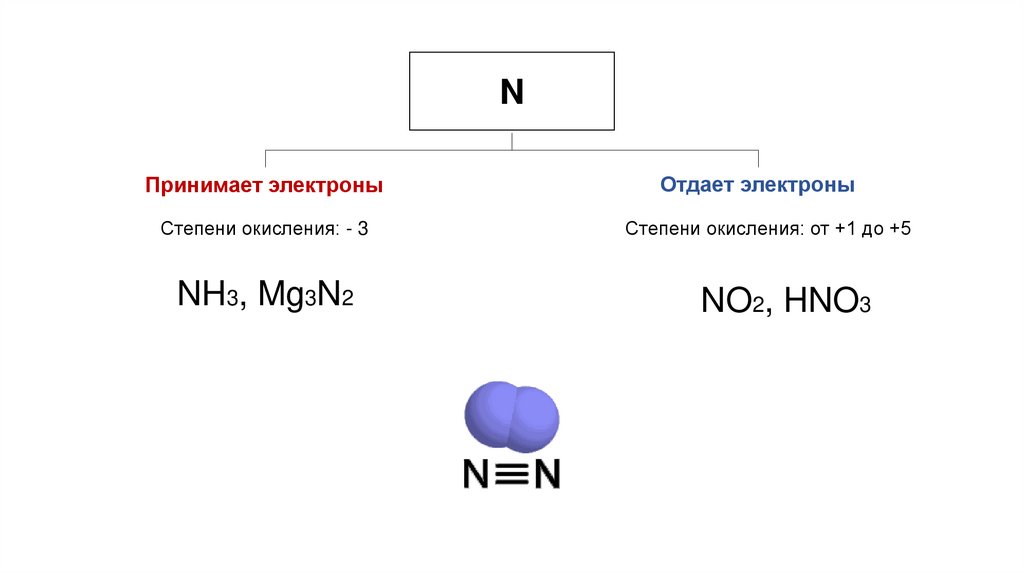
NПринимает электроны
Отдает электроны
Степени окисления: - 3
Степени окисления: от +1 до +5
NH3, Mg3N2
NO2, HNO3
5.
3. НАХОЖДЕНИЕ В ПРИРОДЕВ атмосфере 78%
6.
ЧИЛИЙСКАЯ СЕЛИТРА (NaNO3)7.
С биологической точки зренияазот более ценен, чем любой
драгоценный металл (так как
содержится в белках)
8.
4. ФИЗИЧЕСКИЕ СВОЙСТВААгрегатное состояние:
газ, без цвета и запаха
Малорастворимый в воде
Не ядовит
9.
5. ХИМИЧЕСКИЕ СВОЙСТВА1) С простыми веществами:
А) С металлами до образования нитридов:
N2 + 6Li = 2Li3N
N2 + 3Mg = Mg3N2 (только при сильном нагревании)
Б) С неметаллами:
N2 + O2 = 2NO (под действием электрического тока)
N2 + 3H2 = 2NH3↑ (под температурой, давлением и
катализатором Fe)
10.
6. ПРИМЕНЕНИЕИзготовление азотной кислоты и жидкого азота
11.
КИСЛОРОДНЫЕСОЕДИНЕНИЯ АЗОТА
12.
ОКСИДЫ АЗОТАНесолеобразующие
(N2O, NO)
Солеобразующие
(NO2, N2O3, N2O5)
Ни с чем НЕ реагируют
ВСТУПАЮТ в реакции
13.
Оксид азота (I) N2OБесцветный газ, с резким сладковатым запахом.
Плохо растворим в воде. Имеет название
«веселящий газ».
14.
Оксид азота (III) N2O3Жидкость темно-синего цвета.
Хорошо растворяется в воде с
образованием азотистой кислоты:
N2O3 + H2O = 2HNO2
15.
Оксид азота (IV) NO2Газ бурого цвета с резким, удушливым запахом.
При растворении в воде образует смесь азотистой
и азотной кислот*
2NO2 + H2O = HNO2 + HNO3
2NO2 + H2O + O2 = 4HNO3
* При избытке кислорода образуется только азотная кислота











 Химия
Химия








