Похожие презентации:
מול ומשקל מולקולרי ,משוואה כימית
1.
כימיה ,מצגת 4מול ומשקל מולקולרי ,משוואה כימית
מכללת רידמן
ד"ר דליה גורדון
1
2.
מול ומשקל מולקולארי• כששוקלים אטומים משתמשים ביחידות של גרמים
• אבל אם נשקול אטומים בודדים מסתבר שמדובר
במשקל מאוד מאוד קטן
למשל :אטום אורניום אחד ישקול
3.95*10 -22גרם
ולכן בעייתי מאוד לבצע שקילה שלו במאזניים
• על מנת להתגבר על מכשול זה הומצאה יחידה
כימית חדשה הקרויה מול )(mole
2
3.
מול• זהו שם שמייצג מספר קבוע של חלקיקים ,את
המספר ( 6.02x1023כמו שתריסר מייצג את
המספר .)12
• מספר זה נקרא מספר אבוגדרו.
• מול זוהי כמות החומר אשר מכילה מספר
אבוגדרו ( ) 6.02x1023חלקיקי החומר.
• החלקיקים יכולים להיות אטומים ,מולקולות ,יונים,
אלקטרונים ,וכו'.
3
4.
מול• אם נישקול 1000זרעים של חיטה ו 1000-זרעים
של פרג – המישקל יהיה שונה ,ונוכל לקבוע איזה
זרע כבד יותר .כך גם עם אטומים וחלקיקים
זעירים אחרים .אם ניקח מספר זהה של חלקיקים
נוכל לקבוע מי כבד יותר.
• מול – כמות המכילה את אותו המספר של
חלקיקים אלמנטריים (אטומים ,יונים ,אלקטרונים,
מולקולות) שיש ב 0.012-ק"ג פחמן טהור.
4
5. מול (mole)
מול )(mole• מספר אבוגדרו = 1מול = 6.02*1023חלקיקים
• מסה מולרית -מציין את המשקל של מול חלקיקים
• כל יסוד ייתן מסה מולרית שונה (המופיעה בטבלה
המחזורית)
• מסה מולרית = מסה אטומית (המופיעה בטבלה
המחזורית) מבוטאת בגרמים
• **** אם ניקח יסודות שונים ,במשקל הזהה למסה המולרית
שלהם (המספר שמופיע בטבלה) ,נמצא כי בכל אחד מהם
לקחנו מספר שווה (אבוגדרו) של חלקקיקים****
5
6. 1 מול תמיד יציין את מספר החלקיקים
1מול תמיד יציין את מספר החלקיקים• מהם החלקיקים? תלוי במקרה
• מול Arייתן 6.02*1023אטומים
• מול H2Oייתן 6.02*1023מולקולות H2O
• 1מול מולקולות H2Oנותן 2מול אטומי מימן H
ו 1-מול אטומי חמצן O
• הכל תלוי על איזה חלקיק מסתכלים
6
7.
• Mמסה מולרית:• זהו המסה בגרמים של "חבילת" חומר המכילה מול
( )6.02x1023חלקיקים של אותו חומר.
• המסות המולריות הן מסות יחסיות המבוטאות בגרם למול
חלקיקים .הן אינן מספרים שלמים ,כיוון שהן ממוצעי המסות
המולריות של כל האיזוטופים של היסוד הנתון.
• אם נשקול "חבילה" של 6.02x1023אטומים של יסוד מסוים,
נקבל את הערך המספרי המתאים למסה האטומית
המופיעה בטבלה המחזורית
מסה אטומית זהו מספר המסה = Aכפי שלמדנו( .מס'
הפרוטונים +מס' הנאוטרונים ,ביחידות של מסה אטומית
ולא בגרמים)
7
8. חישוב מסה מולרית (Mw=Molar weight)
חישוב מסה מולרית ()Mw=Molar weight• מסה מולרית = משקלם של 1מול חלקיקים
• משקל מולקולרי של מולקולה שווה לסכום המשקל
המולקולרי של האטומים המרכיבים אותה
• לדוגמה 1:מול H2O
• 16 = Oגרם עבור 1מול
1 - Hגרם עבור אחד מול (יש לנו שני מול אטומים של
מימן)
חישוב הנוסחה
) 18 = 2*1 + 16 = Mw(H2Oגרם למול
משקל מולקולרי = מסה מולרית מבוטאת בגרמים
8
9.
איך מחשבים?מספר מולים * מסה מולרית גרם למול = מסה גרמים
= מסה
מסה מולרית גרם למול
מספר מולים
גרמים
מספר המולים
9
= מסה גרמים
מסה מולרית גרם למול
10. תגובות כימיות
תגובות כימיותתגובה כימית (ריאקציה כימית) היא תהליך שבו
משתנה מבנה המולקולות המרכיבות את החומר.
שינוי פיזיקלי ,כמו הרתחת מים לאדים ,איננו
נחשב לתגובה כימית.
תגובה כימית כרוכה ,בדרך כלל ,ביצירה או
בשבירה של קשר כימי במולקולה.
10
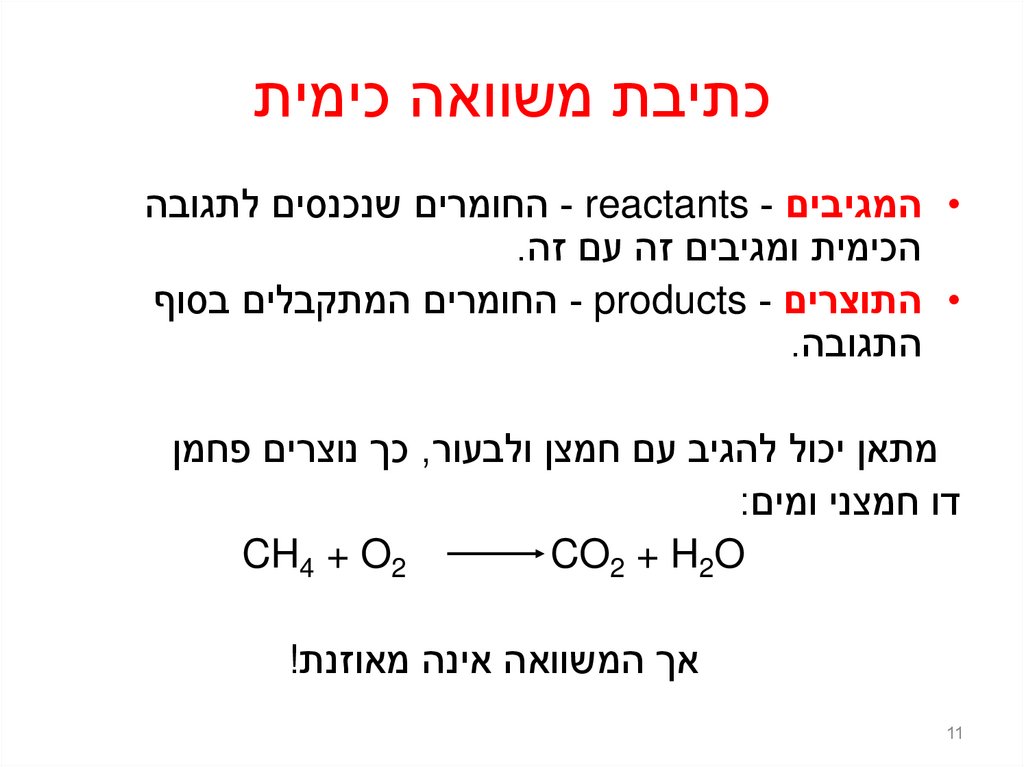
11. כתיבת משוואה כימית
כתיבת משוואה כימית• המגיבים - reactants -החומרים שנכנסים לתגובה
הכימית ומגיבים זה עם זה.
• התוצרים - products -החומרים המתקבלים בסוף
התגובה.
מתאן יכול להגיב עם חמצן ולבעור ,כך נוצרים פחמן
דו חמצני ומים:
CH4 + O2
CO2 + H2O
אך המשוואה אינה מאוזנת!
11
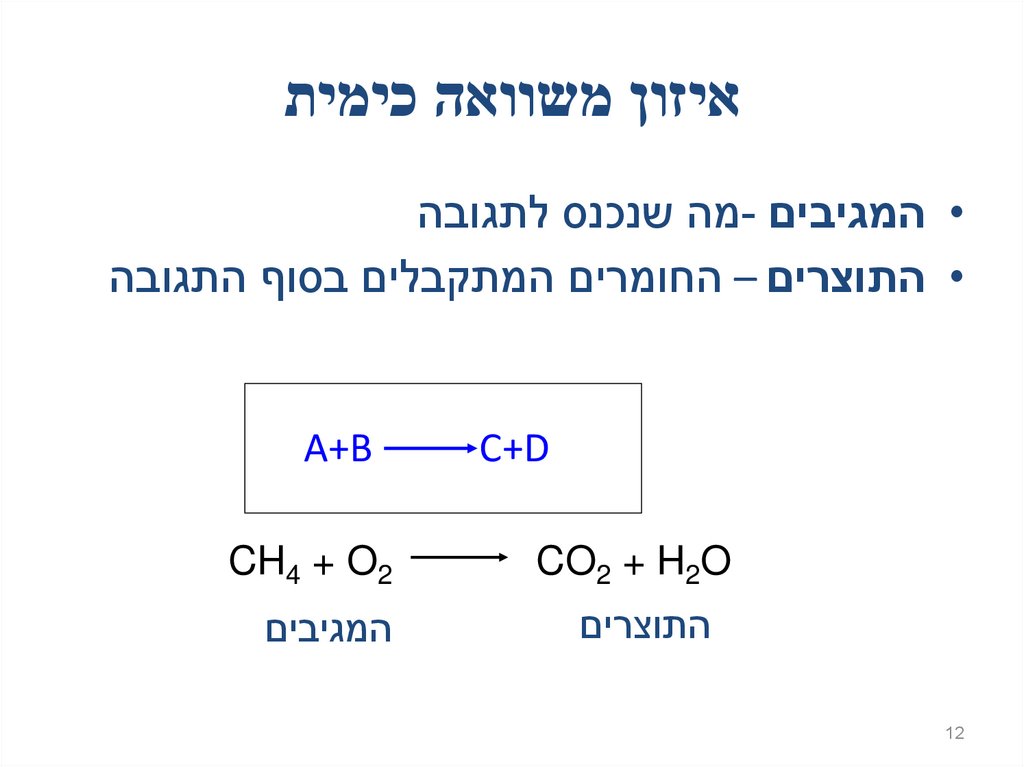
12. איזון משוואה כימית
איזון משוואה כימית• המגיבים -מה שנכנס לתגובה
• התוצרים – החומרים המתקבלים בסוף התגובה
C+D
12
A+B
CO2 + H2O
CH4 + O2
התוצרים
המגיבים
13. איזון משוואות כימיות
איזון משוואות כימיותאיזון משוואה מבוסס על חוק שימור החומר הקובע
כי אטומים אינם נעלמים ואינם נוצרים ,אלא יוצרים
מולקולות חדשות.
הכמות של כל אטום בצד שמאל של משוואה -
(מגיבים)
שווה לכמות של אותו אטום בצד ימין של המשוואה -
(תוצרים).
13
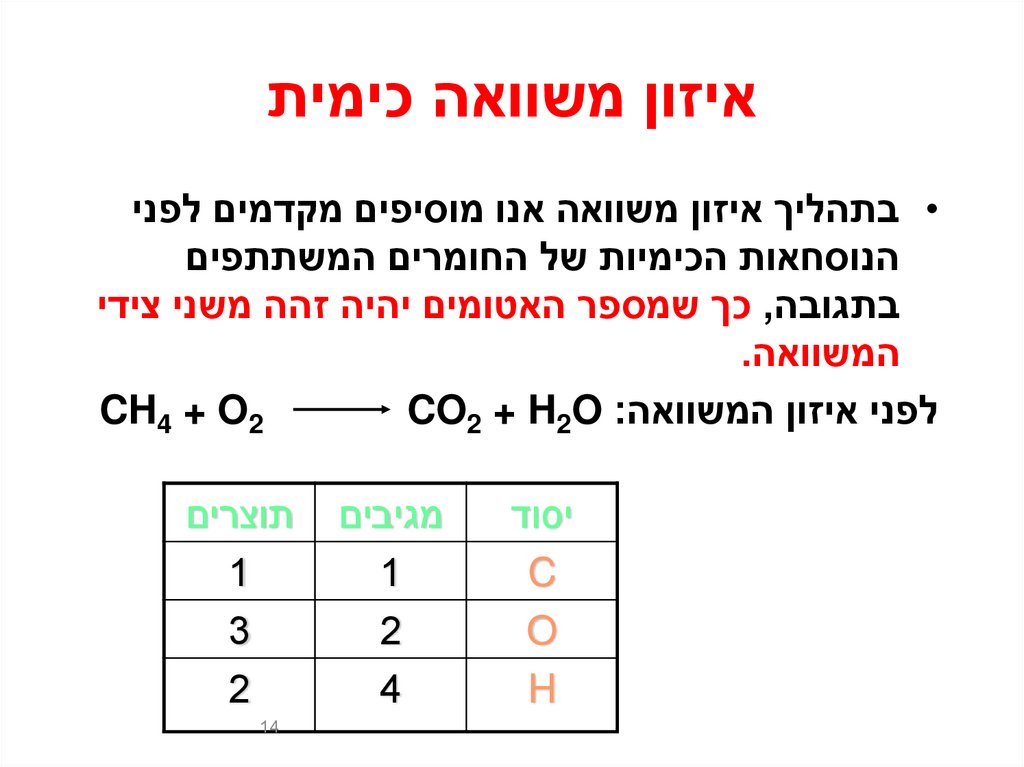
14. איזון משוואה כימית
איזון משוואה כימית• בתהליך איזון משוואה אנו מוסיפים מקדמים לפני
הנוסחאות הכימיות של החומרים המשתתפים
בתגובה ,כך שמספר האטומים יהיה זהה משני צידי
המשוואה.
CH4 + O2
לפני איזון המשוואהCO2 + H2O :
יסוד
C
O
H
מגיבים
1
2
4
תוצרים
1
3
2
14
15.
לאחר איזון המשוואה:CO2 + 2H2O
יסוד
CH4 + 2O2
מגיבים תוצרים
1
4
4
C
O
H
לפני איזון המשוואהCO2 + H2O :
1
4
4
CH4 + O2
יסוד
מגיבים
תוצרים
C
1
1
O
2
3
H
4
2
15
16. כללים באיזון משוואה כימית
כללים באיזון משוואה כימית• כתבו את המשוואה הבלתי מאוזנת.
• התחילו לאזן את המשוואה מהמולקולה שמכילה
הכי הרבה אטומים.
• השאירו יסודות ומולקולות יסוד לסוף.
• אין לשנות את הנוסחה הכימית של המולקולות.
16
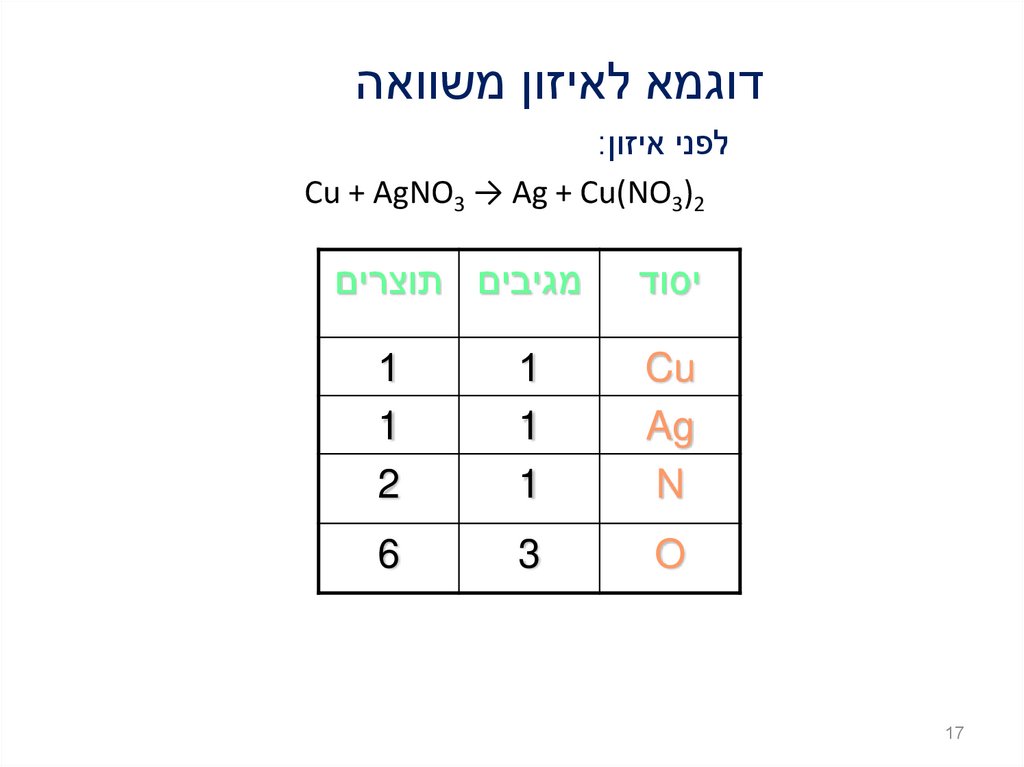
17.
דוגמא לאיזון משוואהלפני איזון:
Cu + AgNO3 → Ag + Cu(NO3)2
יסוד
17
מגיבים תוצרים
Cu
Ag
N
1
1
1
1
1
2
O
3
6
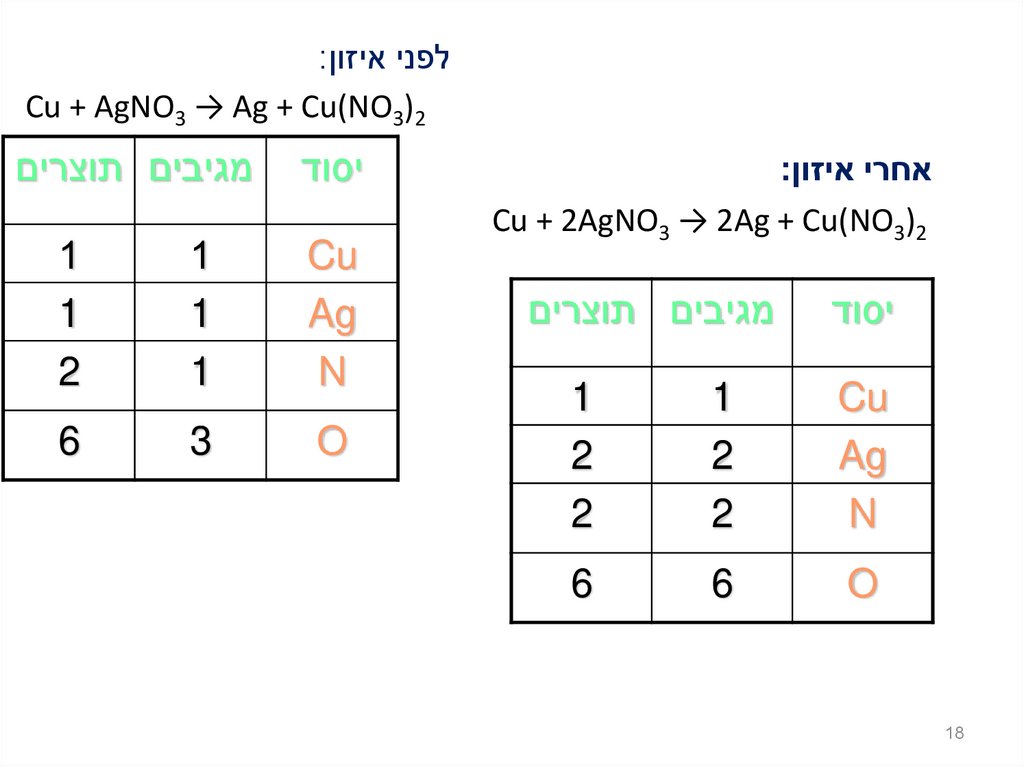
18.
לפני איזון:Cu + AgNO3 → Ag + Cu(NO3)2
אחרי איזון:
Cu + 2AgNO3 → 2Ag + Cu(NO3)2
יסוד
18
מגיבים תוצרים
Cu
Ag
N
1
2
2
1
2
2
O
6
6
יסוד
מגיבים תוצרים
Cu
Ag
N
1
1
1
1
1
2
O
3
6













 Химия
Химия
