Похожие презентации:
Состояние электронов в атоме
1.
Состояниеэлектронов
в атоме
2.
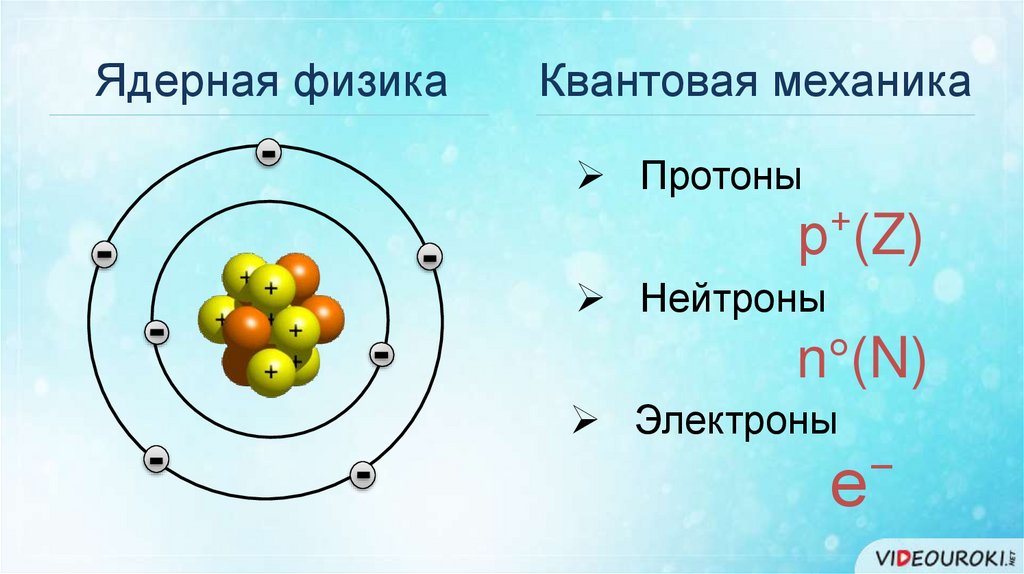
Ядерная физикаКвантовая механика
Протоны
р⁺(Z)
Нейтроны
n°(N)
Электроны
е⁻
3.
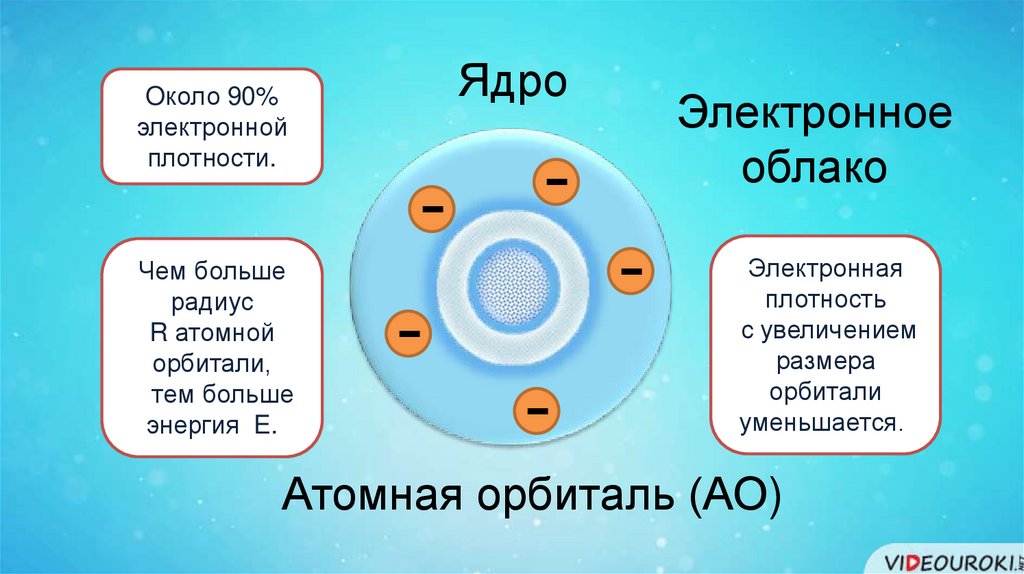
Oколо 90%электронной
плотности.
Чем больше
радиус
R атомной
орбитали,
тем больше
энергия E.
Ядро
-
Электронное
облако
-
Электронная
плотность
с увеличением
размера
орбитали
уменьшается..
Атомная орбиталь (АО)
4.
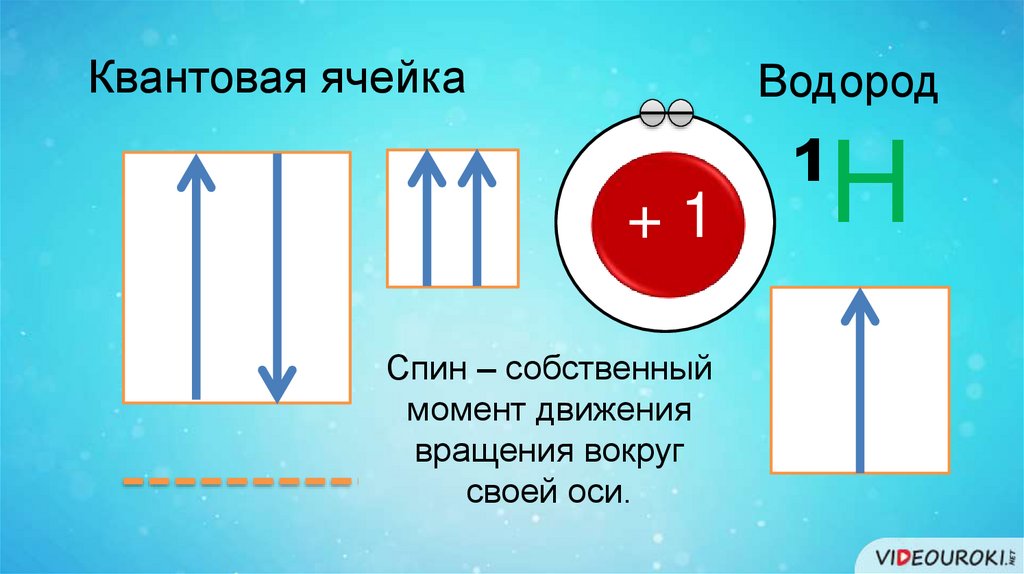
Квантовая ячейкаВодород
+1
Спин – собственный
момент движения
вращения вокруг
своей оси.
¹Н
5.
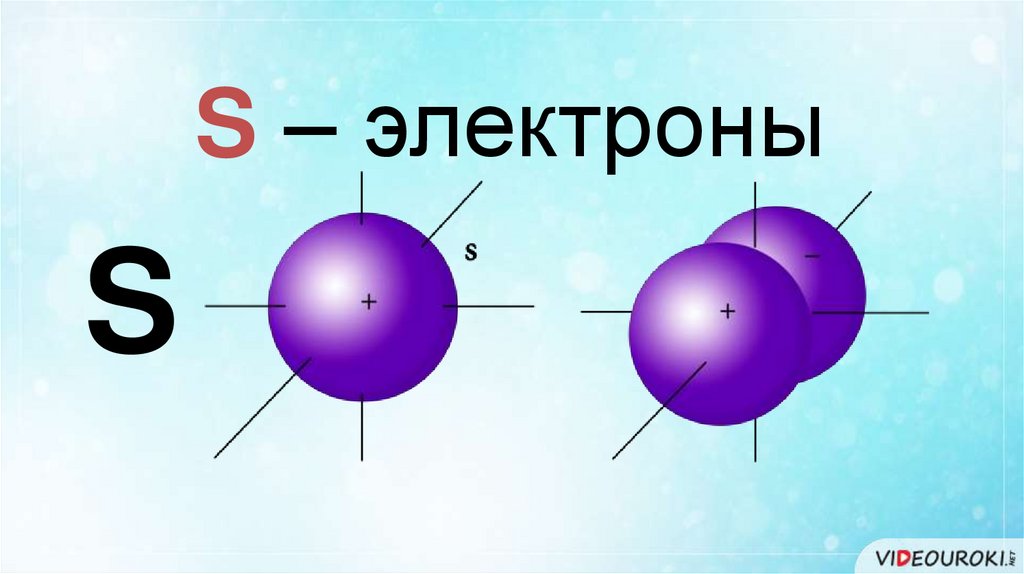
S – электроныS
6.
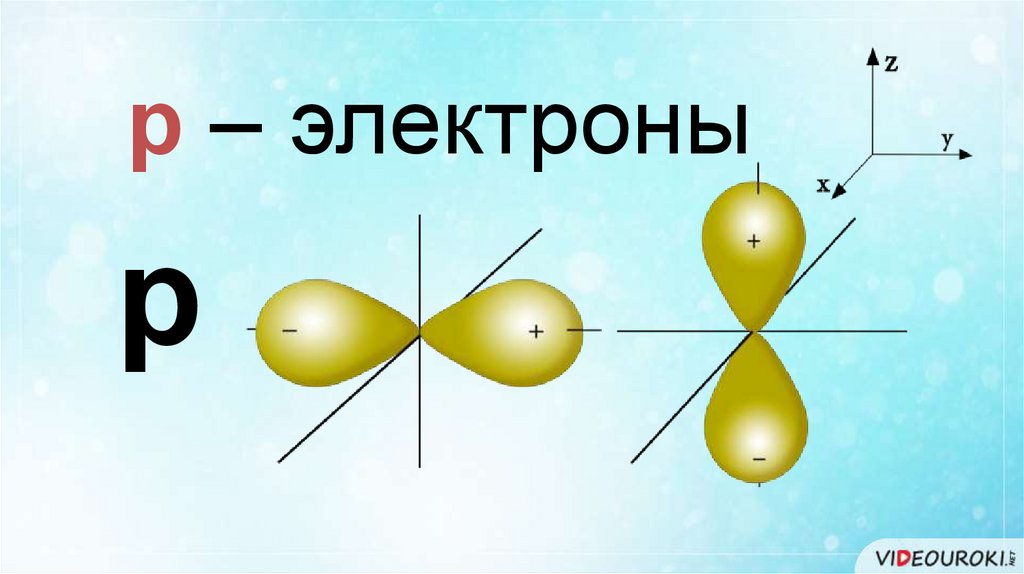
р – электроныр
7.
d – электроныd
8.
f – электроныf
9.
Е – энергияАО
Электроны с
близкими
значениями
энергии
составляют в
атоме единый
электронный
слой.
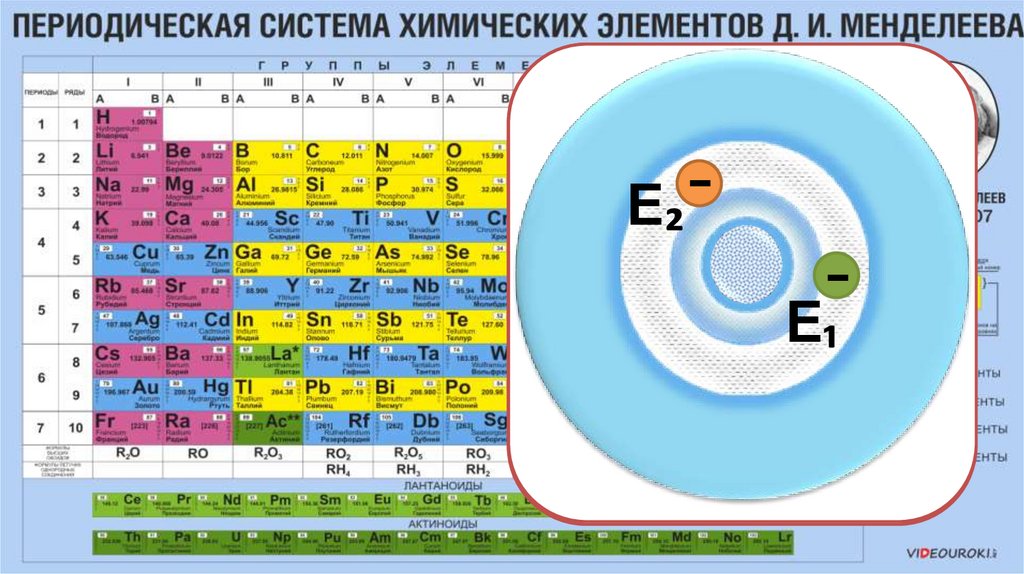
₁₆S
₁₉K
сера
калий
Е
Е₂ -
Чем больше
радиус
орбитали,
тем больше
энергия.
+ 16
19
2e⁻ 8e⁻ 8e⁻8e⁻
2e⁻
2S
2S
Е₁
6e⁻
1e⁻
Атомный
4s
3p
3p
3S
3S
радиус
2p
2p
1S
1S
Энергетический
уровень
10.
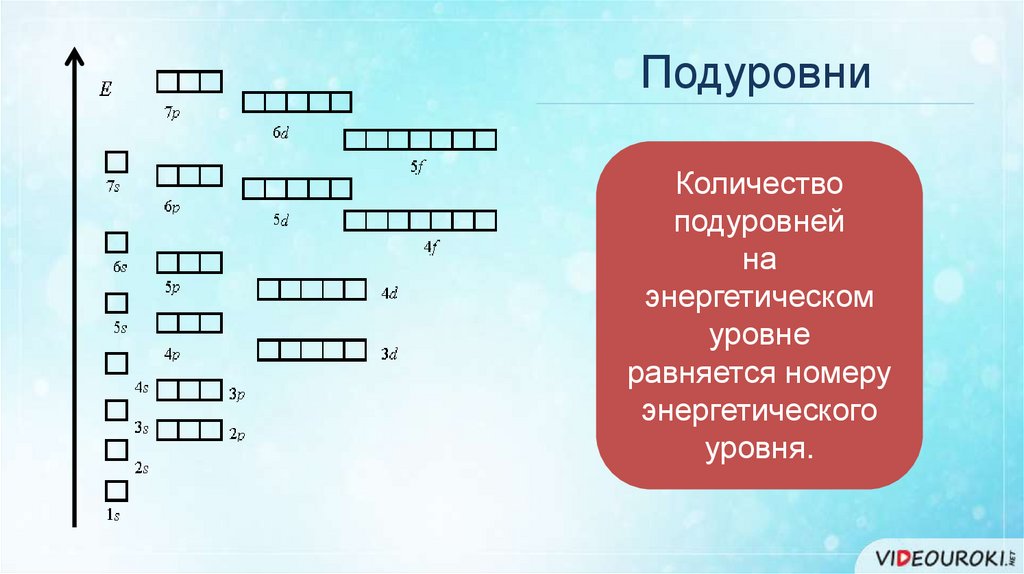
ПодуровниКоличество
подуровней
на
энергетическом
уровне
равняется номеру
энергетического
уровня.
11.
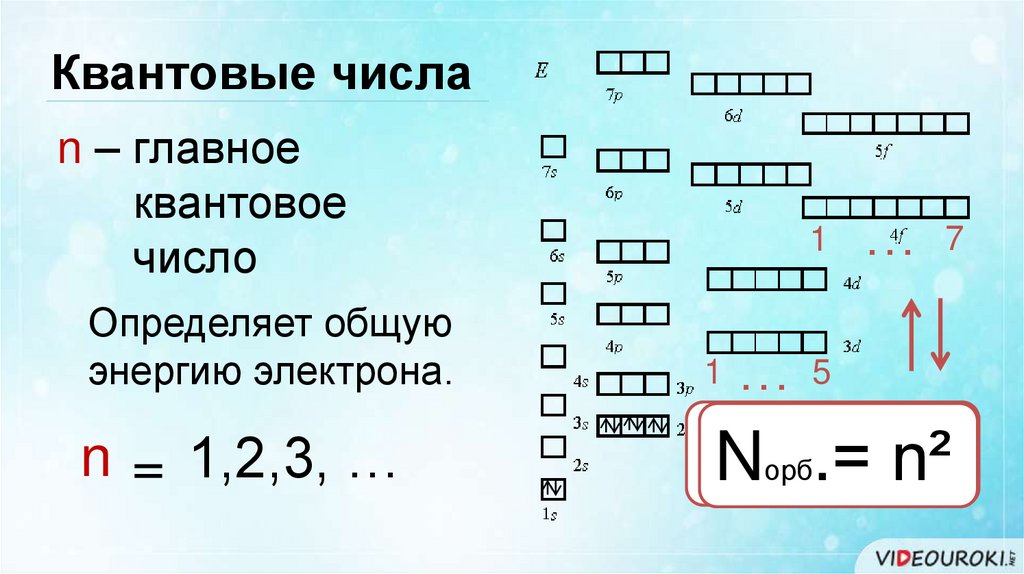
Квантовые числаn – главное
квантовое
число
1
… 7
Определяет общую
энергию электрона.
1
n = 1,2,3, …
N
n²
Nэлорб.=.=2n²
…5
12.
Квантовые числаL =0
L – побочное
квантовое
число
L = 0 до n - 1
s - подуровень
L=1
р - подуровень
Характеризует форму
атомной орбитали и
уточняет ее энергию.
L+ n= Е
АО
L= 2
d - подуровень
L= 3
f - подуровень
13.
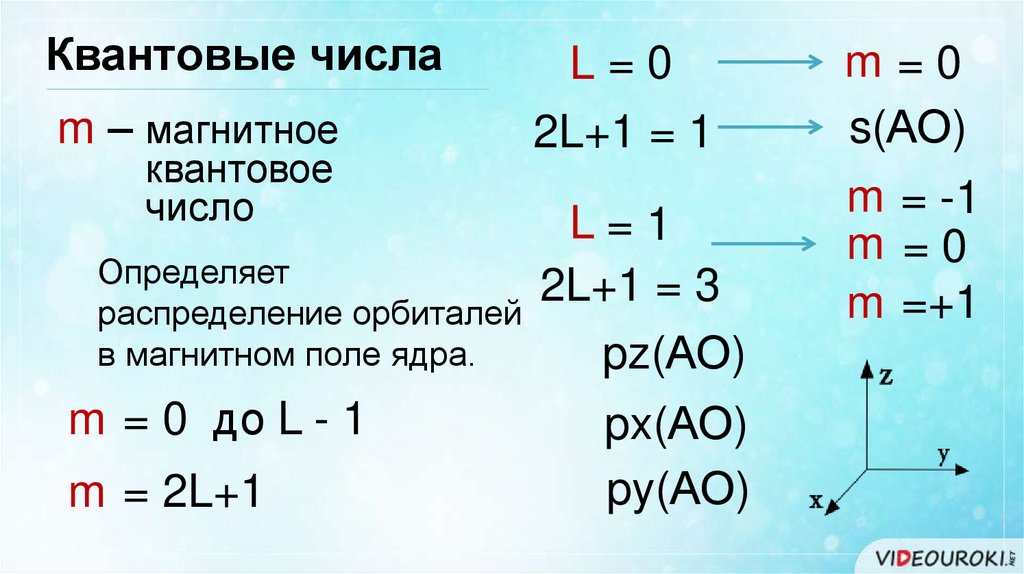
Квантовые числаm – магнитное
квантовое
число
L=0
2L+1 = 1
L=1
Определяет
2L+1 = 3
распределение орбиталей
в магнитном поле ядра.
pz(АО)
m = 0 до L - 1
px(АО)
m = 2L+1
py(АО)
m=0
s(АО)
m = -1
m =0
m =+1
14.
Квантовые числаs – спиновое
квантовое
число
Характеризует магнитный
момент при вращении
электрона вокруг
своей оси.
Е
1/2
-1/2
Н
15.
Число орбиталейв уровне
и подуровне
Количество
энергетических
уровней
Количество
энергетических
подуровней
Максимальное
число
электронов
16.
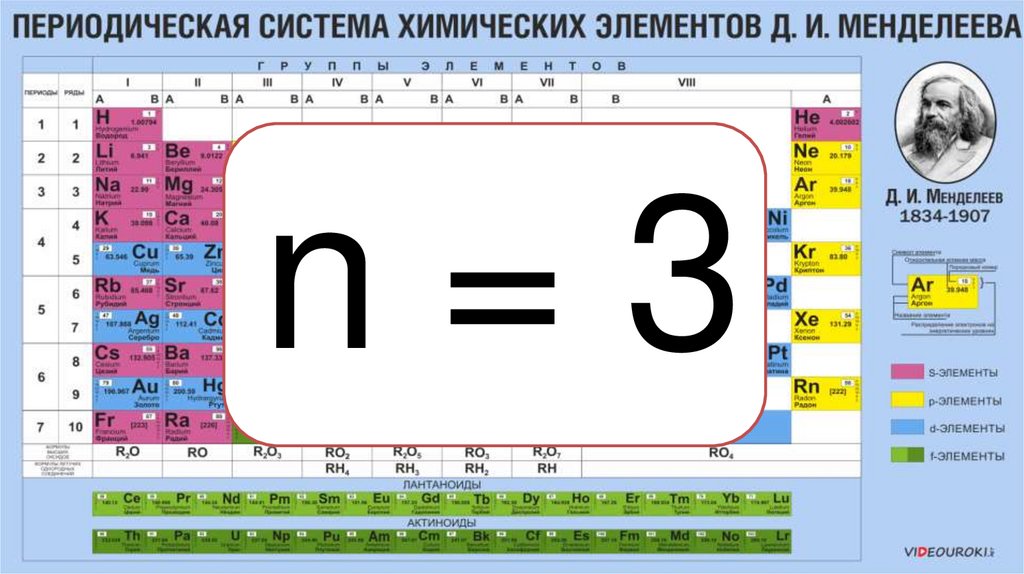
n=317.
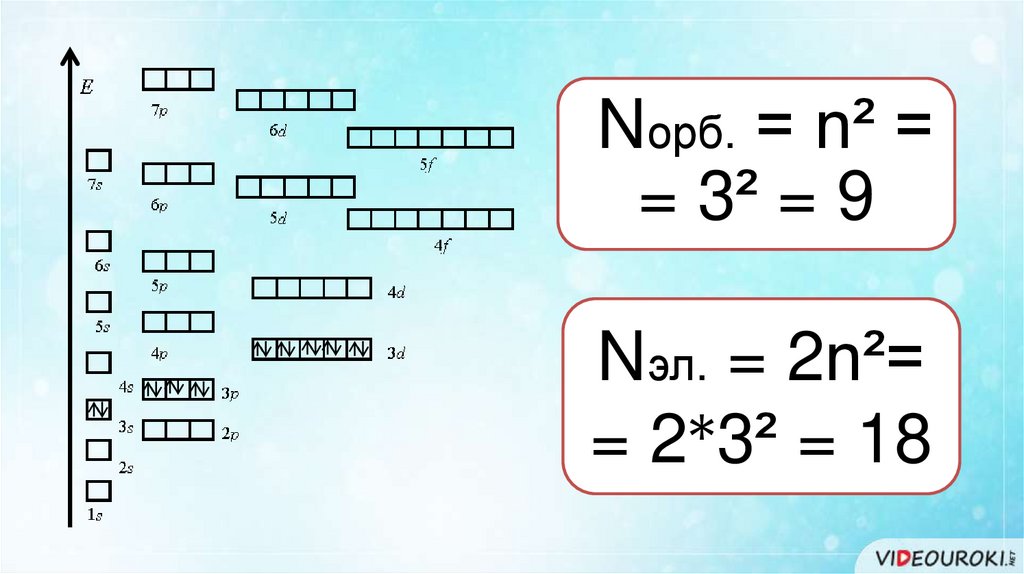
Nорб. = n² == 3² = 9
Nэл. = 2n²=
= 2*3² = 18
18.
ЭнергияКоличество
орбиталей
Форма
Расположение
в пространстве

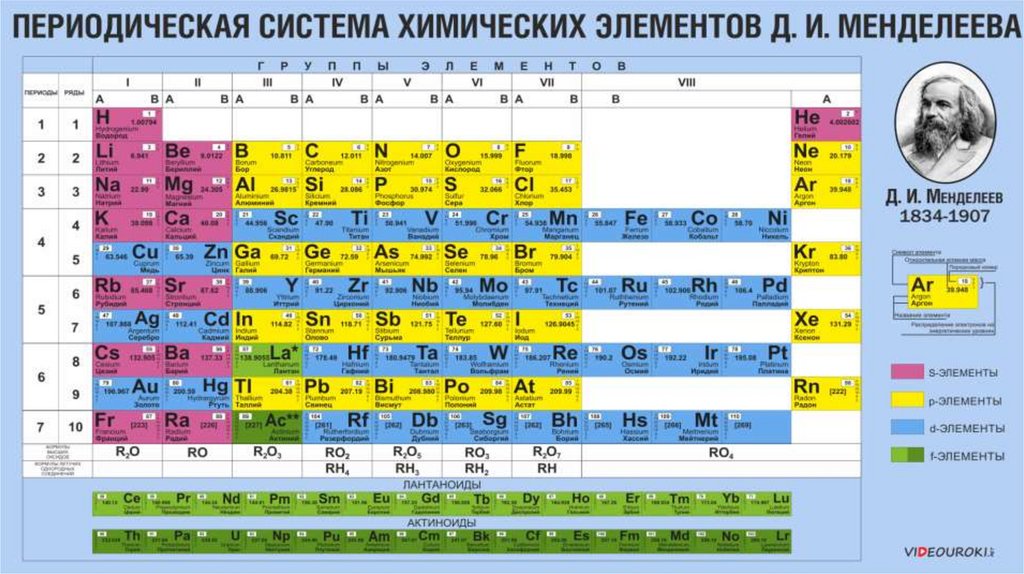


 Химия
Химия








