Похожие презентации:
Фенолы
1. ФЕНОЛЫ
Составитель: И.Н. Пиялкина,учитель химии МБОУ СОШ № 37
города Белово
2. Историческая справка
В 1834г. немецкий химикорганик ФридлибФердинанд Рунге
обнаружил в продуктах
перегонки
каменноугольной смолы
белое кристаллическое
вещество с характерным
запахом. Ему не удалось
определить состав
вещества.
3.
1842г. Огюст Лоранопределил состав
вещества. Новое
вещество обладало
выраженными
кислотными свойствами
и было производным
открытого незадолго до
этого бензола. Лоран
называл бензол
"феном", поэтому новая
кислота получила
название фениловой.
4.
Шарль ФридерикЖерар считал
полученное вещество
спиртом и предложил
называть его фенолом.
Было установлено, что
целая группа веществ
обладает подобным
строением и
свойствами, поэтому их
назвали "фенолами".
5.
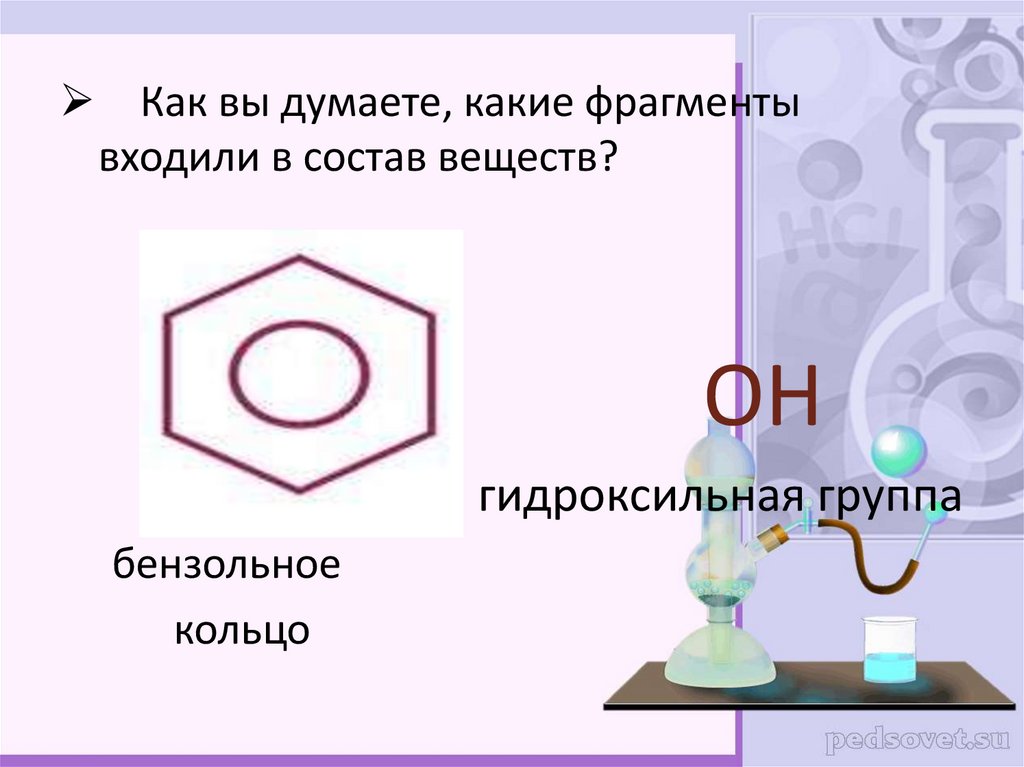
Как вы думаете, какие фрагментывходили в состав веществ?
OH
гидроксильная группа
бензольное
кольцо
6.
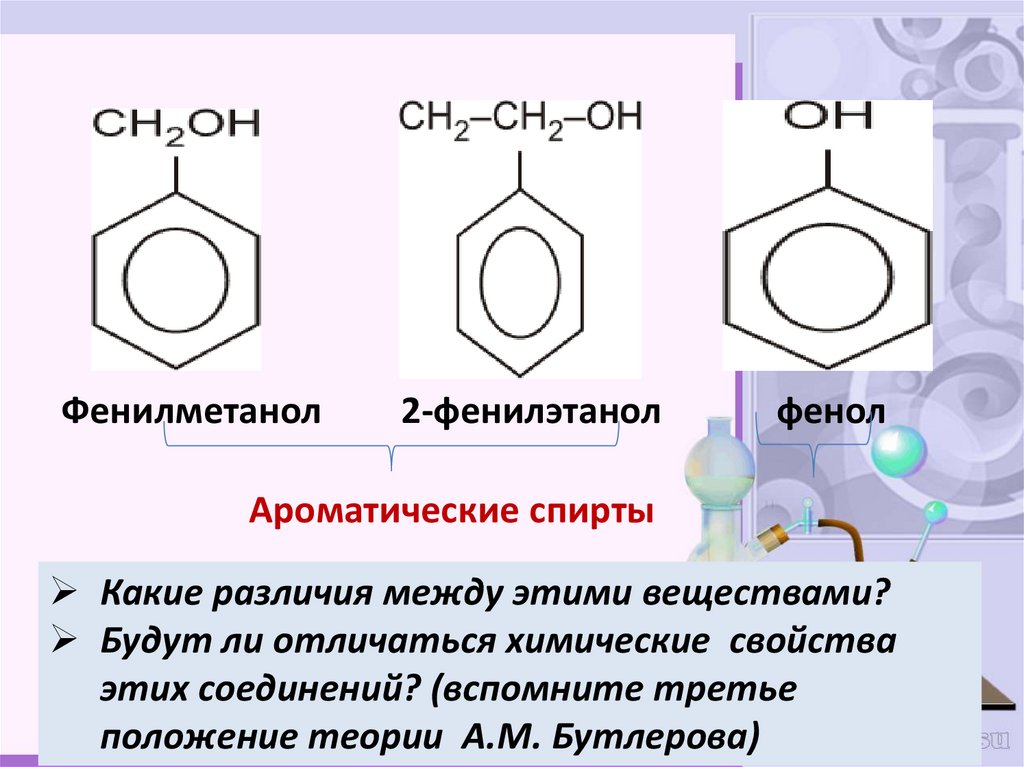
Фенилметанол2-фенилэтанол
фенол
Ароматические спирты
Какие различия между этими веществами?
Будут ли отличаться химические свойства
этих соединений? (вспомните третье
положение теории А.М. Бутлерова)
7.
Фенолы–
органические
вещества,
молекулы которых содержат радикал
фенил, связанный с одной или несколькими
гидроксогруппами.
8. Классификация фенолов
• Фенолы классифицируют поатомности, т.е. по количеству
гидроксильных групп.
• Одноатомные фенолы
содержат в молекуле одну
гидроксильную группу (фенол)
• Двухатомные фенолы содержат
две гидроксильные группы
(1,3-дигидроксибензол, метадигидроксибензол, резорцин)
• Трёхатомные фенолы содержат
три гидроксильные группы
9.
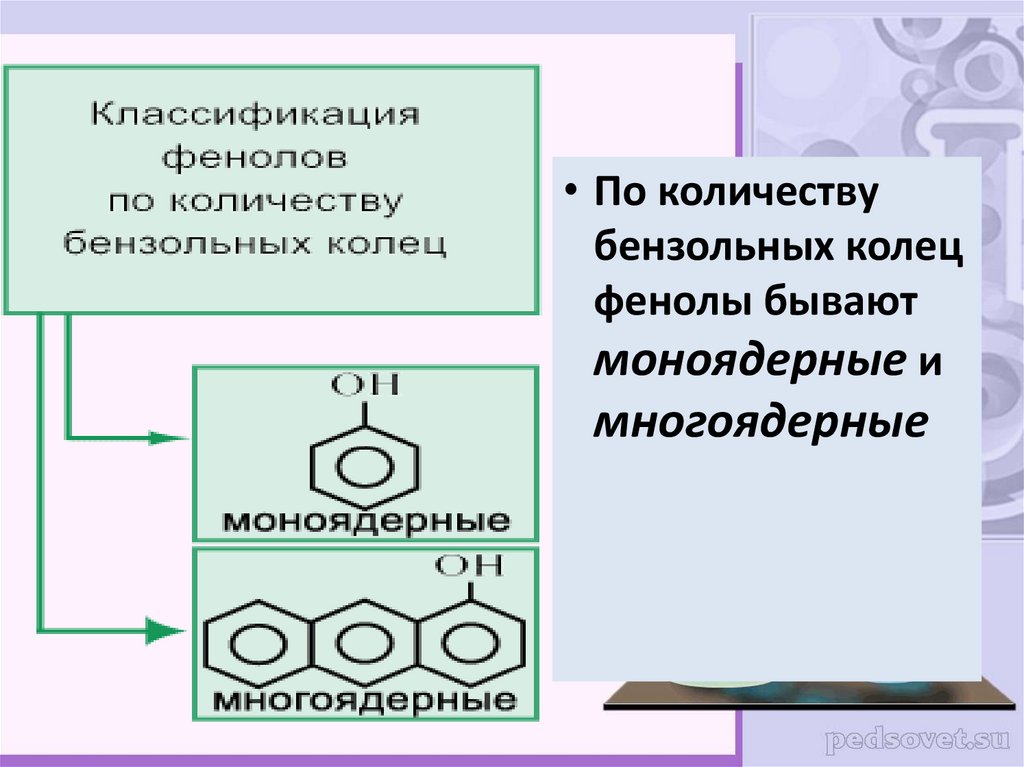
• По количествубензольных колец
фенолы бывают
моноядерные и
многоядерные
10.
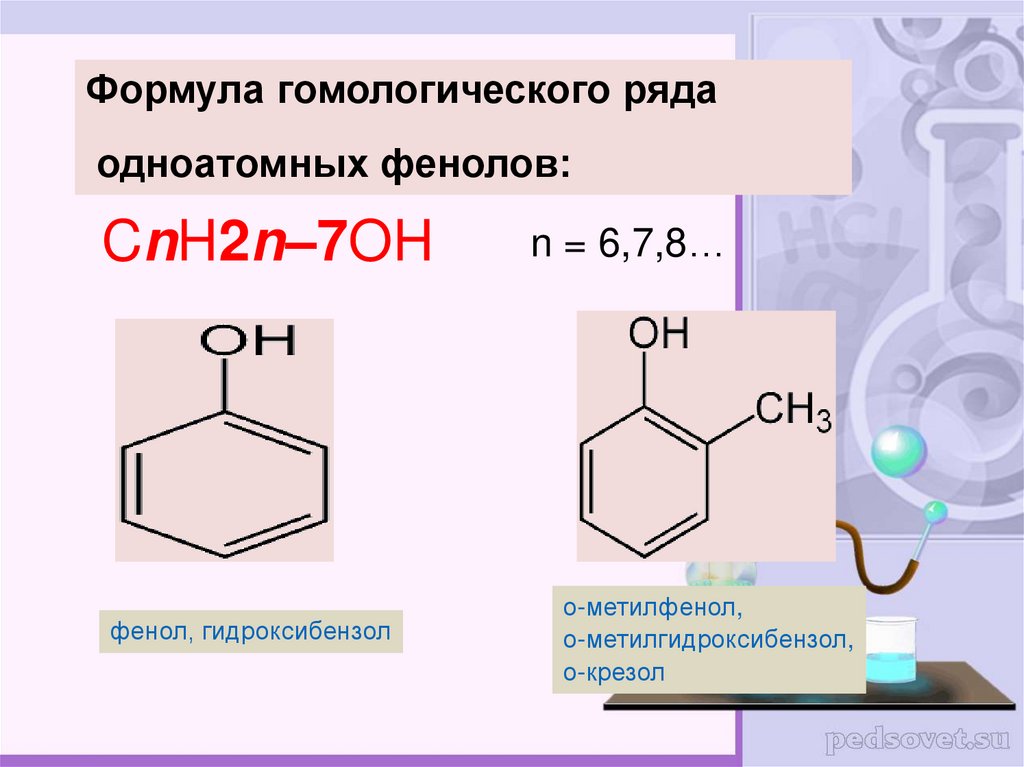
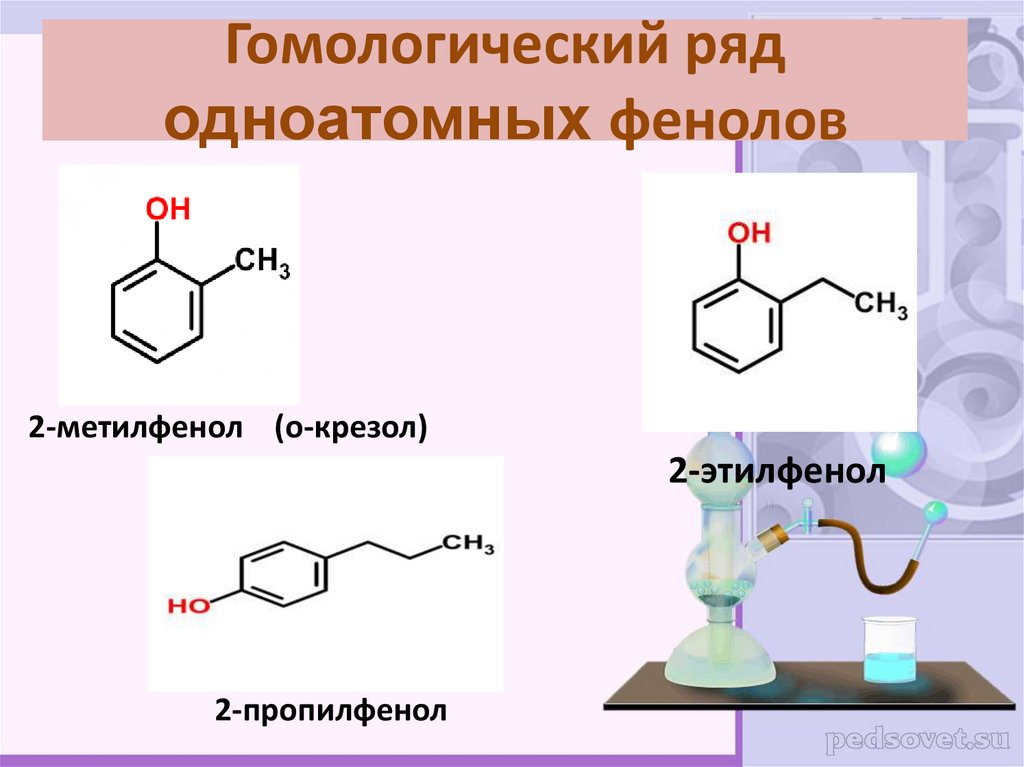
Формула гомологического рядаодноатомных фенолов:
CnH2n–7OH
фенол, гидроксибензол
n = 6,7,8…
о-метилфенол,
о-метилгидроксибензол,
о-крезол
11. Гомологический ряд одноатомных фенолов
2-метилфенол (о-крезол)2-этилфенол
2-пропилфенол
12. Изомерия
Структурная:• 1) по положению заместителей
(у гомологов фенола)
• 2)по положению группы - OH в
многоатомных фенолах
13. Изомерия по положению заместителей (у гомологов фенола)
а) 2-метилфенол(о-крезол)
б) 3-метилфенол
(м-крезол)
в) 4-метилфенол
(n-крезол)
14.
Изомерияпо положению группы - OH в многоатомных
фенолах
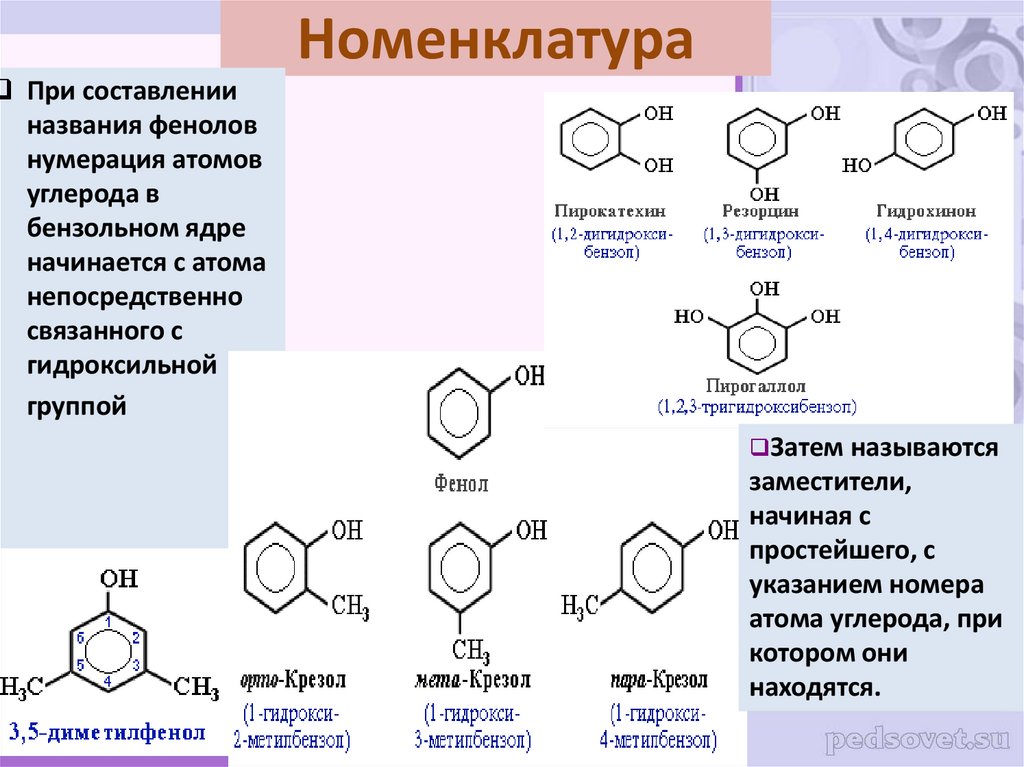
15. Номенклатура
При составленииназвания фенолов
нумерация атомов
углерода в
бензольном ядре
начинается с атома
непосредственно
связанного с
гидроксильной
группой
Затем называются
заместители,
начиная с
простейшего, с
указанием номера
атома углерода, при
котором они
находятся.
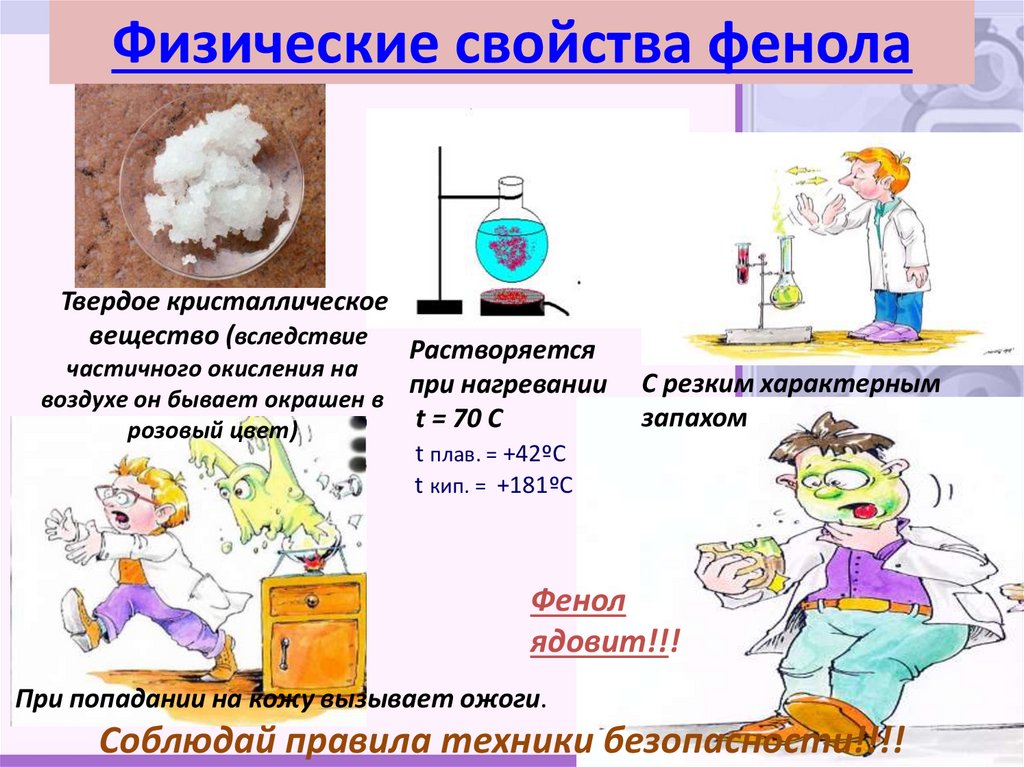
16. Физические свойства фенола
Твердое кристаллическоевещество (вследствие Растворяется
частичного окисления на
при нагревании
воздухе он бывает окрашен в
t = 70 C
розовый цвет)
С резким характерным
запахом
t плав. = +42ºС
t кип. = +181ºС
Фенол
ядовит!!!
При попадании на кожу вызывает ожоги.
Соблюдай правила техники безопасности!!!!
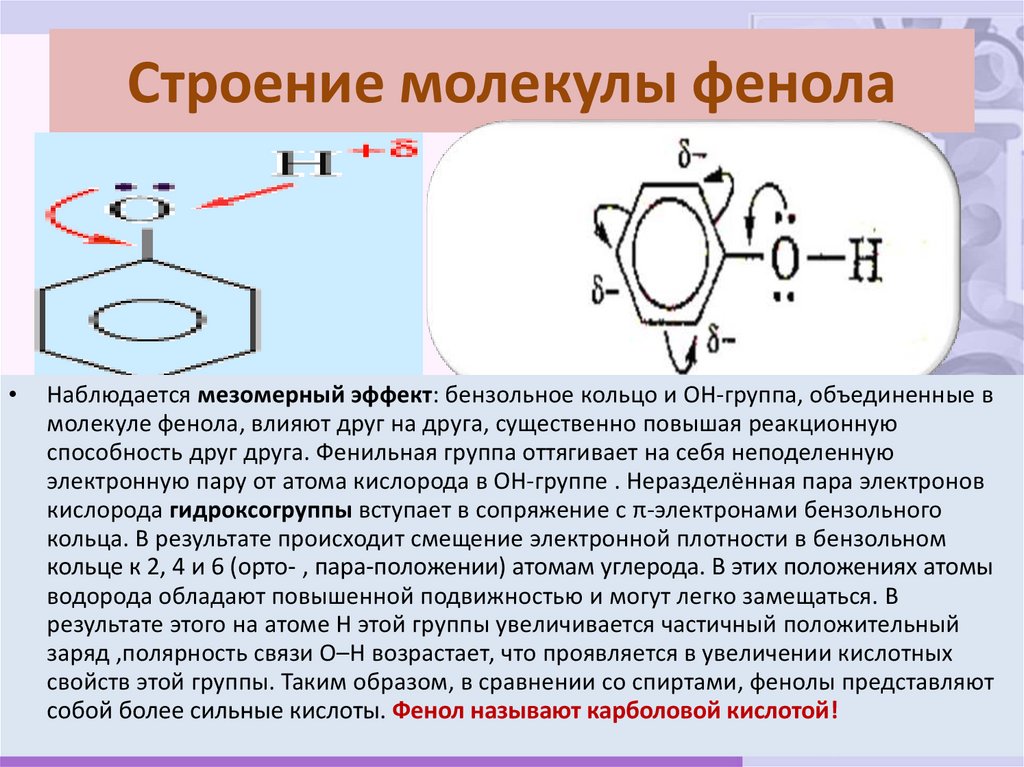
17. Строение молекулы фенола
Наблюдается мезомерный эффект: бензольное кольцо и ОН-группа, объединенные в
молекуле фенола, влияют друг на друга, существенно повышая реакционную
способность друг друга. Фенильная группа оттягивает на себя неподеленную
электронную пару от атома кислорода в ОН-группе . Неразделённая пара электронов
кислорода гидроксогруппы вступает в сопряжение с π-электронами бензольного
кольца. В результате происходит смещение электронной плотности в бензольном
кольце к 2, 4 и 6 (орто- , пара-положении) атомам углерода. В этих положениях атомы
водорода обладают повышенной подвижностью и могут легко замещаться. В
результате этого на атоме Н этой группы увеличивается частичный положительный
заряд ,полярность связи О–Н возрастает, что проявляется в увеличении кислотных
свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют
собой более сильные кислоты. Фенол называют карболовой кислотой!
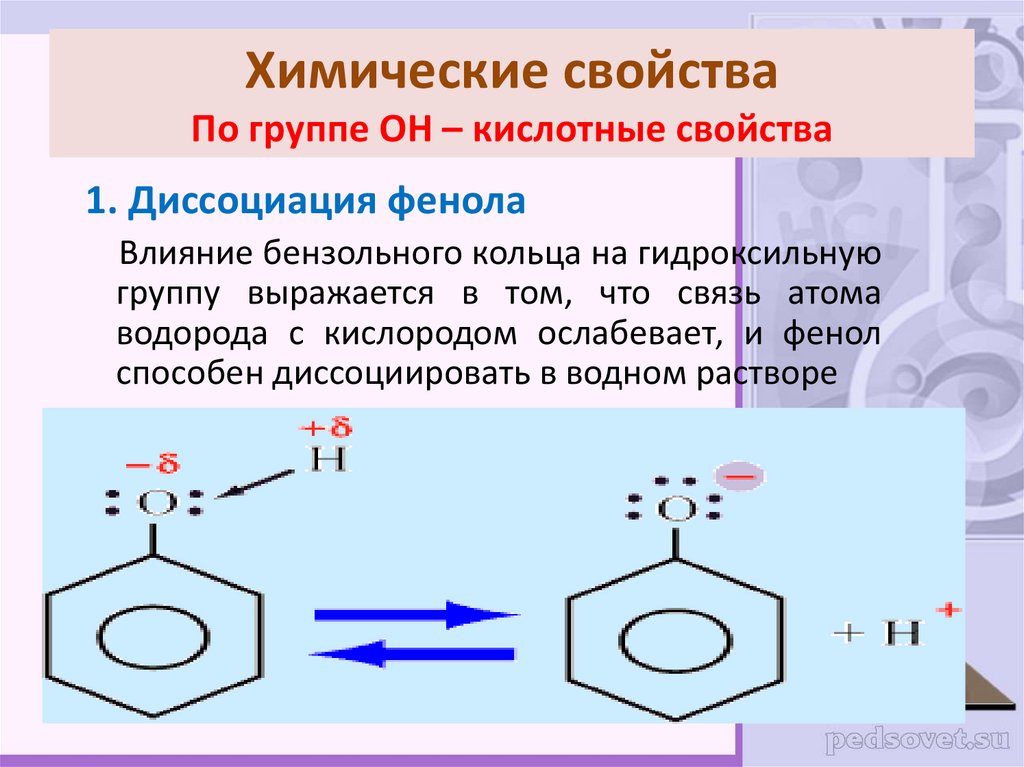
18. Химические свойства По группе ОН – кислотные свойства
1. Диссоциация фенолаВлияние бензольного кольца на гидроксильную
группу выражается в том, что связь атома
водорода с кислородом ослабевает, и фенол
способен диссоциировать в водном растворе
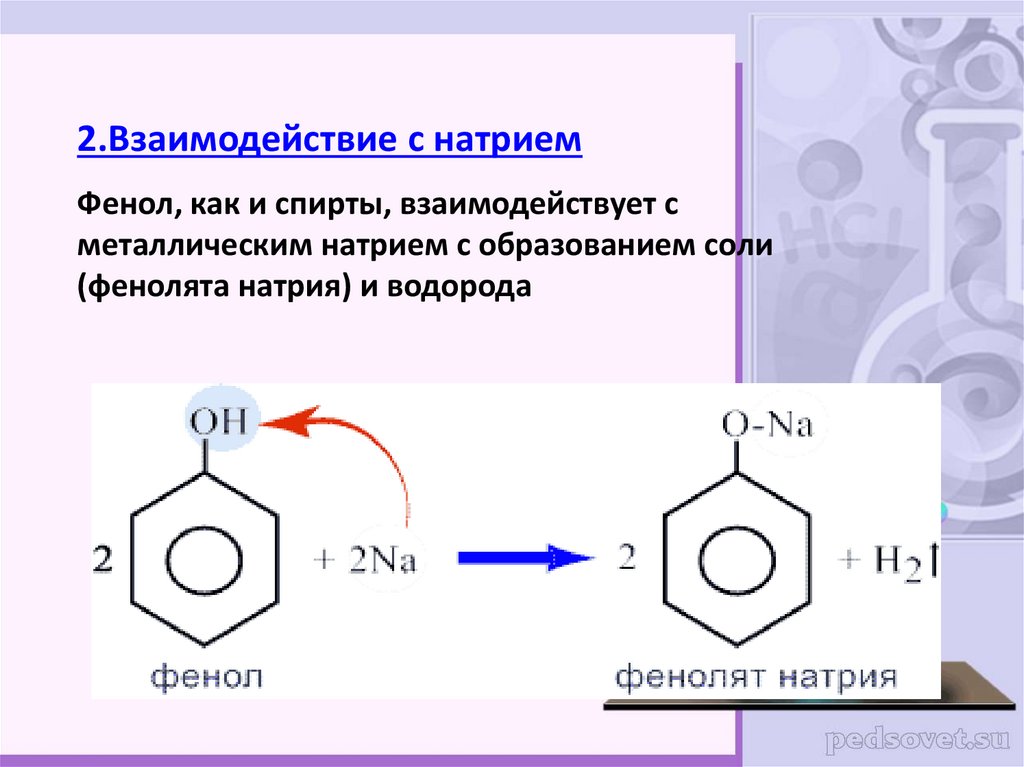
19.
2.Взаимодействие с натриемФенол, как и спирты, взаимодействует с
металлическим натрием с образованием соли
(фенолята натрия) и водорода
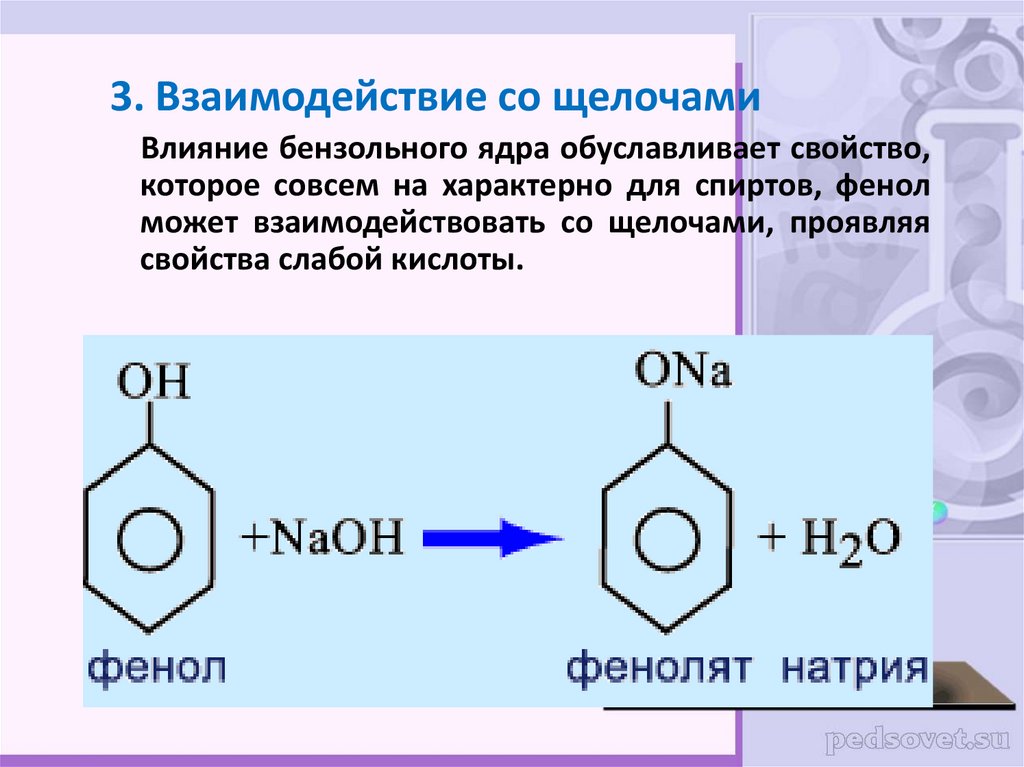
20.
3. Взаимодействие со щелочамиВлияние бензольного ядра обуславливает свойство,
которое совсем на характерно для спиртов, фенол
может взаимодействовать со щелочами, проявляя
свойства слабой кислоты.
21.
22.
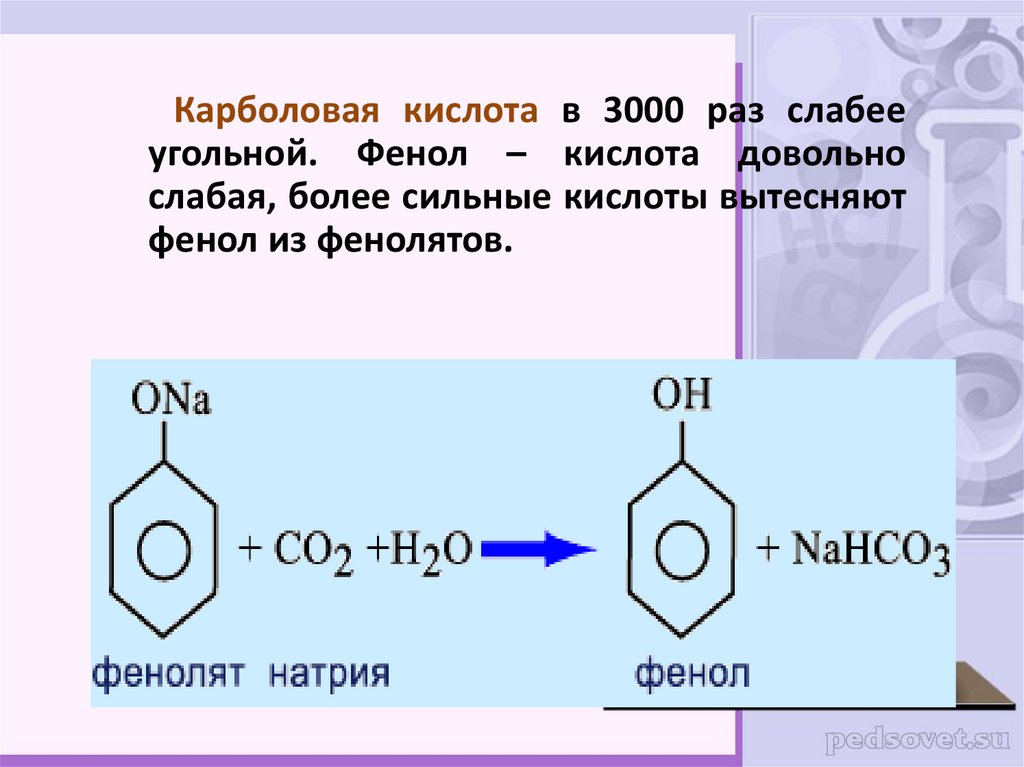
Карболовая кислота в 3000 раз слабееугольной. Фенол – кислота довольно
слабая, более сильные кислоты вытесняют
фенол из фенолятов.
23. Фенол не вступает в реакции дегидратации, не взаимодействует НГал, спиртами, кислотами. Соответствующие производные фенола
получают с помощью фенолятов илигалогенбензолов
дифениловый эфир
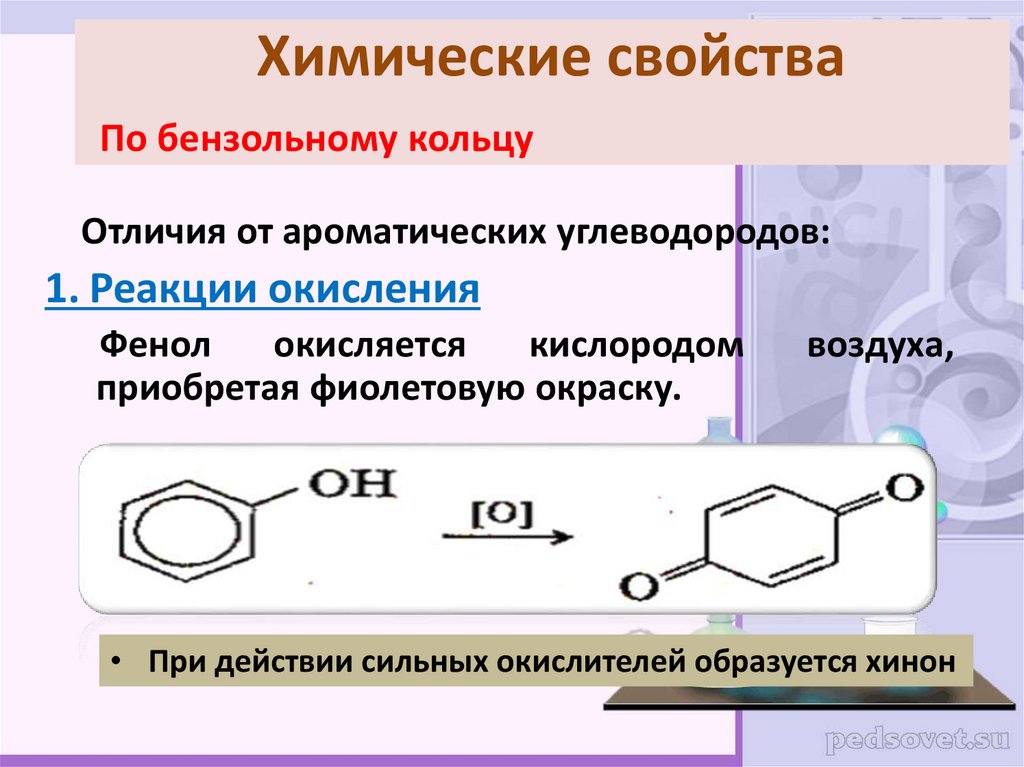
24. Химические свойства По бензольному кольцу
Отличия от ароматических углеводородов:1. Реакции окисления
Фенол
окисляется
кислородом
приобретая фиолетовую окраску.
воздуха,
• При действии сильных окислителей образуется хинон
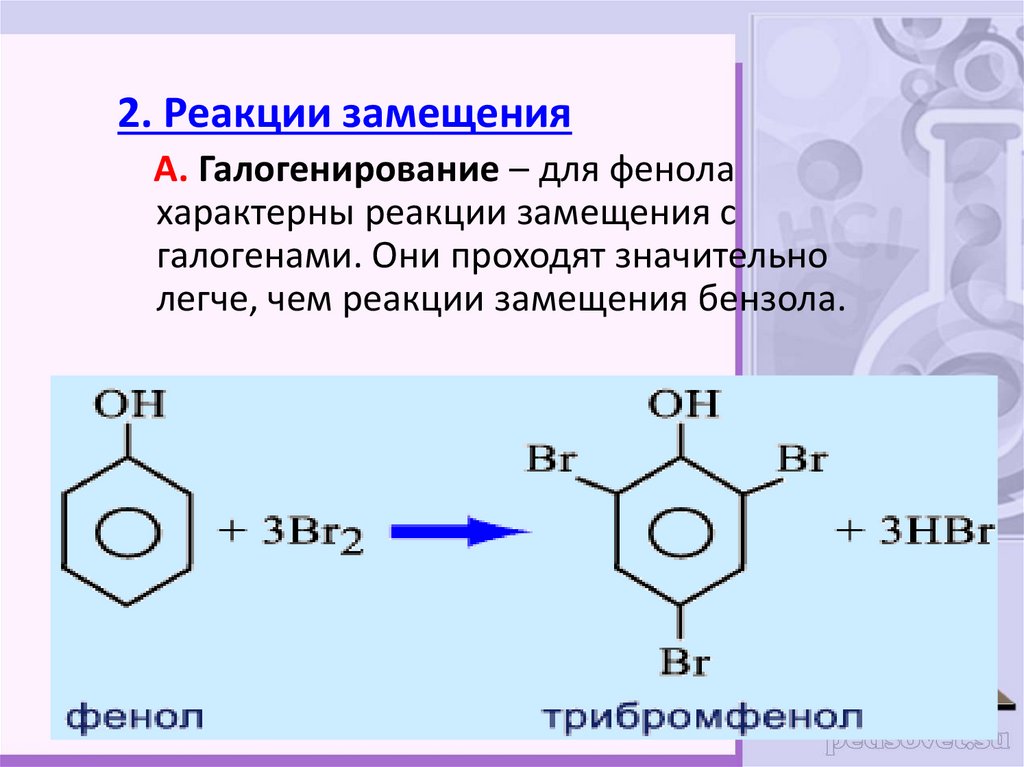
25.
2. Реакции замещенияА. Галогенирование – для фенола
характерны реакции замещения с
галогенами. Они проходят значительно
легче, чем реакции замещения бензола.
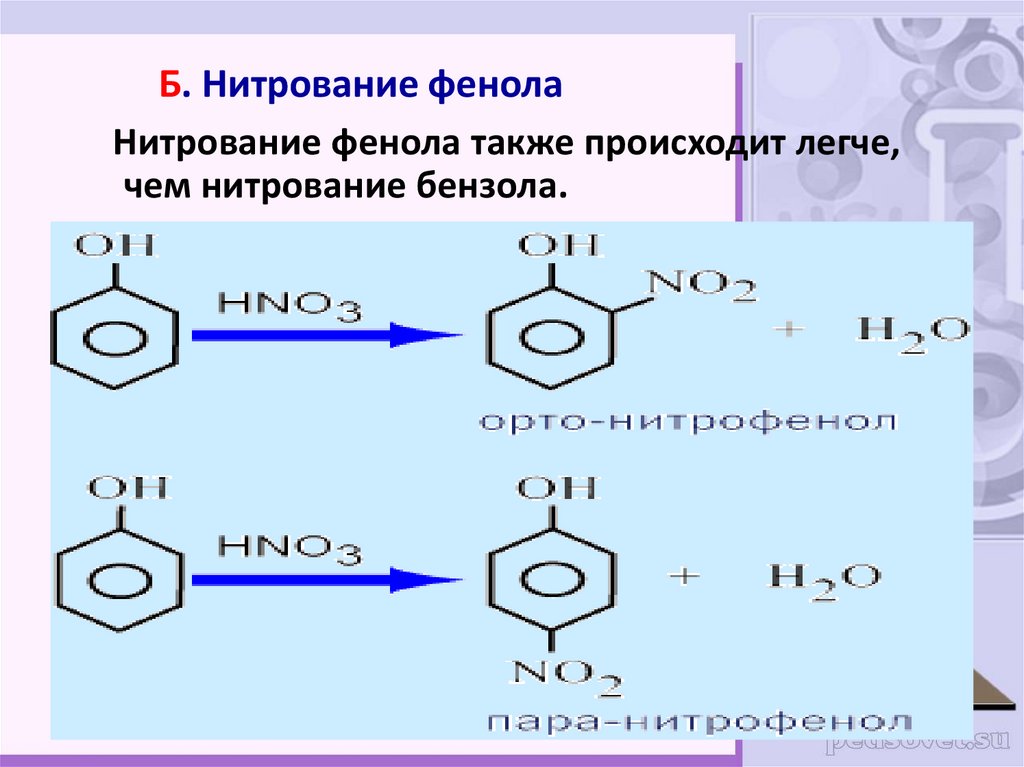
26. Б. Нитрование фенола
Нитрование фенола также происходит легче,чем нитрование бензола.
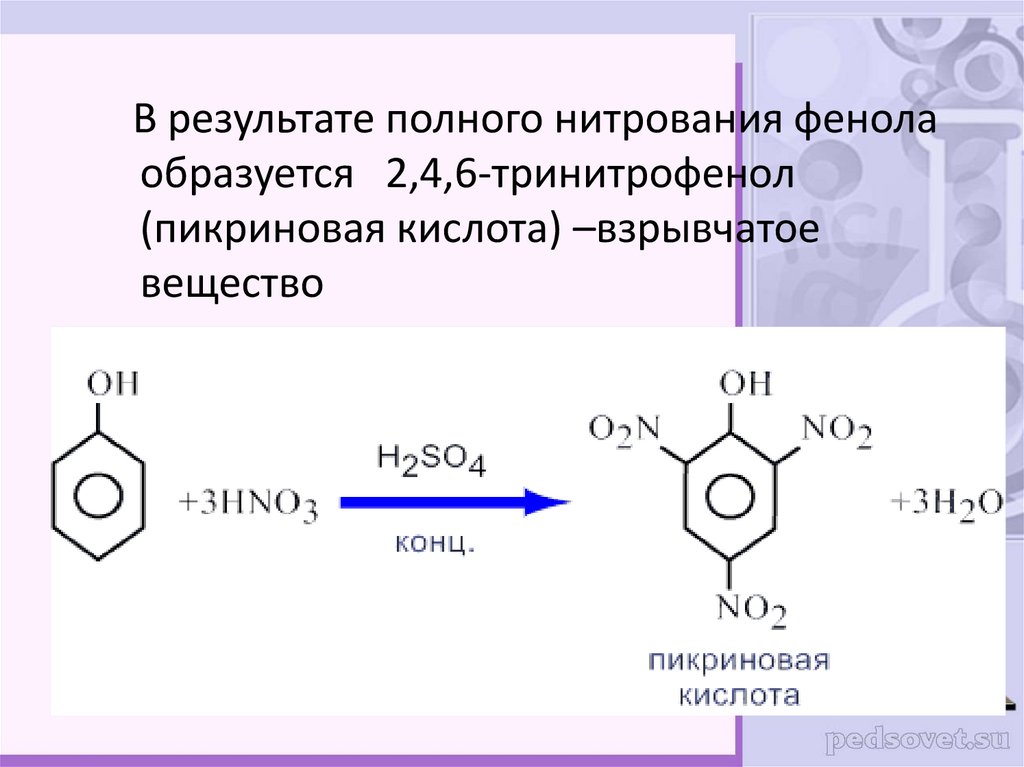
27.
В результате полного нитрования фенолаобразуется 2,4,6-тринитрофенол
(пикриновая кислота) –взрывчатое
вещество
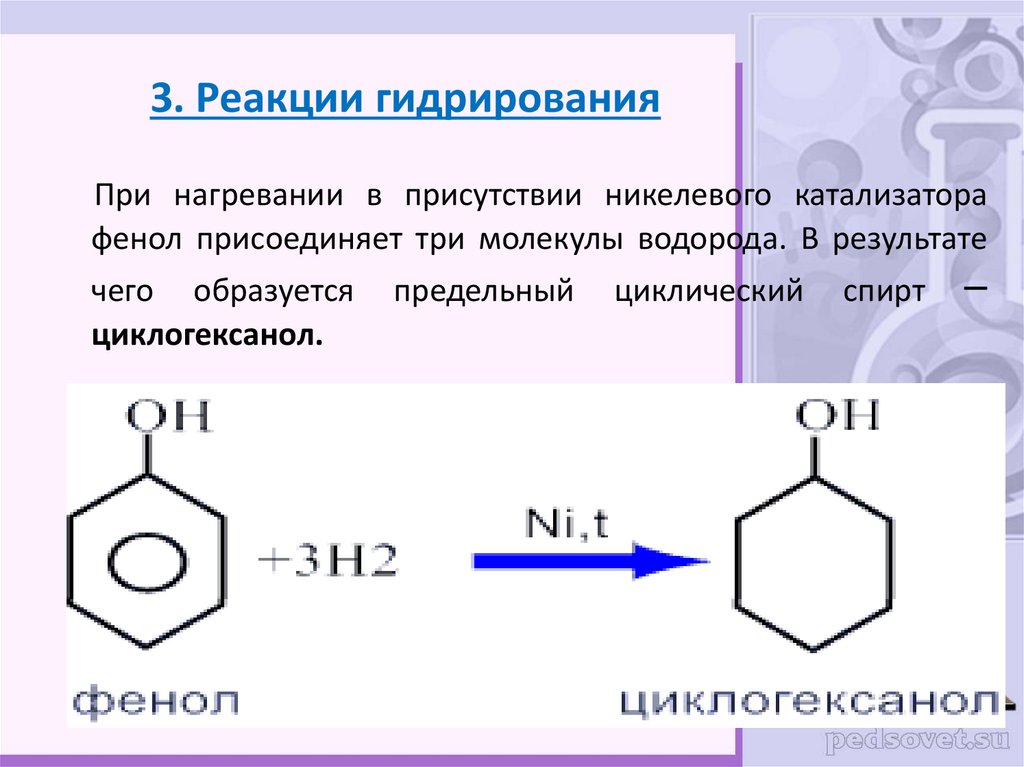
28. 3. Реакции гидрирования
При нагревании в присутствии никелевого катализаторафенол присоединяет три молекулы водорода. В результате
чего образуется
циклогексанол.
предельный
циклический
спирт
–
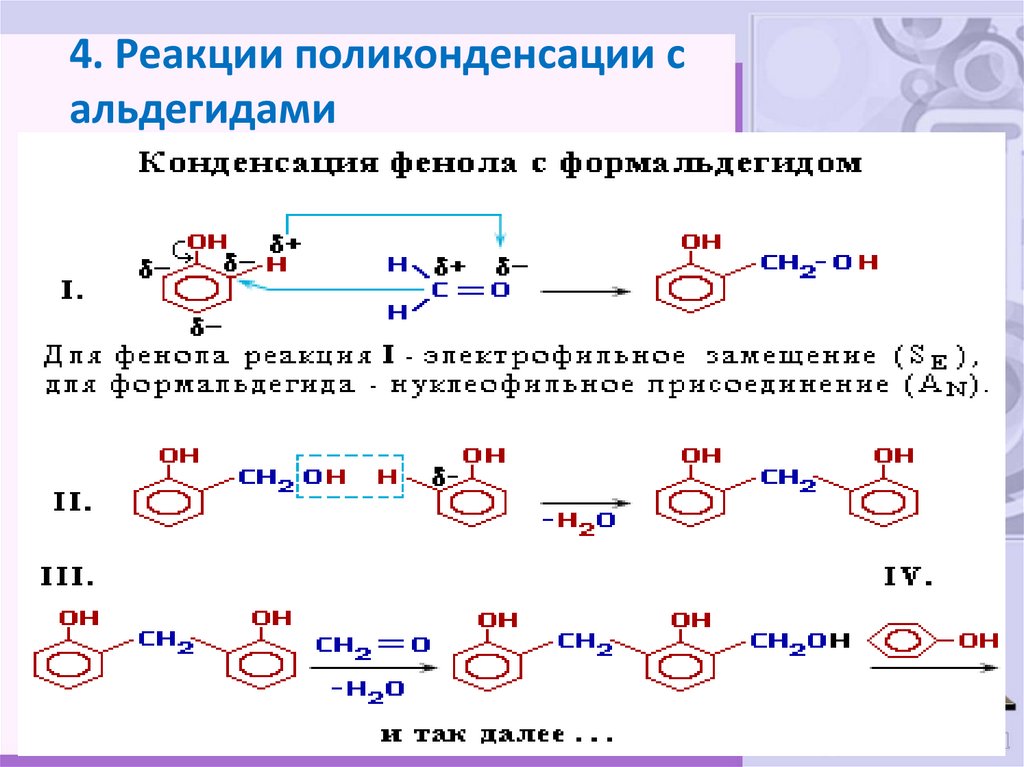
29. 4. Реакции поликонденсации с альдегидами
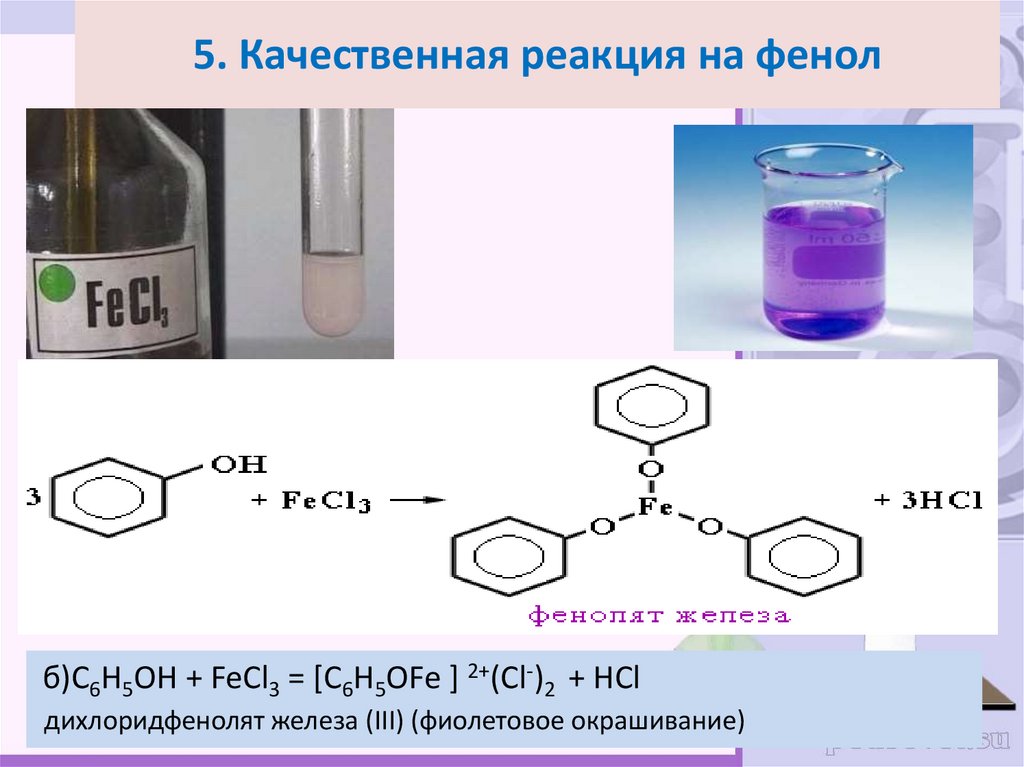
30. 5. Качественная реакция на фенол
б)C6H5OH + FeCl3 = [C6H5OFe ] 2+(Cl-)2 + HClдихлоридфенолят железа (III) (фиолетовое окрашивание)
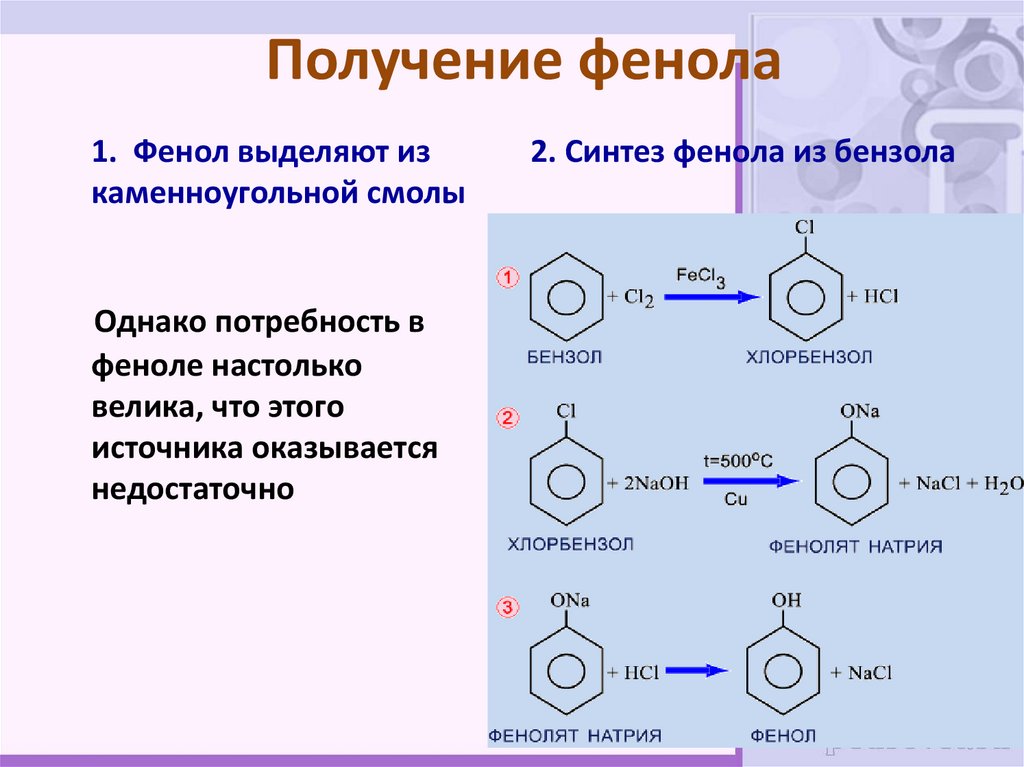
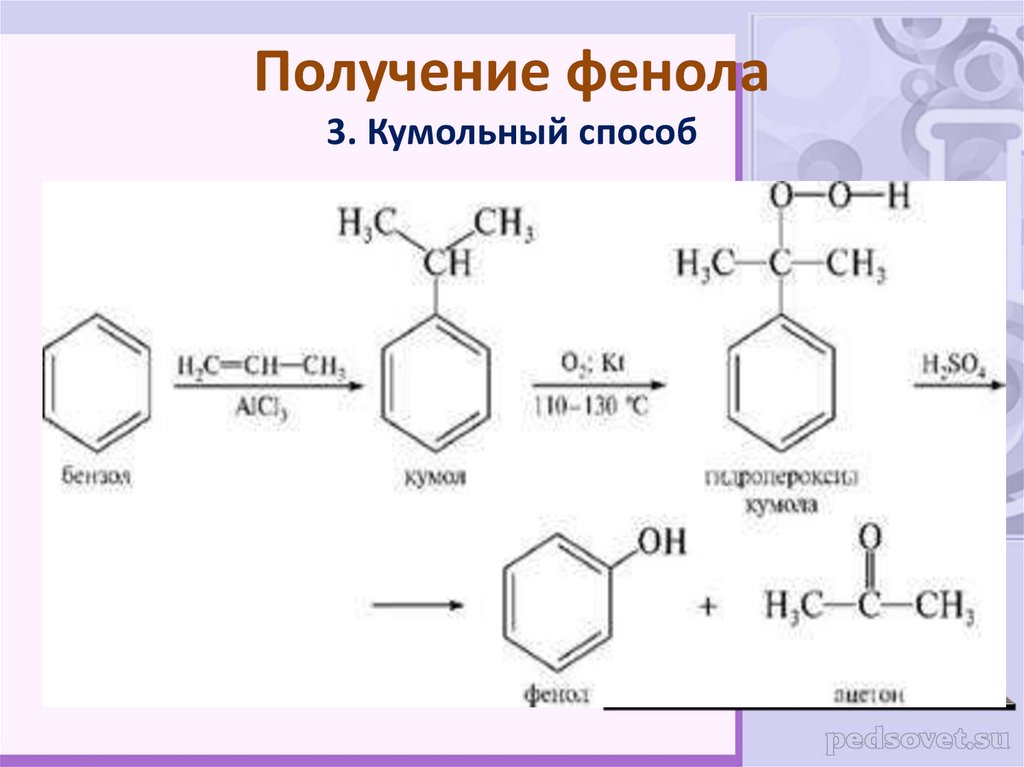
31. Получение фенола
• Одним из основных источников дляпромышленного получения фенола является
каменный уголь
32. Получение фенола
1. Фенол выделяют изкаменноугольной смолы
Однако потребность в
феноле настолько
велика, что этого
источника оказывается
недостаточно
2. Синтез фенола из бензола
33. Получение фенола 3. Кумольный способ
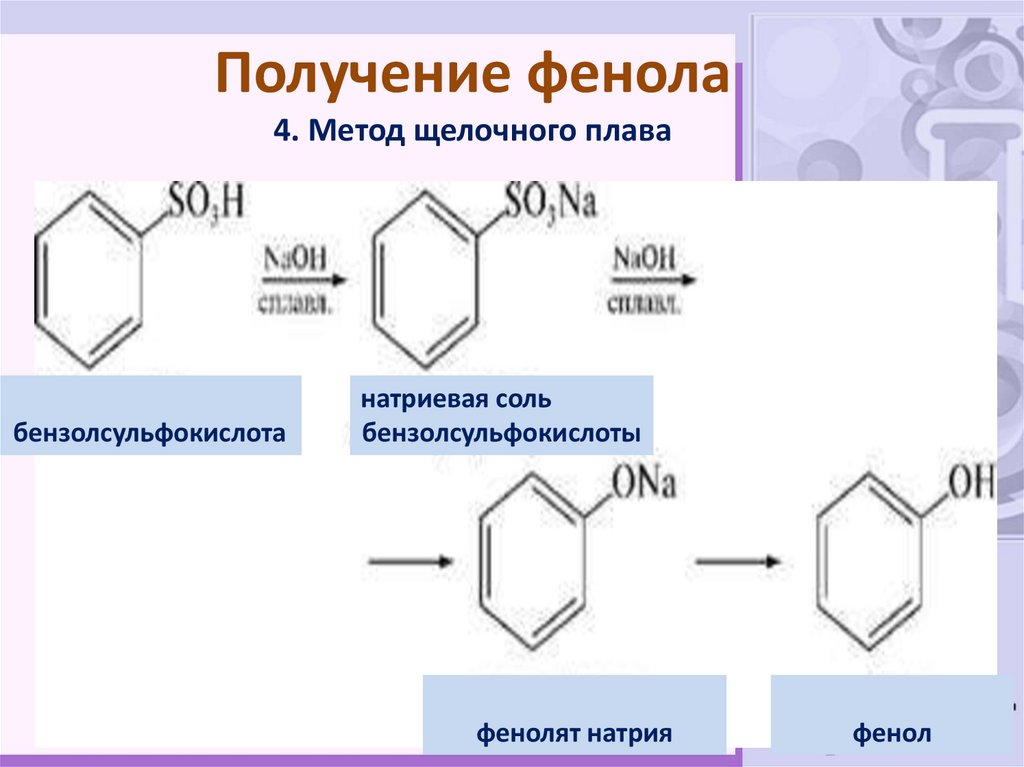
34. Получение фенола 4. Метод щелочного плава
бензолсульфокислотанатриевая соль
бензолсульфокислоты
фенолят натрия
фенол
35. Применение фенола
36. Применение фенола
• Фенолприменяют
для
производства
фенолформальдегидных
пластмасс,
синтетического
волокна
капролактам,
красителей,
лекарств,
взрывчатых веществ и других
продуктов. Раствор фенола в
воде
(карболовая
кислота)
обладает дезинфицирующими
свойствами
37.
По данным на 2006 год мировое потребление фенола имеет следующуюструктуру:
44 % фенола расходуется на производство бисфенола А, который, в свою
очередь, используется для производства поликарбона и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый
для получения искусственных волокон — нейлона и капрона;
остальные 14 % расходуются на другие нужды, в том числе на производство
антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных
алкилфенолов (неонолы), других фенолов (крезолов), лекарственных
препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4
% фенола применяется в медицине (орасепт) как обезболивающее и
антисептическое средство.
Фенол и его производные обуславливают консервирующие свойства
коптильного дыма. Также фенол используют в качестве консерванта в
вакцинах. Пример использования, в качестве антисептика — препарат
«Орасепт». В косметологии как химический пилинг (токсично).
в скотоводстве: дезинфекция животных растворами фенола и его
производных.
в косметологии для проведения глубокого пилинга.
38.
Чем опасен фенол?Практически
сразу
после получения фенола ученые
установили, что это химическое вещество обладает не только
полезными свойствами, что позволяет его использовать в
различных сферах науки и производства, но и является
сильнодействующим ядом. Так, вдыхание паров фенола в
течение непродолжительного времени может привести к
раздражению
носоглотки, ожогам дыхательных путей и
последующему отеку легких с летальным
исходом.
При соприкосновении
раствора фенола с кожей
образуются химические
ожоги, которые впоследствии
трансформируются в язвы.
39.
Сфера применения фенолов достаточно широка, но большинство жителейнашей страны узнало о них из-за скандала, разразившегося в конце 1990-х гг. вокруг
печально известных «фенольных домов» – панельных многоэтажек серии П-49/П,
построенных в конце 1970 – начале 1980-х гг. Эти дома
в
свое
время
считались экспериментальными. В бетон, использованный при их строительстве,
добавляли фенолформальдегид. Это должно было ускорить его затвердевание и тем
самым приблизить сроки сдачи домов. Новоселы, поначалу обрадовавшиеся
просторным квартирам, вскоре поняли, что вместе с новым жильем они получили
целый букет проблем со здоровьем – это и аллергия, и болезни глаз,
почек, дыхательных путей, и даже злокачественные новообразования. Дело в том,
что фенол и его производные без труда проникают в
организм человека через кожу и желудочнокишечный тракт, а пары фенола – через легкие.
В организме фенол легко образует
соединения
с
другими веществами,
присутствующими в организме.
Чем выше концентрация фенола в крови,
тем сильнее его неблагоприятное влияние на
здоровье человека.
40.
Симптомыотравления
фенолом
Хроническое отравление фенолом угрожает не только
жителям
«фенольных
домов».
Недобросовестные
изготовители
мебели,
строительных и отделочных материалов, лакокрасочных изделий,
декоративной косметики. Помните, если вас настораживает неприятный запах
недавно приобретенной вещи, если вам кажется, что ваше здоровье
после покупки мебели или недавнего ремонта пошатнулось, будет лучше
вызвать
специалиста-эколога,
который
проведет
все нужные
исследования и даст необходимые рекомендации. Хроническое отравление
фенолом вызывает поражения центральной нервной системы, нервные
расстройства, сопровождаемые головными болями и потерей сознания, а
также поражения почек, печени, органов дыхания и сердечно-сосудистой
системы.
41. Биологическая роль соединений фенола
Отрицательная(токсическое действие)
Положительная
лекарственные препараты (пурген,
парацетамол)
антисептики (3-5 % раствор – карболовая
кислота)
эфирные масла (обладают сильными
бактерицидными и противовирусными
свойствами, стимулируют иммунную
систему, повышают артериальное
давление: - анетол в укропе, фенхеле, анисе
- карвакрол и тимол в чабреце - эвгенол в
гвоздике, базилике
Флавоноиды (способствуют удалению
радиоактивных элементов из организма)
фенолформальдегидные смолы
пестициды, гербициды, инсектициды
загрязнение вод фенольными отходами
42. Химический диктант
Если утверждение правильное, то ставьте «да», если неправильное, то«нет».
1. Фенолы – это производные ароматических у/в, в молекулах
которых есть гидроксильная группа
2. Из фенолов получают фенопласты
3. При нитровании фенола получают тринитропроизводное
4. Фенол является тугоплавким веществом
5. Формула фенола – С6Н5NH2
6. Фенол при доступе воздуха розовеет
7. При взаимодействии фенола со щелочами, получаются феноляты
8. Фенол – газообразное вещество, с резким запахом
9. Фенолы – производные аренов
10. Фенол является сильной кислотой
11. При воздействии на кожу фенолом образуются язвы и волдыри
12. Фенол называют карболовой кислотой
43.
13. Из фенолов можно получить лекарства и фотореактивы14. Фенол получают только из каменноугольной смолы
15. Фенол представляет собой бесцветные кристаллы
16. При взаимодействии фенола с натрием, получают этилаты
17. Фенол не является антисептиком
18. Радикал С6Н5 называется фенил
19. Растворимость фенола в воде хорошая
20. Фенолы с одной гидроксогруппой называются
одноатомными
21. Все фенолы имеют бензольное ядро
22. При взаимодействии с бромом, образуется бромфенол
23. При взамодействии фенола с хлорным железом, появляется
синее окрашивание






















 Химия
Химия








