Похожие презентации:
Индивидуальные пути обмена аминокислот. Лекция №13. Часть 1
1. Индивидуальные пути обмена аминокислот – 1часть Индивидуальные пути обмена глицина, серина, цистеина, метионина, триптофана,
Лекция № 132. Классификация аминокислот по судьбе безазотистого остатка
Гликогенныеаминокислоты
образуют
промежуточные продукты ОПК (пируват, α-кетоглутарат,
сукцинил-КоА, фумарат, оксалоацетат), идущие процессе
глюконеогенеза на синтез глюкозы.
Кетогенные
аминокислоты
(Лиз,
Лей)
превращаются в ацетил-КоА из которого могут синтезироваться
кетоновые тела.
Гликокетогенные аминокислоты распадаются на два
продукта – метаболит ОПК и ацетил-КоА (Иле) или ацетоацетат
(Три, Фен, Тир), которые могут использоваться для синтеза как
глюкозы, так и кетоновых тел.
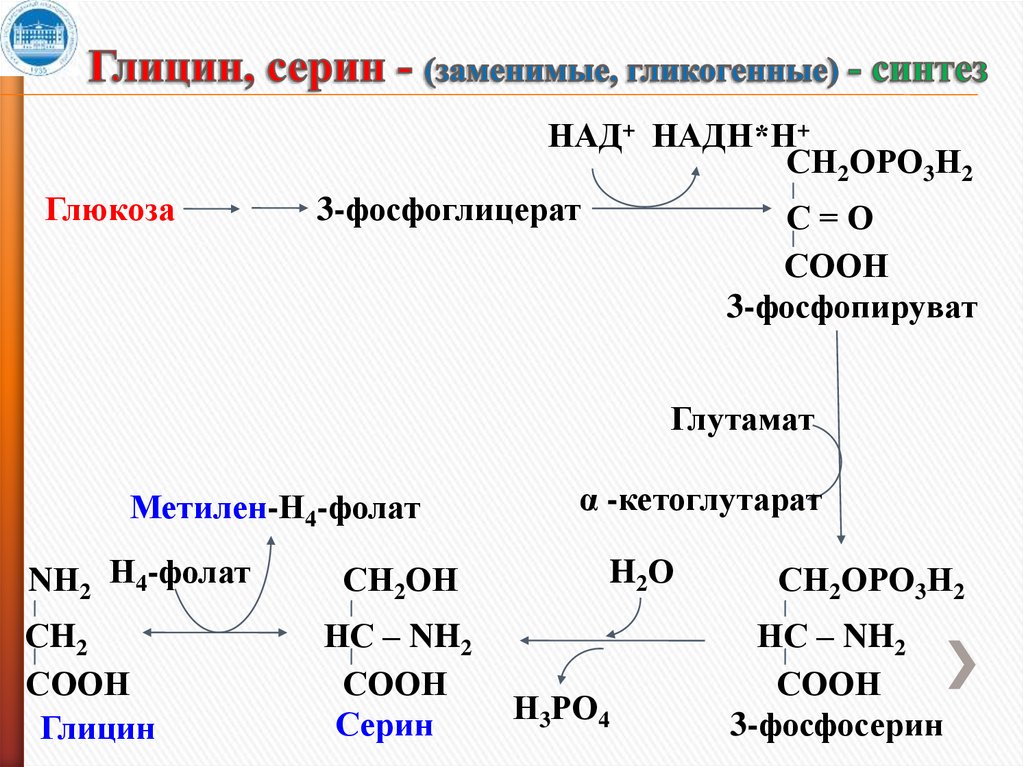
3. Глицин, серин - (заменимые, гликогенные) - синтез
ГлюкозаНАД+ НАДН*Н+
СН2ОРО3Н2
3-фосфоглицерат
С=О
СООН
3-фосфопируват
Глутамат
Метилен-Н4-фолат
NН2 Н4-фолат
СН2ОН
СH2
СООН
Глицин
НС – NH2
СООН
Серин
α -кетоглутарат
H2О
Н3РО4
СН2ОРО3Н2
НС – NH2
СООН
3-фосфосерин
4. Биологическая роль глицина
КреатинфосфатПуриновые
основания
Парные
желчные
кислоты
Белки
Гем
Глицин
Обезвреживающая
функция
Серин,
орнитин
Нейромедиаторная
функция
(тормозной медиатор)
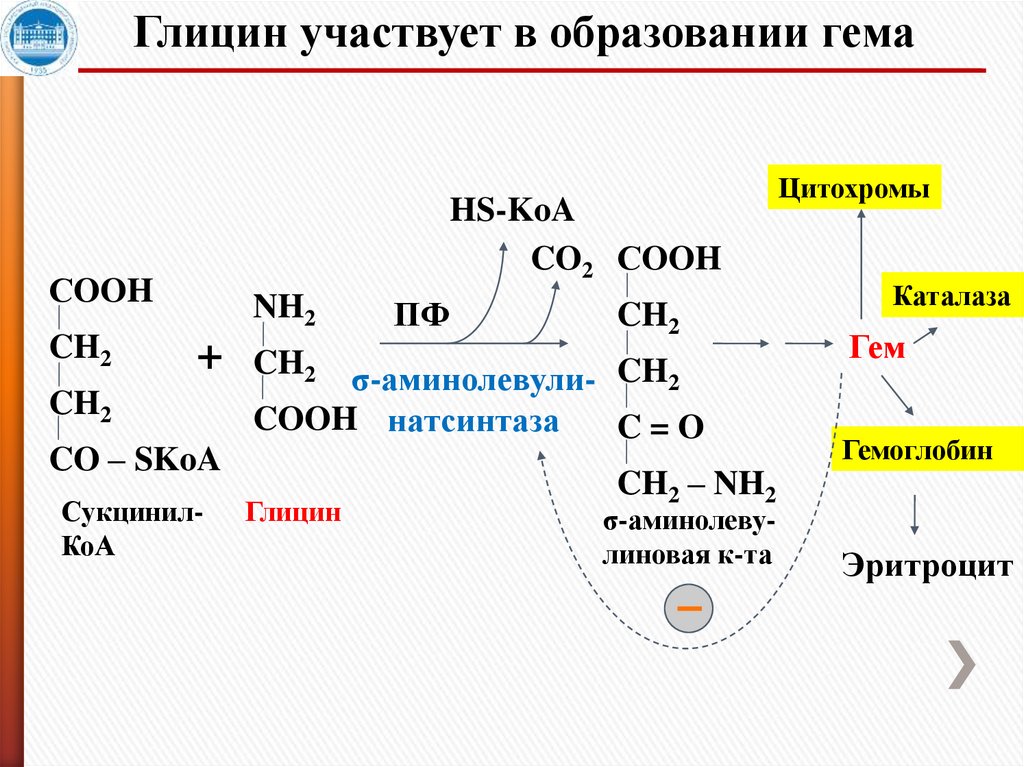
5.
Глицин участвует в образовании гемаHS-KoA
CO2 СOOH
СOOH
CH2
NH2
+ CH2
CH2
CO – SKoA
СукцинилКоА
ПФ
CH2
σ-аминолевули- CH2
COOH натсинтаза
C=O
Глицин
CH2 – NH2
σ-аминолевулиновая к-та
Цитохромы
Каталаза
Гем
Гемоглобин
Эритроцит
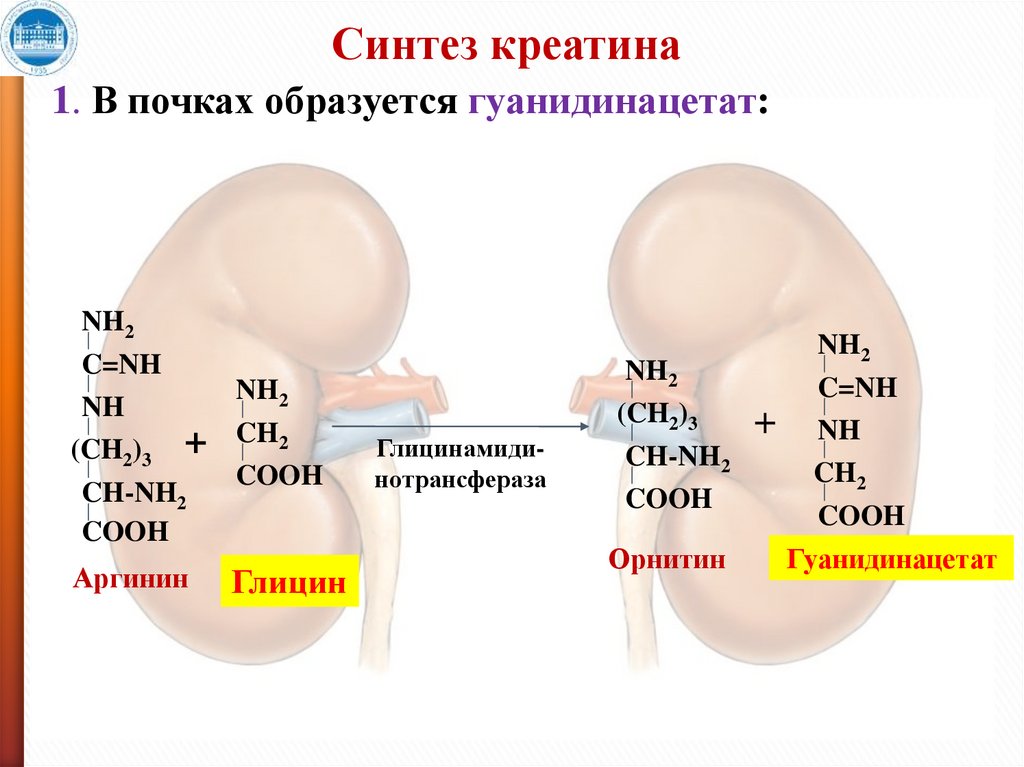
6.
Синтез креатина1. В почках образуется гуанидинацетат:
NH2
C=NH
NH
(CH2)3
+
CH-NH2
COOH
Аргинин
NH2
CH2
COOH
Глицин
Глицинамидинотрансфераза
NH2
(CH2)3
CH-NH2
COOH
Орнитин
+
NH2
C=NH
NH
CH2
COOH
Гуанидинацетат
7.
2. Гунидинацетат с кровотоком поступает впечень, где образуется креатин
N
N
C = NH
NH
CH2
SAM
SAG
Гуанидинацетатметилтрансфераза
C = NH
N – CH3
CH2
COOH
COOH
Гуанидинацетат
Креатин
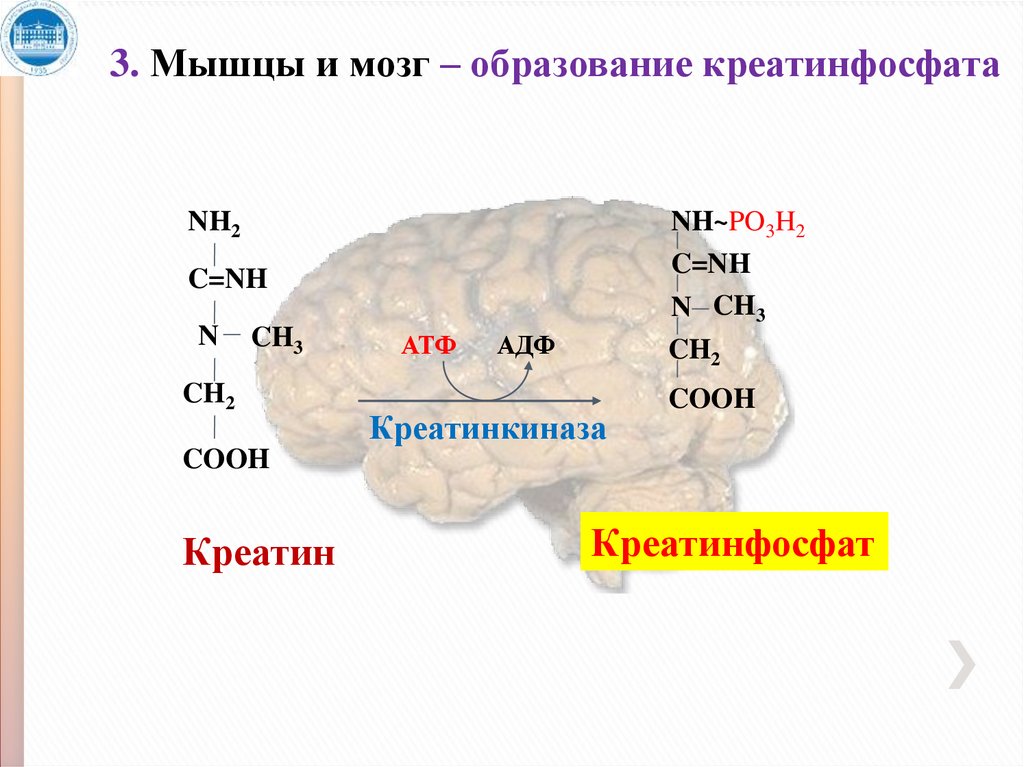
8.
3. Мышцы и мозг – образование креатинфосфатаNH2
NH~PO3H2
C=NH
N CH3
C=NH
N
CH3
CH2
АТФ
АДФ
CH2
Креатинкиназа
COOH
COOH
Креатин
Креатинфосфат
9. Биологическая роль креатинфосфата
4. Катаболизм креатина и креатинфосфатаNH2
C=NH АТФ АДФ
N CH3
CH2
COOH
Креатин
NH~PO3H2
C=NH
N CH3
Креатинкиназа CH
Pi
NH
C=NH
N CH3
2
CH2
COOH
CO
Креатинфосфат
H2 О
Кровь
Почки
Креатинин
Экскреция-1-2 г/сут
снижается выделение
при голодании,
острых инфекциях,
сахарном диабете,
гипертиреозе
10.
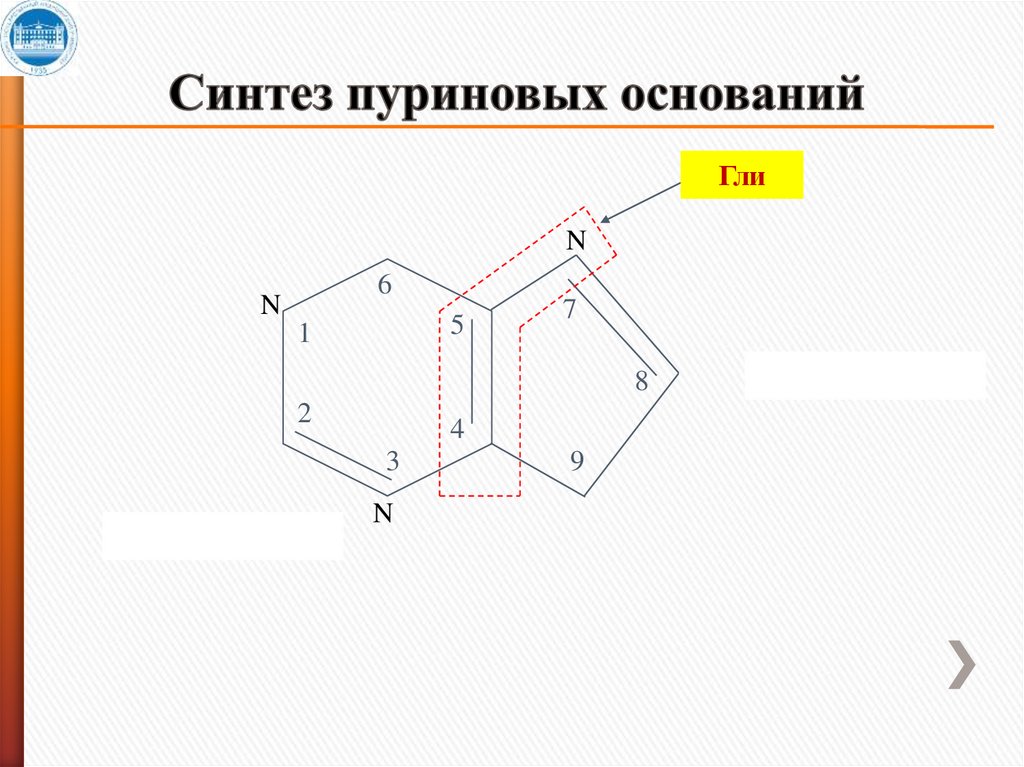
ГлиN
6
N
5
1
7
8
2
4
3
N
9
11. Синтез пуриновых оснований
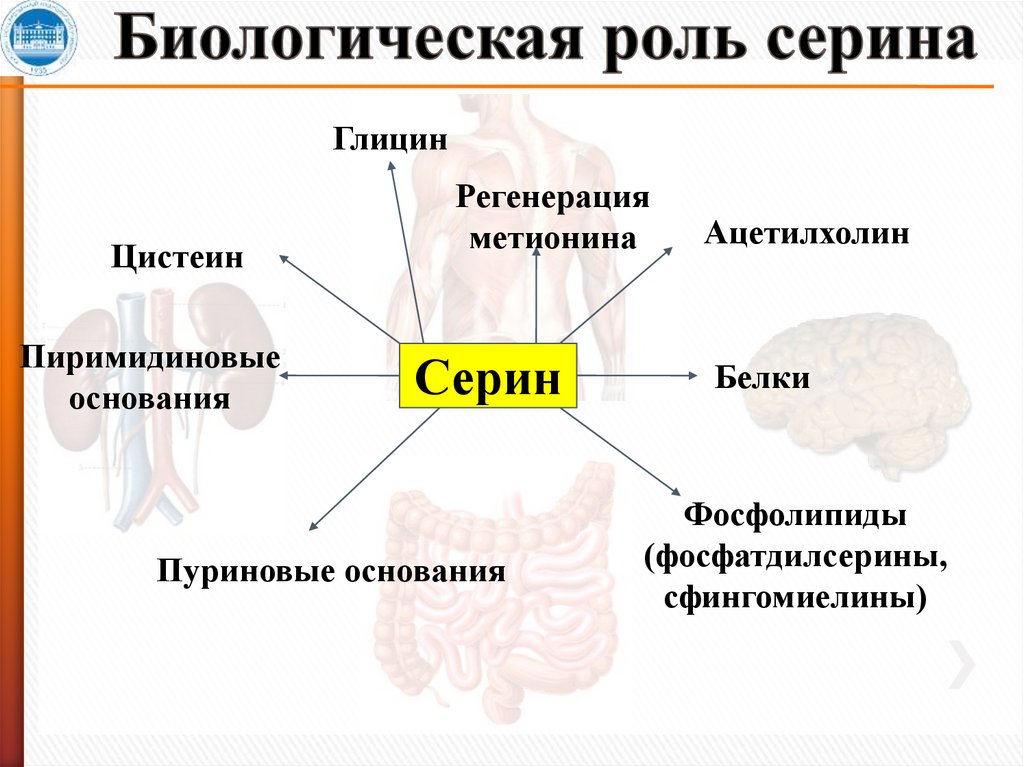
ГлицинЦистеин
Пиримидиновые
основания
Регенерация
метионина
Серин
Пуриновые основания
Ацетилхолин
Белки
Фосфолипиды
(фосфатдилсерины,
сфингомиелины)
12. Биологическая роль серина
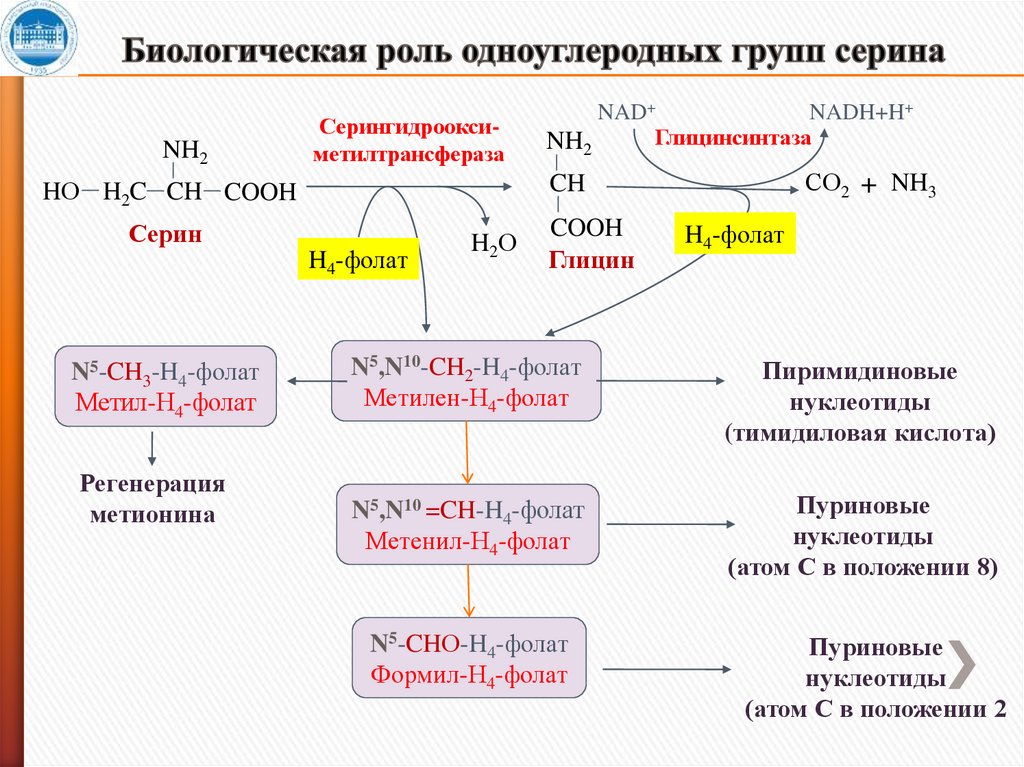
NH2Серингидрооксиметилтрансфераза
Серин
H4-фолат
Регенерация
метионина
СО2 + NH3
CH
HО H2C CH COOH
N5-CH3-H4-фолат
Метил-Н4-фолат
NAD+
NADH+H+
Глицинсинтаза
NH2
H2О
COOH
Глицин
H4-фолат
N5,N10-CH2-H4-фолат
Метилен-Н4-фолат
Пиримидиновые
нуклеотиды
(тимидиловая кислота)
N5,N10 =CH-H4-фолат
Метенил-Н4-фолат
Пуриновые
нуклеотиды
(атом С в положении 8)
N5-CHО-H4-фолат
Формил-Н4-фолат
Пуриновые
нуклеотиды
(атом С в положении 2
13. Биологическая роль одноуглеродных групп серина
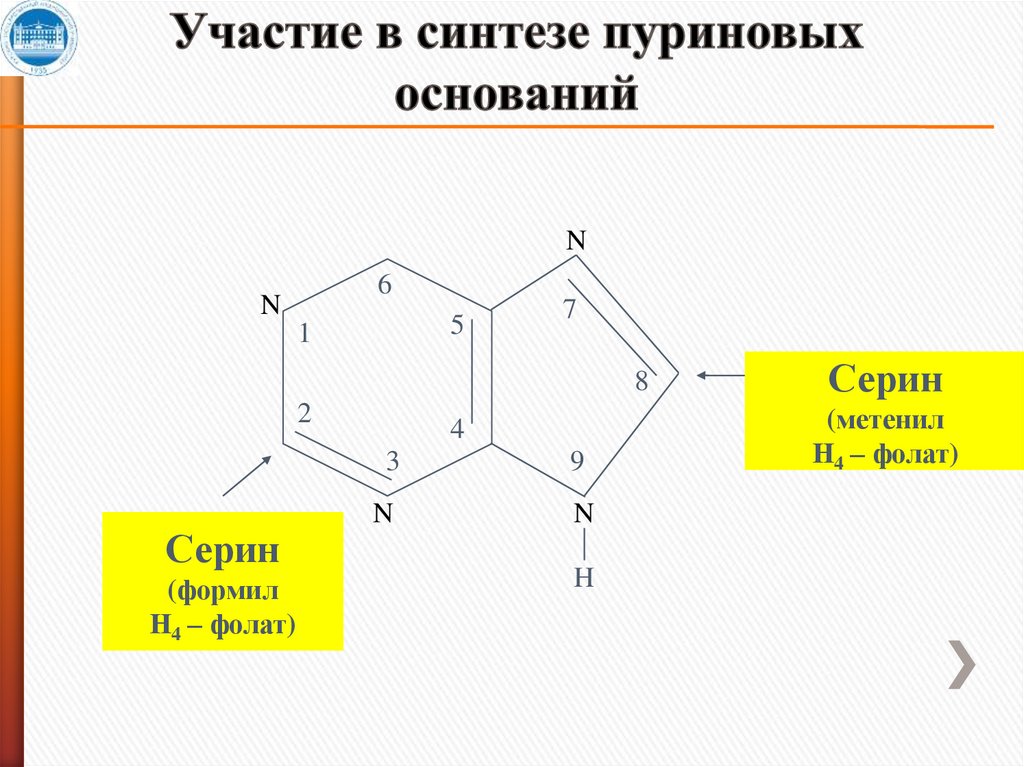
N6
N
5
1
7
8
2
Серин
(формил
Н4 – фолат)
4
3
9
N
N
H
Серин
(метенил
Н4 – фолат)
14. Участие в синтезе пуриновых оснований
СО2С
Асп
Глицин
N
С
N
С
С
С
Серин
NH
N
Глн
Серин
15. Использование глицина и серина для синтеза пуринов
16. Участие в синтезе пиримидиновых оснований
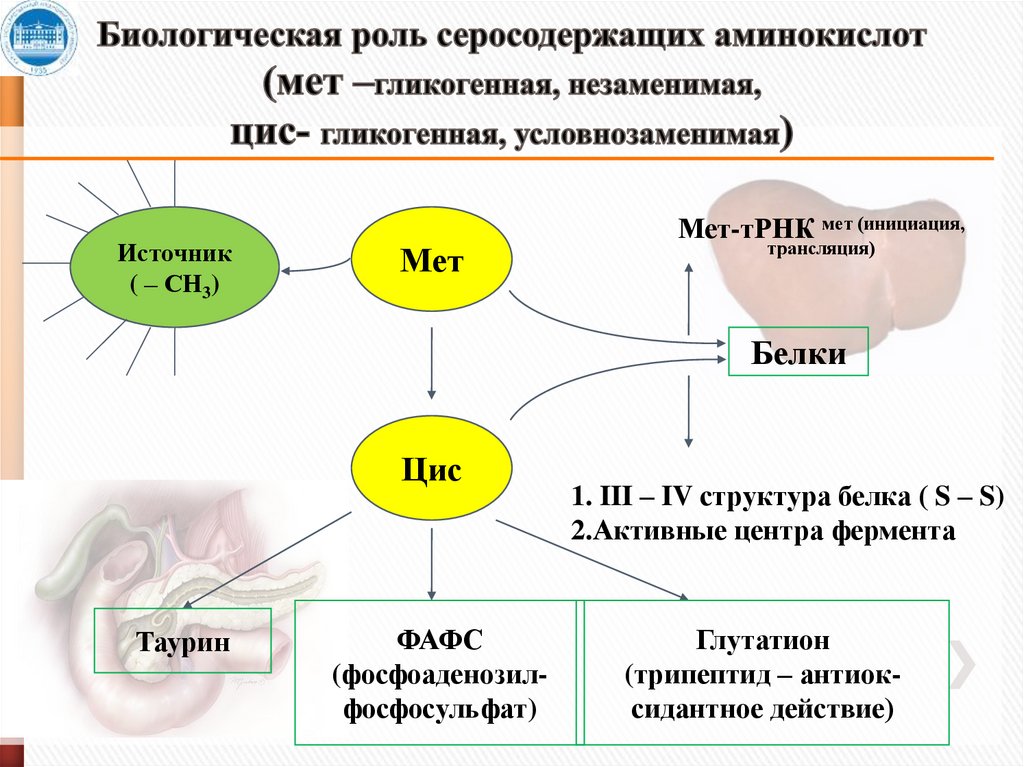
Источник( – СН3)
Мет
Мет-тРНК мет (инициация,
трансляция)
Белки
Цис
Таурин
ФАФС
(фосфоаденозилфосфосульфат)
1. III – IV структура белка ( S – S)
2.Активные центра фермента
Глутатион
(трипептид – антиоксидантное действие)
17. Участие в синтезе ацетилхолина
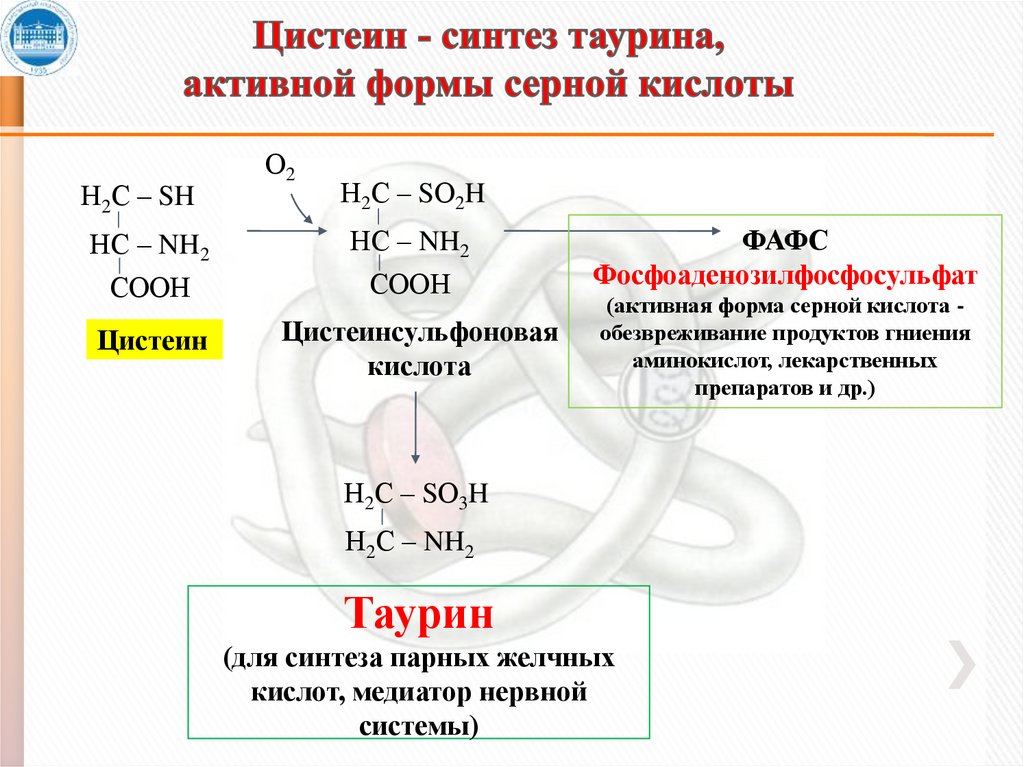
Н2С – SHО2
Н2С – SО2H
НС – NH2
НС – NH2
СООН
СООН
Цистеин
Цистеинсульфоновая
кислота
ФАФС
Фосфоаденозилфосфосульфат
(активная форма серной кислота обезвреживание продуктов гниения
аминокислот, лекарственных
препаратов и др.)
Н2С – SО3H
Н2С – NH2
Таурин
(для синтеза парных желчных
кислот, медиатор нервной
системы)
18.
Метаболизм метионинаМетионин
МетилН4-фолат
SAМ
В12
-СН3
МетиленН4-фолат
Н4-фолат
Глицин
В12(СН3)
Гомоцистеин
Серин
Серин
Глюкоза
Синтез:
адреналина,
холина,
креатина,
карнитина и др.
Цистеин
SAГ
Аденозин
ПФ
Гомосерин
Обезвреживание:
токсических
метаболитов и
лекарственных
веществ
19. Биологическая роль серосодержащих аминокислот (мет –гликогенная, незаменимая, цис- гликогенная, условнозаменимая)
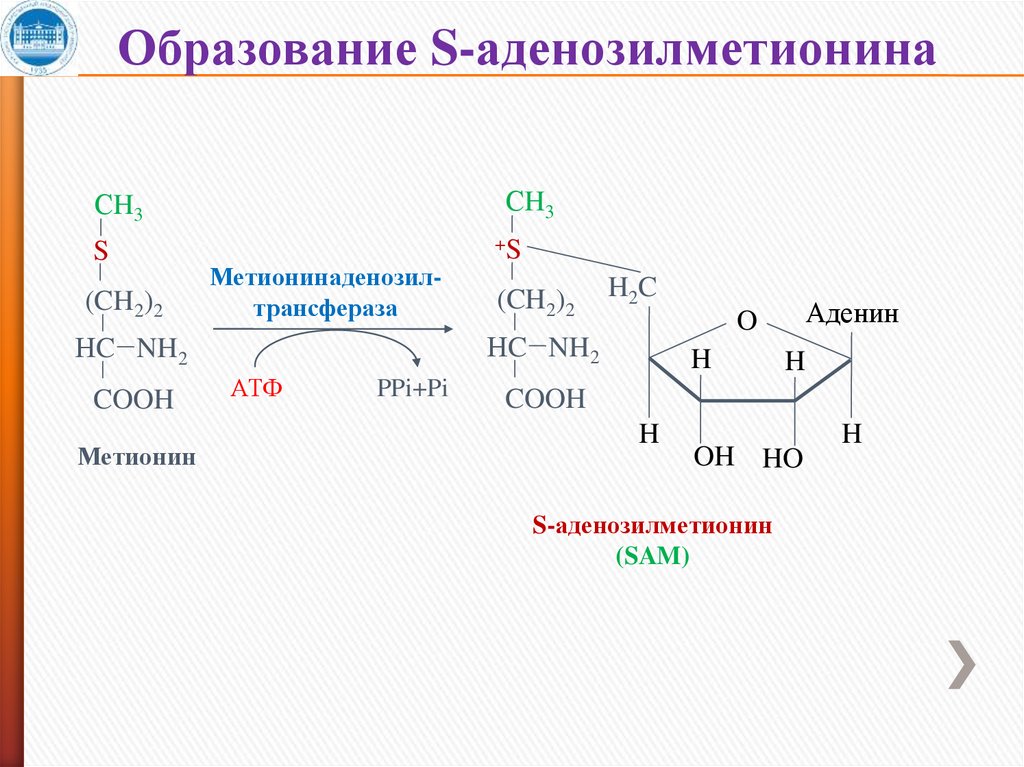
Образование S-аденозилметионинаСH3
СH3
S
+S
(CH2)2
Метионинаденозилтрансфераза
Метионин
H2C
АТФ
PPi+Pi
Аденин
O
НC NH2
НC NH2
COOH
(CH2)2
H
H
COOH
H
OH HO
S-аденозилметионин
(SAM)
H
20. Цистеин - синтез таурина, активной формы серной кислоты
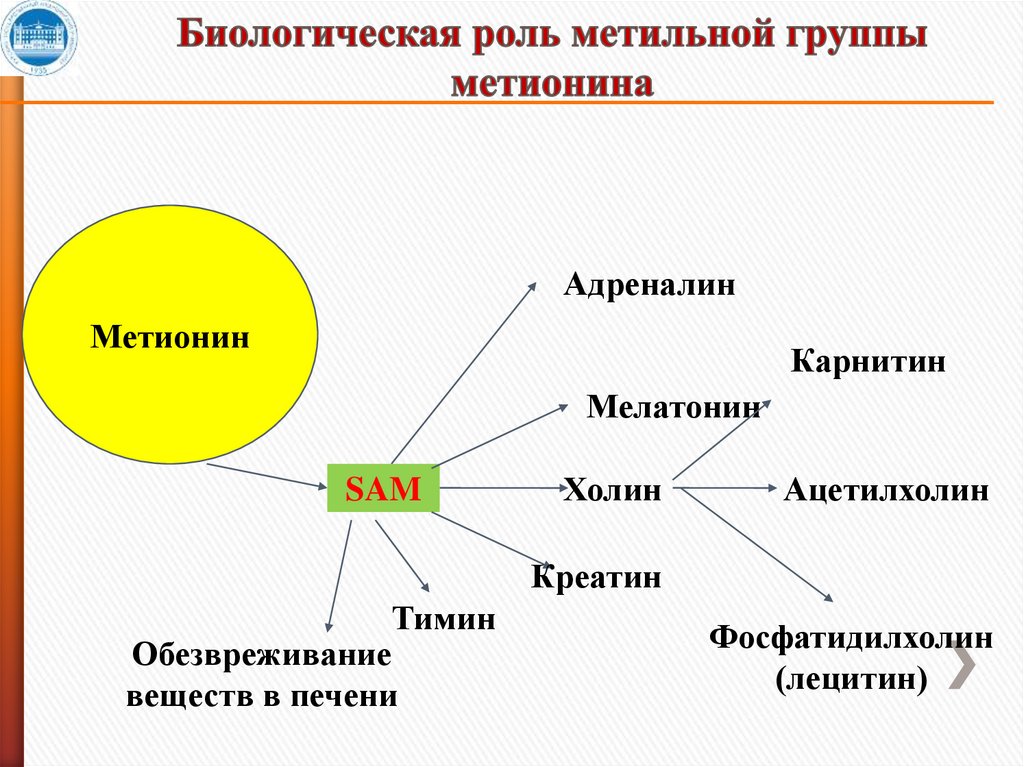
АдреналинМетионин
Карнитин
Мелатонин
SAM
Холин
Ацетилхолин
Креатин
Тимин
Обезвреживание
веществ в печени
Фосфатидилхолин
(лецитин)
21.
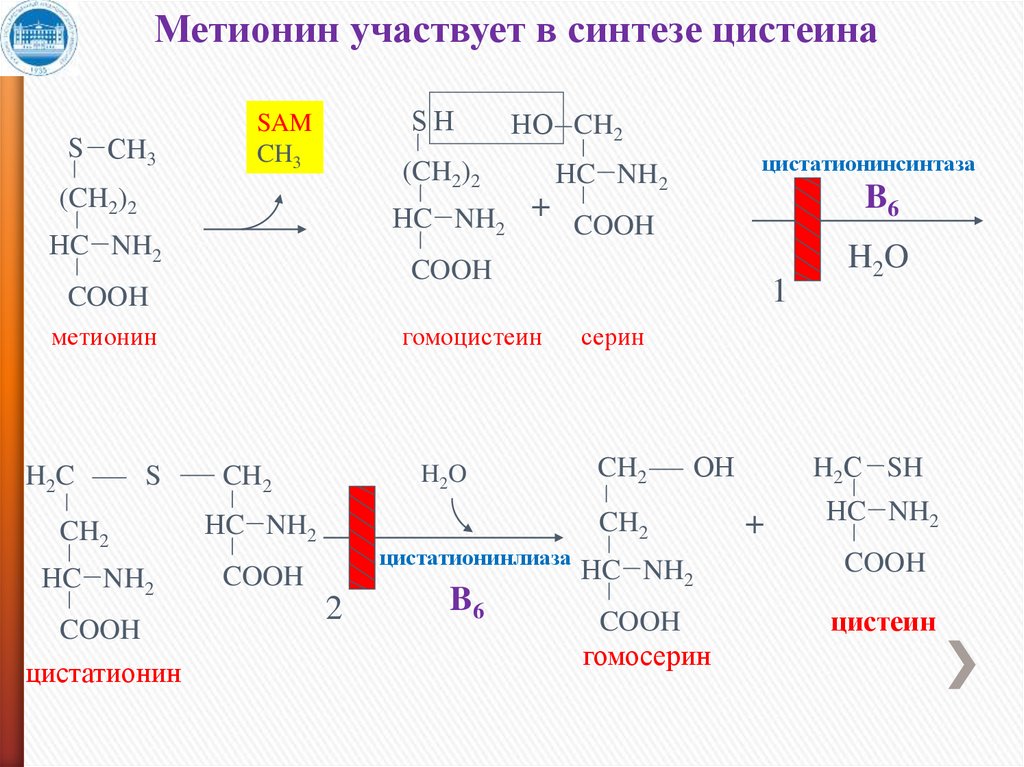
Метионин участвует в синтезе цистеинаS СH3
SН
SAM
CH3
НО CH2
(CH2)2
(CH2)2
НC NH2
НC NH2
+
цистатионинсинтаза
НC NH2
B6
COOH
COOH
1
COOH
метионин
H2C
S
гомоцистеин
CH2
НC NH2
НC NH2
COOH
COOH
цистатионин
H2O
CH2
серин
CH2
ОН
CH2
цистатионинлиаза
2
B6
H2O
H2С SH
+
НC NH2
НC NH2
COOH
COOH
гомосерин
цистеин
22.
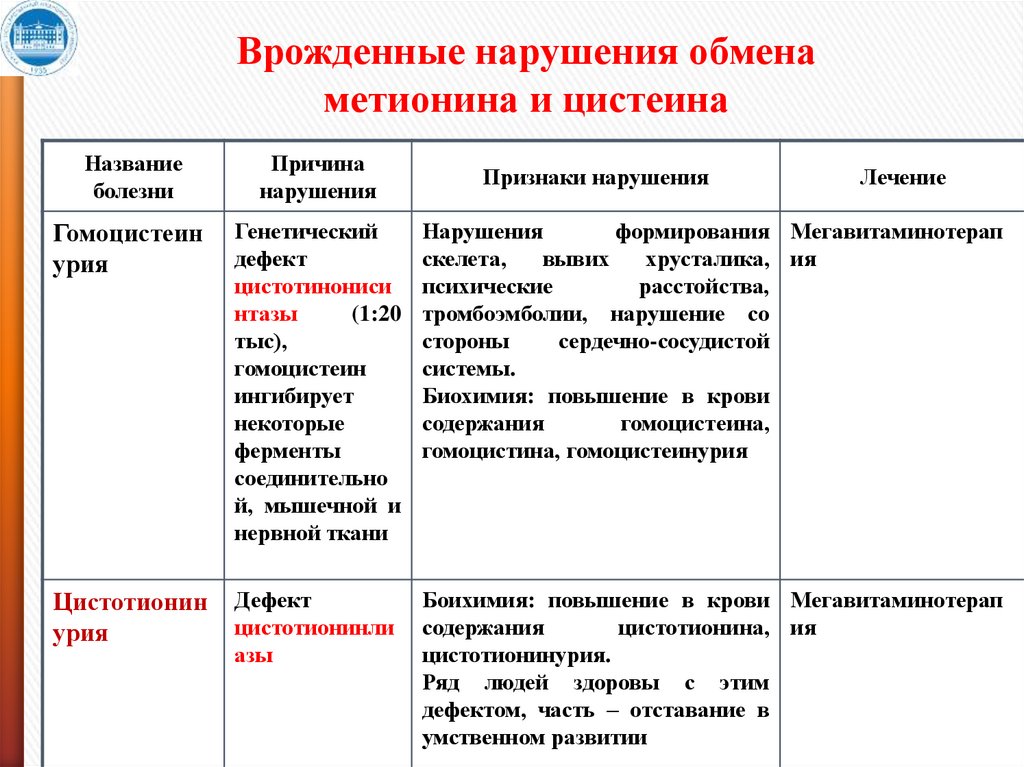
Врожденные нарушения обменаметионина и цистеина
Название
болезни
Причина
нарушения
Гомоцистеин
урия
Генетический
дефект
цистотинониси
нтазы
(1:20
тыс),
гомоцистеин
ингибирует
некоторые
ферменты
соединительно
й, мышечной и
нервной ткани
Нарушения
формирования Мегавитаминотерап
скелета,
вывих
хрусталика, ия
психические
расстойства,
тромбоэмболии, нарушение со
стороны
сердечно-сосудистой
системы.
Биохимия: повышение в крови
содержания
гомоцистеина,
гомоцистина, гомоцистеинурия
Цистотионин
урия
Дефект
цистотионинли
азы
Боихимия: повышение в крови Мегавитаминотерап
содержания
цистотионина, ия
цистотионинурия.
Ряд людей здоровы с этим
дефектом, часть – отставание в
умственном развитии
Признаки нарушения
Лечение
23. Биологическая роль метильной группы метионина
ЭпифизБелок
(активные центры)
Мелатонин (гормон)
Триптофан
Серотонин
(медиатор)
Нервная ткань,
гладкая мускулатура, кишечник
Ацетоацетат Глюкоза
Никотинамид
(витамин РР)
Печень
24.
Синтез серотонина (гладкая мускулатура, кишечник) имелатонина (эпифиз)
СН2
СН
О2
NН2
NН
НО
СООН
Н2О
Триптофандиоксигеназа (С)
Триптофан
НО
СН2
СН2
NН
Серотонин
СН3CoSKoA
Н3СО
СН2
NН2
NН
5-гидрокситриптофан
Н3СО
NН2
SAM
SAG
СН2
NН
NН
Мелатонин
NН
СO
СН3
(В6)
СО2
СН2
(-CH3)
СН2
СООН
Декарбоксилаза -5гидрокситриптофана
СН
СН2
NН2
25. Врожденные нарушения обмена метионина и цистеина
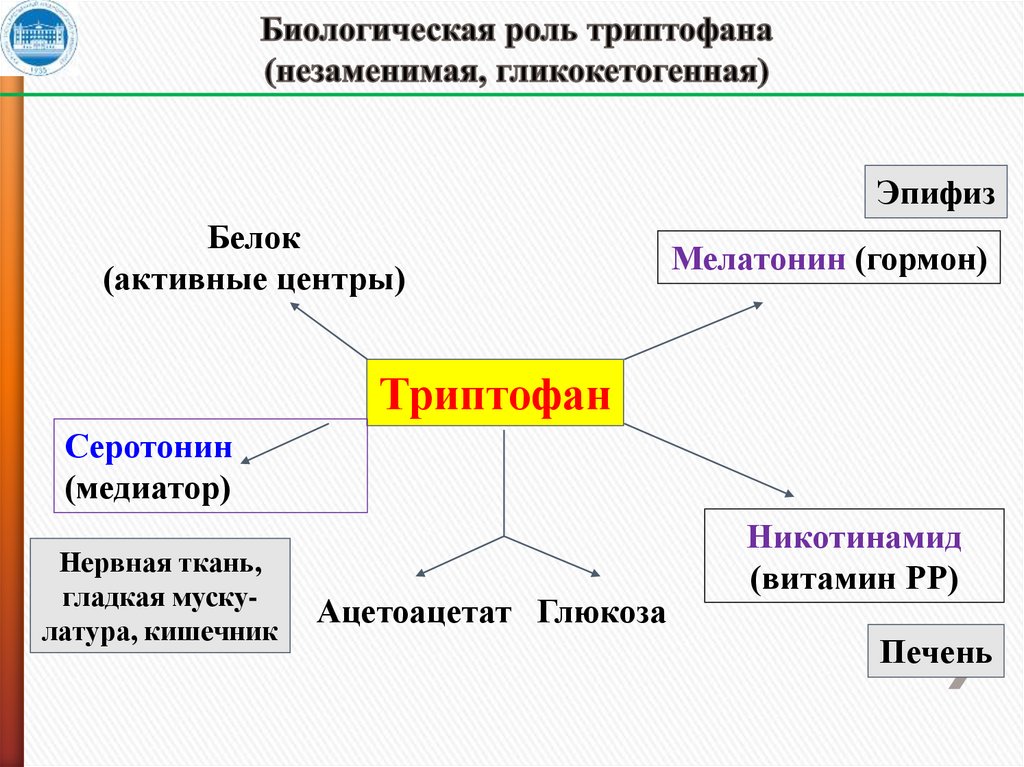
1. Стимулирует сокращения гладкоймускулатуры, перистальтику
кишечника;
2. Оказывает сосудосуживающее
действием, регулирует АД, t,
дыхание;
3. Обладает антидепрессивным
действием;
4. Участвует в аллергических
реакциях.
26. Биологическая роль триптофана (незаменимая, гликокетогенная)
СН2СН
NН2
NН
Триптофан
СООН
Н2О
О2
НО
О
СН2
СН
СООН
СН
NН2
Триптофандиоксигеназа (С)
С
СН2
СООН
NН
5-гидрокситриптофан
АЛА
NН2
О
NН2
С
Кинуренин
NН2
N
Никотинамид
27.
Врожденное нарушение обменатриптофана - болезнь Хартнупа
Возникает
метаболический
дефект
связан
с
генетическим дефектом фермента триптофандиоксигеназы
или врожденным нарушением всасывания триптофана в
кишечнике и реабсорбции в почках.
Основными
клиническими
и
лабораторными
проявлениями являются пеллагроподобные кожные
проявления (дерматит), диарея, задержка умственного
развития (дименция) (гиповитаминоз 3 Д), психические
расстройства, аттаксия, гипераминоацидурия.
триптофандиоксигеназа
Триптофан
5-гидрокситриптофан
28.
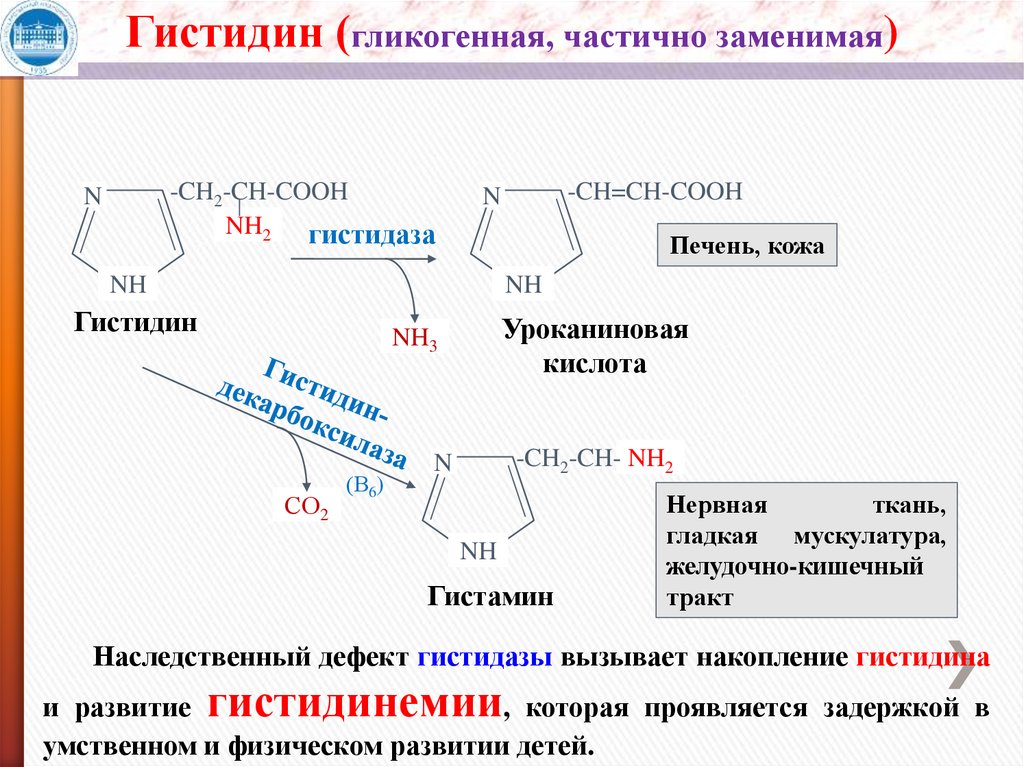
Гистидин (гликогенная, частично заменимая)-CH2-CH-COOH
NH2 гистидаза
N
-CH=CH-COOH
N
Печень, кожа
NH
NH
Гистидин
СО2
(В6)
NH3
Уроканиновая
кислота
N
-CH2-CH- NH2
NH
Гистамин
Нервная
ткань,
гладкая мускулатура,
желудочно-кишечный
тракт
Наследственный дефект гистидазы вызывает накопление гистидина
и развитие гистидинемии, которая проявляется задержкой в
умственном и физическом развитии детей.
29. Биологическая роль серотонина
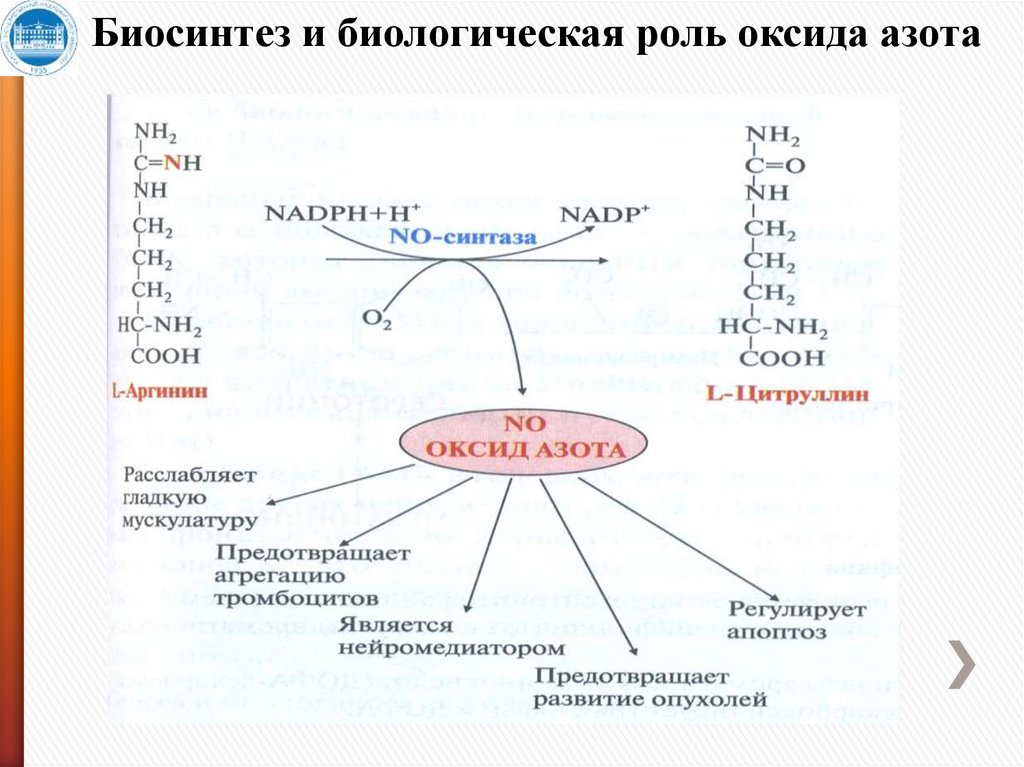
Биологическая роль аргинина(гликогенная, частично заменимая)
1. Используется в синтезе креатина, который
в виде креатинфосфата способен служить
источником энергии для работы мышц
человека и млекопитающих.
2. В мышцах беспозвоночных
аргининосукцинат выполняет
энергетическую функцию.
3. Служит предшественником орнитина.
4. Является источником NO в организме.














 Биология
Биология Химия
Химия








