Похожие презентации:
Полиплоидия в лесной селекции. Лекция 6
1.
Тема: Полиплоидия в леснойселекции
2.
Вопросы.Биологические основы полиплоидии.
Методы получения полиплоидов.
Расщепление у полиплоидов.
Полиплоидия как метод селекции.
Ключевые слова:
полиплоидия, аллополиплоиды, автополиплоиды,
анэуплоиды, гаплоиды, основной набор хромосом,
соматический набор хромосом, гаплоидный набор
хромосом, полиплоидогены, спорофит,
гаметофит, чередование поколений, соматическое
число, гаметическое число.
3.
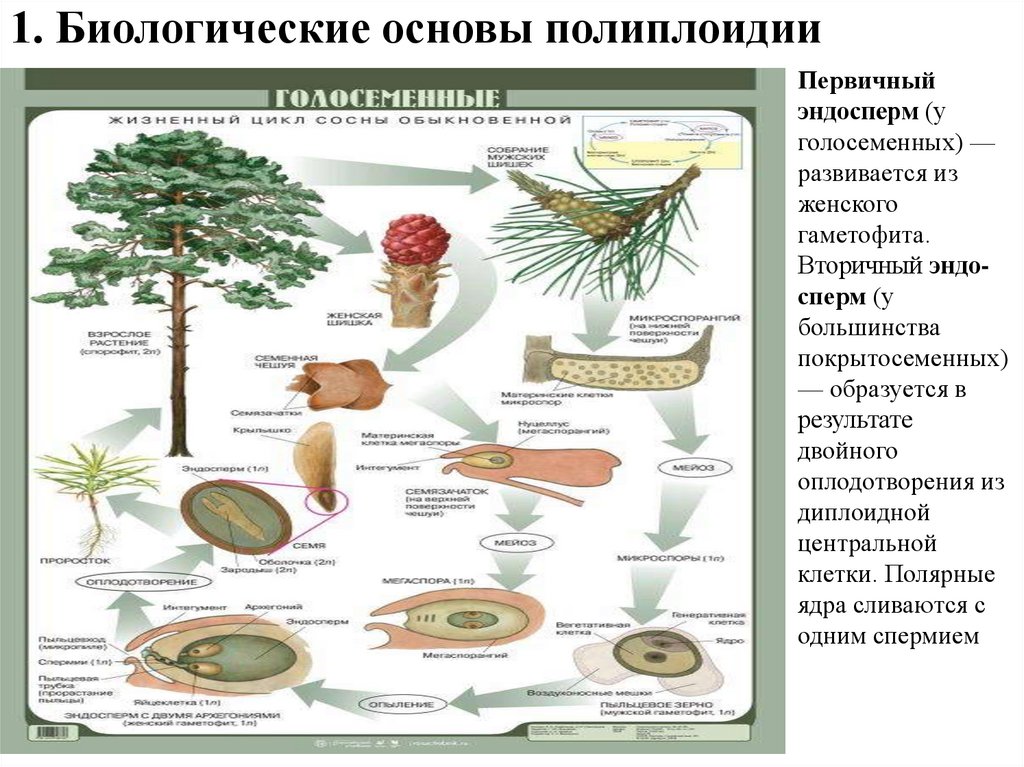
1. Биологические основы полиплоидииПервичный
эндосперм (у
голосеменных) —
развивается из
женского
гаметофита.
Вторичный эндосперм (у
большинства
покрытосеменных)
— образуется в
результате
двойного
оплодотворения из
диплоидной
центральной
клетки. Полярные
ядра сливаются с
одним спермием
4.
Женскийгаметофит
Два гаметофита после
опыления
Опыление
Мужской
гаметофит
Гаплоидная
макроспора
Гаплоидная
микроспора
Мейоз
Нуцеллу
с
Чешуйки женской
шишки
Пыльцевые
мешки
(микроспора
нгии)
Нуцеллус
(макроспорангий
Диплоидная
зигота
Мужской
гаметофит
Спорофилл с
двумя семенами
Семя с
зародешем
Диплоидный спорофит,
спорофита
образующий шишки двоякого
рода
5.
Большинство древесных растений по своейгенетической структуре относится к диплоидным
организмам, имеющим бинарный (двойной) набор
хромосом. При этом каждый диплоидный организм
содержит в ядрах своих клеток по два идентичных
набора хромосом. Одинаковые хромосомы из
каждого набора называются гомологичными и
образуют гомологичные пары хромосом.
Гомологичные хромосомы морфологически
идентичны в отношении всех видимых признаков
(длины, положения центромеры, положения
вторичных перетяжек и др.).
6.
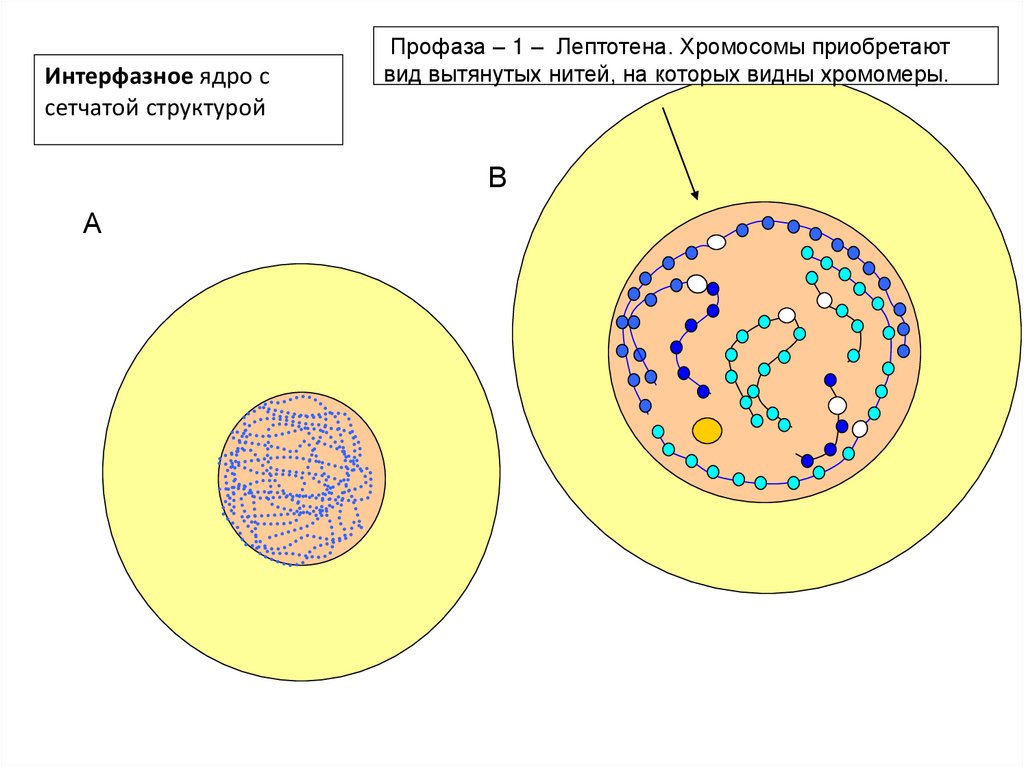
Интерфазное ядро ссетчатой структурой
Профаза – 1 – Лептотена. Хромосомы приобретают
вид вытянутых нитей, на которых видны хромомеры.
В
А
7.
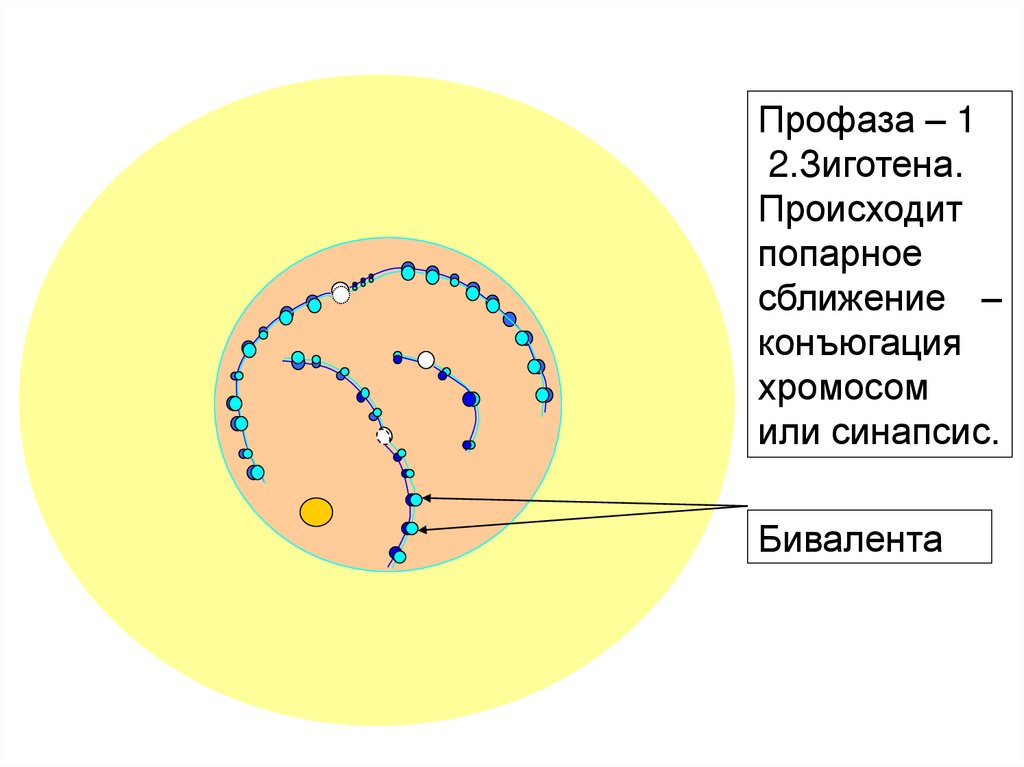
Профаза – 12.Зиготена.
Происходит
попарное
сближение –
конъюгация
хромосом
или синапсис.
Бивалента
8.
Спорофитное поколение многолетних высших растений, вчастности лесных деревьев и кустарников, способно
многократно воспроизводить многочисленные гаметофитные
поколения. Возникновение гамет происходит при
редукционном делении, в результате которого образуются
клетки с уменьшенным вдвое числом хромосом. Такой
одиночный набор хромосом называют гаплоидным.
Гаплоидный набор может состоять из разного количества
хромосом: от двух (у гриба Ustilago maydis) до нескольких
десятков и более сотни. Это число может быть четным (154
хромосомы у шелковицы черной) или нечетным (17 у
представителей подсемейства яблоневых в семействе
розоцветных), но диплоидный (в узком смысле) набор
хромосом всегда четный. В соответствии с этим гаплоидное
число обозначается индексом n, а диплоидное – 2n. Число 2n
характерно для спорофитного поколения, а число n имеет
отношение к гаметофиту.
9.
Вместе с тем удалось установить, что у многих вполне фертильных видов соматическое число хромосом не являетсядиплоидными в узком смысле, и что у многих видов встречаются расы с увеличенным набором хромосом в соматических клетках (Уильямс,1968). Это справедливо и в отношении
древесных и кустарниковых видов. ПРИМЕРЫ
Кофейное дерево - 2n = 22; 33; 44; 66; 88. Яблоня - 2n = 34; 51;
68. чай - 2n = 30; 45; 60. Слива 2n = 48 (Гужов, Фукс, Валичек,
1991, стр. 244).
Многие культивируемые сорта и формы древесных и
кустарниковых растений представляют собой аллополиплоиды
древних гибридных видов. Например, шелковица черная не
является диплоидным видом, а относится к полиплоидным
организмам. Их гаплоидные наборы могут состоять из
нескольких одинаковых (повторяющихся несколько раз)
наборов хромосом, (либо могут быть представлены иным
составом).
10.
Число отдельных негомологичных хромосом,образующих повторяющийся комплекс в
гаплоидном наборе, называется основным числом
хромосом, а сам повторяющийся комплекс
называются основным набором хромосом.
Основное число обозначается индексом х.
Основной набор хромосом может повторяться в
гомологическом наборе несколько раз: 2, 3, 4, 5, 6,
… В соответствии с этим, перед индексом
основного числа ставят числовые коэффициенты
2х – диплоиды, 3х – триплоиды, 4х – тетраплоиды,
5х – пентаплоиды, 6х – гексаплоиды и т.д.
11.
Было замечено, что не все члены полиплоидных серийблизкородственных видов точно соответствуют той
простой схеме, которую мы рассмотрели. Усложнения
возникают вследствие того, что полиплоиды
происходят из нескольких родоначальных видов,
обладающих разными гаплоидными числами,
например: у одного из исходных видов n = 10, а у
другого – n = 19. Их гибрид F1 будет иметь
соматическое число 2n = 29. Такие гибриды, как
правило, бесплодны, вследствие чего сравнительно
недолговечны (в пределах периода онтогенеза) в
популяциях. Они могут приобрести фертильность
вследствие удвоения числа хромосом до 2n = 58.
Тогда гаплоидное число образованного от них нового
фертильного вида будет равно n = 29.
12.
В ряде случаев полиплоиды оказывались более ценнымматериалом с утилитарной точки зрения, поскольку имели
более высокие показатели хозяйственно важных
признаков: высокие темпы роста, урожайность,
содержание витаминов и других веществ, декоративность.
В тоже время часто диплоидные формы оказывались более
продуктивными и устойчивыми, чем полученные от них
полиплоиды.
Например, тетраплоидные формы березы, тополей, вязов,
ольхи и белой акации растут медленнее диплоидных, а
триплоидные особи часто оказываются более
быстрорастущими. В частности триплоидная осина
характеризуется необычайно крупными листьями и
исключительно быстрым ростом, что сделало её объектом
искусственного получения триплоидов.
13.
Гибридизация с последующей полиплоидизацией характерна для представителей подсемейства яблоневых в семействе розоцветных с основным числом 17, образовавшимся в результате гибридизации видов с основнымчислом 8 и 9, которые характерны для этого семейства.
Гибридогенное происхождение подсемейства яблоневых в
настоящее время общепризнанно (Чуксанова, 1974, стр.
68). Видов, которые относятся к естественно
образовавшимся полиплоидам, в природе немало,
встречаются они и сред деревьев и кустарников.
Среди видов боярышников около 70 % относится к видам с
вторично умноженным числом хромосом (Чуксанова, 1974, стр.
68). В.А. Рыбин в 1935 г. (по Гужов, Фукс, Валичек, 1991,
стр.254) путем скрещивания алычи (Prunus cerasifera Her.?
2n=16) и терна или сливы колючей (Prunus spinosa L., 2n=32) и
объединения их хромосомных наборов ресинтезировал сливу
домашнюю (Prunus domestica L., 2n=48).
14.
В общем случае клеточное ядро с числомхромосом, отклоняющимся от гаплоидного или
диплоидного называется анэуплоидным.
Когда число хромосом является точно кратным
гаплоидному числу, то ядра клеток, ткани,
индивиды, расы, виды называются эуплоидными
или полиплоидными.
Полиплоиды – это особи, происходящие из одной
или более родоначальных форм путем увеличения
числа хромосом.
Сбалансированные полиплоиды – это полиплоиды
с четным числом основных наборов хромосом (2х,
4х, 6х и т.д.).
15.
Несбалансированные полиплоиды – это полиплоиды снечетным числом основных наборов хромосом (3х, 5х, 7х …...).
Аутополиплоиды – это полиплоидные особи,
образовавшиеся путем прямого кратного увеличения (в
частном случае удвоения, утроения) хромосомного набора
одной особи, характерного для данного вида, или (в
случае применения экспериментальных методов) группы
генетически одинаковых особей (для чистых линий или
членов популяций, которые полностью фертильны при
скрещивании между собой).
Аллополиплоиды – это полиплоиды (особи и формы),
возникшие из нескольких генетически
дифференцированных родоначальных видов и
характеризующиеся удвоением числа хромосом гибрида,
объединившего в своем гаплоидном наборе гаплоидные
наборы образовавших его родителей.
16.
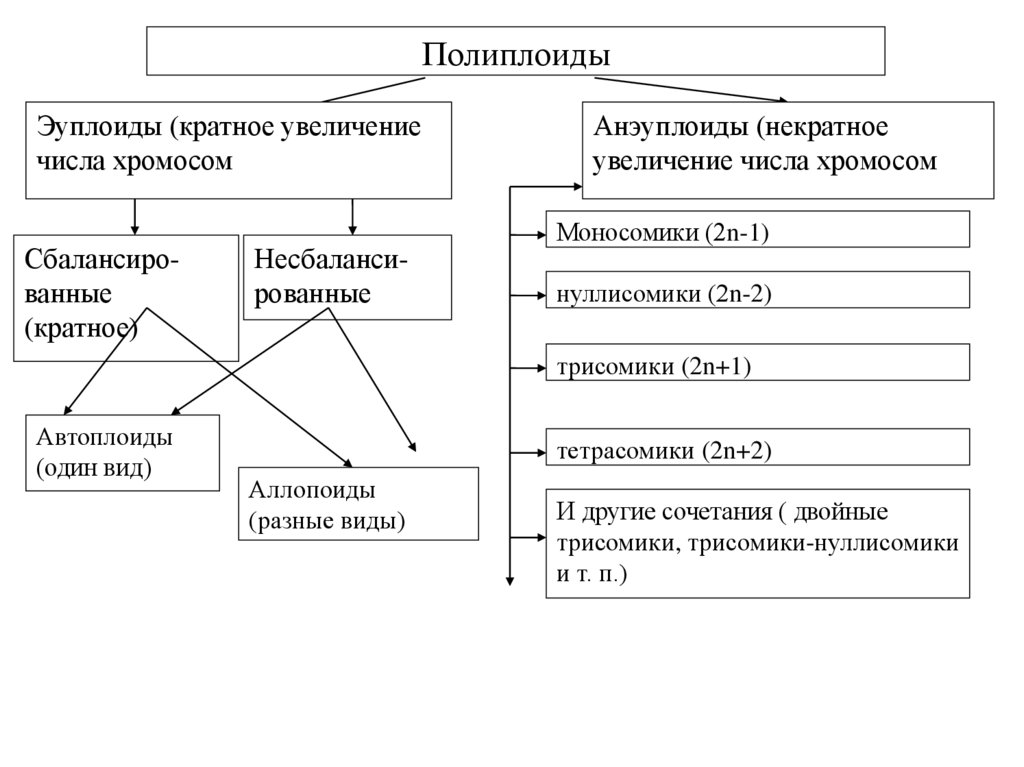
ПолиплоидыЭуплоиды (кратное увеличение
числа хромосом
Сбалансированные
(кратное)
Несбалансированные
Анэуплоиды (некратное
увеличение числа хромосом
Моносомики (2n-1)
нуллисомики (2n-2)
трисомики (2n+1)
Автоплоиды
(один вид)
тетрасомики (2n+2)
Аллопоиды
(разные виды)
И другие сочетания ( двойные
трисомики, трисомики-нуллисомики
и т. п.)
17.
Закономерности наследования признаков уавтополиплоидов, аллополиплоидов и анеуплоидов
специфичны для каждого типа хромосомных
изменений и сильно отличаются от менделевских
закономерностей, наблюдаемых у диплоидных
организмов.
18.
Критерии природы полиплоидов (по У. Уильямсу, 1968)№
Признак
1. Число
хромосом
Аутополиплоиды
Аллополиплоиды
Кратное одному основному Кратное одному или
набору
нескольким основным
наборам
2. Внешняя
морфология
Имеет сходство с
единственным
диплоидным предком
Имеет сходство с двумя
или более предками
3. Коньюгация
хромосом
Часто образует
мультиваленты
Мультивалентов мало
(обусловлены
аутосиндезом)
4. Вторичная
коньюгация
Может возникать у всех
форм в зависимости от
структуры хромосом
5. Характер
расщепления
Полисомический
Дисомический или
дисомический и
полисомический
19.
2. Методы получения полиплоидовВпервые в мире получил экспериментальным
путем растения с удвоенной массой ядерного
вещества И.И. Герасимов в 1888 году. Он
экспериментировал преимущественно на
водорослях. он испытывал действие охлаждения,
хлороформа, хлоралгидрата. Однако наиболее
широко известны его работы, описывающие
результаты термического воздействия.
Все существующие методы получения полиплоидов
можно разделить на две основные группы:
опыление нередуцированными гаметами;
индуцирование полиплоидогеными факторами.
20.
И.И. Герасимовым было установлено иэкспериментально подтверждено, что
температурные аномалии в жизненном цикле
растений могут приводить к возникновению
клеток с увеличенной массой ядерного вещества. В
частности, первоначально были испытаны низкие
положительные и небольшие по значению
отрицательные температуры.
В опытах И.И. Герасимова применялась
температура воды (работы велись с водорослями) –
4о С градуса при продолжительности воздействия
5 – 10 минут.
21.
Механизм действия пониженных температурсостоит в том, что охлаждение в течение
нескольких минут вызывает заметное замедление и
полную остановку процессов деления ядра,
притом, что образование поперечной стенки,
делящей клетку на две новые, продолжается.
После прекращения охлаждения процесс
образования поперечной перегородки
продолжается и может дойти до полного
завершения. Это приводит к образованию
безъядерных и двуядерных клеток или клеток с
удвоенной массой ядерного вещества. Такие
клетки при благоприятных условиях могут расти в
длину и толщину.
22.
Метод в техническом отношении сравнительно прост при егодостаточно высокой эффективности, что обусловило его
широкое и длительное применение как наиболее
распространенного метода получения полиплоидов.
Местом воздействия являются проростки семян растений,
цветки после их опыления.
Согласно методике Дорси, цветки пшеницы и ржи кастрировались,
затем искусственно опылялись, после чего выдерживались при
постоянной температуре от момента опыления до оплодотворения.
На следующем этапе в течение (экспозиция) 20 – 30 минут
создавался повышенный температурный фон (это достигалось
переносом растений из теплиц в другое помещение или фитотрон):
температура поднималась до 42о – 43о С градусов. После этого
растения переносились в теплицу с фиксированным уровнем
температуры.
23.
По другим методикам (Мюнтцинг, Томерторп,Монд, 1936) температурному воздействию на
уровне 40о – 47о С градусов (напряженность
фактора) подвергались колосья ячменя (завязи) в
течение 18 часов (экспозиция). В результате
получались полиплоидные растения.
Карпеченко (1938) воздействовал на искусственно
опыленные после кастрации колосья ячменя
температурой в 50о С градусов (напряженность
фактора) с продолжительностью периода в 30, 45 и
60 минут (экспозиция).
24.
Рентгеновские лучи при получении полиплоидовПервые результаты в получении полиплоидов с
применением рентгеновского излучения были
получены в 30-х годах прошлого столетия (Goodspeed,
1930; De Mol, 1930; Бреславец, 1939). Вместе с тем
отмечается, что результативность такого воздействия
не высока. В работах Л.П. Бреславец (1939) из 500
облученных проростков озимой ржи возникло только 3
полностью тетраплоидных растения. В целом сведения
о достижении заметных положительных результатов
полиплоидизации древесных растений с помощью
облучения рентгеновскими лучами крайне ограничены.
25.
В ряде случаев возникают аномалии мейоза, и редукционногоделения не происходит. В результате образуются яйцеклетки
или пыльцевые зерна с хромосомным числом 2n. При
опылении яйцеклетки с нередуцированным числом хромосом
(хромосомное число гамет 2n) пыльцой с нередуцированным
хромосомным числом (хромосомное число гамет 2n)
образуются тетраплоидные зиготы с хромосомным числом 4n
(2n+2n). Если же пыльцой с удвоенным числом хромосом
(хромосомное число гамет 2n) опылить цветки типичных
(обычных) диплоидных деревьев (хромосомное число гамет
1n), то образуются триплоидные зиготы с хромосомным
числом 3n (2n+1n). Подобным образом в практической
селекции получают тетраплоидную осину с хромосомным
числом 4n. Для этого триплоидной пыльцой (хромосомное
число гамет 3n) опыляют цветки женских диплоидных
деревьев (хромосомное число гамет 1n).
26.
В ряде экспериментов было отмечено возникновениеполиплоидных клеток и целых побегов растений в
процессе регенерации растений и развития образовательной ткани, в частности каллюса (Бреславец, 1963 стр. 11 –
15). Такая ткань развивается как реакция на поранение
растений, например: при черенковании, прививках и др.
Используется метод декапитации – у хорошо развитых
растений удаляют верхучную почку и все боковые почки.
На поверхности среза образуется каллюс, из которого в
дальнейшем дифференцируются побеги, которые после
достижения 4 – 6 см отделяются от исходного растения с
частью каллюса, укореняются. До 10 % из них могут быть
полиплоидами.
27.
Получение полиплоидов путем скрещивания –основано на способности растений
образовывать межвидовые гибриды
Получение полиплоидов в результате полиспермии
основан на возможности слияния двух половых
клеток растений (спермиев) с одной половой
клеткой (яйцеклеткой) , например: при
прорастании нескольких пыльцевых трубок в одну
семяпочку.
Получение триплоидов из семян
Получение полиплоидов воздействием
химических реагентов
28.
Хлорал гидрат. Его применяют чаще всего вконцентрации 75 % и в экспозиции 1 час.
(ИУК, ИМК и их соли), аценафтена, подофилина.
Использование колхицина для получения
полиплоидов
Хотя самые первые опыты по воздействию
колхицина на растения принадлежат Ч. Дарвину
(Бреславец, 1963, стр. 19), направленное и
результативное применение колхицина для
индуцирования полиплоидов принадлежит Блекси
и Эйвери (1937).
29.
Методика обработки растений колхицином основана на следующем.1. Колхицин в водном растворе диффундирует в растительные
ткани.
2. Полиплоидия возникает только в тканях с активным делением
клеток: образовательных тканей – меристематических тканей и
каллюса.
3. Действие колхицина проявляется в наибольшей степени при
создании оптимальных условий для выращивания обработанного
материала, что особенно важно в случаях, когда полиплоидия
индуцируется у семян.
4. Оптимальная продолжительность (экспозиция) воздействия
колхицином для разных видов неодинакова и в значительной
степени зависит от продолжительности периода клеточного деления
в определенной ткани.
5. Оптимальная концентрация колхицина для обработки различных
объектов неодинакова.
30.
Форма применения колхицина – водный раствор, или реже дляспециальных целей водный раствор колхицина в агар-агаре,
ланолиновая паста с колхицином.
Концентрация действующего препарата: наиболее часто
применяются водные растворы колхицина в концентрации от
0,1 % до 1,0 % (Котов, 1997, стр. 176), и до 1,6 % (Бреславец,
1963, стр. 33).
Объекты обработки: прорастающие и не прорастающие
семена, проростки и всходы, распускающиеся цветочные
почки, растущие листья и хвоя, точки роста корней и ветвей,
нарезанные зеленые и одревесневшие черенки перед
укоренением, срезанные ветви при искусственном опылении
на срезанных ветвях, сеянцы и саженцы при их контейнерном
выращивании в теплицах, свободно растущие деревья и
кустарники.
31.
Экспозиция обработки – от нескольких часов донескольких суток и даже до двух недель (Котов,
1997, стр. 176).
Обработка семян состоит в их замачивании в
водных растворах, как правило, низких (0,1 – 0,2
%) концентрациях в экспозиции 12 – 24 (и до 48)
часов. Обработку проводят в чашках Петри или
раскладывают семена на фильтровальную бумагу,
смоченную раствором. Во всех схемах обработки,
по её завершении рекомендуется семена промыть в
дистиллированной воде, подсушить и высеять.
32.
Обработка проростков и всходов предусматривает воздействие наточки роста развивающегося побега. Согласно одной из методик
(Томпсон и Козар, по Бреславец, 1963, стр. 35), семена
первоначально раскладывают в чашки Петри на влажную
фильтровальную бумагу без реагентов и выдерживают в темноте, до
того момента, пока не появятся проростки побегов, а корни – не
прикрепятся к бумаге. После этого кружки фильтровальной бумаги
извлекают из чашек и опрокидывают на другие чашки Петри
несколько меньшего диаметра заполненные раствором колхицина.
При этом размещают их так, чтобы сами кружки только покрывали
чашки сверху, корни оставались бы вне зоны обработки, в раствор
погружались бы только верхушечные части проростков.
Существуют рекомендации (Джиорфи, 1938, по Бреславец, 1963.
стр. 35), по которым растущие кончики проростков окутывали
ватой, смоченной раствором колхицина. Одним из вариантов
является обработка проростков водным раствором колхицина
нанесением его на точку роста между семядолями при помощи
пипетки (Шванитц, по Бреславец, 1963, стр.36).
33.
Обработка листьев и хвои наиболее результативна в период их ростапри воздействии на растущие зоны (периферия листа и основание
хвои). Перспективным может оказаться вариант с обработкой
листьев при их укоренении как листовых черенков: они могут дать
начало полиплоидным растениям.
Обработка растущих побегов и почек предусматривает нанесение капельного
раствора или его втирание на кончики растущих побегов и распускающихся
почек. Обработку можно повторить дважды. Допустимо погружение верхушек
побегов в водный раствор на время от несколько часов до 1 – 2 суток. Для
обеспечения точного воздействия колхицина только на точки роста препарат
можно наносить на обрабатываемую поверхность в форме ланолиновой пасты с
концентрацией 0,5 – 1,0 % или в форме водного раствора (1 часть 2 % раствора)
на агаровой основе (1 часть 3% агар-агара). Для тех же целей применяют
эмульсии, содержащие колхицин, на основе смеси, состоящей из глицерина, воды
и эмульгирующих инертных веществ либо из глицерина, спирта и эмульгаторов.
Эмульсии наносят на точки роста по 3 – 8 капель пипеткой или маленькой
кисточкой. Самым экономичным при высокой эффективности считают метод
нанесения капли раствора непосредственно на почку в течение целого дня или
нескольких дней, повторяя операцию по мере высыхания капли. Известен метод
опрыскивания водным раствором побегов.





























 Биология
Биология








