Похожие презентации:
Termodünaamika. Entroopia. (Loeng 8)
1.
8. loeng.Termodünaamika.
Entroopia.
19. veebruar 2017. a.
1
2.
Suurt ja olulist osa loodusenähtustestkirjeldatakse kui soojusnähtusi – neist
tuntumaid – kehade erinev temperatuur,
soojusülekanne, agregaatolekute muutused jt.
Loodusteadustes vaadeldakse
termodünaamikat kui makroskoopiliste
soojusnähtustega toimuvaid muutusi.
Eeldustena uurimistöö korrastamiseks on
sõnastatud nn. termodünaamika seadused.
Toome loengu alguseks need (neid on kolm)
termodünaamika seadused või printsiibid siin
ära nende ühel võimalikul kujul.
19. veebruar 2017. a.
2
3.
Termodünaamika 1. seadus (energia jäävuseseadus):
Energia ei teki ega kao, vaid muutub ühest
liigist teise.
Termodünaamika 2. seadus:
Soojus ei saa iseenesest minna külmemalt
kehalt soojemale. On muidugi intuitiivne, et soojus kandub üle soojemalt kehalt
külmemale. Entroopia määrabki soojusvahetuse suuna. See on vajalik, sest vastupidine protsess otseselt
energia jäävuse põhimõtet ei riku.
Termodünaamika 3. seadus:
Absoluutne nulltemperatuur on
saavutamatu.
19. veebruar 2017. a.
3
4.
Seega - termodünaamika on teadus, misuurib soojuse vahekorda teiste energialiikidega
s.t. termodünaamika on õpetus soojuse
(energia) ja töö vahelistest seosest
ning seetõttu vaatleb kõiki energialiike ja
nende vastastikuseid muundumisi.
Termodünaamika alused kujunesid 19.
sajandil eelkõige aurumasinate töö ja nendes
masinates toimuvate protsesside
tundmaõppimise baasil.
19. veebruar 2017. a.
4
5.
NB! Loomulikult on ka kõik keemilisedprotsessid, milles toimub soojuse (pro
ENERGIA) eraldumine või neeldumine
automaatselt osa termodünaamikast,
viimane aga toimub kõikides protsessides
mis on keemilised, sest muidu neid ju
lihtsalt ei toimukski (vt. 5. Loeng).
Ja ei toimuks neid protsesse seetõttu, sest
puuduks ju potsentsiaalide vahe, millest osa
protsessi toimumise kaudu degradeeruks
soojuseks.
19. veebruar 2017. a.
5
6.
Kuid kõigepealt meeldetuletus sellest, mis on tööloodus- ja insenerteadustes.
Tööd tehakse (füüsikalises mõttes) siis, kui
liikuvale kehale mõjub liikumissihiline jõud.
Kui kehale mõjub kogu tee s ulatuses jääv jõud
Fs, siis avaldub töö järgmiselt:
A = Fss
ehk
töö = jõud × teepikkus
19. veebruar 2017. a.
6
7.
Tööd mõõdetakse njuutonmeetrites (N×m).Tööühikuks on džaul (1 J)
1N×m = 1 J.
Kõige üldisemalt, et teha vahet, mis on töö ja mis on
energia võib lähtuda järgmisest instruktsioonist:
energia on võime teha tööd ja töö on
liikumine vastandjõu vastu.
Viimane kehtib eriti näitlikult mehhaanikas. Keemias ja
füüsikalises keemias vaadeldakse tööna kõiki
nähtusi mille tulemusena tekib muutus
potentsiaalide vahes.
19. veebruar 2017. a.
7
8.
Kuna ajalooliselt on termodünaamika omakujunemisperioodil suuresti tegelenud suhteliselt
lihtsate inimese poolt loodud termodünaamiliste
süsteemidega, mis kannavad nimetust –
aurumasinad, siis vaatleme neid
sissejuhatuseks veidi lähemalt.
Soojus levib soojendilt jahutile (mida pole
animatsioonidel kõikjal näidatud) ja süsteem
tööd
teeb selle käigus
– antud juhul
paneb auru paisumine kolvi liikuma – aur teeb
paisumistööd.
19. veebruar 2017. a.
8
9.
Seega realiseerib aurumasinana (konverteeribtööks) – kirjeldatav termodünaamiline süsteem
potentsiaalide vahe, mida on võimalik ja
mõistlik kirjeldada soojendaja ja jahutaja
temperatuuride vahe kaudu. Selle potentsiaali
100% realiseerimine tööna (mis on võimatu)
annaks masina kasuteguriks 100%.
Aurumasina ülesandeks on konverteerida
soojusenergia mehhaaniliseks tööks,
selleks adsorbeeritakse soojus soojendajalt
ja suunatakse see jahutajale – tööd
tehakse temperatuuride vahe arvelt.
19. veebruar 2017. a.
9
10.
Juhin tähelepanu asjaolule, et ka aineigasugune keemiline muutumine saab
toimuda ja toimub ainult siis kui eksisteerib
potentsiaalide vahe –
aurumasinate puhul on selliseks
potentsiaalide vaheks temperatuuride
vahe, mis moodustunud arukatla ja
välikeskkonna vahel.
NB! Sisepõlemismootorites genereeritakse vajalik
temperatuuride vahe töötsükli jooksul silindris
endas, mille arvel toimub jällegi paisumistöö.
19. veebruar 2017. a.
10
11. Esimese töötava aurumasina ehitas prantslane Papin 1690. aastal. Aur tõstab paisudes kolvi üles. Seejärel jahutatakse silindrit väljastpoolt külma veega. Aur silindris veeldub, tekib vaakum ning välisrõhk surub kolbi alla ning teeb tööd – tem
Esimese töötava aurumasina ehitas prantslane Papin 1690.aastal. Aur tõstab paisudes kolvi üles. Seejärel jahutatakse
silindrit väljastpoolt külma veega. Aur silindris veeldub, tekib
vaakum ning välisrõhk surub kolbi alla ning teeb tööd –
temperatuuride vahed mille arvel tehakse tööd, on aga
väikesed ja masina võimsus seetõttu madal, kasutegur, nagu
ikka (ή=(T-T')/T).
19. veebruar 2017. a.
11
12. Watti aurumasina (1778) võimsus, ή=(T-T')/T, on samuti madal, kuid kasulikku tööd tehes kasutakse auru paisumisel ära kolvi mõlemad liikumissuunad – masinast lahkuv aur on madalama temperatuuriga ja kasutegur seetõttu veidi suurem, kui eelmisel s
Watti aurumasina (1778) võimsus, ή=(T-T')/T, onsamuti madal,
kuid kasulikku tööd tehes kasutakse auru paisumisel ära kolvi
mõlemad liikumissuunad – masinast lahkuv aur on madalama
temperatuuriga ja kasutegur seetõttu veidi suurem, kui eelmisel
slidel oleval seadmel.
19. veebruar 2017. a.
12
13. Ühekordse auru paisumisega juba täiustatud aurumasina rakendus, kuid ka see on paratamatult väikese võimsusega, kuna temperatuuride vahe (T0/T1 ) on väike. Ühekordse paisumise puhul väljub silindrist suhteliselt kõrge temperatuuriga jääkaur (jä
Ühekordse auru paisumisega juba täiustatud aurumasinarakendus, kuid ka see on paratamatult väikese võimsusega,
kuna temperatuuride vahe (T0/T1 ) on väike. Ühekordse paisumise
puhul väljub silindrist suhteliselt kõrge temperatuuriga jääkaur
(jääksoojus), seega on madal ka kasutegur ja väiksem masina
väjundvõimsus.
19. veebruar 2017. a.
13
14.
NB! Kolmekordse auru paisumisegaaurumasinad (seega - masinast väljuva auru
temperatuur on madalam) olid alates 19.
sajandi keskpaigast purjekate abimasinaks ja
hiljem aurikute masinateks kuni viimaste
väiksemate aurikuteni 1960-ndate aastatel,
olles tolle aja üheks edukamaks laevamasina
tüübiks. Juba 19. saj. keskpaiku ehitatud
masinatel oli võimsuseks 1000 ja rohkemgi
hobujõudu.
Aurumasinaid hakati kasutama nende
leiutamise algusest reeglina mäetööstuses.
19. veebruar 2017. a.
14
15.
Kolmekordese paisumisega aurumasin –temperatuuride vahe soojendaja ja jahuti vahel on suurem
(jahtumine toimub 3-mes silindris) kui eelnevatel slidedel
olnud masinatel – kasutegur on seetõttu kõrgem ja masina
väljundvõimsus suurem.
Taolised aurumasinad olid laevadel kasutusel 19.saj.
keskpaigast kuni 20. saj. 60…70-ndate aastateni.
19. veebruar 2017. a.
15
16.
Selgitus:kolvi käigul alla kõigis kolmes silindris toimub
auru(vee)molekulide kollektiivne liikumine
– aur paisub ja teeb tööd. Eelneval slidel
oleva masina kolmandas silindris kolvi
liikumise lõpuosas aur osaliselt kondenseerub
ning silindrist väljub madala kvaliteediga
energiat kandev ning jahtunud aur-udu –
jääksoojus (mis on ka suhteliselt madala
temperatuuriga ning osakeste liikumine
kolmandas silindris juba korrapäratu).
19. veebruar 2017. a.
16
17.
Jääksoojuse mõistest paremaks arusaamiseksjuhin tähelepanu, et kolmandast silindrist väljuvas
aurus ei ole enam ei osakeste “organiseeritud”,
„kollektiivset“ korrapärast liikumist ja seega ei
mingit kõrgema kvaliteediga energiat.
Niisugust osakeste liikumist, kus
energiakandjad on töö tegemiseks
korrapäraselt organiseeritud – kolb aga
surutakse silindris alla vaid osakeste
korrapärase (suunatud) liikumise tulemusel
– selle käigus molekulide liikumine aeglustub
ja auru temperatuur langeb.
19. veebruar 2017. a.
17
18.
Kolmandast silindrist väljuv aur ei ole enam võimeline omasoojust tööks konverteerima ning osakeste korrapäratu
soojusliikumise käigus soojus hajub – aur kipub
kondenseeruma uduks (veeks) ja nii ta aurulaevas
kondensaatorisse suunataksegi ja sealt katlasse tagasi.
Nõndanimetatud läbitöötanud aurus on kõikide osakeste
liikumine kogu nende ruumalas ühesugune, suuresti
samasugune nagu see on ka jahutajas – energia kvaliteet
on langenud.
Järelikult puudub jahutaja ja töötava keha vahel potentsiaalide
(pro temperatuuride) erinevus – erinevus mille lahendamise
arvel on võimalik teha tööd ning mille tulemusel suureneb
töötava keha – s.o. auru (vee) osakeste korrastamatus.
Seega masinast väljuvad gaasid (aur), udu kannab endaga
kaasas jääksoojust (viimane kõlbab küll aga laeva kajutite
kütteks, aga mitte rohkemaks).
19. veebruar 2017. a.
18
19. Kvaliteetne energia – energia, mis teeb tööd, ehk auru töö kolvi allakäigul – tehakse tööd temperatuuride vahe arvel – soojendaja ja jahutaja temperatuuride vahe arvel – kolvi käigul alla aur paisub, osakesed liiguvad korrapäraselt ning v
Kvaliteetne energia – energia, mis teeb tööd, ehkauru töö kolvi allakäigul – tehakse tööd
temperatuuride vahe arvel – soojendaja ja jahutaja
temperatuuride vahe arvel – kolvi käigul alla aur
paisub, osakesed liiguvad korrapäraselt ning vastavalt
paisumisele aur jahtub (vt. 7. loeng).
19. veebruar 2017. a.
19
20. Jääkenergia – soojusenergia – ehk energia, mis väljub kolmandast silindrist – osakeste liikumine on korrapäratu – osakeste liikumine on ühtlustunud kogu gaasi massis – selle eri osade vahel puuduvad liikumise (potentsiaalide vahed) erinevus
Jääkenergia – soojusenergia – ehk energia, misväljub kolmandast silindrist – osakeste liikumine on
korrapäratu – osakeste liikumine on ühtlustunud kogu
gaasi massis – selle eri osade vahel puuduvad liikumise
(potentsiaalide vahed) erinevused.
19. veebruar 2017. a.
20
21.
Tööd on võimalik teha vaid potentsiaalide vahearvel, soojusmasinates on selleks potentsiaalide
vaheks temperatuuride vahe
ή=(T-T')/T,
kus T- on soojendi temperatuur ja T' - on jahuti
temperatuur ning
soojusmasina kasutegur on η ehk tööd tehakse
energia kvaliteedi languse arvel ehk –
kasutatakse ära temperatuuri (potentsiaalide) vahe
NB! Masina kasutegur ei saa kunagi olla 100% just sellepärast,
et T' ei saa olla 00K, temperatuur mida on võimatu
saavutada.
19. veebruar 2017. a.
21
22.
Eelmisel slidel toodud valem annab ka vastuseküsimusele, miks on diiselmootori ja turbiinide
kasutegurid suuremad kui kolbide süsteemiga
aurumasin. See aga, et suuremat
temperatuuride vahet kasutav (pro
potentsiaalide vahet) masin on suurema
võimsusega, on näha juba järgmisel pildilt.
Suurem soojendaja ja jahutaja temperatuuride vahe on ka
põhjuseks, miks on kõrgema surveastmega
sisepõlemismootorite (kõrgem kütuse põlemise temperatuur
silindris) võimsus ja kasutegur suurem ja miks on suurem
ka auruturbiini võimsus kui see on kolbide süsteemiga
aurumasinal.
19. veebruar 2017. a.
22
23. Turbinia (Suur-Britannia), 1894, esimene aruturbiinlaev – juba ainuüksi pildilt on näha auruturbiini (kasutatakse ülekuumendatud auru) suuremat võimsust ja kasutegurit võrreldes auru kolbmootoritega.
19. veebruar 2017. a.23
24.
Kasuteguri piiriväärtuse algtingimusteks on:1 – T0/T1.
Masina töös on oluline temperatuuride
pro potentsiaalide vahe.
Aurumasinas on temperatuuride vahe suhteliselt väike
võrreldes sellega, mis ta on diiselmootoris, gaasija auruturbiinides jt.
See ongi olnud põhjuseks, miks aurumasinad
tõrjuti välja masinate poolt kus
töötemperatuur ja jahutaja temperatuuride
vahe (pro potentsiaalide vahe) on suurem.
19. veebruar 2017. a.
24
25. Soojusliikumine gaasides - jääksoojuses – tegemist on madalakvaliteedilise energiaga, osakeste liikumine on kaootiline – ei mingit ühesuunalist liikumist mis oleks konverteeritav tööks.
19. veebruar 2017. a.25
26. Energia – soojendamisel katsutis olev materjal paisub ja selle kohal olev kolb tõuseb – süsteem teeb (paisumis)tööd (NB! süsteemi temperatuur langeb) – osakesed liiguvad suunatult.
19. veebruar 2017. a.26
27. Töö – soojus – soojus konverteerub tööks just sellisel määral, kui seda võimaldab temperatuuride vahe (potentsiaalide vahe) väliskeskkonna ja töötavas keha vahel – toimub nn. paisumistöö.
19. veebruar 2017. a.27
28. Põhimõtteliselt toimub analoogiliselt arumasinates ja sisepõlemismootorites energia kvaliteedi langus ka vesiratta töös. Korrastatult voolav vee energia muudetakse mehhaaniliseks tööks ning vesirattal nn. läbitöötanud vee ebakorrapärasemalt voo
Põhimõtteliselt toimub analoogiliselt arumasinates jasisepõlemismootorites energia kvaliteedi langus ka
vesiratta töös. Korrastatult voolav vee energia
muudetakse mehhaaniliseks tööks ning vesirattal nn.
läbitöötanud vee ebakorrapärasemalt voolavast veest
ei ole enam mehhaanilise töö tegijat.
Vesiratta töö jälgimiseks klõpsake palun all oleval
ikoonil.
19. veebruar 2017. a.
28
29. Energia kvaliteedi (q) muutus töö (W) tegemisel.
19. veebruar 2017. a.29
30. Meeldetuletus järgneva paremaks mõistmiseks – Gaaside põhiseadused:
R- universaalne gaasikonstantR = 8.314 J/mol× K
R = 0.082 atm× L/mol× K
R = 62400 mm Hg× cm3/mol× K
Kui ühikuteks on rõhk P [Pa]; mass m [g]; moolide arv n [mol], ruumala
V [m3]; temperatuur T [K] siis R = 8.314 J/mol× K ja kehtib seos:
P V = n R T so. ideaalgaasi olekuvõrrand ka Clapeyroni-Mendelejevi
võrrand
ehk
19. veebruar 2017. a.
30
31.
Selgitus-meeldetuletus järgneva asjus.1 cm3 gaasis on normaaltingimustel 2,68x1019
molekuli. See on Loschmidti arv – sellest
populaarsem on 22,7 (22,4
standarttingimustes) liitrit mooli kohta –
Avogadro arv – selles mahus oleva gaasi
mass – molekulide kogumass - on võrdne
nii mitme grammiga, kui mitu ühikut
on gaasi molekulmassis –
gramm-molekul – ehk üks mool gaasi.
19. veebruar 2017. a.
31
32.
Kuna keemia huvisfääris vaadeldakse osakesi(molekule, aatomeid), siis on lihtsam tegeleda
mitte grammide ja kilogrammidega, vaid
moolidega. Seepärast kasutatakse ka
Boltzmanni konstandi korrutist Avogadro
arvuga – see näitab mõju mitte ühele
molekulile, vaid ühele moolile (see oli
eelmise,
7. loengu üks teemadest) – saame gaaside
universaalkonstandi R.
19. veebruar 2017. a.
32
33.
Soojusliikumise juurde tagasi.Ideaalse gaasi rõhk on võrdeline molekulide
kulgliikumise keskmise kineetilise energiaga (mis
ilma siinjuures tõestust esitamata) on:
E = 2/3 k×T
ja
seega on gaasimolekuli
keskmine
energia võrdeline absoluutse
temperatuuriga.
19. veebruar 2017. a.
33
34.
Kusjuures k onBOTZMANNI KONSTANT.
k on universaalse gaasikonstandi (R) ja Avogadro
arvu jagatis.
Definitsioonivalem, k = R/NA. Botzmanni konstandi
SI-ühik on üks džaul kelvini kohta.
[k] = 1 J/K.
SI ühikutes:
K = 1,38×10-23J/K.
Boltzmanni konstant seob energiaühikutes mõõdetavat
temperatuuri Kelvinites mõõdetava temperatuuriga ehk töö hulga,
mida tehakse ühe osakese kohta temperatuuri tõstmisel10 võrra.
19. veebruar 2017. a.
34
35.
Selgitus Boltzmanni konstandi asjus.Iga kuupsentimeeter gaasi sisaldab 30 miljardit
molekuli. Boltzmanni (1844 – 1906)
konstant määrab kindlaks kui palju muutub
gaasi molekuli liikumise keskmine kineetiline
energia gaasi temperatuuri muutumisel 10
võrra – ergides kraadi kohta. Boltzmanni
konstant K on
1,38x10-16 erg/kraad.
Ja molekulide liikumisenergia vastavalt eelnevale on:
E= 2/3 K×T.
19. veebruar 2017. a.
35
36.
Seega R = 1,38x10-16 x 6,02x1023 = J/kraad x mool –see on kõikide gaaside jaoks universaalne konstant
– kui palju muutub 1 mooli gaasi kõigi molekulide
keskmine soojusliikumise energia gaasi
temperatuuri muutumisel 1o võrra.
Seega on Boltzmanni konstant vaadeldav
universaalse gaasi konstandina ühe molekuli
kohta. See ühendab ja üldistab Boyle-Mariotte,
Gay-Lussaci ja Charlesi seadused ClaperontMendelejevi võrrandiks.
Ja nii lihtne see asi ongi.
19. veebruar 2017. a.
36
37.
Keha siseenergiaon molekulide
mikroskoopilise liikumisega seotud energia.
Erinevalt mehaanilisest energiast, mis avaldub
makroskoopiliste objektidega, iseloomustab
siseenergia objektide silmaga nähtamatuid
omadusi, mis tekivad atomaarses ja molekulaarses
skaalas. Näiteks ei oma klaasis olev vesi ruumi
temperatuurile nähtavalt ei kineetilist ega
potentsiaalset energiat. Mikroskoopilisel
tasandil kujutab see aga suure
kiirusega (sadu meetreid sekundis)
liikuvate molekulide kogumit.
19. veebruar 2017. a.
37
38.
Mikrokoopiline energia ei pruugi muutuda,kui lisada vedelikule kineetilist energiat – pihustada
vedelikku, vedelike segamine jne.
Kuid lisandunud energia on jällegi
madalakvaliteediline (kuigi vedeliku
temperatuur võib tõusta), osakeste liikumine
oli ja jääb kaootiliseks (korrastamatuks) just
nii nagu see on jääksoojuseski.
Kehade siseenergia U moodustub molekulide liikumise
kineetilisest energiast ja molekulide vastastikusest
mõjust tingitud potentsiaalsest energiast.
19. veebruar 2017. a.
38
39.
Teisalt aga kehade siseenergia, mis väljendubmolekulide liikumises suure kiirusega, seletab
seda vahet, miks on vaja “teha nii palju
tööd”, et “tõsta keha temperatuuri nii
vähe”.
Näiteks ühe vannitäie sooja vee saamiseks tuleks teha nädal
aega kõva metsamehe tööd, sellist tööd mida vanasti tehti
kirve ja saega. Eelnevat näidet saab iseloomustada ka
võrdlusega – selleks, et saada vannitäis sooja vett on vajaliku
töö hulk võimalik ümber arvestatud kineetilisele energiale
(E = mv2/2), mis tuleks anda vanniäie vee massile
saavutamaks reaktiivlennuki kiirust. Ja see nõuab tõesti
palju energiat – energia, aga see ongi ju võime teha tööd.
19. veebruar 2017. a.
39
40.
Vannivees on aga osakeste liikumiskiirusjagunenud lihtsalt paljude erinevate osakeste
vahel, mis liiguvad aga erinevates suundades
ja ikka ühe vinge reaktiivlennuki kiirusega.
Keha ise (antud juhul vannivesi) on seetõttu
madalakvaliteedilise energia kandja kuna
liikumine on korrastamata.
Energiat, aga mis on vajalik vee temperatuuri
tõstmiseks, võib ette kujutada kui tööd vannivee kui
keha liikumise kiirendamiseks reaktiivlennuki
kiiruseni. Ja see on muidugi “kõva töö”. NB! Kui vee
osakesed liiguksid aga kõik ühes suunas, oleks tegemist
kõrgekvaliteedilise energiaga - osakeste korrastatud liikumisega.
19. veebruar 2017. a.
40
41.
Kui lämmastiku molekulid liiguksid ka suurimatalvise külma ajal suunatult (korrapäraselt)
oleks tegemist lööklainega, mille energia oleks
oluliselt suurem kui see, mis tekib tuumapommi
plahvatusel ning Maal kunagi olnud suurimad
orkaanid oleksid nende kõrvalt vaid tagasihoidlikud
tuulekesed.
Muidugi, taoline hüpoteetiline võimalus annab ettekujutuse
energiahulgast, mida soojus endaga potentsiaalset kaasas
kannab ja tööks vajalikust korrastatuse määras, et tegevus
(töö) saaks olla suunatud. Teisalt annab see ka ettekujutuse
energia kvaliteedi (osakeste liikumise korrastatusest)
olulisusest meie keskkonna kujunemisel.
Seega edu aluseks igas tegevuses on kord ja korrastatus.
19. veebruar 2017. a.
41
42.
Järgneval slidedel on veel mõned suurused,mis iseloomustavad eelpooltoodut soojuse ja
töö vahekorrast.
Lämmastiku temperatuuri tõstmiseks 100
kelvinilt 800 kelvinile on vajalik osakestele
lisada liikumiskiirust pea kilomeeter
sekundis (3600 km/h) – muidugi kulub
selleks palju tööd, et genereerida niisuguseid
kiirusi meile igati hoomatavale massile.
19. veebruar 2017. a.
42
43. Gaasiosakeste liikumiskiiruse jaotus N2 näitel erinevatel temperatuuridel.
19. veebruar 2017. a.43
44.
Näide: Vee pumpamiseks ja soojendamiseks kuluvaenergia võrdlus
Võib tunduda, et kõrghoonete veevarustuses nõuab
kõige rohkem energiat ja seega ka kulutusi, vee
pumpamine ülemistele korrustele või looduses
vihmapilvede tõstmine maapinna kohale. Teeme
arvutuse, kus võrdleme energiat, mis kulub vee
tõstmiseks ja soojendamiseks. Selgub, et selle
energiahulgaga, mis kulub vee soojendamiseks
15.6 C kuni 60 C võiks sama veehulga tõsta
19 km kõrgusele!
Ehk vee kukkumisel 420 meetri kõrguselt
tõuseks tema temperatuur vaid ühe kraadi
võrra.
19. veebruar 2017. a.
44
45.
Vabaenergia ja seotud energia.Kuna aga keha siseenergia väljendub osakeste korrastamata
liikumise kaudu, siis tuleneb sellest, et süsteemi siseenergiat
U pole võimalik täielikult tööks muuta.
Järelikult
võib siseenergiat vaadelda koosnevana kahest osast
– vabast ja seotud energiast
U = Energiavaba + Energiaseotud
Ainult vabaenergia moodustab selle osa siseenergia
varust, mida saab täielikult muuta tööks – selle kasutamine
on tehniliselt teostatav.
Vabaenergiaga seotud küsimusi vaatleme veidi veel käesoleva
loengu lõpus.
19. veebruar 2017. a.
45
46.
Temperatuuur on aatomite ja molekulidemikroskoopilises skaalas toimuva juhusliku
liikumise keskmise kineetilise energia
mõõt.
Temperatuur iseloomustab kineetilist energiat
molekulide liikumise ühe vabadusastme kohta
(üles, alla, vasakule-paremale – kokku kolm).
Kulgliikumise korral on osakesel vabadusastmeid 3,
pöördliikumine lisab veel ühe vabadusastme (jätke
palun meelde, – see on oluline vedela ja tahke vee –
jää -, soojusmahtuvuse erinevuse mõistmisel).
19. veebruar 2017. a.
46
47.
Kui lisandub ka osakeste pöördliikumine (nt.molekul koosneb kahest ja rohkemast
aatomist), siis lisandub vabadusastmeid ja
molekulide liikumise keskmine kineetiline
energia kasvab, s.t. samal temperatuuril on
keha molekulide kineetiline energia suurem
ehk mida keerukam on molekuli kuju, seda
suurem on aine soojusmahtuvus.
Seda iseloomustab makroskoopiliselt aine
soojusmahtuvus.
19. veebruar 2017. a.
47
48.
Soojusmahtuvuseks nimetataksesoojushulka, mis on vajalik antud
ainekoguse temperatuuri tõstmiseks
1 kraadi võrra.
SI-süsteemi mõõtühik on J×K−1.
Soojusmahtuvust võib väljendada ka ühikulise
ainekoguse kohta, olgu selleks siis mass,
ainehulk vms. Soojusmahtuvust moolides
väljendatud ainehulga kohta nimetatakse
ka moolsoojuseks. Soojusmahtuvust
massiühiku kohta nimetatakse ka
erisoojuseks.
19. veebruar 2017. a.
48
49.
Mida rohkem on osakeste liikumise võimalikkevabadusastmeid, seda suurem on ka aine
soojusmahtuvus.
NB! Jää (tahke vee) soojusmahtuvus(0,51
cal/g) on poole väiksem kui vedelal veel (1,0
cal/g) just seetõttu, et jääs pole võimalik
veemolekulide pöördliikumine – molekulid
on fikseeritud molekulaarvõresse
vesiniksidemete kaudu.
Nii on ka metallide soojusmahtuvused suhtelised väikesed
(metallides pole ju võimalik osakeste pöördliikumine), kohe
kõvasti väiksemad kui on näit. on vee soojusmahtuvus.
19. veebruar 2017. a.
49
50.
Soojusmahtuvus sõltub nii aine olekust(mida võib määratleda nt. temperatuuri ja rõhu
kaudu) kui ka termodünaamilisest protsessist,
milles aine osaleb. Soojusmahtuvust, mida
mõõdetakse konstantse rõhu tingimustes,
nimetatakse isobaariliseks
soojusmahtuvuseks (Cp).
Soojusmahtuvust, mida mõõdetakse
konstantse ruumala tingimustes,
nimetatakse isohooriliseks
soojusmahtuvuseks (CV).
19. veebruar 2017. a.
50
51.
Süsteemi olekutiseloomustatakse olekuparameetritega
ja olekufunktsioonidega;
Olekuparameetrid on mõõdetavad suurused,
temp. T, rõhk P, ruumala V, ainehulk n;
Olekufunktsioon on suurus, mis sõltub ainult
süsteemi olekust (olekuparameetritest), mitte
selle oleku saavutamise viisist (protsessi
teest).
Olekufunktsiooni U (siseenergia) muut DU
arvutatakse süsteemi alg- ja lõppolekule vastavatest
olekufunktsiooni väärtustest, ei arvestata protsessi
iseloomu.
19. veebruar 2017. a.
51
52. Soojusliikumine tahkises – osakeste liikumine on piiratud (osakeste pöördliikumist ei toimu – vedelike soojusmahtuvus on sageli suurem – osakesed saavad ka pöörelda) molekulidevaheliste jõudude poolt – liikumise parameetrid ( k.a.liikumise va
Soojusliikumine tahkises – osakeste liikumine onpiiratud (osakeste pöördliikumist ei toimu – vedelike
soojusmahtuvus on sageli suurem – osakesed saavad ka
pöörelda) molekulidevaheliste jõudude poolt – liikumise
parameetrid ( k.a.liikumise vabadusastmed) määravad aine
soojusmahtuvuse.
19. veebruar 2017. a.
52
53.
Temperatuur ei iseloomusta kogusiseenergiat, vaid ainult siseenergia üht osa kineetilist energiat s.t. osakeste
soojusliikumise kineetilist energiat
(E = mv2/2). Sama temperatuuriga kehad
võivad seega omada erinevat siseenergiat.
Seda iseloomustavad kehade erinevad
erisoojused.
NB! Vee erisoojused.
Temperatuuri mõõtmiseks kasutatakse erinevaid skaalasid:
Celsiuse, Kelvini, Fahrenheiti jt.
19. veebruar 2017. a.
53
54.
Soojuse mehhaaniline ekvivalent.Soojuse ülekanne ja töö on mõlemad seotud
energia muutumisega.
Klassikalises eksperimendis aastal 1843 näitas
James Joule töö ja soojuse ekvivalentsust,
mõõtes vee soojenemist segamisel ja vee
segamiseks kulutatud mehhaanilist energiat.
Joule sai järgmise seose tol ajal kasutusel
olnud soojuse ühiku kalor ja energiaühiku
Joule vahel:
1 cal = 4,1868 J
19. veebruar 2017. a.
54
55.
Soojus muudab keha siseenergiat ningsoojuse arvel saab teha tööd, mida
väidabki termodünaamika esimese
seaduse üks formuleeringutest:
ΔU = Q - A ,
ehk ja veelkord
energia ei teki ega kao, vaid
muutub ühest liigist teise s.t.
muutub vaid energia kvaliteet.
19. veebruar 2017. a.
55
56.
Et asi oleks veidi selgem, siis sõnastameeelneva lause (Energia ei teki ega kao, vaid
muutub ühest liigist teise) – järgmisel moel –
gaasile antav soojushulk on võrdne
siseenergia juurdekasvu ning
paisumisel tehtava töö summaga –
Q = ΔU + A
NB! Avaldis väljendub sisuliselt ka gaaside
universaalkonstandi R kaudu
19. veebruar 2017. a.
56
57.
Keha siseenergia (U) muutus on võrdnekehale juurdeantud soojuse (Q) ja tehtud töö (A)
vahega. Tööd tähistav liige võib valemis esineda nii
pluss- kui miinusmärgiga, sõltuvalt sellest, kas
tehakse välist mehhaanilist tööd või tehakse tööd
keha enda oleku muutmiseks.
Termodünaamika esimene seadus väljendab üldist
energia jäävuse seadust, mis ütleb, et energia ei
teki ega kao, ta võib vaid üle minna ühest
vormist teise.
Termodünaamika esimene seadus rakendab energia
jäävuse soojuslikele ja termodünaamilistele
protsessidele.
19. veebruar 2017. a.
57
58.
Seega, tulenedes eelnevast sõnastame töömõiste veidi üldisemalt järgmisel moel:
töö on energiaülekanne
süsteemile.
See protsess on ekvivalentne raskuse tõstmise
või langetamisega. Süsteemi siseenergia
muutub vastavalt süsteemi poolt tehtud tööga.
Kui teisi muutusi ei toimu, siis
∆U = A
19. veebruar 2017. a.
58
59.
Eelneva moraal tundub olevat kõige muukõrval ka selles, et energiamajanduses tuleb
mehhaanilistele protseduuridele eelistada
soojuse ülekandega seotud tehnoloogiaid, sest
need on energeetilises mõttes palju
efektiivsemad. Just niisamuti on asjalood
atmosfääris ja meres toimuvates protsessides,
kus suured kogused energiat vabanevad ja
konverteeritakse liikumiseks (tuul, hoovused), mis
tulenevad näiliselt väikestest
temperatuurierinevustest.
Võrrelge palun veelkord soojuse ja töö
ekvivalente (1 cal = 4,1868 J).
19. veebruar 2017. a.
59
60.
Üks teeklaas bensiini kaalub 170 grammi, sellepõlemisel vabaneb 1870 kilokalorit – kilokalor
vastab 427 kilogramm-meetrile tööle.
Seega 170 grammi bensiini põlemisel vabanev vastav
tööhulk on 798490 kilogramm-meetrit. Järelikult
saaks 170 grammi bensiini põlemisel saadava
energia abil tõsta 798 tonnise raskuse tõsta 1 meetri
kõrgusele.
Bensiini maht suureneb põlemisel 13000 korda.
Moodustunud gaasid paisuvad – jahtuvad
paisumisel, “kaduma läinud” soojus,
muutub (konverteeritakse) tööks.
19. veebruar 2017. a.
60
61.
Keemias – termodünaamika põhjendab ühevõi teise protsessi võimalikkust või
mittevõimalikkust ja näitab kätte protsessi
suuna.
Termodünaamika aluseks on energia
jäävuse printsiip erinevate
energialiikide ekvivalentsuse printsiip,
lisades siia juurde erinevate energialiikide
kvaliteedi printsiibi.
19. veebruar 2017. a.
61
62.
Üheski loodusnähtuses ei saa energia jäljetultkaduda või eimillestki tekkida. Energia saab
minna ühest liigist teise, kusjuures need
üleminekud toimuvad alati rangelt
ekvivalentsetes vahekordades, kuid
energia üleminekutega muutuvad ka
soojuskandja (aine) osakeste
omavahelised suhted ehk osakeste
omavaheline korrastatusmittekorrastatus.
See on loengu järgneva osa teemaks.
19. veebruar 2017. a.
62
63.
Märkus „energia tootmise“ kohta.Loodusteaduse mõttes on energia tootmine
(täpselt samuti nagu ka aine tootmine) muidugi
võimatu. Oleme ka käeolevas loengus seda korranud
kui termodünaamika esimest seadust - energia ei teki
ega kao – kõik energia pärineb ikka ja alati Suurest
Paugust. Muutub vaid energia kvaliteet (vorm).
Energia „tootjad“ loovad ainult kohatist
korrastatust mujal tekkiva korrastamatuse
arvel kogudes kokku (kontsentreerides)
hajutatud energia.
19. veebruar 2017. a.
63
64.
Korrastatus ja korrastamatus kuiloodusseadus.
Täiendavalt mikroprotsessidele liigub keha kui
tervik teiste kehade suhtes ja omab
makroskoopilist ehk tavalist kineetilist
energiat.
Vastasmõju tõttu teiste kehadega on
vaadeldaval kehal kui tervikul veel
potentsiaalne energia (näit. Maa
gravitatsioonivälja suhtes).
19. veebruar 2017. a.
64
65.
Need kaks – kineetiline ja potentsiaalne energiamoodustavad keha tavalise (makroskoopilise)
mehhaanilise energia.
Mehhaaniline energia võib täielikult üle minna
soojusenergiaks.
Ka soojusenergia võib omakorda üle minna
mehhaaniliseks energiaks, kuid NB!, mitte
kunagi täielikult.
Keha võib küll jahtuda, kuid saada jahtumise arvelt 100%
mehhaanilist energiat ei ole võimalik.
Osa soojusenergiast jääbki soojuseks (nn.
jääksoojuseks) - seda postuleeribki
19. veebruar 2017. a.
termodünaamika 2. seadus.
65
66.
TERMODÜNAAMIKA 2. SEADUSE (Soojus ei saaiseenesest minna külmemalt kehalt soojemale.)
paremaks MÕISTMISEKS TOOME SISSE
KORRASTATUSE-KORRASTAMATUSE MÕISTE
- ENTROOPIA.
Energeetiliste üleminekute pöördumatuse
astme hindamiseks kasutatakse mõistet
ENTROOPIA (kreeka keelest en –
sees, trope – pööre, muundus) mõiste
looja-kasutuselevõtja on
Clausius 1854. a.
19. veebruar 2017. a.
66
67. Rudolf Julius Emanuel Clausius (2. jaanuar 1822 – 24. august 1888) oli saksa füüsik ja matemaatik, üks termodünaamika rajajatest, entroopia mõiste kasutuselevõtja.
19. veebruar 2017. a.67
68.
Ja veel termodünaamika 2-sest seadusest:Soojus ei saa iseenesest minna külmemalt
kehalt soojemale.
Tunneme muidugi intuitiivselt, et soojus kandub
üle soojemalt kehalt külmemale, aga just
entroopia määrabki soojusvahetuse suuna.
Seda tuleb looduses toimuva mõistmiseks alati
arvestada. Kuigi-kuigi vastupidine protsess
otseselt energia jäävuse põhimõtet ei riku –
seetõttu eeldabki soojusvahetuse suund veel
mõningate seaduspärasuste olemasolu.
19. veebruar 2017. a.
68
69.
Energia kvaliteeti iseloomustab hästi ka Teile juba hästituntud lühike käesoleva loengu video „Reaktsiooni
aktivatsioonienergia analoogia“, video sellest kuidas
mees upitab suurt kivi üle takistuse. Takistuse kohal on
kivi potentsiaalne energia ja energia kvaliteet
maksimumis ning takistuselt alla veeredes muutub see
soojuseks.
Energia jäävuse seaduse nõuded on täidetud, kuid
tekkinud soojuse abil kivi tagasiupitamine üle tõkke on võimatu.
Energia kvaliteedi vahe peaks olema sellest videost hästi
ettekujutatav – millal liiguvad kivi osakesed korrapäraselt (kivi
üle tõkke lükates) ja kuidas liiguvad osakesed temperatuuri
tõustes, liiguvad kiiremini seetõttu, et osa kivi potentsiaalsest
energiast konverteerub soojuseks kui kivi üle tõkke kukkudes.
19. veebruar 2017. a.
69
70.
Entroopia on termodünaamikas kasutatavekstensiivne suurus, mis kirjeldab
vaadeldava süsteemi erinevate võimalikku
(osakeste) juhuslike ümberpaigutuste arvu.
Tihti öeldakse, et entroopia mõõdab "korratust".
Protsessidele, milles entroopia kasvab, vastavad
pöördumatud muutused süsteemis, mis
vähendavad süsteemi võimet teha tööd, sest osa
energiast on pöördumatult muundunud
soojuseks ehk ebakorrapäraseks liikumiseks
(ehkki liikumine pro energia ei kao).
19. veebruar 2017. a.
70
71.
Entroopia on üks termodünaamika (ja koguloodusteaduste) põhimõistetest. Selle
muudab oluliseks termodünaamika teine
seadus, mille järgi ei saa isoleeritud
süsteemi entroopia kunagi (iseenesest)
kahaneda.
Seega saavad iseeneslikud protsessid isoleeritud
süsteemis toimuda vaid entroopia kasvamise
suunas ehk
süsteemi korrastatus ei saa tekkida
iseenesest.
19. veebruar 2017. a.
71
72.
Protsessid, millesentroopia
kahaneb, saavad toimuda vaid
siis, kui süsteem teeb tööd.
Nii saab soojus iseeneslikult kanduda vaid
soojemalt kehalt külmemale.
Selleks, et käivitada vastupidine protsess, kus
soojus kandub külmemalt kehalt soojemale,
tuleb teha tööd (vaadake palun töö ja
energia määratlust
1. loengust).
19. veebruar 2017. a.
72
73.
Entroopia ja termodünaamika 2 seadus.Iseenesliku protsessi toimumise tulemus
looduses on protsessi tasakaaluolek
(potentsiaalide vahe kadumine).
Protsesside toimumise võimalikkuse,
nende võimalikkuse puhul nende suuna
ja tasakaaluolekud määratlebki
termodünaamika
2 seadus:
19. veebruar 2017. a.
73
74.
kõik protsessid looduses toimuvadiseenesest ainult ühes suunas, soojus
läheb iseenesest ainult kõrgema
temperatuuriga kehalt madalama
temperatuuriga kehale kusjuures aine
korrastamatus suureneb.
ΔS max,
kus S on korrastamatuse ehk entroopia
määr.
19. veebruar 2017. a.
74
75. Spontaanne (iseeneslik) protsess – soojus läheb iseeneslikult üle soojemalt kehalt külmemale, kusjuures nn. algseisu korrastatud temperatuuri jaotus kehas asendub korrastamata, juhusliku jaotusega. Video: Soojusmasinate kasutegurid ja entroopia.
19. veebruar 2017. a.75
76. Töö – soojus – paisumisel gaas jahtub, tehes tööd – keha siseenergia väheneb, ning osakeste liikumise korrapäratus suureneb.
19. veebruar 2017. a.76
77.
Seega on termodünaamika II seadus sõnastada kajärgneval moel:
soojus ei saa iseenesest üle minna külmemalt
kehalt kuumemale, ükskõik missugused
vahepealsed protsessid või energia
muundumised seejuures toimuksid
EHK
energia kandub alati kõrgema potentsiaaliga
süsteemilt üle madalama potentsiaaliga
süsteemile, kusjuures see ülekandumine kestab
seni, kuni saabub termodünaamiline tasakaal.
19. veebruar 2017. a.
77
78.
Tõenäosus, et gaasiga täidetud anumamõlemas pooles on ühepalju osakesi, on
alati suurim ja mida rohkem on osakesi, seda
väiksemaks jääb ebavõrdsete jaotuste tõenäosus.
L. Boltzmann seostas taolise olukorra kirjelduse
entroopia väärtusega ja väljendas vastava oleku
tõenäosust matemaatiliselt, millest tulenes sellest,
et
maksimaalse entroopiaga olekule
vastab alati suurima
tõenäosusega olek.
19. veebruar 2017. a.
78
79. Spontaanne (iseeneslik) protsess – aine hajub – hajutatud olek (korrastamata olek) on suurema tõenäosusega kui korrastatud aine olek.
19. veebruar 2017. a.79
80.
Suurima tõenäosusega oleku saabumisel on tulemusuniversaalne: see kehtib nii erinevate gaaside
segunemisel kui ka erineva temperatuuri
jaotusega süsteemide ühinemisel, erinevate
liikuvate kehadega süsteemi jne ühinemisel.
Selle tõttu toimub temperatuuride ühtlustumine ja
soojuse üleminek kuumemalt kehalt külmemale,
erinevate kehade liikumishulkade ühtlustumine.
Ka vastupidised protsessid on statistiliselt võimalikud,
kuid molekulide väga suure arvu tõttu ülimalt
väikese tõenäosusega.
19. veebruar 2017. a.
80
81. Mittepöörduv protsess. Kui kambreid A ja B ühendav kraan avada, arvestame suurima tõenäosusega, sellega, et ühtlustuvad kambrites nii rõhud kui temperatuurid. Vastupidise protsessi esile kutsumiseks on vaja väljastpoolt tulevat mõjutust (gaas tul
Mittepöörduv protsess.Kui kambreid A ja B ühendav kraan avada, arvestame
suurima tõenäosusega, sellega, et ühtlustuvad kambrites
nii rõhud kui temperatuurid. Vastupidise protsessi esile
kutsumiseks on vaja väljastpoolt tulevat mõjutust (gaas
tuleb tagasi pumbata – tuleb teha tööd).
19. veebruar 2017. a.
81
82.
Seletus eelneva osas.Igasuguse molekulide jaotuse tõenäolisus on
võrdne. Kuid neid tõenäosusi on väga palju.
Näide – 10 valikuvõimalusest seitsme
etteantud järjestuse juhuslikke
kombinatsioone on 107, järelikult on ühe
suvalise kombinatsiooni tõenäosus üks
miljondik.
Aga kui 1 cm3 õhus on 2,68 x 1019 molekuli,
siis on kaotab mõtte teha vahet sõnadel
“äärmiselt ebatõenäoline “ ja “võimatu”.
19. veebruar 2017. a.
82
83.
Eelneva illustreerimiseks – kujutage ette,et teil on anumatäis musti ja valgeid
kuulikesi, mis on laotud kasti – mustad all ja
valged pealpool. Kui Te segate kuulikesed
omavahel läbi, siis iga kuulide jaotus on
võrdtõenäoline, kaasa arvatud jaotus, kus
valged ja mustad kuulid on jaotunud kaheks
kihiks.
Kui arukas oleks loota, et kuulikeste segamisel
moodustuks eelneva pöördjaotus - kõik
valged kuulid oleksid all ja mustad nende
peal.
19. veebruar 2017. a.
83
84.
Valgete ja mustade kuulikeste jaotumist kihitivõib vaadelda kui kõrge korrastusastmega
süsteemi seisundit ja olukorda, kus
kuulikesed on jaotunud ebakorrapäraselt,
olukorraga mis on realiseerunud –
entroopia on suurenenud ja väljastpoolt
energiat rakendamata (tööd tegemata välise
energia arvel) ei ole võimalik endist
korrastatud olukorda taastada.
19. veebruar 2017. a.
84
85.
Entroopia määra põhivõrrand on:S = k×lnW,
kus
k on Boltzmann’i konstant (sisuliselt gaaside
universaalkonstant ühe molekuli jaoks – tema
väärtus 1,381 × 10-23 J×K-1) ja W on
positsioonide arv, kuidas molekulide paigutus
saab antud temperatuuril korrastuda.
Kui suureneb W, suureneb ka S (entroopia),
kuid nende seos on logaritmiline.
19. veebruar 2017. a.
85
86.
Suurus W on aatomite ja molekulide võimalikepaiknemiste arv, mis kõik vastavad samale
energiale. Iga molekulide paigutus aines on
omanäoline, teistest erinev see, mida
kutsutakse mikroolekuks; seega on W
samale energiale vastavate erinevate
mikroolekute hulk. Iga mikroolek kestab
vaid hetke. Kui mõõdame süsteemi omadusi,
määrame seega mõõtmise ajal olnud
mikroolekute keskväärtust.
19. veebruar 2017. a.
86
87.
Boltzmannivalemi järgi arvutatud
entroopiat nimetatakse statistiliseks
entroopiaks.
NB! Kui süsteemis molekulide hulka
kahekordistada, suureneb mikroolekute hulk
W W2
ja entroopia k×lnW-st k×lnW2-ks
(või 2k×lnW-ks)
19. veebruar 2017. a.
87
88.
SEEGAmääratletakse entroopiat tõenäosuse
(mikroolekute) W (tegemist on korrastatusemittekorrastatusega) kaudu Boltzmanni
võrrandi abil:
S= R/NA × lnW,
kus R on universaalne gaasikonstant,
NA - Avogadro arv,
R/NA =1,38.10-23 J/K×mol ongi entroopia mõõtühik.
19. veebruar 2017. a.
88
89. Positsiooniline korrastatus-korrastamatus aines (CO). Kui aines on N molekuli, siis on võimalik võimalikku 2N sama energia paigutust – järelikult sõltub entroopia määr ka viimasest.
19. veebruar 2017. a.89
90. L. Bolzmann’i (1844 -1906) hauasammas Viinis – tähelepanu entroopia määratlusele valemina tema hauasamba ülaosal.
19. veebruar 2017. a.90
91.
Miks muutub korrapärane mehhaanilineliikumine korrapäratuks soojusliikumiseks?
Põhjus on oleku tõenäolisuses – korrapäratu
liikumise tõenäosus on lihtsalt suurim.
Loodusseadus - termodünaamika teine
seadus ütleb: kõik looduslikud protsessid
kulgevad nende olekute tõenäosuse
kasvamise suunas. Eelnevat võib
sõnastada kui entroopia iseenesliku
kasvamise seadust ehk jällegi – suurima
tõenäosusega oleku saavutamist.
19. veebruar 2017. a.
91
92.
Entroopia kasvamise seadus ontähtsaim loodusseadus – temast järeldub ka
see, et teist liiki igavese jõumasina ehitamine on võimatu, või
ja mis on seesama, et
kehad püüdlevad iseenesest tasakaaluolekusse (st
ei ole võimalik luua tasakaalustamatust potentsiaalide vahet - ilma väljastpoolt süsteemile
energiat lisamata).
Entroopia (korrastamatuse) iseenesliku
kasvamise seadus ongi termodünaamika
teine seadus.
Esimene on energia jäävuse seadus, mis toimib sõltumatult
termodünaamika teisest seadusest.
19. veebruar 2017. a.
92
93. Töö – soojus – paisumisel gaas jahtub, tehes tööd – keha siseenergia väheneb, osakeste liikumise korratus suureneb. Nähtus iseloomustab termodünaamika teist seadust – süsteemi koguenergia ei muutu, küll aga toimub pöördumatu protsess
Töö – soojus – paisumisel gaas jahtub, tehes tööd – kehasiseenergia väheneb, osakeste liikumise korratus suureneb.
Nähtus iseloomustab termodünaamika teist seadust –
süsteemi koguenergia ei muutu, küll aga toimub
pöördumatu protsess – entroopia suurenemine.
19. veebruar 2017. a.
93
94. Gaasi paisumisel entroopia (korrastamatus) kasvab logaritmiliselt (lnW).
19. veebruar 2017. a.94
95.
Energia jäävuse seadus on mehhaanikaseadus, sellele alluvad tingimusteta nii suured
kehad kui ka üksikud aatomid ja molekulid.
Mis puutub entroopia kasvamise
seadusse, siis kehtib ta küllalt suure
osakeste kogumi korral, kuid üksiku
molekuli jaoks ei saa seda formuleerida.
Seega - termodünaamika teine seadus
on statistilise iseloomuga (see märgibki
tema seost suure osakeste hulgaga), aga see
ei vähenda mingil määral tema tähtsust ega
täpsust.
19. veebruar 2017. a.
95
96.
Eelnevast tulenebki, et oma olemuselt ontermodünaamika seaduspärasustest – vaid
termodünaamika I seadus – energia
jäävuse ja muundumise seadus universaalne.
Termodünaamika II seadus ja III seadus
(viimase lihtsaim formuleering - temperatuuri
absoluutne nullpunkt on saavutamatu) on
oma loomult statistilised, neist viimane
veel kvantteoreetilise päritoluga.
19. veebruar 2017. a.
96
97.
Entroopia kasvamise seadusmäärab protsesside
kulgemise suuna.
Selles mõttes on entroopia
looduslike rikkuste ülemjaotaja,
aga energia on looduse
raamatupidaja.
(entroopia – töö mõõt)
19. veebruar 2017. a.
97
98.
Entroopia kasvu seadus tähendabsüsteemide üleminekut maksimaalse
tõenäosusega olekusse. Selles
seisnebki termodünaamiliste protsesside
pöördumatus.
Selles seisneb ka loodusteaduste jaoks
fundamentaalne tõsiasi – aeg
on
asümmeetriline.
19. veebruar 2017. a.
98
99.
Viimane tõsiasi on aluseks olnud Maailmakujunemiseks selliseks nagu ta on oma
mitmekesisuses ja selle mõistmine on olnud
üheks lähtepunktiks relatiivsusteooria
loomisel, kvantmehhaanika kujunemisel
ja muidugi evolutsiooniteooria
väljajoonistumisel juba
19-nda saj. keskel - Ch. R. Darwin – tema
peateos “Liikide tekkimine…” 1859. aastal.
19. veebruar 2017. a.
99
100.
Just paljukomponendiliste süsteemide ülemineksuurema statistilise tõenäosusega olekusse
määrabki
aja kulgemise suuna - nn.
ajanoole ehk
sümmeetria
puudumisele
fundamentaalsetes protsessides
ehk kõik süsteemides toimuvad muutused on
suunatud suurima tõenäosuse saavutamisele.
19. veebruar 2017. a.
100
101.
Mida keerukam on süsteem, midakorrapärasem ta on, seda väiksem on tema
entroopia ning seda tõenäolisem on tema
iseeneslik lagunemine.
Keerulised süsteemid ei teki iseenesest
(õigemini - nende iseenesliku tekke
tõenäosus on kaduvväike), neid saab
ehitada-luua ainult ümbritseva
keskkonna entroopia kasvu
arvel.
19. veebruar 2017. a.
101
102.
Seega - jah, energiat on võimalik kontsentreerida,koguda kokku ruumis hajutatud energiat, näiteks vett
hüdroelektrijaam tammi taha, keerata üles kella vedru
jne. Oma olemuselt sarnaneb see maavarade
tootmisega, protsess milles hajutatud materjal
kogutakse kokku – kuld, kivisüsi, uraan jne.
Kütuse põletamise kaudu – soojusenergia – tekitatud
potentsiaalide vahe arvel tehakse tööd (s.o.
korrastatuse loomise kaudu) luuakse näiteks
elektronide korrastatud jaotus ehk igapäevakeeles soojuselektrijaam „toodab“ elektrienergiat –
elektronide (laengute) korrastatust mida tuleb ja saab
tõkete, „elektronide tammide“ (isolaatorite abil) ka
koguda. Loomulikult on selleks ka teisi viise.
19. veebruar 2017. a.
102
103.
Ja veel „energia tootmise“ asjus:teame eelnevast, et Maailm koosneb mateeriast ja
kiirgusest (energiast) ja sedagi, et
mateeria erinevaid vorme nimetatakse aineteks.
Aine ja energia on aga loodusteaduste jaoks
ühe ja sama materjali kaks vormi.
Ainet saab iseloomustada massi kaudu (ainet
saab kaaluda), mass aga on rangelt võrdeline
energiaga (E = m×c2).
Seega „toota“ ei saa me ühte ega teist – me
vaid saame neid kontsenteerida ja muuta
nende kvaliteeti.
19. veebruar 2017. a.
103
104.
Siit ja seega saame sõnastada 4 ajatut printsiipi,mis tulenevad ajast ja entroopiast.
•Printsiip A. Aeg on fundamentaalne suurus. Aja
toime on kõige elementaarsem protsess looduse, mille
kaudu luuakse olemasolevatest sündmustest uued
sündmused. Põhjuslikkus tuleneb otseselt aja
pöördumatust olemusest.
•Printsiip B. Ajal on fundamentaalne suund. Tulevik
areneb oleviku olemisest, puuduvad põhjuslikud
silmused või piirkonnad, kus aeg „edeneb tagurpidi“.
Fundamentaalsed seadused, mis arendavad
tulevikku olevikust, on pöördumatud – minevikku
seisundeid ei saa konstrueerida oleviku
seisunditest.
19. veebruar 2017. a.
104
105.
• Printsiip C. Objekti aeg-ruumi omadusedvõi sündmused tulenevad selle suhetest
teiste dünaamiliste objektidega. Kõigil
aegruumi omadustel on dünaamiline päritolu.
• Printsiip D. Energia on fundamentaalne.
Energia ja liikumishulk (moment) ei ilmu välja
aegruumist, pigem on tõene vastupidine.
Aegruum ilmub välja fundamentaalsemast
põhjuslikust ja dünaamilisest olekust,
kus energia ja moment on algsed.
19. veebruar 2017. a.
105
106.
Näiteid entroopia muutumisest.Entroopia kasv DS > 0 toimub
sulamisel, aurustumisel, lahustumisel, temperatuuri
tõstmisel (intensiivistub osakeste kaootiline
liikumine), reaktsioonid, kus gaasiliste ainete hulk
(maht, moolide arv) kasvab;
Entroopia kahanemine DS < 0 toimub
gaasi veeldumisel, tahkestumisel, gaasiliste ainete
mahu vähenemisel.
Korrastatuse suurenemine ja vähenemine
reaktsioonide käigus:
C(s) + O2(g) 2CO(g) DS > 0
3H2(g)+ N2(g) 2NH3(g) DS < 0
19. veebruar 2017. a.
106
107. Jää sulab korrastatus väheneb entroopia suureneb.
Jää sulab korrastatus vähenebentroopia suureneb.
19. veebruar 2017. a.
107
108. Jääkentroopia jääs. Igal vee molekulil kaks pikka ja kaks lühikest vesiniksidet – sidemete erinevad paigutused suurendavad jää võimalikku entroopiat, jää struktuuri korrastamatust. Pikemate sidemete osakaal suurendab jää entroopiat – sidem
Jääkentroopia jääs. Igal vee molekulil kaks pikka ja kakslühikest vesiniksidet – sidemete erinevad paigutused
suurendavad jää võimalikku entroopiat, jää struktuuri
korrastamatust.
Pikemate sidemete osakaal suurendab jää entroopiat –
sidemete lõhkumine (jää sulamine, vee aurustumine) aga
veelgi enam.
19. veebruar 2017. a.
108
109. Tahke aine sulamisel korrastatus väheneb – entroopia suureneb.
19. veebruar 2017. a.109
110.
Ja lisaks veel mõned Murphy seadustest, seadused,mille kehtivust, elu (kahjuks) igapäevaselt kinnitab.
Neist esimene ja oluliseim:
Kui midagi saab untsu minna, siis ka ta läheb.
Ja järgnevalt tuletis sellest:
Kui midagi ei saa untsu minna, siis midagi ikka
läheb.
Sealt siis Murphy filosoofia:
Naeratage... homme on veel hullem.
Ja edasi - Murphy konstant:
Asjad purunevad võrdelises seoses nende
väärtusega.
19. veebruar 2017. a.
110
111.
Entroopia – kordame üle.Seotud energia moodustab süsteemi siseenergia
selle osa, mis ei ole tööks muudetav – selle osa
energiast üleminek on võimalik ainult soojuseks,
millena ta ka hajub.
Vabaenergia sisaldub süsteemis potentsiaalse
energiana – kui süsteem teeb tööd, siis
vabaenergia hulk väheneb (spontaanselt iseeneslikult) – entroopia on vaadeldav tehtud töö
mõõduna.
Näide:
gaas on suurema rõhu all võimeline tegema rohkem
tööd kui gaas väiksema rõhu all.
19. veebruar 2017. a.
111
112.
Tööd iseloomustab osakeste korrapäranekollektiivne liikumine, soojust aga
kaootiline liikumine.
Töö iseeneslikku üleminekut soojuseks võib seetõttu
käsitleda molekulaarse süsteemi üleminekuna
osakeste korrapäraselt liikumiselt suurema
tõenäosusega korrapäratule liikumisele.
Entroopiat võib vaadelda kui osakeste
soojusliikumise kaootilisuse mõõtu ja
vabaenergiat kui “kättesaadavat” energiat.
Näide: lõhkeaine plahvatas – moodustunud osakesed on
stabiilsemad, paiknevad korratult, lõhkeaines olev
energia oli aga kergesti “kättesaadav”. Keerate kella
ülesse – vedrus elev energia on kergesti „kättesaadav“.
19. veebruar 2017. a.
112
113.
Mitte mingil juhul ei saa isoleeritudmakrosüsteemi entroopia iseeneslikult
väheneda.
Siiski ei tähenda see seda, et protsessid,
millega kaasneb entroopia vähenemine on
võimatud, aga nende esilekutsumiseks peab
toimuma soojusvahetus (energiavahetus)
ümbritseva keskkonnaga ning ärge unustage,
et iga süsteem minimiseerib oma
energeetilise taseme, nähtus, mis
otseselt tuleneb termodünaamika teisest
seadusest.
19. veebruar 2017. a.
113
114. Suletud ja avatud süsteemid.
19. veebruar 2017. a.114
115. Entroopia.
Seega – suletud süsteemis, millesT = const ja V = const,
saavad toimuda ainult protsessid, mille puhul
vabaenergia väheneb, s.o. entroopia
suureneb - sellised protsessid on
pöördumatud.
Järelikult
on entroopia muutus isoleeritud süsteemis
protsessi pöördumatuse kvalitatiivseks
mõõduks.
19. veebruar 2017. a.
115
116.
Maailm tunneb vaid üht süsteemi, kus toimubstruktuuri “iseeneslik“ üleminek lihtsamalt
(suure tõenäosusega) olekult keerulisemale
(väiksema tõenäosusega) olekule.
See süsteem on elusloodus.
Termodünaamika seaduste ilmne rikkumine
eluslooduses on tänapäeva teaduse seisukohalt
tingitud informatsiooni kogumisele ja
kasutamisele programmeeritud juhtsüsteemist,
mis, töötades molekulaarsel tasemel, säilitab
(arenemisvõimeliste liikide kujul) just madalama
entroopiaga seisundeid.
19. veebruar 2017. a.
116
117.
Elu Maakeral, kogu fossiilkütustepõletamisel põhinev energeetika on võimalik
vaid fotosünteesi poolt genereeritud
hapendajate (O2) ja taandajate (CH2O)
omavahelise redokspotentsiaalide
erinevuse tõttu, sinna salvestatud
vabaenergia tõttu – viimane ongi vaadeldav
negentroopiana (korrastatusega – negatiivse
entroopiaga) ja on toimunud ning toimub
päikeseenergia salvestamise ja selle
kasutamise arvel.
19. veebruar 2017. a.
117
118.
Fotosüntees on suurim redoksreaktsioonmis Maal tema ajaloo jooksul on toimunud.
Alates evolutsiooni poolt fotosünteesi
„leiutamisest“ on taandavate omadustega
keskkonnast litosfääri ülemises osas,
hüdrosfääris ja atmosfääris on nendes ümber
kujunenud elementide jaotus ja teiseks saanud
nende ühendid. Fotosünteesi nimetatakse
geokeemilises plaanis ka „fotosünteetiliseks
oksüdeerimiseks“
Maa sisekihid vulkanismi kaudu toovad esile seda, mida mis
elukeskkonda vastandab ning rahva müütides kannab nimetust
„põrgu“, kohta kus puudub elu.
19. veebruar 2017. a.
118
119.
Entroopia Päikesel suureneb janegentoopia (korrastatus) kasvab seal, kus
see on võimalik. Me tunneme selleks ainult
üht protsessi –
fotosünteesi.
Looduses toimubki termodünaamika
vaatepunktist vastupidine protsess –
fotosünteesi kaudu negentroopia
(negatiivne entroopia = korrastatuse)
loomine.
19. veebruar 2017. a.
119
120.
Fotosüntees (kreeka photo- 'valgus' +synthesis – ühendamine, liitmine) on looduses
asetleidev protsess, mille käigus elusorganismid
muudavad päikeseenergia keemiliseks energiaks.
Fotosüntees toimub fotoaktiivsete pigmentide,
eelkõige
klorofülli kaasabil.
Fotosünteesi lähteaineteks on süsinikdioksiid, vesi
ja mineraalained (energiaallikaks on
päikeseenergia), lõpp-produktiks ehk saaduseks
on süsivesikud, peamiselt glükoos, fruktoos ja
tärklis ning kõrvalsaaduseks hapnik.
19. veebruar 2017. a.
120
121.
Fotosünteesi kindlustamisel ja meie elualuseks olev protsess on väga õnnestunud
tuumaenergia kasutamise viis – Päike ei ole ju
midagi muud kui efektiivne, ilus ja esialgu ohutu
tuumareaktor - termotuumareaktor.
Teisalt Maailmaruum oma madala (3 kraadi
absoluutsel temperatuuriskaalal)
temperatuuriga on suurepärane „prügikast“
madalakvaliteetse (läbitöötatud) jääksoojuse
paigutamiseks.
19. veebruar 2017. a.
121
122.
Fotosünteesi lihtsustatud üldvalemina:6CO2 + 12H2O + footonid →
C6H12O6 + 6O2 + 6H2O
EHK
süsihappegaas + vesi +
valgusenergia(footonid) →
glükoos + hapnik + vesi
19. veebruar 2017. a.
122
123. Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides.
Eksotermilinereaktsioon
Kõrge aktivatsiooni
energia, väike
soojusefekt –
vabaenergia väheneb
Endotermiline reaktsioon
(vaja lisada vabaenergiat)
19. veebruar 2017. a.
Madal aktivatsioonienergia, suur soojusefekt –
reaktsioon kulgeb iseeneslikult – vabaenergia
väheneb
123
124.
Fotosünteesi protsesside –fotosünteetilise oksüdeerimise tulemusena on võimalik nende organismide
olemasolu, kes kasutavad fotosünteesi produkte
oma elutegevuse tagamiseks – seened, paljud
mikroorganismid, kõik loomad (inimene kaasa
arvatud). Fotosünteesi produktide kasutajad saavad
eksiteerida järgneva reaktsiooni kaudu, reaktsiooni
kaudu milles reageerivad omavahel “universaalne”
taandaja ja “universaalne” hapendaja (mõlemad
on fotosünteesi produktid):
„CH2O“ + O2 ↔ CO2 + H2O
19. veebruar 2017. a.
124
125.
Kordame üle:fotosünteesi reaktsiooni tulemusena seotud
CO2 lülitab süsiniku uuesti globaalsesse
ringlusesse.
Elu Maakeral ja kogu fossiilkütuste põletamisel
põhinev energeetika on võimalik vaid fotosünteesi
poolt genereeritud hapendajate (O2) ja taandajate
(CH2O) vahelise potentsiaali vahe tõttu.
Fotosünteesi poolt genereeritud potentsiaalide vahe
ongi vaadeldav negentroopiana (korrastatusega),
päikeseenergia arvel loodud potentsiaalide vahega.
19. veebruar 2017. a.
125
126. Kordame – fotosüntees.
19. veebruar 2017. a.126
127. RuBisCo ehk Ribulose-1,5-bisphosphate carboxylase/oxygenase – ensüüm-valk mida on Maailmas kõige rohkem, ensüüm mis katalüüsib CO2 lülitumist energiarikkasse glükoosi.
19. veebruar 2017. a.127
128.
19. veebruar 2017. a.128
129.
19. veebruar 2017. a.129
130.
Juhin siinjuures tähelepanu asjaolule, etrohelistele taimedele vajalikud toitelemendid
– valgus (footonid), mineraalid, vesi ja
süsihappegaas – nende allikaks on
veeorganismidele veekeskkond ning
maimaataimedele pinnas ja atmosfäär – siis need on
ained millest taim ehitab üles oma keha.
Toitumiseks vajaliku „teine pool“ - oma keha
ülesehitamiseks vajalik energia pärineb loomulikult
Päikeselt, selle kaudu toimub taime „ehitusplokkide„
korrastamine – toimub negentroopia –
korrastatuse – loomine, footonite
vahendusel.
19. veebruar 2017. a.
130
131.
Loomsete organismide puhul on need kaks pooltomavahel ühendatud – oma toiduga saame me nii
keha ülesehitamiseks vajaliku materjali kui ka
energia mille kaudu see keha ülesehitamine toimub.
Seega – fotosünteesi käigus toimub lõppkokkuvõttes
endotermiline reaktsioon – energia salvestatakse.
Meie aga - eelkõige aeroobid – toimetame
eksotermiliste reaktsioonide vallandamise kaudu –
universaalse taandaja ja universaalse hapendaja
vahelise reaktsiooni vallandamise kaudu – tulemuseks
on loomulikult roheliste taimede poolt tekitatud
korrastatuse (negentroopia) asendamine
korrastamatusega – entroopiaga.
19. veebruar 2017. a.
131
132. Maakera elustiku tagajaks - negentroopia allikaks on Päike. Temperatuuride vahe võimaldab selle süsteemi väga suurt kasutegurit = (6000 – 300) : 6000 = 0,95(!). 3K Maailmaruumi (jahutaja - heitsoojuse „prügikast“) temperatuur on väga lähedal
Maakera elustiku tagajaks - negentroopiaallikaks on Päike.
Temperatuuride vahe võimaldab selle süsteemi väga suurt
kasutegurit = (6000 – 300) : 6000 = 0,95(!).
3K Maailmaruumi (jahutaja - heitsoojuse „prügikast“)
temperatuur on väga lähedal absoluutsele nullile.
19. veebruar 2017. a.
132
133.
Kasuteguri piiriväärtus on:1 – T0/T1.
Oluline on temperatuuride (potentsiaalide) vahe.
Aurumasinas on temperatuuride vahe suhteliselt
väike võrreldes sellega mis see on diiselmootoris ja
gaasiturbiinides.
See ongi olnud põhjuseks miks aurumasinad tõrjuti
välja masinate poolt kus töötemperatuur ja jahutaja
temperatuuride vahe on olnud suurem.
Päikese (soojendaja 60000 K ) ja Maa (3000 K )
temperatuuride vahe on veelgi suurem – sellest ka
suurem kasutegur.
19. veebruar 2017. a.
133
134.
Nii kehtib termodünaamika II seadus kaMaailmaruumis ja meie Päikesesüsteemis – kõik
siin toimuvad protsessid on spontaansed.
Aga igas spontaanses protsessis peab süsteemi ja
ümbritseva keskkonna summaarne entroopia
kasvama.
DSuniversum = DSsüsteem + DSkeskkond > 0
puu põlemine CO2+ soojus (hajub
universumis).
Entroopia muutus reaktsioonides.
Standardne entroopia muut
DS° = Sni S°(produktid) - Sni
S°(lähteained)
n
19. veebruar
a.
i-2017.
ainete
koefitsiendid reaktsioonivõrrandis
134
135.
Vaatleme veelkord eelpoolesitletud materjaliveidi igapäevasemast, kuid ühtlasi ka natuke
üldisemast seisukohast, nimelt sellest mis on
seotud keskkonnaga ja ka selle kaitsega.
Väidan, et loodusteaduste seisukohast on
olemas keskkonnaseisundi halvenemisele
objektiivne süvapõhjus ning selleks on
entroopia kasvu seadus.
Hästituntud energia jäävuse seadusega
ollakse harjunud ning väga vähe kohtame (kuigi
ikka kohtame kah) soovi seda seadust
ignoreerida ehk projekteerida igiliikurit.
19. veebruar 2017. a.
135
136.
Kuid entroopia kasvu seadus on niisamafundamentaalne ja kindel loodusseadus kui energia
jäävuse seadus. Oma mõningase ebaharilikkuse
(statistilise olemuse) tõttu oleks entroopia
seadus (termodünaamika teine printsiip)
nagu mõneti ebakindel ning tekitab mulje,
et sellest võimalik kuidagi „mööda hiilida“.
Aga ei ole!
Viimasest tekibki sageli süvaraskus keskkonnakaitses.
Entroopia kasvu seadus keskkonnakaitse kontekstis tähendab
seda, et kõikide protsesside käigus muutuvad energia ja aine
kvaliteedilt halvemaks, et energia ja aine kvaliteet on pärast
protsessi madalamad (s.t. kehvemad) kui enne.
19. veebruar 2017. a.
136
137.
Kordan veel – energia jäävuse seadusütleb, et energia pärast pole tegelikult tarvis
muretseda: seda ei tule kuskilt juurde ega
lähe kaduma.
Entroopia kasvu seadusest järeldub, et
kasutada saame üksnes kõrge
kvaliteediga energiat (ainet) ja
kasutamise käigus muutub see
ilmtingimata madalama kvaliteediga
energiaks (aineks): ning meile vajalikud
tulemused saame ainuüksi selliste
muundumiste käigus ja tulemusel.
19. veebruar 2017. a.
137
138.
On ainult üks võimalus igasugustemuutumiste teostamiseks – see toimub
alati potentsiaalide vahe arvel ehk
entroopia kasvu arvel, aine ja energia
kvaliteedi languse tulemusel ehk seda,
et halva kvaliteediga energia ja aine on
korrastamata, palju rohkem „sassis“
olekus, selle entroopia on kõrgem.
19. veebruar 2017. a.
138
139.
Kuid NB! – palun mitte unustada, et kõiktermodünaamika seadused on sõnastatud
summaarse energia ja entroopia kohta –
arvesse tuleb võtta kõik kanalid, mida mööda
energia ja entroopia sisse tulevad ning samuti
kõik teed ja viisid, mis neid vaadeldavast
protsessist jälle välja viivad. Ning seega, kasvab
suletud süsteemi entroopia, toimub suletud süsteemi
energia ja aine kvaliteedi halvenemine, mis ei välista
selles ülejäänud süsteemi korrastatuse arvel veelgi
paremini korrastatud negentroopia (korrastatuse)
saarekeste tekkimist.
19. veebruar 2017. a.
139
140.
Toon eelneva illustreerimiseks veelkord näiteelusloodusest – kui oleks olnud võimalik entroopia
kasvu seadusele allumatu olend, siis oleks tal olnud
evolutsioonis niivõrd suur eelis, et ta oleks
evolutsiooni käigus kindlalt peale jäänud.
Täiskasvanuna poleks tal vaja süüa ega juua –
mäkkeronimiseks ning mäe otsa jõudnuna, oleks tema
keha energia muutnud vaid oma vormi, alla laskudes
oleks jällegi lihtsalt uuesti muutnud oma vormi.
Kadusid soojusele poleks üldse (meenutage olukorda
kus auto pidurdamisel kuumenenud pidurid auto uuesti
tekkinud soojuse arvel liikuma paneksid) – kuumaks
aetud keha energia oleks taolise Maailmas kergesti
muudetav kineetiliseks.
19. veebruar 2017. a.
140
141.
Keskkonnakaitsega seoses tehakse pahatihtijuttu jäätmevabast tootmisest.
Termodünaamika seisukohalt on see teaduse
ja teadmistevastane jutt, just sama tark nagu
jutt kuumadest piduriklotsidest, mis auto oma
soojuse arvel liikuma panevad. Kui midagi
muud, siis vähemalt madalakvaliteedilist soojust
peab igas protsessis tekkima.
Eelnevast tuleneb Maailma arengu dialektiline
vastuolu: vajame puhast elukeskkonda, aga
evolutsiooni laine kannab edasi just neid,
kes seda keskkonda kõige enam rikuvad.
19. veebruar 2017. a.
141
142.
Täpselt sama järeldus on kehtivmajanduslikult edukate ühiskondade kohta.
Ka kliima soojenemine tekib sellest, et meie
Maakera ei suuda vabaneda küllalt kiirest
madalakvaliteedilisest soojusest – aga selleks,
et ainuüksi atmosfäär saaks toimida meie
ootuste kohaselt, peab ta vabanema nn.
jääksoojusest.
Seega meie tehnoloogiline eduks, meie tarkus on
kergitanud meie ette globaalprobleemid, mis seotud
meie keskkonna kvaliteediga, millest ilmseim nn.
kliimasoojenemine – sellest aga lähemalt
10.
Loengus.
19. veebruar 2017. a.
142
143.
Kui süsteemi temperatuurid on ühtlustunud(kui kaob potentsiaalide vahe) ja entroopia
saavutanud oma maksimumi (s.t. puudub
igasugune korrastatus) on tegemist
nähtusega mida nimetatakse
SOOJUSSURMAKS kuigi energiat võib
sellises Maailmas olla küllaga, on aga vajalik
vastaspool, mille suhtes oleks energiat palju
– eluks ja toimimiseks ehk lihtsalt
igasugusteks muutusteks on vajalik
potentsiaalide vahe.
19. veebruar 2017. a.
143
144.
Energia jäävuse seaduse seisukohalt on kõikkallihinnaline energia alles, kuid, et midagi
süsteemis toimuks on vaja potentsiaalide
vahet ehk korrastatust.
Soojussurma tingimustes ei toimu
mitte midagi - süsteemis puudub
potentsiaalide vahe – süsteem on
täielikult töövõimetu – võimetu
igasuguseks muutuseks.
19. veebruar 2017. a.
144
145.
Soojussurmas on isekulgevprotsess maksimiseerinud oma
korrastamatuse, ehk energia on
jõudnud oma
„surnuaeda“ -
entroopiasse.
Midagi võib toimuma hakata ainult negatiivse
entroopia (negentroopia) – korrastatuse lisandumisel süsteemi. Ja see saab toimuda ainult
selle lisandumisel väljastpoolt vaadeldavat
süsteemi.
19. veebruar 2017. a.
145
146.
Universumi soojussurm(termodünaamiline paradoks) tekib siis kui
termodünaamika seaduspärasused rakenduvad
kogu Universumile.
Et midagi üldse toimuda saaks, peab alati olemas olema
temperatuuride vahe. Elu Maalgi on võimalik seetõttu, et on
olemas kuum keha (Päike), jahutav keha (külm
Maailmaruum) ning töötav keha (Maa).
Kui peaksid kaduma kõik
temperatuurierinevused, kui kaovad kõik
potentsiaalide erinevused, saabub
soojussurm – süsteem muutub
töövõimetuks.
19. veebruar 2017. a.
146
147.
Soojus läheb alati üle soojemalt kehalt külmemale,mistõttu soojem keha jahtub ning külmem keha
soojeneb kuni temperatuuride võrdsustumiseni.
Igaviku jooksul võrdsustuvad Maailmas kõik
temperatuurid.
SEEGA - Igaveses Universumis peaks juba
olema saabunud soojussurm, kuid kuna
see nii ei ole, pole Universum igavene.
Paradoksi sõnastas 1865. aastal üks
termodünaamika rajajaid, Rudolf J. E. Clausius.
Paisuva lõpliku Universumi puhul see paradoks
kaob.
19. veebruar 2017. a.
147
148.
Kuna aga suure tõenäosusega pole Universumigavene, Universumis olevad ained on pidevas
muutuses-teisenemises (vt. 2. loeng – tumeaine),
asjaolu, et saarekesed Universumis, kus
negentroopia (korrastatus) kasvab ja kasvab vaid
seni kuni on võimalik kasutada teistest Universumi
aladelt saabuvat energiat kus omakorda kasvab
entroopia ehk korrastamatus.
Meie siin Päikesesüsteemis, planeedil Maa
kasutame korrastatuse (negentroopia)
loomiseks Päikeselt saabuvat kiirgust
(energiat),…
19. veebruar 2017. a.
148
149.
…mille arvel ja klorofülli vahenduselkonverteeritakse see siin keerukamateks
struktuurideks (korrastatuseks) – eluks ning
võimalik, et veel meile mõnesse seni tundmatusse struktuuri.
Seetõttu võib termodünaamika teist seadust
vaadelda (analoogiliselt ajanoolega) kui
entroopia noolt ja Universumi
asümmeetriat
kirjeldavaks seaduseks.
19. veebruar 2017. a.
149
150. Kui Universum oleks igavene, siis peaks kogu taevas olema tähtede poolt valgustatud (kui nad on olemas, või must, kui tähed on kustunud). Kui Universum on tekkinud kunagi (Suur Pauk), siis tähed süttivad taevalaotuses järk-järgult ja ka kustuvad j
Kui Universum oleks igavene, siis peaks kogutaevas olema tähtede poolt valgustatud (kui nad on
olemas, või must, kui tähed on kustunud). Kui
Universum on tekkinud kunagi (Suur Pauk), siis tähed
süttivad taevalaotuses järk-järgult ja ka kustuvad järkjärgult.
19. veebruar 2017. a.
150
151.
Kordame veelkord!See, et Maakeral midagi toimub – moodustuvad
uued keerukad struktuurid, on tekkinud elu,
toimub laevaehitus, ehitatakse sadamaid,
tehakse lapsi jne. – need on kõik protsessid
mille käigus korrastatus suureneb ehk entroopia
väheneb.
Kokkuvõttes toimub see kõik Päikesel toimuvate
protsesside arvel – entroopia suurenemine
Päikesel on selleks allikaks, mis võimaldab
entroopiat Maal vähendada.
19. veebruar 2017. a.
151
152.
Seni kuni mateeria areng on tähtede faasis, seni kunitähtedes on piisavalt vesinikku, mis pole veel
konverteerunud raskemateks elementideks, on
võimalik selle energia arvel, mida tähed
kiirgavad, et Maailmaruumis moodustuksid
seda negatiivset entroopiat kasutavad
“saarekesed”.
Ja kõige selle taga on Universumi
“ülemjagaja” – korrastatusekorrastamatuse vahekord, see mille
toimet kirjeldab lihtne termodünaamika teine
seadus.
19. veebruar 2017. a.
152
153.
Üheks selliseks “saarekeseks” kus täht millenimi on Päike korrastub Päikese
negentroopia arvel osa ainest ja nii
moodustub meie elukeskkond.
“Vahendajaks” Päikese ja meie Maa vahel on
klorofüll ja edasi tuleb kõik see mida me
naudime – hapnik atmosfääris, meri täis
elusorganisme ja sellel sõitvaid laevu, meie
ise, Mereakadeemia ja veel palju muud ehk
kõik see mis sai võimalikuks Maa ajaloo
suurima redoksprotsessi – fotosünteetilise
oksüdeerimise tulemusena.
19. veebruar 2017. a.
153
154.
Paljud keemilised reaktsioonid kulgevadspontaanselt vaid ühes suunas (näiteks
teemati ärapõletamine, esimesena tegi seda
Antoine Lavoisie 1778.a.):
Cteemant(S) + O2(g) CO2(g)
Neid protsesse saab küll pöörata, kuid
selleks peab tegema tööd.
Isoleeritud süsteemis kulgeb protsess
spontaanselt kui suureneb süsteemi
korrapäratus.
19. veebruar 2017. a.
154
155.
Igas spontaanses protsessis peabsüsteemi ja seda ümbritseva keskkonna
korrapäratus suurenema.
Süsteemi korrapäratuse mõõduks on
entroopia (S, J/K×mol).
Erinevalt entalpiast (reaktsiooni
koguenergiast) on entroopia otseselt
eksperimentaalselt määratav suurus.
19. veebruar 2017. a.
155
156.
Vedeliku keetmisel suureneb süsteemientroopia, sest molekulide liikumine muutub
korrapäratumaks.
Entroopia muudu arvutamiseks võib kasutada
valemit:
ΔS = Q : T
(Q – aurustumissoojus cal/mool; T – vedeliku
keemistemperatuur)
Seega entroopia kui olekufunktsiooni suurus on määratud
soojuse ja temperatuuri suhtega – see on tuletatav Carnot
ringprotsessist (Carnot' ringprotsess koosneb isotermilisest paisumisesttöötav keha on kokkupuutes soojusallikaga vt. koolifüüsika kursusest).
19. veebruar 2017. a.
156
157.
Tõstes liikmed ümber Carnot protsessikirjeldavas võrduses
Q0 : Qi = T0 : Ti ,
saame olekufunktsioonid mis
peegeldavad muutusi korrastatuses ehk
entroopias
∆S0 = Q0 : T0
∆Si = Qi : Ti,
19. veebruar 2017. a.
157
158.
A Termodünaamika II printsiibi mõned formuleeringud:1) Ei ole võimalik selline protsess, mille ainus
lõpptulemus oleks soojuse üleminek
külmemalt kehalt soojemale.
Soojuse ülekandmine külmemalt kehalt soojemale on võimalik,
kuid sel juhul peab mingi masin
tegema tööd soojuse ära võtmiseks külmemalt kehalt, st
ümbritsevates kehades toimub muutus lõpptulemuseks on soojuse ülekandmine külmemalt kehalt
soojemale ja masina poolt ümbritsevas
keskkonnas teostatud muutus.
Selliselt toimivad näiteks külmkapp ja soojapump.
19. veebruar 2017. a.
158
159.
2) On võimatu selline protsess, mille ainuslõpptulemus oleks soojuse võtmine mingilt kehalt ja
selle täielik muundamine tööks.
Ideaalne gaas paisub soojendamisel ning teeb seejuures tööd kogu juurdeantav soojushulk võib
minna paisumisel tehtud tööks, kuid - gaasi ruumala on
suurenenud, st juurdeantava soojushulga
muutmine tööks ei ole protsessi ainus lõpptulemus.
Teisalt, kui soojusmasin töötab tsükli alusel, siis toimub
vahepeal soojushulga Q2 andmine külmemale kehale, st
kogu juurdeantav soojushulk ei muundu tööks.
Seega – iga masin saab teha tööd ainult väliskeskkonnalt
saadud soojushulga Q ja oma siseenergia ∆U
kahanemise arvel.
19. veebruar 2017. a.
159
160. Taoline masin – on sama võimatu kui selle kõrval olev sinine konstruktsioon - soojus ei saa iseeneslikult minna üle mehhaaniliseks tööks – masina töölepanekuks oleks vaja protsessist „välja võtta“ entroopia - soojushulga ja temperatuuri s
Taoline masin – on sama võimatu kui selle kõrval olev sininekonstruktsioon - soojus ei saa iseeneslikult minna üle mehhaaniliseks
tööks – masina töölepanekuks oleks vaja protsessist „välja võtta“ entroopia
- soojushulga ja temperatuuri suhe Q/T.
19. veebruar 2017. a.
160
161.
Kordame - Termodünaamika II seadus.Isoleeritud termodünaamlise süsteemi
entroopia muut mistahes protsessi korral on
suurem nullist:
ΔS ≥ 0
Entroopia muut protsessi käigus on võrdne
nulliga vaid pööratavate protsesside
korral. Iga süsteem,
mis läheb mittetasakaalulisest olekust üle
tasakaalulisse olekusse suurendab
entroopiat ehk korrastamatust.
19. veebruar 2017. a.
161
162.
Entroopia iseloomustab mingi antudprotsessi puhul energia üleminekut sellisse
vormi, millest ta ei saa enam iseeneslikult
tagasi pöörduda või minna üle uutesse
vormidesse ehk korrastamatus ei muutu
iseenesest korrastatuseks just nii nagu
mürast ei sünni iseeneslikult info.
19. veebruar 2017. a.
162
163.
Elektripliidil vee keemajamisel soojusekskonverteeritud elektrienergia võiks ilma
energia jäävuse seadust rikkumata minna
uuesti tagasi elektrienergiaks ning
käivitada arvuti.
Sellist energia konverteerumise võimatust
määratleb termodünaamika teine seadus
ja arusaam energia kvaliteedist, mida
kirjeldab entroopia mõiste ja mõisted
vabaenergiast ning seotud energiast - viimast
ei ole võimalik konverteerida kasulikuks
tööks.
19. veebruar 2017. a.
163
164.
Või kui ja veelkord Teie liikuva auto kineetiline energiakonverteerub pidurdamisel punase fooritule
eel soojuseks – soojenevad Teie auto pidurid
(kui Te muidugi pidurdate oma autot).
Kuid soojenenud piduriklotsid ei suuda Teie
autot pärast rohelise fooritule süttimist
uuesti liikuma panna.
Kuigi kui see ka nii juhtuks, ei oleks energia
jäävuse printsiipi rikutud. Rikutud oleks aga
termodünaamika teine printsiip.
19. veebruar 2017. a.
164
165.
Entroopia ja seotud energiamõisted on seega väga lähedased
∆S0 = Q0 : T0
Entroopiat tähistatakse S. Tema väärtus
oleneb absoluutsest temperatuurist: see osa
siseenergiast, mis pole suuteline muutuma
kasulikuks tööks ja antakse ära soojuse näol,
võrdub keha absoluutse temperatuuri ja
entroopia korrutisega TS.
19. veebruar 2017. a.
165
166.
Seda suurust TS nimetakse seotudenergiaks.
Seega
SEOTUD ENERGIA = TS
Eelnevast tuleneb – mida kõrgem on
temperatuur ja suurem on korrastamatus,
seda suurem on seotud energia osakaal
süsteemis.
Seega – loengu alguses näidatud aurumasinad – mida
kõrgem on silindrist väljuva jääkauru temperatuur ja
mida kaootilisem osakeste liikumine, seda madalam on
masina kasutegur.
19. veebruar 2017. a.
166
167.
Clausius formuleeris termodünaamika teise seadusejärgnevalt: igasuguse isoleeritud süsteemi
entroopia püüab saavutada maksimumi.
See tähendab, et protsess kulgeb iseeneslikult ainult
süsteemi sellise olekuni, mille puhul entroopia
saavutab antud tingimustes oma maksimaalse
võimaliku väärtuse.
Seetõttu on süsteemi püsiva tasakaalu oleku
eelduseks:
ΔS = max
19. veebruar 2017. a.
167
168. Spontaanne (iseeneslik) protsess – soojus hajub – osakeste parameetrid ühtlustuvad.
19. veebruar 2017. a.168
169.
Seega – protsess on spontaanne (iseeneslik),kui tal on kalduvus toimuda välise mõjuta –
spontaansed protsessid võivad olla nii kiired
(näit. plahvatus) kui ka aeglased (näit.
laevakere roostetamine).
JA
Entroopia on korrapärasuse mõõt; vastavalt
termodünaamika teisele seadusele kaasneb
isoleeritud süstemis iga spontaanse
protsessiga entroopia kasv ehk entroopia
on mittekahanev suurus.
19. veebruar 2017. a.
169
170.
Kristallid, ideaalselt korrastatud struktuurigatemperatuuri absoluutse nulli juures, on
entroopia väikseim. Taolise jahutatud
kristalli struktuur on kergesti rikutav –
temperatuuri tõusuga keha entroopia
suureneb – soojus kandub soojemalt kehalt
külmemale üle spontaalselt.
Näide infovallast – korrastatusest tähtede
järjestusest sünnib loengu konspekt. Selleks,
et nii juhtuks on vaja teha tööd.
19. veebruar 2017. a.
170
171.
Lähtudes eelnevast võib sõnastada ka lause:temperatuuri absoluutne null
saavutamiseks on vaja sooritada
lõpmatu arv jahutustsükleid.
Viimast lauset on vaadeldakse ka kui
termodünaamika kolmandat seadust.
19. veebruar 2017. a.
171
172.
Seotud energia – siseenergia väärtusetu osaväljendamisel soojusühikutes (kalorites-joulides
mooli kohta): Q ja siit
Q = T × ΔS
ja edasi entroopia muutus (vt. slide 122)
ΔS = Q : T
Kuna, mida kõrgem on temperatuur, seda suurem on osakeste
KORRASTAMATUS.
Entroopiat saab järelikult kasutada energia
seotuse (väärtusetuse) iseloomustamiseks
antud temperatuuril – entroopia mõõtühikuks on:
-1
J×(deg×mool)
19. veebruar 2017. a.
172
173.
Seega - siseenergiat U pole võimalik täielikultmuuta tööks.
Siseenergia koosneb kahest osast – vabast ja
seotud energiast.
Vabaenergia on see osa siseenergia varust,
mida saab muuta täielikult tööks
F = U – TS
Seega – mida suurem on TS, seda väiksem on
süsteemi vabaenergia osa – selle energia osa,
mis on süsteemist “kättesaadav”. Seega
veelkord – mida kõrgem on temperatuur ja mida
suurem on korrastamatus, seda vähem on
süsteemis vabaenergiat.
19. veebruar 2017. a.
173
174.
Praktikas ei määrata U ja S väärtusi otse, vaidnad on leitavad mitmesuguste protsesside
mõõtmise tulemusel ja seega saame:
Seotud energia – see osa mida ei saa muuta
tööks:
Δ(TS) = T × ΔS
ehk seotud energia osa süsteemis on seda
suurem, mida kõrgem on temperatuur ja
mida suurem on süsteemi korrastamatus.
19. veebruar 2017. a.
174
175.
Vabaenergiast lihtsalt.Vast kõige lihtsamal moel võib vabaenergiat
määratleda kui energiat “mis on kohe saadaval”.
Toon eelneva kohta näite: kui teil on täispuhutud
õhupall, siis on õhupallis olev gaas nõrgalt kokku
surutud, selleks on tehtud tööd – selles on mingi
hulk energiat. Kui pall katki torgata, vabaneb
energia - vabaneb kohe – see ongi vabaenergia.
Pallis olev energia “jagunes” palli lõhkemise hetkel
kaheks. “Kasutamata” jääb aga laiali paiskunud
gaasi siseneergia – osakeste mikroliikumised –
vabaenergia lennutas aga palli tükid laiali
vabaenergia tegi tööd.
19. veebruar 2017. a.
175
176.
Ja veel vabaenergiast – Te keerasite üles omamehhaanilise kella – vedrus salvestatud energia –
(vaba)energia vabaneb järk-järgult ning paneb liikuma
kella hammasrattad – vedrusse salvestatud energia
arvel tehakse tööd. Osa sellest aga muutub soojuseks
ja hajub – ning ei ole enam kasutatav töö tegemiseks,
näiteks kella uuesti üleskeeramiseks.
Ülesanne isemõtlemiseks – Te lahustasite
happes üleskeeratud vedruga kella – kuhu jäi
kella vedrusse talletatud energia? Ja milline
oleks ning kuidas muutus kella vedrusse
talletatud energia kvaliteet?
19. veebruar 2017. a.
176
177. Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides.
Eksotermilinereaktsioon
Kõrge aktivatsiooni
energia, väike
soojusefekt –
vabaenergia väheneb
Endotermiline reaktsioon
(vaja lisada vabaenergiat)
19. veebruar 2017. a.
Madal aktivatsioonienergia, suur soojusefekt –
reaktsioon kulgeb iseeneslikult – vabaenergia
väheneb
177
178.
Entroopia muutused on jälgitavad,kui panna soojuslikult isoleeritud anumasse kokku
erinevatel temperatuuridel kehad. Ajapikku
nende temperatuurid võrdsustuvad - süsteem läheb
üle tasakaaluolekusse.
Entroopia (süsteemi korrastamatus) on selle
protsessi käigus suurenenud.
Entroopia on protsesside pööratavuse mõõt, näitab
protsesside toimumise iseeneslikku suunda –
korrastamatusest ei sünni iseenesest
korrastatust – selleks et see toimuks, on vaja
teha tööd.
19. veebruar 2017. a.
178
179.
Seepärast on soojusenergia kõigemadalamat, kõige kehvemat liiki energia.
Mehhaaniline energia ja elektrienergia on
soojusenergiast universaalsemad, oma
kvaliteedilt kõrgemad.
Ja ka kallimad – elekter (kõrgeima kvaliteediga
energia) kallineb meil pidevalt!
Kahjuks ei odavne aga meie elus ka
madalaimat liiki energia - hind – selle energia
hind, mis on kasutusel meie tubade
kütmiseks!
19. veebruar 2017. a.
179
180.
ENTROOPIA (S) on energia kvaliteetiiseloomustav füüsikaline suurus: mida
suurem on entroopia, seda madalam on
energia kvaliteet. Definitsioonivalem:
ΔS = Q : T.
Entroopia SI-ühik on üks joule kelvini kohta,
[ΔS] = 1 (J : K).
Entroopia muut ΔS ei olene tingimustest,
millistel süsteem läheb algolekust
lõppolekusse; oleneb vaid alg- ja lõppolekut
iseloomustavatest suurustest.
19. veebruar 2017. a.
180
181. Süsteemi siseenergia.
Kui termodünaamiline süsteem ei võta osaenergiavahetusest ümbritseva keskkonnaga,
on tegemist isoleeritud süsteemiga –
praktikas neid ei eksisteeri, kuid arvutuste
tegemisel eeldatakse nende olemasolu.
Ligikaudu isoleerituks võib lugeda süsteeme,
kus protsessid toimuvad väga kiiresti
(plahvatused).
19. veebruar 2017. a.
181
182. Süsteemi siseenergia.
Termodünaamilisele süsteemile on omaneteatav kindel energiavaru.
Liikuval autol on teatav kineetilise energia varu
– ja peale selle tema kütusepaagis olevas
kütuses vastav hulk potentsiaalset keemilist
energiat.
Kogu süsteemi täielikku energiavaru
nimetatakse siseenergiaks ja tähistatakse:
U
19. veebruar 2017. a.
182
183.
Süsteemi siseenergia U koosnebsüsteemi moodustavate ainete
aatomisisesest energiast, osakeste
liikumisenergiate summast,
potentsiaalsest mehhaanilisest energiast,
potentsiaalsest keemilisest energiast jne.
Isoleeritud süsteemis toimuvad kõik
energeetilised protsessid nii, et teatavat ühte
liiki energia mingi koguse kadumisega mõne
füüsikalise või keemilise protsessi tulemusel,
kaasneb samas süsteemis, mingi teist liiki
energia ekvivalentse koguse tekkimine.
19. veebruar 2017. a.
183
184.
Kui antud süsteemis märkida “kadumaminevat”(hajuvat) energiat negatiivse suurusena ja
asemele tekkivat positiivse suurusena, siis
isoleeritud süsteemis on
energiamuutuste algebraline summa null
ΔU = 0
19. veebruar 2017. a.
184
185.
Süsteemi siseenergiast veel.SEEGA
Isoleeritud süsteemis toimunud füüsikaliste või
keemiliste protsesside puhul võrdub
süsteemi siseenergia muutus alati nulliga.
Isoleeritud süsteemis on kõikide energialiikide
summa püsiv suurus:
Σ E = U = const,
kuid erinevused tekivad on need energia
kvaliteedis.
19. veebruar 2017. a.
185
186. Maxwelli’i deemon (Nature 1874).
19. veebruar 2017. a.186
187.
Maxwelli deemon. See on piltlik kujundentroopia kasvu seaduse rikkumise kohta.
Kujutame, et meie kahekambrilise ruumi vaheseinas on uks,
mida avab ja sulgeb molekulaarsete mõõtmetega "deemon",
avades ukse, kui madalama temperatuuriga ruumist läheneb
kiire (või kõrgema temperatuuriga ruumist aeglane) molekul.
Eeldades, et ukse avamine ei nõua energiat, saame sel teel
tekitada ühes ruumipooles kõrgema temperatuuri teise ruumi
temperatuuri languse arvel - seega vähendada summaarset
entroopiat.
Ainus vajalik tingimus sellise "II liiki
perpetum mobile valmistamiseks on
"informatsiooni kasutav deemon".
19. veebruar 2017. a.
187
188.
Kuidas on lood tegelikult, on probleem koos omafilosoofilise-kvantloodusteadusliku taustaga. Kuid
ilmne on see, et informatsiooni saamine
kvantmehhaanika seaduspärasuste kohaselt
käituvate osakeste kohta, annab meile
informatsiooni vaid osakese ühe parameetri kohta,
kusjuures info saamise tulemusel, osakese teised
parameetrid muutuvad. Tehniliselt on ju tõesti nii,
et määramaks elektroni asukohta peab osakene
kohtuma teisega mille parameeter on määratletav.
Kohtumise ehk vastasmõju tulemusel muutuvad
aga jälgitava osakese teised parameetrid. Seega
vaatlus muudab osakese olekut (vt. 3. loeng –
“kahepilu katse”).
19. veebruar 2017. a.
188
189.
Matemaatikud on näiteks seisukohal, etentroopia kasvu seadus kehtib ka
informatsioonivoogude kohta.
Toon näite: teadmiste mahu plahvatuslik kasv viimase
viiekümne aasta vältel on viinud äärmiselt madalale
tõenäosuse, et üks indiviid (või grupp) suudaks
kontrollida saabuva info kvaliteeti. Ja raskusi selles
vallas näikse olevat isegi USA NSA-l.
Tuntud on ka II Maailmasõja ajal liitlaste dessandiga Prantsusmaale
maabumise ettevalmistamine, kus nn
D-day kohta oli liikvel nii palju erinevat informatsiooni, et selle tõelised
asjaolud jäidki sakslastele, vaatamata nende luure ja sakslaste
teenistuses olevate prantsuse kollaborantide laialdasele võrgustikule,
saladuseks.
19. veebruar 2017. a.
189
190.
"Deemon", kes veel sada aastat tagasi olivõimeline eristama tõde valest (infot mürast),
on nüüdseks oma mõju kaotanud ning
kaootiliselt liikuv (väär)informatsioon täidab
enamuse inimeste teadvuse.
Kokkuvõttes on ikka nii, nagu elektroni
käitumist muudab vaatleja olemasolu (vt. 2.
loengu video – elektronide käitumine
kahepilu katses vaatleja olemasolul ja selle
puudumisel), on ka siin vaatlejapoolse
protsessi mõjutava jõuga tegemist.
19. veebruar 2017. a.
190
191.
Eelneva jätkuks seoses entroopia küsimustegasobib hästi näide keemiliste sidemete
tekkimisest-lagunemisest.
Teatavasti on keemiline reaktsioon
keemiliste sidemete ümberkujunemise
protsess, millega kaasneb energia
neeldumine, või vabanemine soojusena,
kiirgus- või elektrienergia kujul.
Keemiliste reaktsioonide käigus kas neeldub
või vabaneb soojust- energiaefektidest on
tähtsaim soojusefekt.
19. veebruar 2017. a.
191
192.
Soojusefekt - soojushulk, mis püsivaltemperatuuril eraldub või neeldub ainete
mittepöörataval ja täielikul reageerimisel.
Soojuslike muutuste uurimisega tegeleb
termokeemia.
Termodünaamika on ka õpetus
mitmesuguste protsesside energeetilistest
efektidest.
19. veebruar 2017. a.
192
193.
Hessi seadus selle klassikalisel näitel.Soojusefekt, olles võrdne reaktsioonisaaduste
ja lähteainete entalpiate erinevusega, ei sõltu
reaktsiooni tegeliku toimumise viisist ega
selle vaheetappidest.
Analoogia füüsikalise tööga on siin täielik –
füüsikalises mõttes ei sõltu tehtud töö hulk
sellest millist teed mööda me mäe otsa
ronisime – ronimisel tehtud töö sõltub vaid
mäe kõrgusest.
19. veebruar 2017. a.
193
194.
19. veebruar 2017. a.194
195.
Näiteks soojusefekt reaktsioonis.C(grafiit) + O2(g) CO2(g) DH° =
-393.5 kJ
Kui me saame aga grafiidist enne süsinikoksiidi:
C(grafiit) + 1/2 O2(g) CO(g)
DH° = -110.5 kJ
ja põletame CO seejärel edasi süsinikdioksiidiks:
CO(g) + 1/2 O2(g) CO2(g) DH°= 283.0 kJ
on summaarne eralduv soojushulk ikka sama
-110.5 + (-283.0) = -393.5 kJ
19. veebruar 2017. a.
195
196.
Hessi seadus kokkuvõtvalt.Muutus süsteemi energias, mis kaasneb
süsteemi üleminekuga algolekust
lõppolekusse on määratud ainult alg- ja
lõppolekuga, ega sõltu üleminekuteest.
Isoleeritud süsteemi energia on konstantne
suurus.
vesi jää = vesi aur jää
19. veebruar 2017. a.
196
197.
Veel - näitena eelneva kohta:kui võtta
100 g vett temperatuuriga 25 kraadi,
kuumutada see keemiseni, aurustada, aurud
uuesti kondenseerida ning jahutada 60
kraadini, siis kogu siseenergia muutus on
täpselt sama suur, kui kuumutame vee kohe
60-ne kraadini.
19. veebruar 2017. a.
197
198. Siseenergia juurde tagasi.
Termodünaamika I seadus = energia jäävuseprintsiip- energia vabanemine või neeldumine
keemilise reaktsiooni käigus peab põhjustama
vastava muutuse reaktsioonisaaduste energiavarus,
võrreldes lähteainete summaarse energiavaruga.
Siseenergia- kehade sisemine energiavaru U;
Eksotermiline reaktsioon- soojus vabaneb U
vähenemise arvelt;
Endotermiline reaktsioon- soojus neeldub U kasvab.
19. veebruar 2017. a.
198
199.
qv=DU,kus qv – püsival ruumalal toimuva reaktsiooni soojusefekt;
DU- reaktsioonisaaduste ja lähteainete summaarsete
siseenergiate U2 ja U1 erinevus (U2-U1).
Siseenergia on süsteemis olevate
aineosakeste ja nende vastastikuse toime
summaarne energia. Siseenergia - süsteemi
koguenergiast eraldame süsteemi kui terviku
kineetilise ja potentsiaalse energia.
Süsteemi siseenergia absoluutväärtust mõõta ei
saa, on võimalik vaid määrata DU väärtusi
(tähendab on võimalik mõõta vaid muutust).
19. veebruar 2017. a.
199
200.
Protsessi koguenergia kannab nimetustentalpia.
DH= ΔG + TΔS
s.t. protsessi koguenergia ehk entalpia
muut koosneb vabast energiast (ΔG), mis
võib muutuda tööks ja seotud energiaks
(TΔS), mis on seda suurem, mida
kõrgemad-suuremad on T ja S, saab
eralduda ainult
soojusena.
NB! Entalpia mõõtühik on J (joule).
19. veebruar 2017. a.
200
201.
Keemilise reaktsiooni kulgemisel kas eraldubvõi neeldub soojust.
Konstantsel rõhul kulgeva reaktsiooni
soojusefekt võrdub süsteemi entalpia
muutusega (DH).
Reaktsioonid kulgevad entalpia
vähenemise (DH <0) ja entroopia kasvu
(ΔS >0) suunas (ehk energia kulub (hajub) ära ja kaob
algproduktide korrastatus).
19. veebruar 2017. a.
201
202.
Entalpia.Gaasireaktsioonidel esineb süsteemi ruumala
muutus, püsivaks loetakse välisrõhku P.
Vastavat isobaarset soojusefekti tähistatakse
qp .
Gaaside eraldumisega toimuvas reaktsioonis peab
süsteem kulutama osa oma energiast
paisumistööks. Püsiva välisrõhu ületamisega seotud
paisumistöö W:
W = PDV,
kus DV on reaktsiooni ruumalaefekt.
19. veebruar 2017. a.
202
203.
Termodünaamika I seaduse põhjal:qp – w =DU, siit
qp = DU + PDV = D(U+PV) = DH,
DH - olekufunktsioon entalpia muut.
Soojusefekt on võrdne süsteemi
entalpiamuuduga.
DH = DU+ DnRT,
Dn - gaaside moolide arvu muut keemilises
reaktsioonis.
19. veebruar 2017. a.
203
204.
Vabaenergia mõiste praktilisemakskasutamiseks võeti kasutusele uus
olekufunktsioon mis kirjeldaks seda kui
palju mittepaisumistööd on süsteem
võimeline tegema – põhiline kaalutlus toidu ja
kütuste uurimisel, elektriliste ning
mehhaanilise töö arvutamisel,
korrodeerumise ennustamisel jne.
Olekufunktsioon kannab nimetust Gibbs’i
energia (nimetatud selle uurija J.W.Gibbs’i
järgi 1839…1903).
19. veebruar 2017. a.
204
205.
Mittepaisumistöö hõlmab ka lihaste töö janärvisignaalide edasikandumist ning on
seega bioenergeetika ja rakkudes toimuva
aluseks.
Seega Gibbs`i energia muutus on
süsteemi ja tema väliskeskkonna
summaarne energiamuut konstantsel rõhul
ja temperatuuril. Konstantsel temperatuuril
ja rõhul toimuva iseenesliku protsessi
Gibbs`i energia väheneb.
19. veebruar 2017. a.
205
206. NB! Vabaenergia (Gibbsi energia) on miinimumis, siis kui entroopia on maksimumis ehk korrastamatus on nii suur, et enam “segasemaks” süsteem ei saa minna.
19. veebruar 2017. a.206
207. Gaasi paisumisel kasvab entroopia logaritmiliselt.
19. veebruar 2017. a.207
208. Entalpia.
Reaktsiooni energia ja reaktsiooni entalpia vahel onjärgmine seos:
DH = DU + pDV
Näide:
Zn + H2SO4 ZnSO4 + H2
DU = -145,5kJ×mol-1
DH = -143,2kJ×mol-1
pDV = 2,3kJ×mol-1
Kuna vedelike ja tahkete ainete mooliruumalad on palju
väiksemad gaasi mooliruumalast, siis oleneb DV väärtus
peamiselt gaaside tekkimisest ja kadumisest reaktsiooni
vältel.
19. veebruar 2017. a.
208
209. Hessi seaduse juurde.
19. veebruar 2017. a.209
210. Endotermia – eksotermia.
19. veebruar 2017. a.210
211.
Selgitusi.Omavahel reageerivad ained on praktiliselt alati molekulidena.
Nende omavahelisel reageerimisel, reaktsiooni esimesel etapil
lõhutakse lähteainete molekulides keemilised sidemed,
teises etapis moodustuvad uued sidemed. Juhul kui
lähteainete molekulide keemiliste sidemete lõhkumiseks
kulub vähem energiat kui eraldub uute sidemete
moodustumisel on tegemist eksotermilise reaktsiooniga
(metaan põleb ja eraldub soojus).
Endotermilise reaktsiooni puhul aga kulub lähteainetes olevate
keemiliste sidemete lõhkumiseks rohkem energiat kui
eraldub uute moodustumisel (välgu toimel
lämmastikoksiidide moodustumisel atmosfääris).
19. veebruar 2017. a.
211
212. Termodünaamika esimese seaduse juurde, kolvi tõstmiseks tehakse tööd, süsteemi siseenergia väheneb selle võrra A = FΔS – see on osa võrreldav kogu reaktsiooni entalpiaga.
19. veebruar 2017. a.212
213.
2 H2 + O2 2 H2O + DH (DH = -584 KJ vedelfaas)Entalpia muutus protsessis (DH) võrdub
protsessis (reaktsioonis) neelduva või eralduva
soojushulgaga.
Kui protsessis eraldub energiat nimetatakse seda
eksotermiliseks protsessiks (DH < 0).
Kui energiat tuleb süsteemi juurde anda on tegemist
endotermilise protsessiga (DH > 0).
1 mooli jää sulamisel
H2O(s) H2O(l)
DH = +6.01 kJ
süsteemi entalpia kasvab.
19. veebruar 2017. a.
213
214.
1 mooli metaani põlemiselCH4(g) + 2O2(g) CO2(g)+ 2H2O(g)
DH = - 890.4 kJ, järelikult:
süsteemi entalpia väheneb (miinusmärk).
Entalpia muut mingis protsessis võrdub
saaduste ja lähteainete entalpiate vahega:
DH = SH(saadused) - SH(lähteained)
19. veebruar 2017. a.
214
215. Reaktsiooni standardne entalpia.
Soojusefekt (DH°) on entalpia muutreaktsiooni läbiviimisel standardtingimustel.
DH° leidmiseks tuleb lahutada reaktsioonisaaduste
standardsete tekkeentalpiate summast lähteainete
standardsete tekkeentalpiate summa.
DH° = Sni DHf°298 (produktid) - Sni DHf°298
(lähteained)
Üldkujul reaktsioonile
aA + bB cC + dD
DH°= [c×DHf°298(C) + d×DHf°298(D)] - [a×DHf°298(A) +
b×DHf°298 (B)]
19. veebruar 2017. a.
215
216. Näide:
4FeS2(s) + 11O2(g) = 2Fe2O3(s) +8SO2(g)reaktsiooni soojusefekt DH0 on:
(ekso, DH < 0)
19. veebruar 2017. a.
216
217.
Soojenemiskõver.Sulamis- ja aurustumisentalpiad (aurustumise koguenergia)
mõjutavad soojenemiskõverate kuju. Soojenemiskõver on
graafik, mis näitab objekti temperatuurimuutust, kui objekti
soojendatakse konstantsel rõhul konstantse kiirusega, st.
protsessi koguenergia (entalpia).
Järgneval slidel on toodud külma jää soojenemine – esialgu
tõused jää temperatuur ühtlase kiirusega – vee molekulid on
suletud tahkisesse ja vibreerivad temperatuuri tõustes üha
kiiremini kuni vibreerimine muutub piisavalt tugevaks, et
üksteisest eraldada. Temperatuuri tõstes kasutatakse kogu
lisatav energia molekulidevaheliste tõmbejõudude
ületamiseks.
19. veebruar 2017. a.
217
218.
Alles pärast jää sulamist hakkab temperatuurtaas tõusma ning see jätkub kuni
keemistemperatuurini. Keemistemperatuuril
tekib soojenemiskõveral taas platoo. Sel
temperatuuril on molekulide energia piisav, et
vedelast faasist aurufaasi lahkuda – kogu lisatav
energia kasutataksegi auru moodustamiseks ja
seda pole võimalik kasutada keha temperatuuri
tõstmiseks. Kui kogu aine on läinud üle aurufaasi,
jätkub temperatuuritõus jälle ühtlases tempos –
nüüd algab moodustunud auru temperatuuri tõus.
19. veebruar 2017. a.
218
219.
Vedeliku soojenemiskõvera tõus on sedajärsem, mida madalam on vedeliku
soojusmahtuvus. Vee soojenemiskõveral on
jääle ja aurule vastavad kõveraosad järsema
tõusuga kui vedela vee kõveraosa tõus ning
seetõttu teame, et vedela vee soojusmahtuvus
on suurem kui jääl ja aurul.
Vedela vee suur soojusmahtuvus on tingitud seal
säilinud vesiniksidemete võrgust. Molekulid on
seotud vesiniksidemetega ning nende sidemete
võnkumine ja sidemete lõhkumine tarvitab
rohkem energiat kui aatomitevaheliste jäikade
sidemete võnkumine.
19. veebruar 2017. a.
219
220.
f02-09-P08853019. veebruar 2017. a.
220
221.
Tekkesoojus- on 1 mooli ühendi tekkimisel lihtainetest
vabanev või neelduv soojushulk.
Arvutamisel kasutatakse standardseid
tekkeentalpiaid DHf°298 (tabelitest).
Standardtingimustes püsivate lihtainete (grafiit,
rombiline S, vedel broom jt.) tekkeentalpiad
võrduvad 0.
19. veebruar 2017. a.
221
222.
Aine põlemissoojuseks nimetatakse1 mooli aine täielikul põlemisel vabanevat
soojushulka.
Täieliku põlemise produktideks on
mittepõlevad ained - CO2, H2O, N2 ja SO2.
19. veebruar 2017. a.
222
223.
Lisamaterjali loengule jamaterjali loengus
räägitu kordamiseks.
19. veebruar 2017. a.
223
224.
Termodünaamika seadustele vastavalt toimub meieMaailmas kõik, mis siin Maailmas üldse toimub ning
seega mitte ainult see, mida me peame
loodusteadusteaduste valdkonda kuuluvaks. Või
õigemini arvame sinna mitte kuuluvaks. Kordan
veelkord – loodusseadused ja loomulikult ka
termodünaamika seaduspärasused kehtivad ka
ühiskonna kohta, ka meie igapäevase elu kohta. Selles
vallas on aga kujunenud kombeks esitada väiteid, mis
mitte kuidagi ei sobitu kokku nn. tõenduspõhise
maailmapildiga (teadusliku maailmapildiga). Kuna,
aga ühiskonna ja kultuurivaldkonna ning ka majandus
ja riigikorraldus toimimine on pika reageerimisajaga,
19. veebruar 2017. a.
224
225.
siis ühe või kahe valimisperioodi vältel jääb tõepoolestnn. moodsatele demokraatlikele valitsejatele (s.t.
harimatute poolt võimule hääletatud-manipiuleeritud
kamp intrigaane) mulje, et ühiskonna toimine on
valdkond, kus looduseadused ei kehti ning milles
toimuvad muutused on prognoosimatud ning sellest
tulenevalt poliitikutele on lubatud harimatus ja „julge
pealehakkamine“.
Olen kindel, et kõik on kuulnud praegu sageli korratavat väidet,
et mitmekesisus rikastavat, pidades selle all sagedasti silmas
nihkunud seksuaalsuhteid ja muidki inimeste eluvõimetuid
veidrusi (mis muidugi on inimkonna minevikus alati mingil moel
olemas olnud ning pole seega mingiks kaasaegseks
„avastuseks“).
19. veebruar 2017. a.
225
226.
„Rikastamise“ osas on aga enamasti selgitamatajäetud, et mis-kes ja mida ning millega rikastab.
Võimalik, et homoseksuaalsus ehk ühetaolisus
seksuaalsuhetes (mis muidugi bioloogilises mõttes ei
ole seksuaalsuhted) on asjaosalistele huvitav, aga
inimpopulatsiooni ta kuidagi rikastada ei saa.
Keerukam, seega ka informatiivsem ehk madalama
entroopiaga, on kindlasti liit, mis põhineb
heteroseksuaalsel (madalama entroopitasemega)
ühendusel. Loengus rõhutasin seda, et igasuguse
muutuse aluseks on potentsiaalide vahe ehk suhte
eelduseks on erinevus. Elementide puhul on ju ka keemilise
sideme tekkimise eelduseks enamasti elektronegatiivsuse
erinevused või siis osapoolte erinevused nende laengutes või
laengute jaotumises jaotumises.
19. veebruar 2017. a.
226
227.
Olukorda, kus Maailmast on kadunud potentsiaalidevahe kannab nimetust soojussurm (vaata käesolev
loeng). Soojussurm nagu iga surm on igavene, sest
midagi enam ei toimu – kõik mis kunagi oli, on juba
toimunud, energia (mis on täpselt sama hävinematu
kui mateeria) on degradeerunud, omandanud oma
madalaima kvaliteedi. Seetõttu ei ole soojussurma
saabumisel ka enam midagi omavahel segadavahetada-mõjutada. Praegu toimuv intensiivne pagulasvool
Euroopasse ei ole ju ka midagi muud kui erinevuste (mis oma
mõõdukal olemasolul tõesti rikastab) tasandamine, ehk
rahvuskultuuride surma genereerimine analoogiliselt
soojussurmaga – olukorra tekitamist, kus enam midagi
vahetada (no näiteks nn. kultuuri) ei ole.
19. veebruar 2017. a.
227
228.
Ja veel samal teemal, aga imeravimite kaudu –teatavasti on viimasel ajal uuesti käibele tulnud
paksukeste tarvis kaalulangetajana aine
nimelühendiga DNP, ehk dinitrofenool, juba mitmeid
aastakümneid biokeemias tuntud preparaat mida
biokeemia vallas liigitatakse LAHUTAJATE hulka.
Ehk tegemist on ainega, mis muudab meie, õigemini
kõikide elusorganismide, rakumembraanid laengutele
selliselt läbitavaks, et kaoks membraanide
prootonpotentsiaal (sellest täpsemalt 13. Loengus)
ehk eeldus elus olemiseks. Seega lahutatakse DNP
mõjul nn. toiduainete katabolism potentsiaalide
loomisest, selle loomisest, mis on elusorganismide
igasuguse elutegevuse…
19. veebruar 2017. a.
228
229.
…eelduseks, nähtuseks, mille kaudu organismidväärindavad energiat, muudavad selle kasutatavaks –
moodustub nüüd juba Teile tuntud vabaeenergia –
moodustuvad hästikorrastatud süsteemid, mis tagavad
elu enese eksistentsi. Lahutajate kasutamisel eraldub
aga vabanev energia soojusena – kõige kehvema
kvaliteediga energiana, inimeste puhul tõusebki DNP
manustamisel kehatemperatuur ja kui doos on piisav,
siis järgneb protsessi loogilise jätkuna surm. Surm
järgneb seetõttu, et rakumembraanide spetsiifilise
läbilaskvuse kadumisel pole organismis enam piisavalt
kvaliteetset energiat salvestatuna elektrilise
potentsiaalide vahena membraanidel (moodustub
ainult madalakvaliteetne soojusenergia)…
19. veebruar 2017. a.
229
230.
…ehk organismi korrastamatus ei ole enam kokkusobiveluks vajaliku korrastatusega ehk organismis pole
enam elutegevuse tagamiseks kasutatavat energiat ja
struktuuri, mis selle saaks tagada. Seega toimivad
lahutajad organismile sarnaselt olukorrale, kus
Euroopal puuduvad riigipiirid ning kõik tulnukad on siia
oodatud, ehk Euroopa kultuur koos oma „väärtustega“
kaob olematusse – just seetõttu, et membraanid (pro
piirivalve) eri kultuuride vahel on lakanud toimimast.
Ja veel - teatavasti toimivad kütuseelemendid täpselt samal
põhimõttel nagu elusorganismidki – nende tööks on vajalik
membraan, mis laseb läbi prootoneid ja ei lase läbi elektrone,
just nii nagu rakumembraanidki – selektiivse läbilaskvuse
kadumisel lõpetab element töö (küttelementidest lähemalt
13. Loeng).
19. veebruar 2017. a.
230
231.
Ja veel – organismide kohastumine tagab mitte ainult nendeellujäämise, vaid tagab paremini kohastatuile suurema
arvukuse. Selle taustal seisab valik ja selle taustal omakorda
väga karm liigisisene konkurents (täpselt nii nagu
majanduseski).
Konkurents, mis on paljudele isenditele hävitav, kuid liigi jaoks
möödapääsematult vajalik. Enamasti on konkurentsi
mehhanismiks suguline valik – erineva „konstruktsiooniga“
(mehed-naised kui soovite) sama liigi isendid, erinevate
„ülesannetega“ oma eluteel peavad kohtuma ja moodustama
keeruka elu võrgustiku ehk struktuuri.
19. veebruar 2017. a.
231
232.
Iga hälve, iga lihtsustus, mis tekitab sellessegadust, süsteemi entroopia suurenemist on
tulevikuta. Nii on juba aastamiljardeid elu
(inimkond vastavalt aastatuhandeid) omal teel,
ajuti komistades ja kukkudes, jõudnud
tänasesse päeva ning tema edasikestmise
eelduseks saab olla ainult entroopia „tõrjumine“
endast, süsteemist kus me elame, seni kuni
meil jätkub selleks ressursi, et säilitada
erinevusi, aga ikka määral, mis jätaks nii
mõnedki meid alles ning teeks meist kellegile
esivanemad.
19. veebruar 2017. a.
232
233.
Ja nii vast ongi loodusseaduseks see, et kõik, misinimesed siin ilmas on teinud ja ühiskonda
kujundanud, olgu see siis hea või halb, on seda tehtud
ikka naiste pärast, sest naised on iga populatsiooni
kullafond ja stabiilsuse tagajad.
Ning veel – inimpopulatsioonis (ja ka
loomapopulatsioonides) on alati meeste varieeruvus
suurem kui naistel – kui mees on loll, siis on hästi loll,
aga kui tark, ka siis on sageli ka hästi tark. Meie, meeste peal
evolutsioon eksperimenteeribki. Aga kullaga ei riskita, seda
hoitakse näguripäevadeks. Ärgem siis saatkem naisi sinna kuhu
peavad minema mehed. Siis ehitavad naised-mehed koos
üles selle mille aeg (mehed naiste pärast?) lõhkunud on.
19. veebruar 2017. a.
233
234. Kokkuvõtteks. Entroopia ja termodünaamika 2 seadus.
Iseenesliku protsessi toimumise tulemus looduseson protsessi tasakaaluolek. Protsesside suuna ja
tasakaaluolekud määrab termodünaamika 2
seadus:
kõik protsessid looduses toimuvad iseeneslikult
ainult ühes suunas, soojus läheb iseenesest
ainult kõrgema temperatuuriga kehalt
madalama temperatuuriga kehale ehk
ΔS max
19. veebruar 2017. a.
234
235.
ENTROOPIA (S) on energia kvaliteetiiseloomustav füüsikaline suurus: mida
suurem on entroopia, seda madalam on
energia kvaliteet. Definitsioonivalem:
ΔS = Q : T.
Entroopia SI-ühik on üks joule kelvini kohta,
[ΔS] = 1 (J : K).
Entroopia muut ΔS ei olene tingimustest,
millistel süsteem läheb algolekust
lõppolekusse; oleneb vaid alg- ja lõppolekut
iseloomustavatest suurustest.
19. veebruar 2017. a.
235
236.
Entroopia muut võimaldab otsustada, kas protsesson pöörduv või pöördumatu. Kui protsess on
pöörduv, siis entroopia on jääv, ΔS = 0. Kui
protsess on pöördumatu, siis entroopia kasvab,
ΔS > 0, ja energia kvaliteet väheneb. See
tähendab, et kõrgema kvaliteediga (meile
kasutamiseks sobiv) energia muundub
vähemkvaliteetseks (meile mittevajalikuks)
energiaks.
Protsessid, milles entroopia väheneb ΔS > 0 on
võimalikud ainult täiendava energia lisamisel
süsteemi – elu on süsteem, mis vähendab iseenda
entroopiat Päikese energia arvel.
19. veebruar 2017. a.
236
237.
Avatud süsteemides võib energia väheneda, kuid seesaab toimuda vaid keskkonna entroopia kasvu
arvel. Summaarne entroopia muut ei saa olla
kunagi negatiivne – kehtib entroopia kasvu seadus.
Entroopia on ka süsteemi korrastamatuse mõõt:
mida suurem on entroopia, seda suurem on
süsteemi korrastamatus ehk kaos. Süsteemi
entroopia võrdub Boltzmanni konstandi ja oleku
tõenäosuse naturaallogaritmi korrutisega,
S = k×lnW.
19. veebruar 2017. a.
237
238. Negentroopia allikas Maakera jaoks on Päike. Kasutegur = (6000 – 300) : 6000 = 0,95(!)
19. veebruar 2017. a.238
239.
Looduses põhiliselt endotermiliselt toimuvreaktsioonide võrgustik – fotosüntees –
on allikaks energiarikastele ühenditele –
puit, kivisüsi, nafta jt. – ja selle
reaktsiooni “jääkproduktile” – vabale
hapnikule.
Puidu põlemine ja meie elutegevus – on
võimalik vaid endotermiliselt tekkinud
ühendite ebastabiilsuse tõttu.
19. veebruar 2017. a.
239
240.
Külmkapi korral on jahutajakskülmkapis olev õhk, esemed kapis; ning soojendajaks
väliskeskkond. Töötavaks kehaks on mootor
koos gaasisüsteemiga. Gaasiga tehakse tööd (näiteks Joule'iThomsoni efekti kasutades), mille
tulemusena võetakse tsükliliselt külmkapi sisemusest energiat
Q2 ning soojendajale antakse
soojushulk Q1=A+Q2 .
Samamoodi - soojapumba korral võetakse sooja kas välisõhust
või Maa
sisemusest, temperatuuriga T2, ning antakse edasi toaõhule,
temperatuuriga T1, kusjuures T 1>T 2 .
Külmkapi korral arvestatakse külmkapi efektiivsust - mitu
korda ületab külmkapilt ara võetav
soojushulk äravõtmiseks vajaliku töö.
19. veebruar 2017. a.
240
241. Näiteid entroopia asjus.
Kristallisatsioon – jahutatava vedeliku võiamorfse aine kristalliseerimise protsessis
entroopia väheneb, sest molekulide liikumine
muutub korrapärasemaks. Absoluutse nulli
lähedastel temperatuuridel on osakeste
ruumiline paigutus ideaalses kristallis täiesti
korrapärane. Sellise keha entroopia võrdub
nulliga.
Plancki postulaat: kui T =00K, siis S = 0
19. veebruar 2017. a.
241
242. Termodünaamika II seadusest
EHKSoojus ei saa iseenesest üle minna külmemamalt
kehalt kuumemale, ükskõik missugused
vahepealsed protsessid või energia
muundumised seejuures toimuksid
EHK
energia kandub alati kõrgema potentsiaaliga
süsteemilt üle madalama potentsiaaliga
süsteemile, kusjuures see ülekandumine kestab
seni, kuni saabub termodünaamiline tasakaal.
19. veebruar 2017. a.
242
243.
Entroopia ja vabaenergia.4 Fe(s) + 3 O2(g) 2 Fe2O3(s)
DH = -1648.4 kJ (eksotermiline)
S°(Fe) = 27.3 J/K×mol
S°(O2) = 205.0 J/K×mol
S°(Fe2O3) = 87.4 J/mol×K
ja entroopia muut kogu reaktsioonis:
DS° = 2×87.4 - [4×27.3 + 3×205.0] = -549.4 J/K < 0
Süsteemi (antud reaktsiooni) entroopia seega kahaneb
(DS < 0), üldine (summaarne)
entroopia aga vastavalt termodünaamika II seadusele ilmselt
kasvab (eksotermiline
protsess - soojus hajub ümbritsevasse keskkonda).
19. veebruar 2017. a.
243
244.
Metallide tootmisel maagist materjal korrastub,luuakse potentsiaalide vahe – saadakse
puhas metall (raud). Rauas on vabaenergia
(Gibbsi energia) hulk suurem kui
rauamaagis –eeldus raua
korrodeerumiseks.
Looduses rauas olev vabaenergia vabaneb – raud
oksüdeerub (roostetab = korrodeerub), raua vabaenergia
hajub soojusena ning hästikorrastatud raua asemel jääb
alles väiksema korrastusastmega rooste.
Ning looduses leidubki raud vaid maagina (roostena), kust
seda tuleb välja sulatada, suurendades produkti
vabaenergiat (ja nii luues eelduse raua roostetamiseks).
19. veebruar 2017. a.
244
245.
J.W.Gibbs (1839-1903) - ameerika füüsik-teoreetik,peam. tööd keemil. termodünaamika ja statistil. mehaanika
alalt, üks vektorarvutuse loojaid.
Keemiliste protsesside termodünaamilise tasakaalu
väljendamine Gibbsi energia kaudu.
Püsival rõhul ja temperatuuril sõltub G väärtus ainult
süsteemi koostisest (keemil. reaktsiooni toimumisest).
Keemilise reaktsiooni käigus G väheneb, Gmin
(tasakaaluolek):
G = Gminvõi G = 0
Püsivat tasakaalu iseloomustab Gibbsi energia
miinimum.
19. veebruar 2017. a.
245
246.
Keemilise reaktsiooni suuna jatasakaaluoleku kriteeriumid
Gibbsi energia (vabaenergiat) - entalpiat ja
entroopiat ühendav termodünaamiline
funktsioon (G)
G = H - TS
on Gibbsi energia definitsioonavaldis
kus G - Gibbsi energia
H - entalpia
S - entroopia
19. veebruar 2017. a.
246
247.
Gibbsi energia muut DGavaldub reaktsioonientalpia DH ja reaktsioonientroopia
DS kaudu :
DG = DH - TDS
Gibbsi energia abil on mugav väljendada
keemiliste protsesside
tasakaalu (selles on tema kasutamise mõte)
DG saab arvutada
- DH ja DS kaudu
- reaktsioonis osalevate ainete tekkereaktsioonide
DG väärtuste
kaudu (algebraline liitmine nagu tekke-entalpiate puhul)
19. veebruar 2017. a.
247
248.
Iseeneslikud protsessid suletud süsteemis lõpevad alatitasakaaluolekuga.
Püsiva P ja T korral võivad seega iseeneslikult toimuda
vaid need keemil. reaktsioonid, mille puhul G väheneb:
DG < 0
alusel iseloomustab G vähenemine ainete
reaktsioonivõimet, G konstantsus - süsteemi
tasakaaluolekut (kui P ja T on püsivad) ja reaktsioon
saab toimuda ainult eksotermilises (DH < 0) suunas
(soojus eraldub).
19. veebruar 2017. a.
248
249.
G muutumine keemilise reaktsiooni käigus.G ja aine koostise muutused süsteemis reaktsiooni toimumisel (A)
lähteainete poolest rikkas või (B) saaduste poolest rikkas segus.
Tasakaaluasend (C) on mõlemal juhul kokkulangev: süsteem ei suuda
omaenese jõududega tasakaalust väljuda.
Keemilise reaktsiooni teostatavus.
Kõik iseeneslikud füüsikal. ja keemil. protsessid toimuvad Gibbsi
energia
DG = DH - TDS
vähenemise suunas.
Entalpia ja entroopia võivad protsessi jooksul kas väheneda või
suureneda, kuid Gibbsi energia (vabaenergia) väheneb alati.
19. veebruar 2017. a.
249
250.
Iseeneslike protsesside puhul on alati DG <0.Järelikult soodustab neid protsesse entalpia vähenemine
(DH < 0) ja entroopia suurenemine (DS > 0)
Reaktsioonid, kus DG < 0, on võimalikud (liiguvad suunas:
lähteained (reagendid) produktid.
Kuid see tingimus ei osuta reaktsioonide toimumise
kiirusele (seda külge käsitleb keemiline kineetika).
Toodud avaldiste alusel on termodünaamiliselt alati
võimalikud eksotermilised reaktsioonid (DH < 0), millede
puhul tekivad gaasid (DS > 0).
19. veebruar 2017. a.
250
251.
Endotermilised reaktsioonid (DH > 0) saavadtoimuda ainult entroopiafaktori mõjul, kui
TDS >> 0.
See tingimus osutab, et
- temperatuur peab olema suhteliselt
kõrge
- gaase peab eralduma rohkem, kui neid
reaktsiooni astub.
19. veebruar 2017. a.
251
252.
Gaaside neeldumisega negatiivse ruumalaefektigareaktsioonid (DS < 0) on entalpiafaktori mõju
tõttu (kui DH << 0) võimalikud ainult madalatel
temperatuuridel.
Kui gaasiliste ainete hulgad reaktsiooni käigus (ei
muutu osakeste arv) ei muutu (Dn = 0) või kui
reaktsioonis osalevad ainult vedelad ja tahked
ained, siis DS 0
19. veebruar 2017. a.
252
253.
Aine tekke standartne Gibbsi energia (ΔGf0)– standard Gibbs free energy of formation.
Gibbsi energia muutus ühe mooli aine
moodustumisel elementidest nende
stabiilsetest lihtainetest rõhul 1 bar.
19. veebruar 2017. a.
253
254.
Vabaenergia ja seotud energia.Eelnevast tuleneb omakorda, et süsteemi
siseenergiat U pole võimalik täielikult tööks muuta.
Järelikult
võib siseenergiat vaadelda koosnevana kahest osast
– vabast ja seotud energiast
U = Energiavaba + Energiaseotud
Ainult vabaenergia moodustab selle osa siseenergia
varust, mida saab täielikult muuta tööks – selle
kasutamine on tehniliselt teostatav.
19. veebruar 2017. a.
254
255. Entroopia.
Iga energiavorm (mehhaaniline, elektriline, keemiline jt.) võibtäielikult üle minna soojusenergiaks.
Vastassuunaline muundumine ei saa kunagi olla täielik – osa
soojusenergiast hajub ja ei ole konverteeritav tööks –
madalakvaliteediline energia on väärtusetu
See tähendab,
et toimub energia osaline degradatsioon (kvaliteedi
alanemine). Lähtudes selle kasutatavuse seisukohalt on
kütmine elektriga mitte eriti arukas tegevus (kontsentreeritud energia) elektrienergia degradeeritakse
soojuseks (Gibbsi energia vabaneb), mis hajub ja entroopia
maksimaliseerub.
Seega kütmine elektrienergiaga tulemuseks saame soojuse,
kuid suurendame entroopiat.
19. veebruar 2017. a.
255
256.
Tavatingimustes on molekulide kineetiline energia2,5 kJ/mol ja aeg kahe omavahelise põrke vahel
10-9…10-12 s.
Molekulide energia jaotub sarnaselt Gaussi kõveraga
(tegelikult log-normaalse kõveraga, mille
erijuhuks on Gaussi kõver) ning põrkumisel
reageerivad eelkõige suurema energiaga molekulid
– suurima keemiline aktiivsusega molekulid (näit.
valentselektronid asuvad kõrgematel orbitaalidel).
19. veebruar 2017. a.
256
257. Energia ja töö ühikute vahekordi 1J = 1N×m = 1 kg×m2/s2.
Jerg
cal
Wh
10-7
1
2,39×10-8 2,78×10-11
1
107
0,239
2,78×10-4
1
1,16×10-3
861
1
4,184
4,184×107
3,6×103
3,6×1010
19. veebruar 2017. a.
257














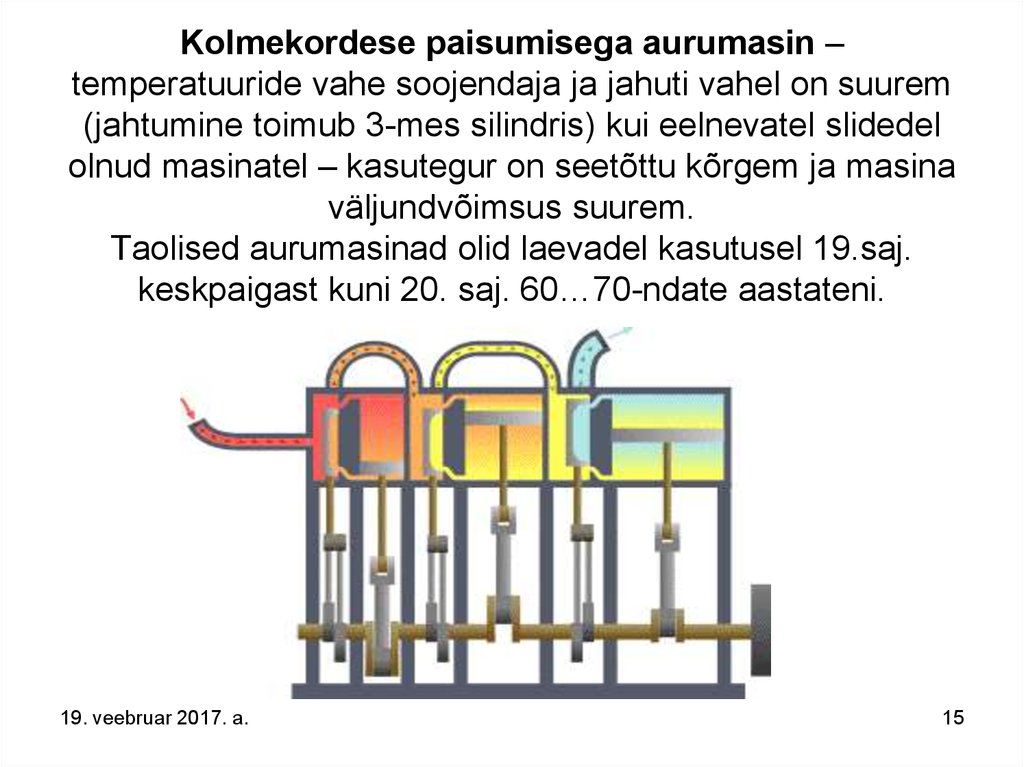









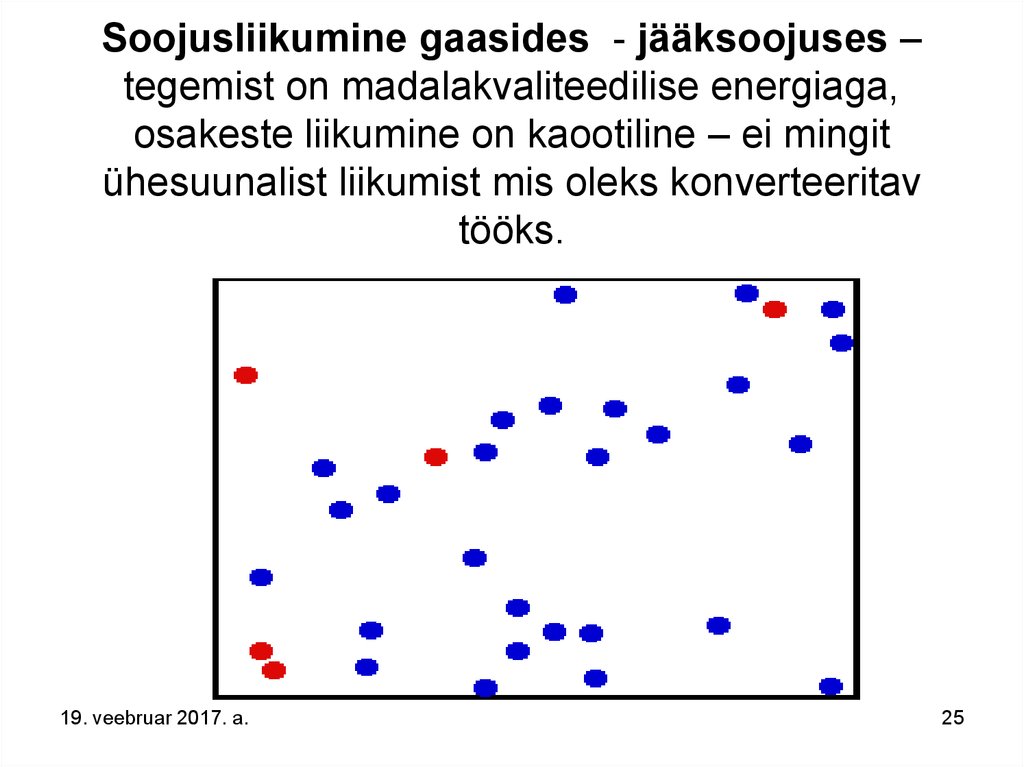
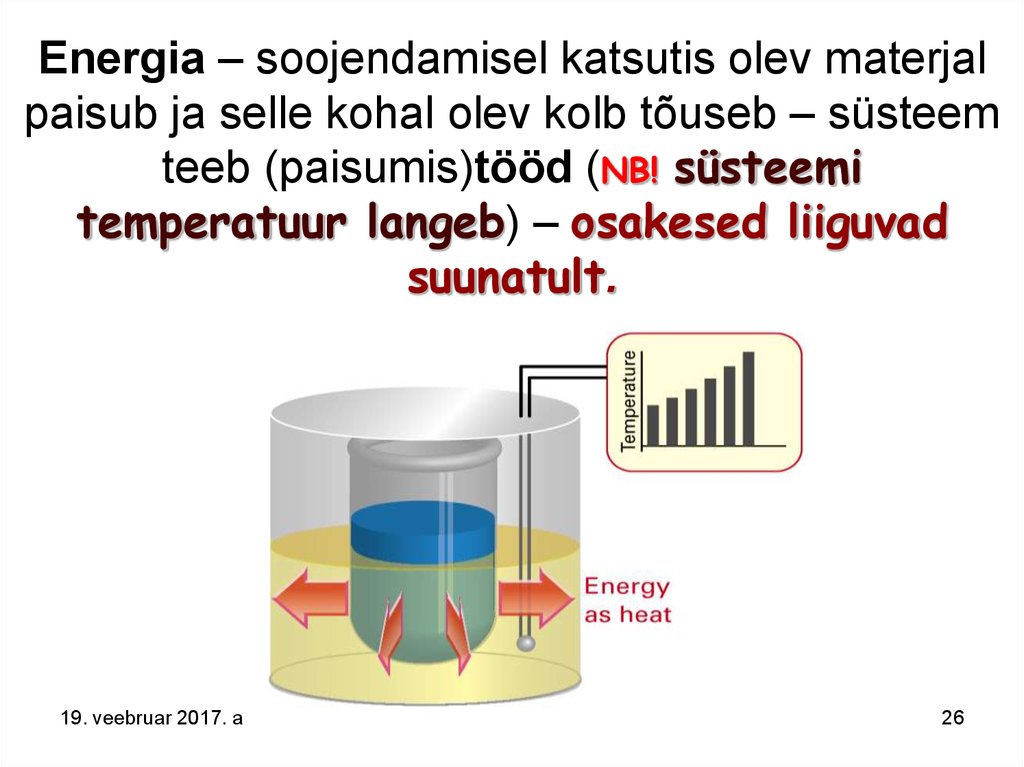





































































































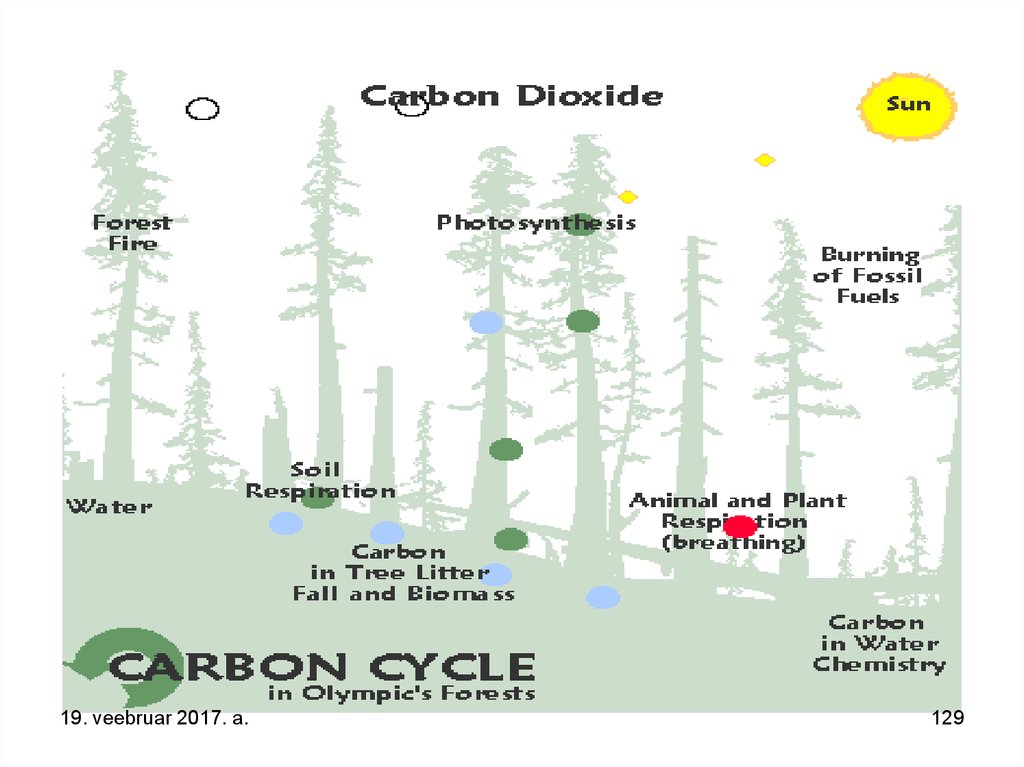






























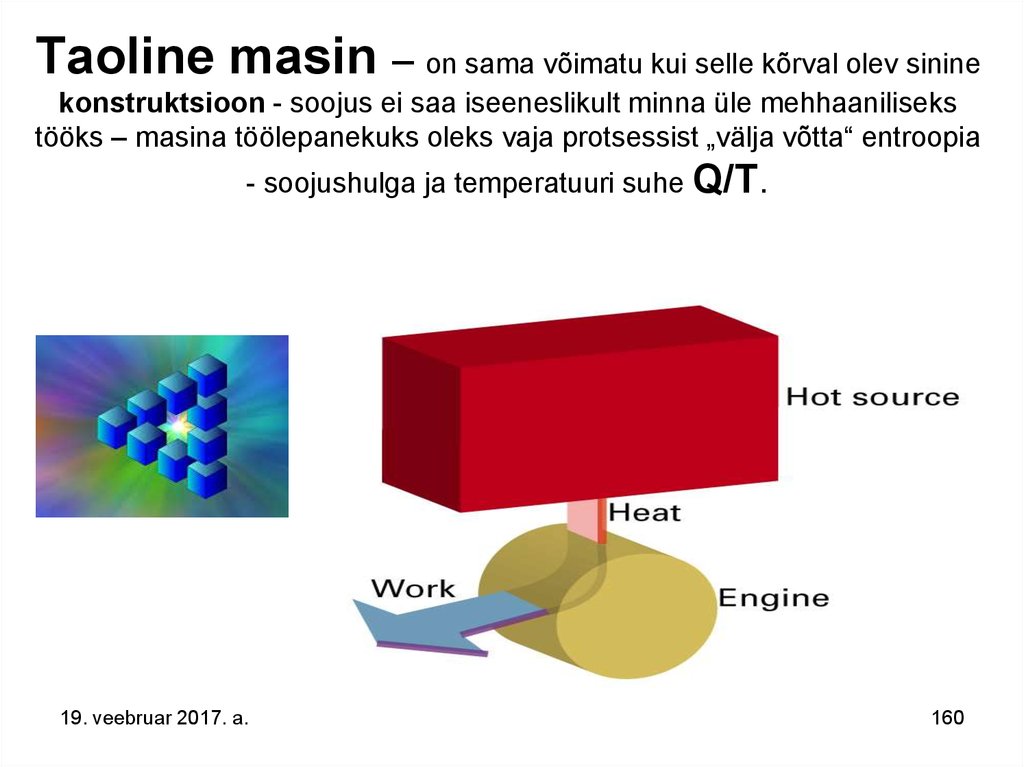













































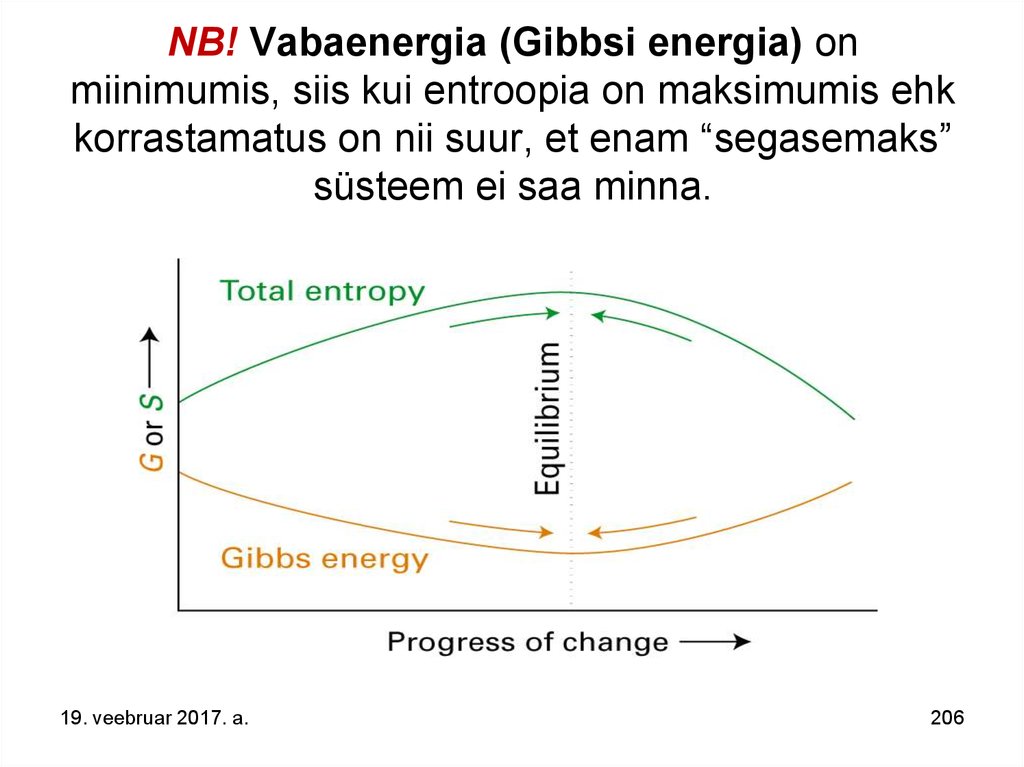
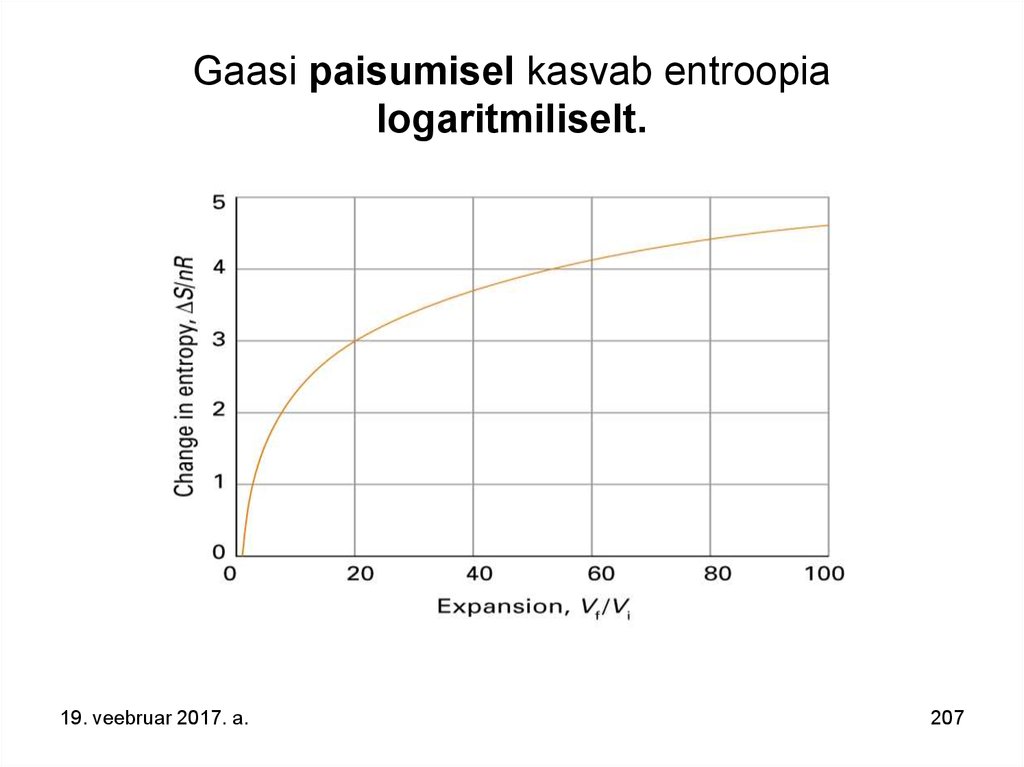

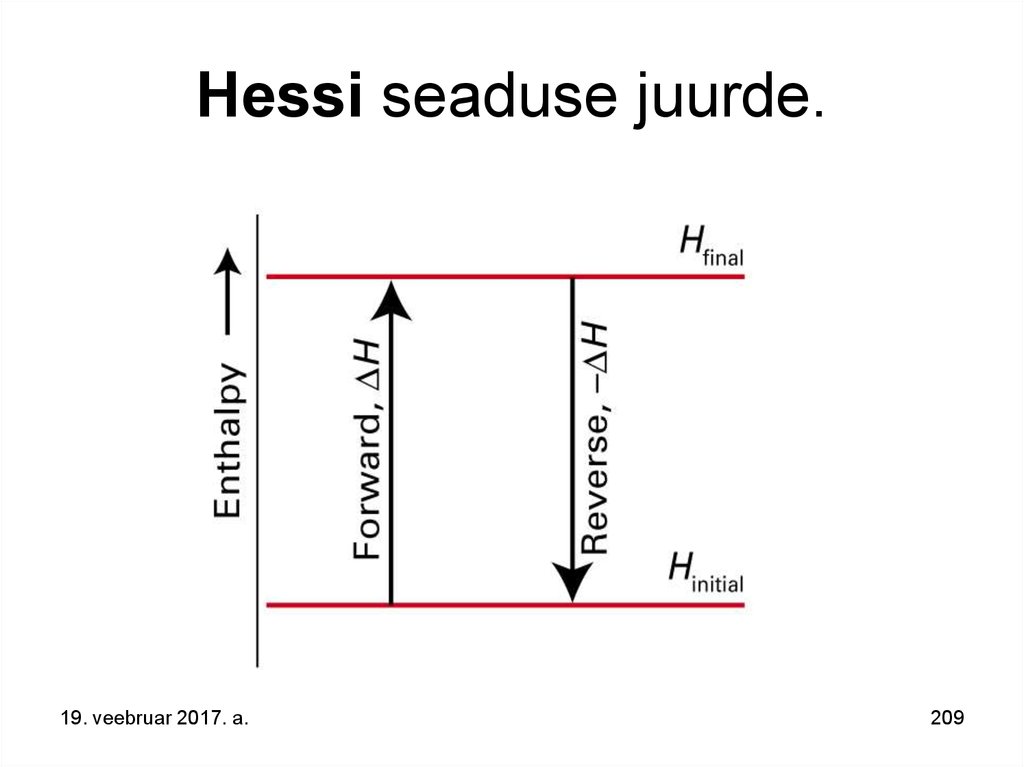
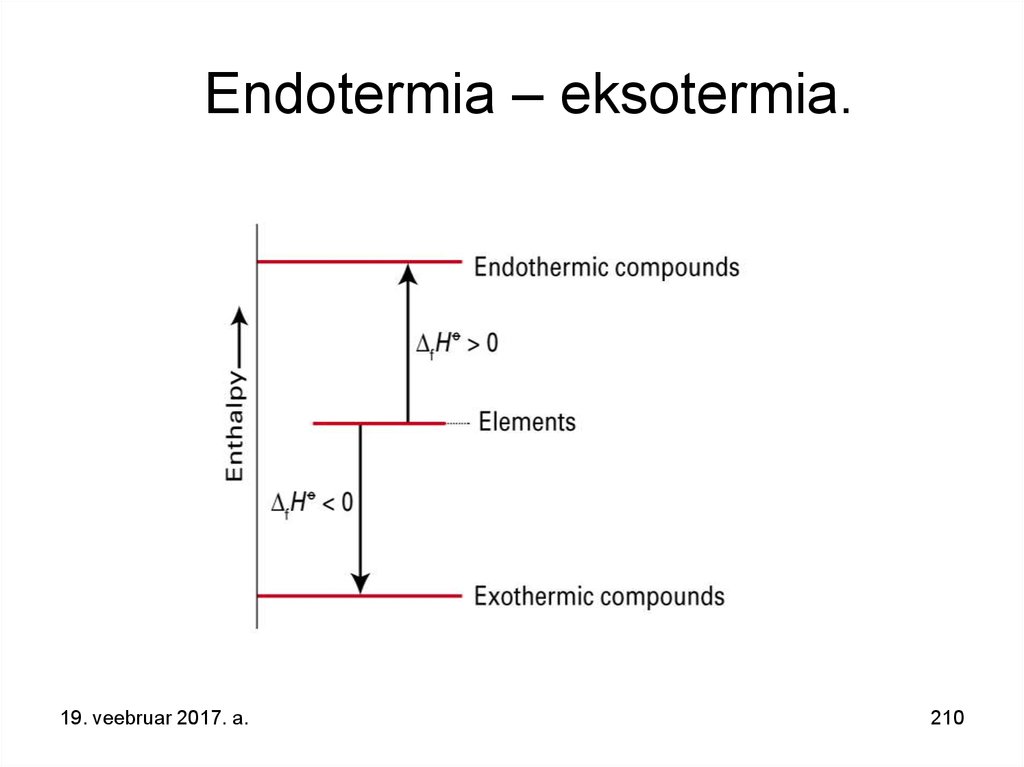



























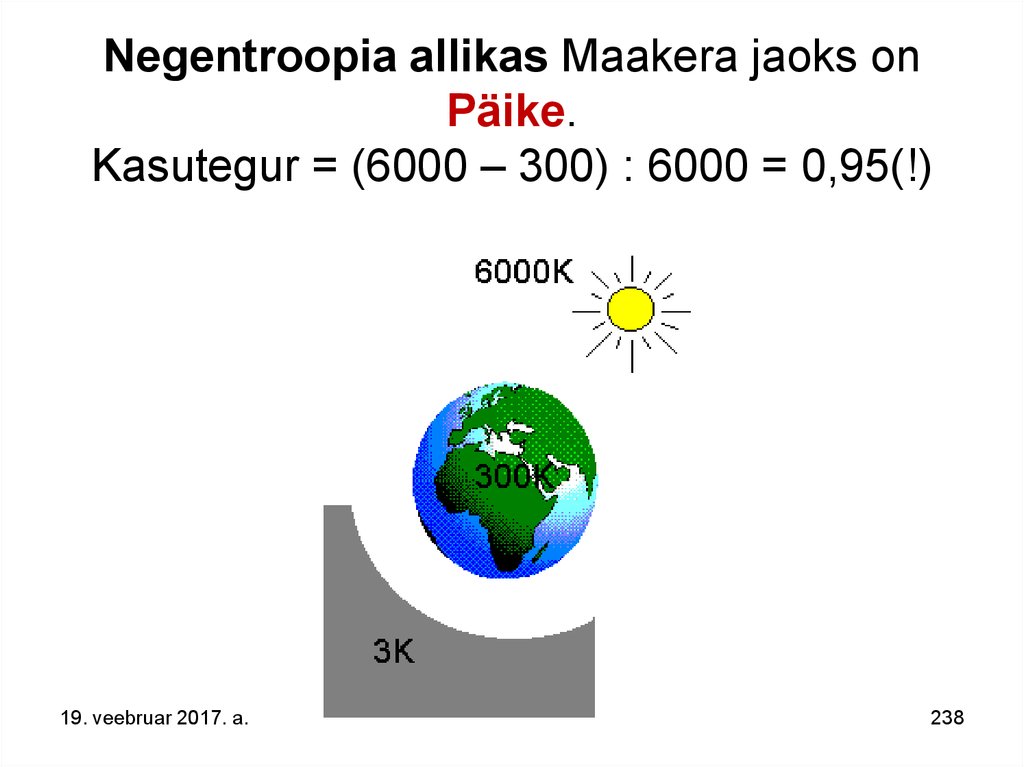


















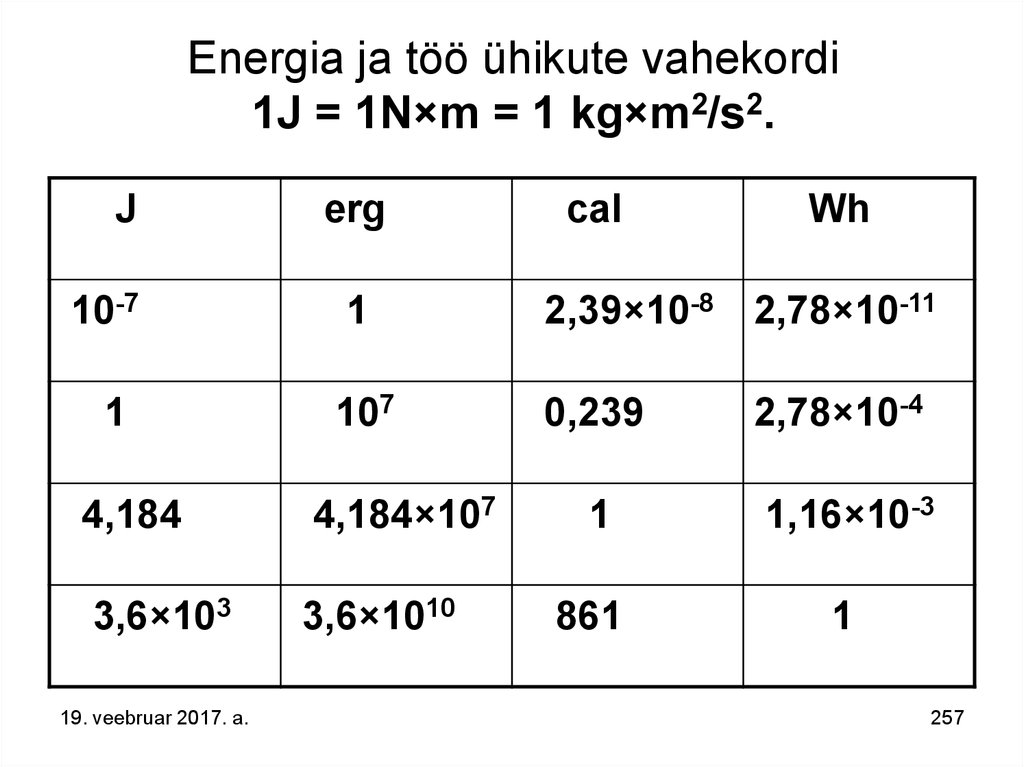
 Физика
Физика Химия
Химия
