Похожие презентации:
Ауыр металдар
1. Мыс – периодтық жүйенің IV периодында, І В тобында орна- ласқан атомдық нөмірі 29 болатын элемент. Cu деп белгіленеді. Жай мыс – алтын қызыл са
Мыс – периодтық жүйенің IV периодында, І В тобында орналасқан атомдық нөмірі 29 болатын элемент. Cu деп белгіленеді.Жай мыс – алтын қызыл сары түсті, пластикалық металл.
Жер қыртысындағы мөлшері 0,0016%. Ежелгі заманнан
қолданылып келеді. Жер қыртысындағы мөлшері 0,00470,0055%. Теңіз және өзен-көл суында мыстың мөлшері өте аз:
0,0000003%; 0,0000001%.
2. Мырыш Zn – химиялық элементтердің периодтық жүйесінде IІ топта, ІV периодта орналасқан элемент. Атомдық нөмірі 30. Қалыпты жағдай-да мырыш –
Мырыш Zn – химиялық элементтердің периодтық жүйесінде IІ топта,ІV периодта орналасқан элемент. Атомдық нөмірі 30. Қалыпты жағдайда мырыш – берік ақ сұр түсті металл. Атомдық массасы 65,38. Жер
қыртысындағы мөлшері 0,0083%.
Мырыш – ағзадағы маңызды элемент, тірі ағзаларда орташа 0,0004%
мырыш кездеседі.
Таза мырыш – күміс түсті ақ пластикалық металл. Тығыздығы 7,133
г/см3, балқу температурасы 692,6 К, қайнау температурасы 1179,2 К.
Бөлме температурасында берік, ауада оксидті қабықша түзеді.
3. Қорғасын Pb – химиялық элементтердің периодтық жүйесінде VI периодта, IV топта орналасқан элемент. Атомдық нөмірі 82. Жай қорғасын – едәуір же
Қорғасын Pb – химиялық элементтердің периодтық жүйесіндеVI периодта, IV топта орналасқан элемент. Атомдық нөмірі 82. Жай
қорғасын – едәуір жеңіл балқитын көк реңкті ақ күміс түсті металл.
Жер қыртысындағы мөлшері 0,0016%. Қорғасын жеке күйінде кездеспейді. Әр түрлі тау жыныстарында болады. Мырыш-колчеданды,
мыс-никельді кендермен бірге жүреді. Тірі ағзаларда 0,00005%, мұхит суында 0,00003% қорғасын бар.
Қорғасынның жылуөткізгіштігі төмен, 273 К-да 35,1 Вт/м*К. Металл жұмсақ, пышақпен кесіледі. Бетін оксидті қабықша қаптайды.
Тығыздығы 11,3415 г/см3; балқу температурасы 600,61 К; қайнау
температурасы 2022 К.
.
4. Минералдары галенит PbS сфалерит ZnS халькопирит CuFeS2 пирит FeS2 арсенопирит FeAsS касситерит SnO2 халькозин Cu2S ковеллин CuS CuS
Минералдарыгаленит PbS
сфалерит ZnS
халькопирит CuFeS2
арсенопирит FeAsS
касситерит SnO2
халькозин Cu2S
CuS
пирит FeS2
ковеллин CuS
5. Минералдары борнит Cu5FeS4 англезит PbSO4 смитсонит ZnCO3 вульфенит PbMoO4 азурит (CuCO3)2*Cu(OH)2 церуссит PbCO3 малахит Cu2CO3(OH)2 цинкит ZnO
Минералдарыборнит Cu5FeS4
азурит (CuCO3)2*Cu(OH)2
англезит PbSO4
смитсонит ZnCO3
церуссит PbCO3
малахит Cu2CO3(OH)2
вульфенит PbMoO4
цинкит ZnO
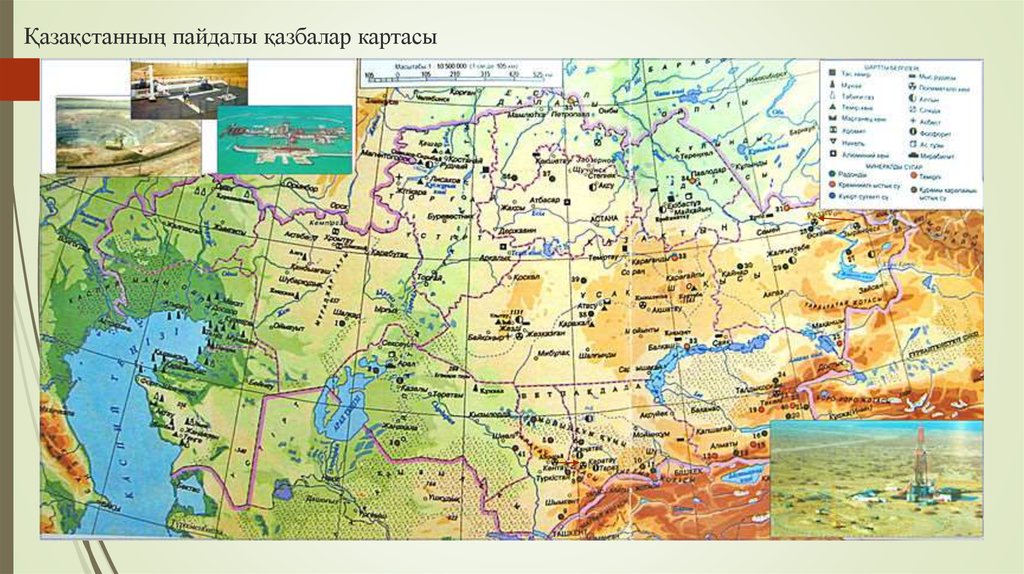
6. Қазақстанның пайдалы қазбалар картасы
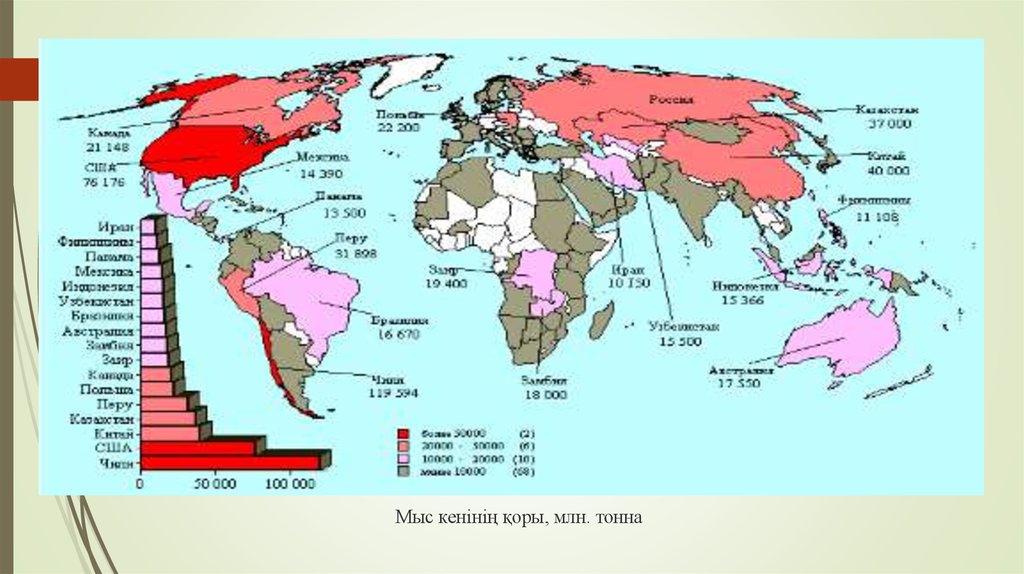
7. Мыс кенінің қоры, млн. тонна
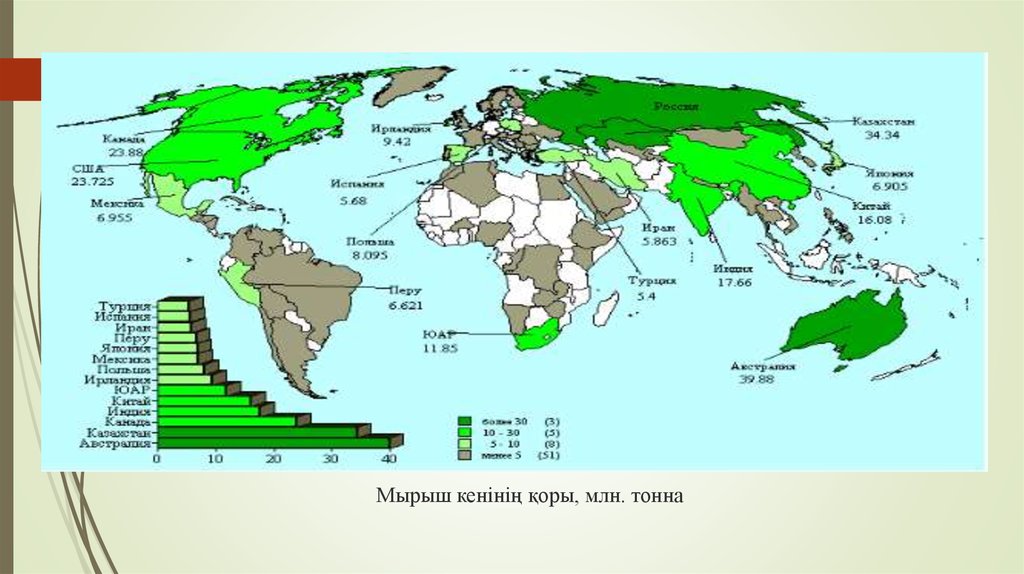
8. эээ Мырыш кенінің қоры, млн. тонна
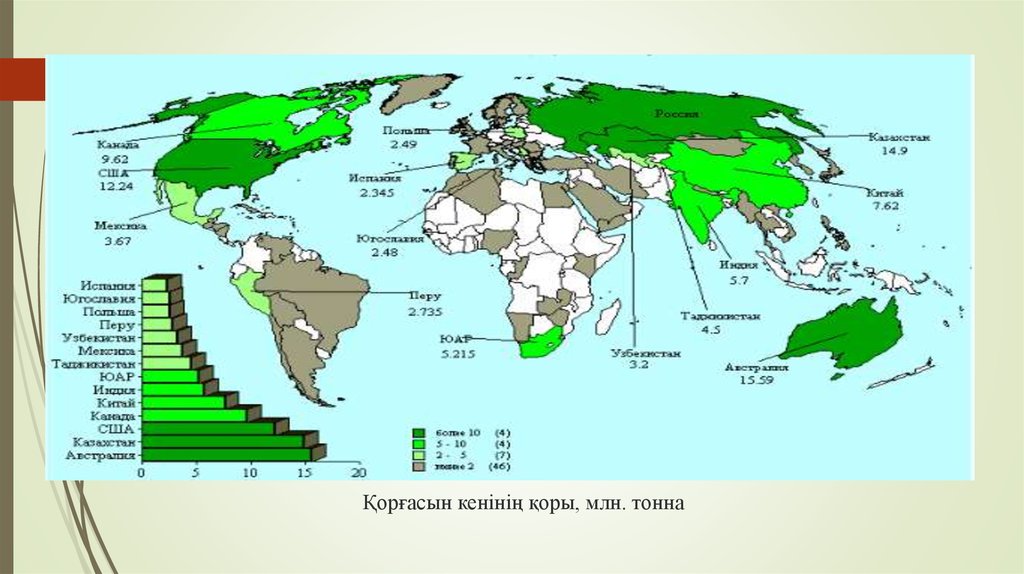
9. Қорғасын кенінің қоры, млн. тонна
10. Физикалық қасиеттері Мыс – алтын қызыл металл, ауада тез оксидті қабықшамен қапталады, бұл оған қызыл сары реңк береді. Мыстың жұқа қабықш
Физикалық қасиеттеріМыс – алтын қызыл металл, ауада тез оксидті қабықшамен қапталады, бұл оған қызыл сары реңк
береді. Мыстың жұқа қабықшасы жарықта жасыл көк түсте болады.
Мыс – күкіртті не күміс түсті металдардан ерекше айқын түсі бар металдың бірі (осмий, алтын,
цезий). Бұл оның толған 3-ші атомдық орбиталынан жартылай толған 4-шісіне элек-трондардың
ауысуымен түсіндіріледі: олардың арасындағы энергетикалық айырмашылық қызыл сары толқын
ұзындығымен бірдей.
Мыс кубтық орталықтандырылған кристалдық тор түзеді.
Мыс жоғары жылу және электрөткізгіштігімен (күмістен кейін) ерекшеленеді. 20 0С-та 55-58
МСм/м. Жылуөткізгіштігі 401 Вт/м К.
Тығыздығы 8,92 г/см3. Балқу және қайнау температурасы 1356,55 К және 2840,15 К.
Мыстың құймалары бар: мырышпен – жез, қалайымен – қола, никельмен – мельхиор, т.б.
11. Химиялық қасиеттері Мыс қосылыстарда +1, +2 тотығу дәрежелерін көрсетеді. +1 қосылыстары ерімейтін (CuI, Cu2O, CuCl) не кешенді (мысалы, [Cu(NH3)2]+ ) болад
Химиялық қасиеттеріМыс қосылыстарда +1, +2 тотығу дәрежелерін көрсетеді. +1 қосылыстары ерімейтін (CuI,
Cu2O, CuCl) не кешенді (мысалы, [Cu(NH3)2]+ ) болады. Оның қосылыстары түссіз. +2
тотығу дәрежелі қосылыстары тұрақты. Олардың тұздары көк, көк жасыл түсті болады. +3,
+5 тотығу дәрежелі қосылыстары да болады. Мысалы, купраборан анионы Cu(B11H11)23Ауада ылғал және СО2 болғанда өзгермейді. Мыс – әлсіз тотықсыздандырғыш, сумен, сұйытылған қышқылдармен әрекеттеспейді. Концентрлі күкірт, азот қышқылдарында, патша
сұйығында, оттекте, галогендерде, халькогендерде, бейметалл оксидтерінде тотығады. Қыздырғанда галогенсутектермен әрекеттеседі.
1) Ылғалды ауада мыс (ІІ) гидрокарбонатын түзіп тотығады:
2Cu + H2O + CO2 + O2 = Cu2CO3(OH)2 ↓
2) Концентрлі суық күкірт қышқылымен әрекеттеседі:
Cu + H2SO4 = CuO + SO2 ↑ + H2O
12. 3) Концентрлі ыстық күкірт қышқылымен әрекеттеседі: Cu + 2H2SO4 = CuSO4 + SO2 ↑ + 2H2O 4) Сусыз концентрлі ыстық күкірт қышқылымен де әрекеттеседі: 2Cu + 2H2SO4
= Cu2SO4 + SO2 ↑ + 2H2O5) Сұйытылған күкірт қышқылымен қыздырғанда оттек қатысында:
2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O
6) Концентрлі азот қышқылымен:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
7) Сұйытылған азот қышқылымен:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO ↑ + 4H2O
8) «Патша сұйықтығымен» де әрекеттеседі:
3Cu + 2HNO3 + 6HCl = 3CuCl2 + 2NO ↑ + 4H2O
200 0С-та
13. 9) Сұйытылған тұз қышқылымен оттек қатысында әрекеттеседі: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O 10) Концетрлі ыстық тұз қышқылымен: 2Cu + 4HCl = 2H[CuCl2] + H2 ↑ 11) Концентр
9) Сұйытылған тұз қышқылымен оттек қатысында әрекеттеседі:2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
10) Концетрлі ыстық тұз қышқылымен:
2Cu + 4HCl = 2H[CuCl2] + H2 ↑
11) Концентрлі бромсутек қышқылымен:
2Cu + 4HBr = 2H[CuBr2] + H2 ↑
12) Хлорсутек газымен 500 – 600 0С-та әрекеттеседі:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
13) Концентрлі сірке қышқылымен оттек қатысында араласады:
2Cu + 4CH3COOH + O2 = [Cu2(H2O)2(CH3COO)4]
14) Мыс оттекпен 200 және 400 – 500 0С-та оттекпен әрекеттеседі:
4Cu + O2 = 2Cu2О
4Cu + O2 = 2CuO
14. Кен орындары Мыс-қорғасын-мырыш кендері Қазақстанда мына аумақтарда шоғырланған: 1)Шығыс Қазақстан (Риддер, Зырян, Белоусов, Орлов, Николае
Кен орындарыМыс-қорғасын-мырыш кендері Қазақстанда мына аумақтарда шоғырланған:
1)Шығыс Қазақстан (Риддер, Зырян, Белоусов, Орлов, Николаев, Тишин, Малеев);
2)Сарыарқа (Ақбастау, Ақжал, Құсмұрын, Алаайғыр, Қарағайлы, Жәйрем);
3)Қаратау (Ащысай, Мырғалымсай, Байжансай);
4)Жетісу Алатауы (Көксу, Текелі).
Мыс кен орындары Орталық Қазақстанда орналасқан (Жезқазған, Қоңырат, Ақтоғай, Айдарлы, ЖаманАйбат, Бозшакөл, Көксай, Қасқырмыс, Нұрқазған, т.б.).
Қорғасын мен мырыштың 100-ден аса кен орындары анықталып, 58-і пайдаланылуда. Негізгі кен
орындары: Жәйрем, Үшқатын, Бестөбе, Қарағайлы, Шалқия, Текелі.
15.
16. Мыс көптеген өндірістік, шаруашылық саларында қолданылады: 1) Электротехникада мыс сымдары энергия сақтайтын орамдарда, трансформаторлар
Мыс көптеген өндірістік, шаруашылық саларында қолданылады:1) Электротехникада мыс сымдары энергия сақтайтын орамдарда, трансформаторларда;
2) Жоғары өткізгіштігіне байланысты жылу бөлінетін, жылу беретін жерлерде қолданылады (суыту радиоторлары, кондиционерлер, жылу радиоторлары);
3) Құбыр өндірісінде мыс құбырлары сұйықтар мен газдарды тасымалдауға су құбырларының ішкі жүйелерінде, жылыту жүйелерін газбен жабдықтауда;
4) Құрылыста ғимараттардың төбелеріне мыстан жасалған қаңылтырлар пайдаланылады;
5) Музыкалық аспаптар мен мүсіндерді жасауда;
6) Мыстың алюминиймен құймасы – дюраль (мыс 4,4%) ұшақ жасауда;
7) Зергерлік істе мыс пен алтынның құймалары бұйымның деформациясына, қатаңдығына қарай қолданылады;
8) Бериллий қоласынан (мыс 1,5-3%) сағаттың, байланыс құралдарының, автокөліктің бөліктерін жасайды;
17.
Батарейкалар менаккумуляторларда қарсы
электрод ретінде
Қатты дәнекерлеуші заттарда
олардың балқу температураларын төмендету үшін
Бағалы металдарды
тотықсыздандыру, басқа да
металдарды қорғасыннан
бөліп алу үшін
Мырыш, оның
өнімдерінің
қолданылуы
Қара металдар мен олардың
құймаларын жемірілуден
қорғау үшін
Полиграфияда көптаралымды
басылымда иллюстрацияны
басу үшін
Мырыш оксиді медицинада антисептиктер,
Мырыш хлориді қағазды ағартуда, ағашты
қабынуға қарсы зат ретінде, бояу өндірісінде ақ
шіруден қорғау мақсатында, улағыш дәрілер
пигмент, электроникада шала өткізгіш ретінде;
құрамында;
Мырыш сульфиді бояу өндірісінде, жартылай
Мырыш селениді оптикалық шыны жасауда;
өткізгіш ретінде;
Мырыш сульфаты мырышты электролиз арМырыш фосфиді кемірушілерге қарсы дәрі;
қылы алуда, мырыштауда электролит құрауМырыш ацетаты медицинада, катализатор ретінде; шысы, флотореагент, микротыңайтқыш
Мырыштың басқа металдармен (алюминий, магний) ретінде, матаны бояуда қолданылады.
құймалары машина жасау өндірісінде қолданылады.
18.
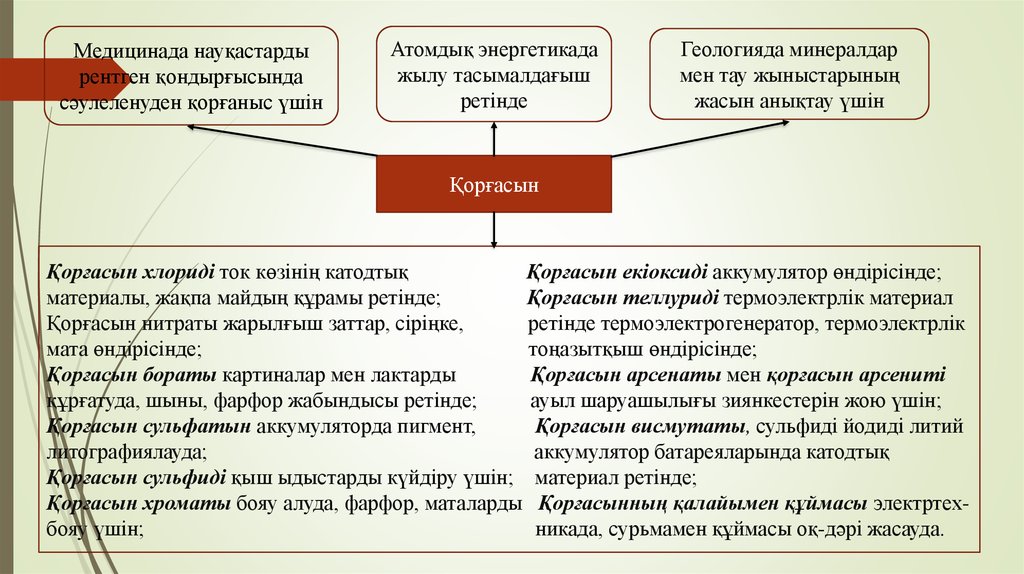
Медицинада науқастардырентген қондырғысында
сәулеленуден қорғаныс үшін
Атомдық энергетикада
жылу тасымалдағыш
ретінде
Геологияда минералдар
мен тау жыныстарының
жасын анықтау үшін
Қорғасын
Қорғасын хлориді ток көзінің катодтық
Қорғасын екіоксиді аккумулятор өндірісінде;
материалы, жақпа майдың құрамы ретінде;
Қорғасын теллуриді термоэлектрлік материал
Қорғасын нитраты жарылғыш заттар, сіріңке,
ретінде термоэлектрогенератор, термоэлектрлік
мата өндірісінде;
тоңазытқыш өндірісінде;
Қорғасын бораты картиналар мен лактарды
Қорғасын арсенаты мен қорғасын арсениті
құрғатуда, шыны, фарфор жабындысы ретінде;
ауыл шаруашылығы зиянкестерін жою үшін;
Қорғасын сульфатын аккумуляторда пигмент,
Қорғасын висмутаты, сульфиді йодиді литий
литографиялауда;
аккумулятор батареяларында катодтық
Қорғасын сульфиді қыш ыдыстарды күйдіру үшін; материал ретінде;
Қорғасын хроматы бояу алуда, фарфор, маталарды Қорғасынның қалайымен құймасы электртехбояу үшін;
никада, сурьмамен құймасы оқ-дәрі жасауда.






![Химиялық қасиеттері Мыс қосылыстарда +1, +2 тотығу дәрежелерін көрсетеді. +1 қосылыстары ерімейтін (CuI, Cu2O, CuCl) не кешенді (мысалы, [Cu(NH3)2]+ ) болад Химиялық қасиеттері Мыс қосылыстарда +1, +2 тотығу дәрежелерін көрсетеді. +1 қосылыстары ерімейтін (CuI, Cu2O, CuCl) не кешенді (мысалы, [Cu(NH3)2]+ ) болад](https://cf.ppt-online.org/files/slide/x/Xkc8CL1WY3ZiV60QEsSNdPMyFU4xTf7auebj5D/slide-10.jpg)

![9) Сұйытылған тұз қышқылымен оттек қатысында әрекеттеседі: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O 10) Концетрлі ыстық тұз қышқылымен: 2Cu + 4HCl = 2H[CuCl2] + H2 ↑ 11) Концентр 9) Сұйытылған тұз қышқылымен оттек қатысында әрекеттеседі: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O 10) Концетрлі ыстық тұз қышқылымен: 2Cu + 4HCl = 2H[CuCl2] + H2 ↑ 11) Концентр](https://cf.ppt-online.org/files/slide/x/Xkc8CL1WY3ZiV60QEsSNdPMyFU4xTf7auebj5D/slide-12.jpg)




 Химия
Химия